Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el curso CEDIP 2007 AUGE Perinatal y Ginecológico (Centro de Diagnóstico e Investigaciones Perinatales), Hospital Sótero del Río, Universidad Católica de Chile. El curso se realizó los días 23, 24 y 25 de agosto de 2007.
Cardiopatías congénitas: epidemiología
En la actualidad, la mortalidad perinatal en Chile es de 8,6/1000 RNV; de esta cifra, 60% está asociada a retardo de crecimiento intrauterino y parto prematuro y 40%, a malformaciones congénitas. La mortalidad materna es 12/100.000. Dentro de las malformaciones congénitas la causa más frecuente es la cardiopatía congénita; sin embargo, es la que menos se diagnostica. En el folleto de Acceso Universal a las Garantías Explícitas en Salud (AUGE) no aparece el diagnóstico prenatal de las cardiopatías congénitas, a pesar de que en el año 2002 se llegó a acuerdo sobre el procedimiento a seguir para efectuar el tamizaje y diagnóstico de éstas; por lo tanto, pronto el folleto se deberá modificar.
La cardiopatía congénita se presenta en 8 a 15/1000 recién nacidos vivos en la población general y es la causa de alrededor de 20% de las muertes neonatales, aunque, según el informe de la Organización Mundial de la Salud (OMS), participa en forma directa o indirecta en más de 40% de las muertes infantiles. Este tipo de malformación es 6 veces más frecuente que las aneuploidías y 4 veces más frecuentes que las malformaciones del sistema nervioso central, como por ejemplo, la anencefalia; sin embargo, éstas no suelen pasar inadvertidas, como ocurre con las cardiopatías. Debido a lo anterior se ha elaborado un largo listado de las condiciones, tanto maternas como fetales, en las que se debe solicitar una ecocardiografía antenatal, pero es importante recordar que, igual que en las demás áreas de la obstetricia, los grupos de riesgo no acumulan más de un tercio de los casos: sólo 10% de los niños cardiópatas provienen de un grupo de riesgo y los restantes 80% a 90% provienen de madres de la población general (Hoffmann,
Am J Card, 1978; Yagel,
UOG 2001).
Hay varios aspectos a considerar sobre la ecocardiografía fetal, que se analizarán a continuación.
Quién realiza la ecocardiografía
Lo primero es tener claro que quienquiera que haga una ecografía prenatal tiene la obligación de examinar el corazón del niño, ya que tal vez sea la única oportunidad para evaluar la anatomía fetal. Una vez que se realiza el diagnóstico cobra gran importancia el concepto de equipo de cardiología perinatal, en que la concurrencia de cardiólogos, cardiocirujanos, neonatólogos y especialistas en Medicina Materno-fetal constituye la mejor alternativa para estos niños.
Si se tiene como objetivo el tamizaje de cardiopatías congénitas, todos los ginecólogos deben realizar este examen; pero, dada la complejidad del órgano, es muy importante la acreditación, que asegura que el médico sabe hacer el examen, cuenta con equipamiento y sistema de registro adecuado y posee un registro histórico, que le permite determinar el porcentaje de aciertos y fallas. El proceso de acreditación se inició en Chile y se propagó hacia América Latina; se basa en un curso de cardiología neonatal y constituye la norma para ésta y las demás prácticas clínicas.
Cuándo se realiza la ecocardiografía fetal
La estrategia que establece el Ministerio de Salud indica que se debe hacer entre las 11 y las 14 semanas, entre las 18 y las 24 semanas y a las 32 semanas. Además, en todo examen que se realice al niño antes de nacer, aunque sea a las 40 semanas, en el caso de un embarazo en vías de prolongación, se debe mirar el corazón en busca de patologías evolutivas, ya que siempre existe la posibilidad de que en los exámenes anteriores se haya pasado por alto el diagnóstico de cardiopatía congénita. La pesquisa oportuna puede hacer la diferencia en cuanto a la sobrevida del niño.
En las siguientes imágenes, que corresponden a una ecocardiografía en un feto de 12 semanas de gestación, se puede ver claramente, en rojo, las entradas: la primera corresponde a la arteria aorta y el plano de los tres vasos, con los otros dos vasos en azul. El tamizaje de cardiopatías congénitas, que se realiza siguiendo el método de planos paralelos ascendentes a las 12 semanas de gestación, tiene una sensibilidad inicial cercana a 80% y permite hacer diagnósticos a esta edad gestacional, como el de este caso clínico clínico, en que el feto tenía translucencia nucal aumentada, hueso nasal muy pequeño y flujo reverso en el
ductus venoso. La ecocardiografía mostró ausencia de flujo a través de la válvula mitral, comunicación en la punta y fibroelastosis subendocárdica (lo blanco), elementos que configuran un síndrome de hipoplasia ventricular izquierda, con una comunicación interventricular (CIV) muscular de la punta y fibroelastosis subendocárdica (Fig. 1).
Figura 1. Ecocardiografía en feto de 12 semanas de gestación. Síndrome de hipoplasia ventricular izquierda.
Con el objetivo de determinar qué porcentaje de los niños cardiópatas presentan alguno de estos dos parámetros alterados: ductus venoso y translucencia nucal, durante su vida intrauterina, se revisaron los antecedentes de los niños que nacieron con cardiopatía en dos centros y se encontró que 38% de ellos tenía translucencia nucal elevada, lo que concuerda con la literatura internacional. Al sacar de este grupo a los niños con aneuploidía, la sensibilidad disminuyó a 20-22% (Tabla I).
Tabla I. Translucencia nucal y cardiopatía. U Chile = Universidad de Chile
Lo anterior concuerda con las comunicaciones más recientes, en especial del área cardiológica: en una de ellas se evaluó a más de 600 niños con cardiopatía y se encontró que, del grupo de niños euploides, sólo 23% presentaron ductus venoso o translucencia nucal anormales durante su vida intrauterina. En consecuencia, es probable que el rendimiento, que en un principio fue muy alto, no sea superior a dicha cifra.
Cómo se hace la ecocardiografía fetal
Se recomienda utilizar todas las herramientas disponibles: 2D,
doppler, modo M y ultrasonido tridimensional. El ultrasonido 3D permite obtener imágenes muy nítidas, con volumen, del corazón y todas sus estructuras anatómicas: válvulas, foramen, bandas moderadoras,
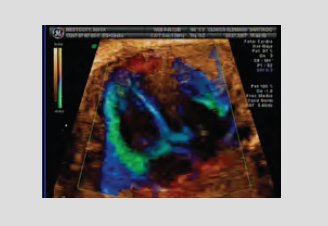
septum e incluso permite apreciar la contractilidad miocárdica, aunque esto no ayuda en forma significativa al diagnóstico. Lo importante de este tipo de examen es que se puede enviar a otras instituciones, ciudades, países o continentes para que lo examine un experto, hecho que constituye una ventaja muy importante (Fig. 2).
Figura 2. Examen cardiológico mediante Ultrasonido 3D
Las nueva técnica STIC (Spatio-Temporal Image Correlation) realiza una correlación espacio temporal de las imágenes y añade movimiento a la ecografía 3D, lo que permite obtener, no sólo información anatómica, sino también funcional. En la siguiente figura se muestra cómo esta técnica permite ver dos planos simultáneos en tiempo real: el plano de las cuatro cámaras y el plano ortogonal, que corresponde, en este caso, al arco ductal. Con esta técnica se examina el corazón en forma bidimensional o en forma volumétrica, como se ve en la imagen; con el transductor sobre el abdomen, se puede girar y observar la imagen de cuatro cámaras del corazón, y el plano de sección ortogonal permite visualizar cómo está la salida de los vasos sanguíneos (Fig. 3). No está clara la utilidad futura de esta técnica, pero es probable que tenga muchas ventajas en el ámbito docente y en la transmisión de imágenes.
Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)
Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)
Algunas técnicas nuevas, que se conocerán más en los próximos años, permiten estudiar la función miocárdica. Entre ellas está el doppler tisular, técnica en la que no se colorea los glóbulos rojos, sino las estructuras en movimiento y permite saber cómo está la contractilidad del corazón y la velocidad con que se contrae y relaja el miocardio. El desarrollo de estas nuevas técnicas abrirá una puerta para el estudio de la disfunción miocárdica sin recurrir a índices directos, como se hace en la actualidad (Fig. 4).
Figura 4. Doppler tisular
Cómo se realiza el tamizaje de cardiopatías congénitas
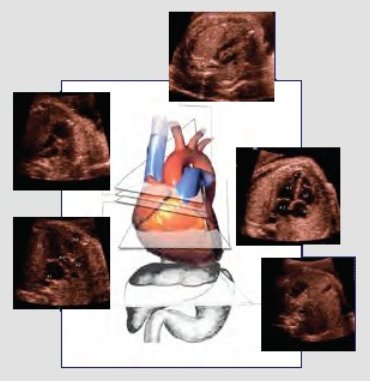
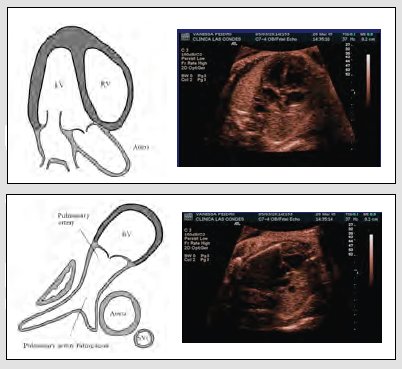
El tamizaje se realiza en planos transversales ascendentes sucesivos, que parten en el abdomen. Hay cuatro cámaras y a medida que se sube en el plano de sección, es inevitable, en un paciente normal, encontrar la aorta; uno o dos milímetros más arriba se encuentra la arteria pulmonar y, un poco más arriba, el plano de los tres vasos (Fig. 5).
Figura 5. Tamizaje de cardiopatías congénitas
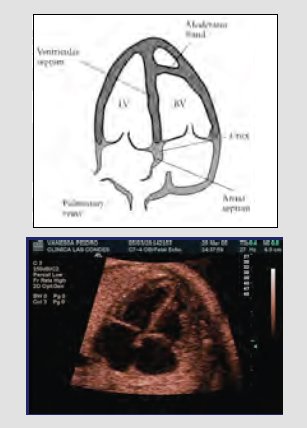
Esta técnica ha dado tan buenos resultados, que la Sociedad Internacional de Ultrasonido en Obstetricia y Ginecología recomienda la imagen de cuatro cámaras del corazón como referencia del examen básico que se debe realizar en todos los pacientes. En el examen se debe identificar lo siguiente: que haya dos válvulas, dos ventrículos y dos aurículas, de tamaño similar; que la punta del corazón se ubique sobre el estómago, hacia la izquierda; que detrás de la aurícula izquierda haya sólo un vaso; que el septum y la cruz del corazón estén intactos; y que la válvula tricúspide esté levemente más apical que la mitral. Este examen se debe realizar en toda la población, idealmente entre las 18 y las 24 semanas de gestación, como examen básico de rutina (Fig. 6). Algunos de los requisitos que deben cumplir las máquinas se pueden resumir en los siguientes pasos: oprimir el modo ecocardiografía fetal en la máquina o elegir el modo que tenga la mayor cantidad de cuadros por segundo.
Figura 6. Imagen de cuatro cámaras del corazón: examen básico del tamizaje prenatal de cardiopatías congénitas
Esta imagen se acompañará luego de los tractos de salida, cuyas características son las siguientes: origen de la aorta en ventrículo izquierdo, origen de la pulmonar en ventrículo derecho; ramas de la aorta en el arco; la pulmonar se divide hacia la columna y sus ramas tienen un tamaño similar; continuidad de la aorta con el velo anterior de la válvula mitral y con el septum interventricular; y presencia de vena cava y pulmonar. De ellas, la más importante, para identificar esta compleja red de vasos que llegan y salen del corazón, es la aorta, que sale del ventrículo izquierdo y hace un arco, del cual salen vasos y la arteria pulmonar; ésta sale del ventrículo derecho, se dirige hacia atrás y se divide en dos (Fig. 7).
Figura 7. Tractos de salida
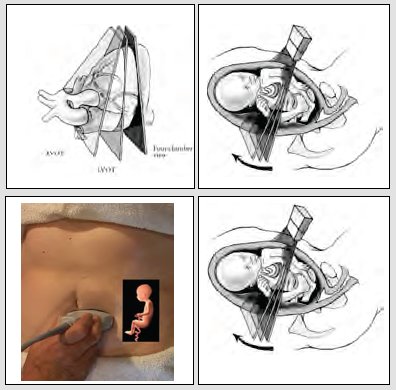
Para examinar al paciente, hay tres alternativas: la primera es seguir los vasos, hacer un eje largo de los ventrículos derecho e izquierdo y un eje corto de los grandes vasos, técnica que es muy difícil aprender y más aún enseñar (Fig. 8). Las otras alternativas consisten en angular el transductor o desplazarlo levemente en forma de planos paralelos y lo que se va a obtener, después de cuatro cámaras, va a ser el tracto de salida de la aorta, donde se va a identificar la válvula aórtica y la aorta, con una de sus paredes que continúa el septum y con uno de los velos de la válvula mitral. Unos pocos milímetros más arriba, se va a identificar el ventrículo derecho, válvula pulmonar, la rama principal de la arteria pulmonar y muchas veces se logra ver la bifurcación en sus dos ramas y, un par de milímetros más arriba, los tres vasos (Fig. 9). En la vida real, este examen se realiza en no más de cinco a diez segundos; se debe identificar bien la presentación del niño, qué es derecho o izquierdo; iniciando desde el estómago, se sube el plano de sección a cuatro cámaras y, un par de milímetros más arriba, se va a visualizar la salida de la aorta. Este es el examen básico y extendido que se debe realizar en todas las pacientes.
Figura 8. Cómo se realiza el tamizaje de cardiopatías congénitas
Figura 9. Cómo se realiza el tamizaje de cardiopatías congénitas
¿Qué se puede encontrar en el examen ecocardiográfico fetal?
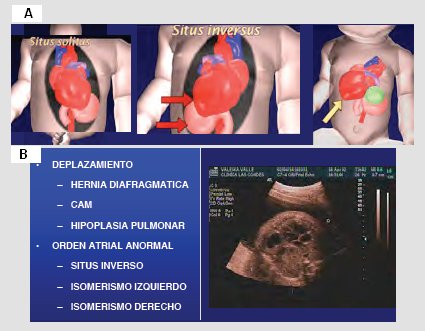
Para saber lo que se puede encontrar, lo primero es recordar que el corazón está hacia la izquierda, para lo cual se debe identificar con claridad hacia dónde está la cabeza, el dorso y tener muy presente que el feto puede estar en posición cefálica, podálica o en múltiples variedades de posición. Cuando el corazón esta a la izquierda, sobre el estómago, se denomina
situs solitus; cuando ambos están hacia la derecha, se denomina
situs inversus; y cuando el corazón esta desplazado hacia la derecha, se denomina
dextroposición (Fig. 10 A). Entre las variaciones de posición o
situs están los desplazamientos, que pueden deberse a una hernia diafragmática e hipoplasia pulmonar, entre otras causas; están los casos de orden atrial anormal, que incluyen el
situs inverso y el isomerismo izquierdo o derecho. En la Fig. 10 B se muestra el corazón hacia la derecha debido a una hernia diafragmática.
Figura 10. A: Posición o situs. B: Hernia diafragmática
También puede haber aumentos de volumen localizados en el corazón, que pueden ser causados por infartos, diabetes, aneurismas o tumores, como por ejemplo, un rabdomioma, que se asocia a menudo con esclerosis múltiple o esclerosis tuberosa. Ésta es una enfermedad congénita que se caracteriza por depósitos de proteínas en el cerebro que son invisibles al ultrasonido, pero se pueden visualizar con resonancia nuclear magnética y se manifiestan por convulsiones precoces de difícil manejo y retardo mental profundo.
LA eficacia del diagnóstico mediante las cuatro cámaras es de 15% a 20%; si se usan los tractos de salida, se logra 40% a 50% y, si participan cardiólogos que colaboran en el equipo de cardiología perinatal, la eficacia puede subir a 80%. Durante el primer trimestre se logra 20% de diagnóstico si se utiliza translucencia nucal y ductus; si se realiza el mismo examen que en el adulto, se podría llegar a 80% de diagnóstico.
Utilidad del diagnóstico prenatal de cardiopatías congénitas
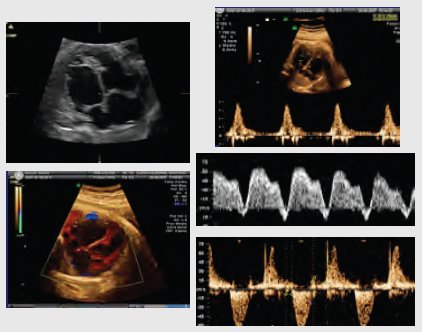
El diagnóstico prenatal mejora la sobrevida, en comparación con el diagnóstico postnatal; permite diagnosticar arritmias como la taquicardia supraventricular, en que el corazón late muy rápido, con frecuencias auriculoventriculares 1:1 y el
flutter auricular, con bloqueo 2 x 1, en que la aurícula late más rápido y el ventrículo a la mitad de la frecuencia de la aurícula. En estos niños se debe realizar tratamiento con digitálicos, como primera opción, y flecainida, como segunda opción. El desarrollo de la cardiología perinatal ha permitido que estos niños sobrevivan, ya que sin tratamiento su mortalidad es elevada. Otra patología importante es la insuficiencia cardiaca debido a sobrecarga ventricular, que es poco frecuente, pero se puede ver en corazones disfuncionales por anemia fetal, fístulas arteriovenosas o alteraciones miocárdicas, como la miocardiopatía no compactada o la insuficiencia polivalvular, entre otras. En la siguiente imagen se observa un corazón de gran tamaño, con poca contracción miocárdica; la fracción de acortamiento es 2 y 10, cuando debería ser 20 y 30 para un ventrículo y otro; el índice de Tei, que mide el tiempo de eyección ventricular y de entrada, alcanza un valor de 1, cuando en condiciones normales es de 0,3, lo que demuestra que el corazón funciona muy mal. Este caso corresponde a una miocardiopatía dilatada, que se manejó digitalizando al niño por vía transplacentaria (Fig. 11).
Figura 11. Miocardiopatía dilatada
Cirugía fetal y neonatal
Se ha planteado la utilidad de la cirugía fetal en estenosis aórtica crítica, estenosis pulmonar, síndrome de hipoplasia ventricular izquierda y malformaciones cardíacas aisladas. En casos de estenosis aórtica típica, se ha intentado pasar una aguja directamente transabdominal y luego transtorácica, enfrentar el tracto de salida del ventrículo izquierdo, pasar la guía, inflar el balón y dilatar la válvula; pero no se ha obtenido buenos resultados: el procedimiento se pudo realizar sólo en 20 de 26 casos, de los cuales 12 quedaron con insuficiencia y 5 de ellos, con insuficiencia grave. Aún no esta claro si es mejor tratar
in utero.
El mayor impacto del desarrollo de la cardiología perinatal se observa a nivel de la terapia neonatal. Desde hace algunos años se plantea como un objetivo nacional lograr el diagnóstico y tratamiento oportuno en tres condiciones: la cardiopatía
ductus dependiente, el drenaje venoso pulmonar anómalo completo y el bloqueo aurculoventricular completo.
En el caso de las patologías
ductus dependientes, si no se hace el diagnóstico y se cierra el
ductus, esto ocasionará la muerte de un paciente que habría podido sobrevivir si se hubiera efectuado tratamiento quirúrgico. Entre estas cardiopatías están: transposición de grandes arterias tipo D; atresia pulmonar con
septum intacto; tetralogía de Fallot acentuado (
shunt de aorta a pulmonar por
ductus); comunicación interventricular y atresia pulmonar; comunicación interventricular y coartación aórtica; interrupción de arco aórtico; hipoplasia de ventrículo izquierdo; atresia tricuspídea con estenosis pulmonar acentuada; cardiopatía congénita compleja con estenosis pulmonar acentuada; y estenosis aórtica crítica. El diagnóstico prenatal de estas enfermedades mejora la sobrevida, el tiempo de transferencia, el tiempo de cirugía y también la calidad de vida. Hace cinco o seis años atrás todos estos niños fallecían debido a que no se operaban, pero el diagnóstico prenatal incentivó a los equipos de cardiocirujanos a aplicar esta técnica, gracias a la cual la sobrevida en Chile se acerca hoy a 60% y hay alrededor de 60 a 70 niños operados. Chile es uno de los pocos países en América Latina en que se realiza esta técnica, en la actualidad.
El diagnóstico de coartación de la aorta también se puede efectuar en el período prenatal: en la imagen de cuatro cámaras se observa el corazón de tamaño normal, ubicado hacia la izquierda, con una desproporción en el tamaño de los ventrículos, con el ventrículo izquierdo de menor tamaño que el derecho; las arterias aorta y pulmonar deberían ser de tamaño similar, pero la aorta es más pequeña que la pulmonar. El diagnóstico prenatal de esta patología también mejora en forma significativa los resultados postnatales.
En cuanto a la estenosis pulmonar con
septum intacto, al
doppler color se observará la aurícula derecha aumentada de tamaño y la válvula tricúspide insuficiente, lo que refleja la presencia de una obstrucción distal a ella, a nivel de la arteria pulmonar, que causa la insuficiencia y la dilatación auricular. Cuando se cierra el
ductus, lo que ocurre habitualmente a las 48 - 72 horas, si el niño no está recibiendo prostaglandinas o no se ha hecho cirugía, fallece. En el caso de la agenesia de la pulmonar, se observa una arteria pulmonar muy dilatada y la sangre sale del ventrículo derecho hacia la pulmonar y regresa. En estos casos no hay grandes ventajas entre hacer o no diagnóstico, ya que de todos modos tienen mal pronóstico.
La transposición de grandes vasos es una de las patologías que más se beneficia con el diagnóstico prenatal: disminuye el tiempo de hospitalización (2 días
versus 73 días), mejora la sobrevida desde 0%, antes de la cirugía a 15%, post cirugía y reduce la mortalidad. Para el niño afectado, hacer el diagnóstico prenatal de esta patología marca la diferencia entre la vida y la muerte. El drenaje venoso pulmonar anómalo total también es una de las patologías en que el diagnóstico prenatal tiene gran impacto, pero los casos son muy pocos.
Diagnóstico de cardiopatías congénitas: estado actual
En un análisis del diagnóstico de cardiopatías en niños hospitalizados en las unidades de cuidado intensivo en dos centros, Universidad de Chile y Clínica Las Condes, entre los años 2003 y 2004, se encontró que, en un total de 5960 niños, 23 tenían una cardiopatía congénita mayor, 19 de las cuales se diagnosticaron en forma prenatal. Entre las que se pasaron por alto hubo un drenaje venoso anómalo completo. Si se tiene acceso a
Doppler color, se debe observar el retorno venoso por las venas pulmonares llegando a la aurícula izquierda, porque con blanco y negro puede haber confusión.
En un estudio de la Universidad de Chile, en el que se analizaron datos de 3000 niños, se observó que la presencia de una malformación cardiaca mayor aumenta 17 veces el riesgo de aneuploidía. Entonces, en una paciente de 28 años, que tiene un riesgo de 1:600, la presencia de una cardiopatía congénita aumenta el riesgo a 1:34; pero esto sólo ocurre en 1% de las pacientes. En el 95% de las pacientes, la ausencia de una cardiopatía mayor y de los otros marcadores va a disminuir el riesgo 3,5 veces y, para nuestros datos, disminuye el riesgo 4 veces, bajando de 1:600 a 1:2.800.
En suma, el corazón es el órgano que con mayor frecuencia presenta malformaciones, el que más impacta en la mortalidad por malformaciones, el más difícil de diagnosticar y el que con menor frecuencia se diagnostica. El diagnóstico antenatal es útil en terapia fetal, diagnóstico de aneuploidías y, especialmente, en terapia neonatal. Esto es válido en países desarrollados, con muchos centros cardioquirúrgicos de rápido acceso para todos los habitantes; como Chile está lejos de esta realidad, se implementó, dentro del sistema AUGE, la medida de tamizaje de cardiopatías congénitas, cuya eficacia debería ser muy alta, ya que al diagnóstico prenatal permitirá permanecer vivos y, probablemente, sanos, a niños que de otro modo fallecerían poco tiempo después de nacer.

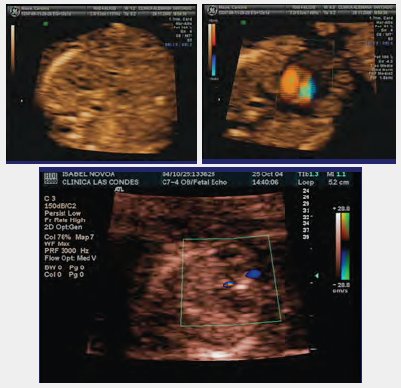 Figura 1. Ecocardiografía en feto de 12 semanas de gestación. Síndrome de hipoplasia ventricular izquierda.
Figura 1. Ecocardiografía en feto de 12 semanas de gestación. Síndrome de hipoplasia ventricular izquierda.

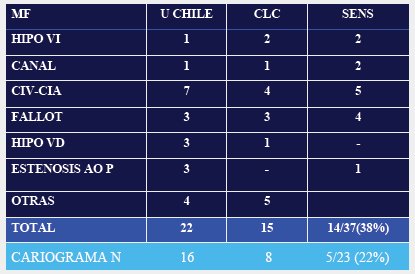 Tabla I. Translucencia nucal y cardiopatía. U Chile = Universidad de Chile
Tabla I. Translucencia nucal y cardiopatía. U Chile = Universidad de Chile

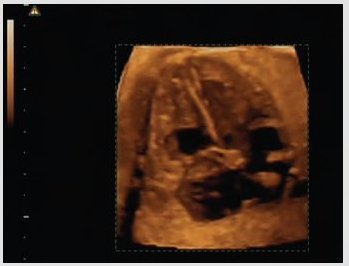 Figura 2. Examen cardiológico mediante Ultrasonido 3D
Figura 2. Examen cardiológico mediante Ultrasonido 3D

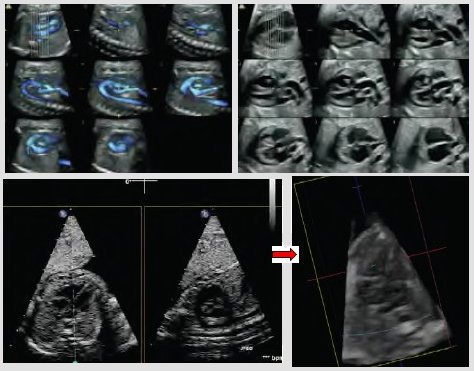 Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)
Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)

Esta
obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Figura 1. Ecocardiografía en feto de 12 semanas de gestación. Síndrome de hipoplasia ventricular izquierda.
Figura 1. Ecocardiografía en feto de 12 semanas de gestación. Síndrome de hipoplasia ventricular izquierda.

 Tabla I. Translucencia nucal y cardiopatía. U Chile = Universidad de Chile
Tabla I. Translucencia nucal y cardiopatía. U Chile = Universidad de Chile

 Figura 2. Examen cardiológico mediante Ultrasonido 3D
Figura 2. Examen cardiológico mediante Ultrasonido 3D

 Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)
Figura 3. Examen cardiológico mediante STIC (Spatio-Temporal Image Correlation)









 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
Hernán Muñoz[1]
Expositor:
Hernán Muñoz[1]

