Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Vacunas para el Nuevo Milenio, organizado en Santiago por la Sociedad Chilena de Infectología desde el 8 al 10 de agosto de 2005.
Directora del Curso: Dra. María Teresa Valenzuela.
El título de esta exposición: “Al fin una realidad”, se debe a que hace siete años se pensó que esta realidad había llegado con la vacuna Rotashield® de Wyeth Lederle; pero esta vacuna fue retirada mercado. Por eso, aunque en 1998 fue una posibilidad, en 2005 finalmente ha llegado a ser una realidad.
El nombre de este virus proviene del latín “rota,” que significa rueda. Detectado por primera vez en seres humanos en 1973, en biopsia duodenal de niños australianos con diarrea aguda severa, es el patógeno más común de diarrea severa en el mundo y afecta por igual a países industrializados y subdesarrollados, ya que la mejoría de la higiene ambiental no controla la infección. Es la causa de 600.000 muertes por año, principalmente en países en desarrollo, y se estima que cada minuto muere un niño en el mundo debido al Rotavirus.
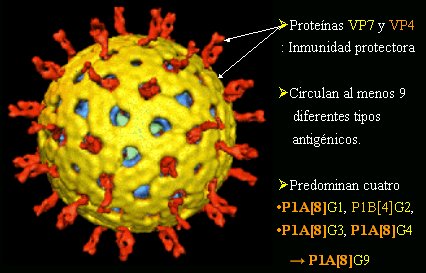
Para comprender el desarrollo de la vacuna antirotavirus, se debe entender el concepto de serotipos o linajes. Este virus se compone de tres cápsides, que son tres esferas, una dentro de la otra (Fig. 1). La cápside más interna aparece en verde claro, la intermedia en azul y la externa en amarillo; a través de la cápside externa emergen proyecciones (en rojo) que corresponde a una proteína fundamental para la introducción del virus a la célula intestinal. Esto según los conocimientos actuales, porque el conocimiento va avanzando y otras proteínas podrían tener un papel importante.
Figura 1. Estructura del Rotavirus
Las experiencias en animales, en cultivos celulares y el correlato de protección en seres humanos apoyan con fuerza la hipótesis de que las dos proteínas relacionadas con la inmunidad antirotavirus forman parte de la cápside externa: la proteína VP7, que forma la matriz en amarillo; y la proteína VP4, que forma las espigas. Como la proteína VP7 es una glicoproteína, se denomina también proteína G, y como la proteína VP4 es proteasa sensible, se denomina proteína P.
Igual que la mayoría de los microorganismos, desde virus a bacterias, circulan diferentes combinaciones de serotipos dados, en este caso, por combinaciones de VP7 y VP4. Podría haber muchas combinaciones diferentes de VP7 y VP4 que afecten a seres humanos y se ha descrito al menos 9, en escala mundial, en más de 500 publicaciones que aparecen en Pubmed; de las 9 combinaciones de tipo G y P, 4 tienden a predominar, las que representan más de 90% de las combinaciones descritas: la proteína VP7 G1, G2, G3 y G4. G1, G3 y G4 se combinan con el mismo tipo de VP4, que es P8, de tal manera que en escala mundial circulan mucho G1P8, G3P8 y G4P8, y también circula G2P4. El virus G2 es completamente diferente en relación con VP7 y VP4, porque no comparte la proteína VP4. Durante los 5 últimos años ha surgido otro serotipo, G9, en Brasil, México, Australia, Inglaterra y es probable que en la actualidad circule en todo el mundo; afortunadamente, G9 tiende a asociarse con VP4 P8, por lo cual comparte VP4, en cierta forma, con G1, G3 y G4.
Este concepto es muy relevante para comprender las estrategias de vacunas que se han desarrollado.
Las vacunas monovalentes, que fueron la primera estrategia que se desarrolló, se basaron en la hipótesis de que, si bien hay varios serotipos circulantes, una vacuna con una sola combinación de VP7 y VP4, de un solo serotipo, podría provocar inmunidad cruzada contra los otros serotipos, ya sea por compartir la proteína VP4 o por otros referentes antigénicos que se desconocen.
Esta estrategia, en la década de 1980, utilizó rotavirus bovino u ovino, que difiere en VP7 y VP4, postulándose la posibilidad de una inmunidad cruzada amplia. Se realizaron varios estudios con vacunas obtenidas de animales y se encontró protección, pero no fue óptima, y se tendió a abandonar esta estrategia. Sin embargo, existe una cepa de rotavirus obtenida de ovejas, de un serotipo completamente distinto al VP7 y VP4 humanos, que se utiliza en China, desde hace varios años, en el mercado privado; no hay información científica sobre su rendimiento ni sobre su seguridad.
Luego se comenzaron a estudiar vacunas monovalentes humanas, basadas en el concepto de que un rotavirus obtenido de un ser humano protegerá más eficientemente contra infección que un virus obtenido de un animal. Esta fue la base de la vacuna Rotarix®, del laboratorio GlaxoSmithKline, que utilizó un rotavirus humano, la cepa 8912 originaria de un niño infectado en Cincinnati, Estados Unidos. Esa cepa la tomó el grupo del Gamble Institute, en Estados Unidos, Cincinnati, la atenuó en el laboratorio y después la cedió a GlaxoSmithKline, que realizó un clonaje y varios pasajes más, para asegurar la atenuación.
En las unidades de recién nacidos se ha detectado rotavirus de serotipos especiales, en relación con su VP4, que tienden a causar escasa enfermedad en los recién nacidos, por lo que se piensa que son cepas naturalmente atenuadas. No se sabe por qué sucede lo anterior ni por qué circulan en algunas unidades de recién nacidos, aunque hay varias teorías al respecto. Estas cepas, que podrían ser naturalmente atenuadas por su estructura, se están usando como candidatas a vacunas y se encuentran en estudios tempranos de fase 1 y 2.
Las vacunas multivalentes entraron en desarrollo durante la década de 1990 y la primera vacuna licenciada fue Rotashield (R), basada en el concepto de que la vacuna debe proteger contra todos los serotipos prevalentes en escala mundial; por tanto, debe abarcar, por lo menos, G1, G2, G3 y G4.
Esta estrategia se basa en utilizar virus recombinante animal-humano. Es más fácil trabajar con virus obtenidos de animales en laboratorio que con virus humanos; estos virus se co-cultivan con virus humanos para obtener virus recombinantes en donde su cobertura externa, su VP7 o VP4, sea de origen humano. Por lo tanto, se obtiene un virus con las proteínas propias de un virus animal, excepto la proteína externa, la que se recombina con las proteínas VP4 o VP7 de un virus humano. Rotashield tenía cuatro virus de base simia, pero el abrigo VP7 era G1 humano, G2 humano y G4 humano. Como el virus simio G3 era en todo parecido al G3 humano, se dejó también el virus simio nativo, de tal manera que la vacuna tenía estos 4 virus: 3 recombinados y uno nativo.
Merck siguió la misma estrategia con su vacuna Rotateq (R). En este caso, el origen no es simio, es una vacuna de origen bovino de serotipos diferentes a los humanos, los que se han recombinado con cinco virus humanos: VP7 G1, G2, G3, G4 y un P8, de tal manera que son cinco virus recombinados, cada uno de los cuales tiene un antígeno recombinante. Las vacunas que están licenciadas en este momento son la de oveja, en China; Rotarix, que está licenciada en Latinoamérica y Europa y algunos países africanos; y Rotateq, que está en fase Licenciamiento en Estados Unidos y algunos países de América Latina.
Con la vacuna Rotashield surgió un problema. Se estudió extensamente, durante 17 años, en cuatro estudios de campo importantes. En América Latina, la eficacia de esta vacuna contra todo tipo de infección por rotavirus (leve, moderada o grave) fue de alrededor de 50%, la cual fue más alta en Finlandia, y la protección contra infección grave fue 80%, porcentaje que se consideró suficiente para una vacuna entérica. Sin embargo, en los estudios de fase 2 y 3, se observó una leve tendencia a un mayor número de invaginaciones intestinales en los niños vacunados (5 casos en 10.054 niños vacunados, versus 1 caso en 4633 niños que recibieron placebo), pero la cifra no fue estadísticamente significativa y, con el apoyo de la Academia Americana de Pediatría se aprobó la vacuna para su uso universal en Estados Unidos, con advertencia de la necesidad de vigilar los casos de invaginación intestinal.
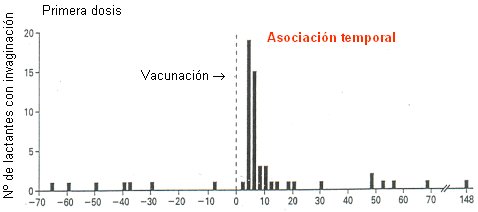
Esta vacuna se licenció en Estados Unidos en 1998, hubo vigilancia post comercialización de efectos adversos y se pudo observar una acumulación de casos de invaginación intestinal dentro de las dos primeras semanas siguientes a la vacunación (Fig. 2), especialmente después de la primera dosis de vacuna. Esto se observó después de haber administrado alrededor de 1.800.000 dosis, en aproximadamente 600.000 niños. No hubo una gran cantidad de casos de invaginación intestinal, alrededor de 60 casos en 600.000 niños vacunados, con un riesgo atribuible estimado de 1/10.000 niños vacunados, lo que significa que de 10.000 niños que recibieran esta vacuna en un programa, 1 desarrollaría una invaginación intestinal.
Figura 2. Rotashield e invaginación (Murphy et al, N Engl J Med 2001 344 564–72).
Es importante hacer notar que estudios posteriores destinados a determinar la incidencia de invaginación intestinal ideopática mostraron que de cada 10.000 niños, 5 desarrollan invaginaciones intestinales idiopáticas en forma natural, antes del año de vida, por múltiples motivos, entre ellos la predisposición genética, y en muchos casos por causas desconocidas. De haberse implementado un Programa de vacunación con Rotashield con el riesgo atribuible señalado, en vez de 5 invaginaciones esperadas en 10.000 niños, habrían ocurrido seis.
Dos casas comerciales aceptaron la tarea, junto con investigadores de nivel mundial y con el apoyo de la OMS y otras instituciones, de seguir adelante con el desarrollo de vacunas antirotavirus. El desafío era mayúsculo, porque junto con demostrar eficacia adecuada, las nuevas vacunas deberían demostrar su seguridad y su no asociación con invaginación intestinal.
La mayor cantidad de información disponible se refiere a la vacuna GSK cepa 89-12, vacuna humana atenuada cuya cepa original es la 89-12 y tiene sólo un serotipo, el G1P8, que es el más prevalente en escala mundial: representa más de 60% circulante en todo el mundo. Terminó el estudio de fase III y la vacuna está en fase de licenciamiento.
La otra es la vacuna recombinante bovina pentavalente MSD, vacuna bovina-humana G1, G2, G3, G4, P(8)1A (P7G6), de Merck Sharp & Dome. El serotipo bovino es un P7G6, completamente diferente a los serotipos que infectan a seres humanos, y ha sido recombinado con los otros 5 serotipos VP7 y VP4 humanos, para tener 5 virus recombinados en una vacuna. También ha terminado el estudio de fase III y está en fase de licenciamiento (Nota del autor: en el momento de esta presentación, la vacuna no había sido aún licenciada en los Estados Unidos).
Concentraré la exposición en Rotarix, porque tenemos mucha experiencia con ella, pero mencionaremos cuando corresponda los avances con Rotateq, que es la vacuna de Merck y cuyos resultados no están aún publicados; la información disponible se presentó hace un mes en un congreso en Valencia (Nota del autor: en el momento de esta presentación no había sido publicado el estudio de Fase III).
Rotarix se compone de un virus vivo atenuado de la cepa 9-12, monovalente, P1A(P8)G1, que confiere protección cruzada contra cepas G3, G4 y G9, porque comparte la proteína VP4, y tal vez contra G2, por otros serotipos. Como Rotateq tiene los cinco serotipos incorporados, se puede esperar que proteja contra los cinco. En ambas vacunas la administración es vía oral: Rotarix es una vacuna liofilizada, por lo que se debe reconstituir con un buffer y se administra con una jeringuilla; la vacuna Rotateq viene líquida, en un frasco plástico, de manera que sólo se da vuelta, se aprieta y caen las gotas.
Rotarix se administra en dos dosis, la primera entre las 6 y 14 semanas, y la segunda, entre las 14 y 24 semanas; la intención es administrarla junto con las otras vacunas del Programa Ampliado de Inmunizaciones (PAI), con un intervalo mínimo de 1 mes entre dosis. Los estudios realizados para ver si hay interferencia con la vacuna antipolio oral demostraron que no hay competencia significativa. En el caso de Rotateq, es necesario administrar tres dosis, a los 2, 4 y 6 meses de edad, también junto con las otras vacunas del PAI, pero no se ha hecho estudios para determinar el grado de interferencia con antipolio oral. Con la vacuna Rotarix (Fig. 3); el adminículo de transferencia se coloca encima de la tapa y se inyecta el fluido que viene en la jeringuilla; no hay aguja de por medio y se utiliza la misma jeringuilla para adminsitrar la vacuna.
Figura 3. Vacuna monodosis liofilizada Rotarix (Vacuna humana RV)
Se ha completado un número importante de estudios de la vacuna Rotarix que avalan su eficacia y su seguridad. Hay dos estudios fase I en adultos y niños, en Bélgica y Alemania, y 8 estudios fase II en Canadá, Europa, Asia, África y América Latina, con más de 7.000 niños registrados, más de 11.000 dosis administradas; se siguió a la mayoría de los niños hasta el año de edad. Antes de la experiencia con Rotashield, lo anterior habría bastado para licenciar una vacuna, pero, como con esta vacuna la invaginación intestinal ocurre con una frecuencia de 1/10.000 niños, se necesitaba más de 60.000 niños para hacer este estudio.
Los objetivos de los estudios fase II fueron los de determinar seguridad y reactogenicidad, inmunogenicidad y eficacia con diferentes dosis, diferentes edades de administración (complementación PAI), con vacuna concomitante y sin ella (OPV, DTPc y DTPa y combinaciones (Hep B, Hib), con lactancia materna y sin ella. Los objetivos del estudio Rotarix fase IIb en América Latina incluyeron evaluar reactogenicidad, eficacia y perfil de seguridad en alrededor de 2.000 niños registrados en México, Venezuela y Brasil.
Los resultados demostraron que Rotarix es muy poco reactogénica, menos que Rotashield, ya que la incidencia de fiebre superior a 38,5ºC, después ya sea de la primera o de la segunda dosis, tos, diarrea, vómitos, irritabilidad y pérdida del apetito, fue exactamente igual que en el grupo que recibió placebo, es decir, esta vacuna se comportó igual que el placebo en cuanto a reactogenicidad. En cuanto a inmunogenicidad, esta vacuna fue lo bastante inmunogénica como para seguir adelante con los estudios de eficacia.
Con respecto a seguridad, era muy importante que, en los estudios de fase II, esta vacuna no mostrara una tendencia de aumento de casos de invaginación como la que mostró Rotashield. Por fortuna no fue así, como lo demuestra la sumatoria de 8 estudios fase II, con 7.072 niños registrados, de los cuales 5.292 recibieron la vacuna y 1.780 recibieron placebo, en una proporción 3:1, exactamente la misma que se encontró para invaginación intestinal, ya que hubo 4 casos en total, 3 en el grupo de vacunados y 1 en el grupo placebo. Por otra parte, hubo 15 fallecidos, 9 entre los vacunados y 6 en el grupo placebo, es decir, la vacuna no se asoció con mayor mortalidad. Estos resultados dieron la luz verde para pasar a los estudios fase III (Human Rotavirus Vaccine Investigator Brochure, marzo 2004).
Respecto a eficacia, los estudios efectuados en América Latina fueron muy prometedores. Al comparar la columna en rojo versus placebo (Tabla I), se observa que se encontró 86% de protección contra gastroenteritis grave por rotavirus y 70% contra toda gastroenteritis. Hubo 79% de protección contra hospitalización por gastroenteritis secundaria a rotavirus. Todas estas cifras validan que se trata de una buena vacuna.
Tabla I. Eficacia de Rotarix (VED April 2004, Jamaica. GSK human rotavirus vaccine (51 episodios en 49 sujetos)
La vacuna demostró protección, no sólo contra G1 sino también contra los otros serotipos (la mitad de los serotipos que circularon en América Latina durante este estudio fueron G9). Hubo 17 casos de gastroenteritis grave por rotavirus no G1 en el grupo placebo, versus 3 en el grupo vacunado, es decir, la vacuna otorgó 83% de protección contra rotavirus no G1, lo que demostró la protección cruzada.
Se desarrolló, por último, el estudio fase III, de seguridad y eficacia, estudio que nos tocó liderar. Fue un estudio de gran magnitud; de hecho, en América Latina es uno de los estudios más grandes que se ha realizado sobre vacunas. Participaron 11 países latinoamericanos y Finlandia; se registraron 63.225 niños, en un tiempo récord de 8 meses, y ya concluyó la etapa de seguridad, en la cual se hizo vigilancia activa de la invaginación intestinal. También concluyó el primer año de seguimiento por eficacia y está en marcha el segundo año.
Un grupo de 31.673 niños recibió placebo y se evaluó de manera muy estricta la aparición de invaginación intestinal: al mes después de la primera dosis, dentro del mes de colocada la segunda dosis y también fuera de una ventana de 30 días, que se estableció porque con Rotashield la mayoría de los casos de invaginación intestinal ocurrió entre dos y tres semanas después de la dosis.
Hubo 7 casos de invaginación intestinal dentro de la ventana de 30 días después de las dosis 1 y 2, en niños con placebo, y hubo 9 casos más hasta los 6 meses de edad, con un total de 16 casos entre cerca de 32.000 niños; es decir, 1 de cada 2.000 niños del grupo placebo presentó invaginación intestinal idiopática no asociada con vacuna, resultado comparable al que encontramos en nuestro estudio de vigilancia de invaginación.
En un número similar de niños vacunados, hubo 6 casos de invaginación intestinal en la ventana versus 7 con placebo; y 3 casos fuera de la ventana, es decir, hubo un total de 9 casos de invaginación intestinal en niños vacunados, con un riesgo diferencial negativo, lo cual plantearía que la vacuna incluso podría proteger contra la invaginación intestinal, pero el intervalo de confianza pasa por 1, por lo tanto, lo que se puede decir con certeza es que esta vacuna no se asocia con un aumento de invaginación intestinal. Con Rotateq se hizo el mismo estudio, en 70.000 niños de Estados Unidos y Europa, y se llegó a la misma conclusión.
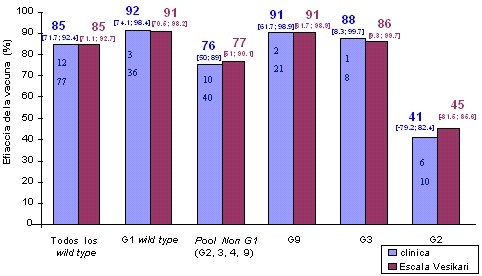
La cohorte de eficacia de Rotarix fue de 20.169 lactantes (alrededor de 5.000 en el caso de Rotateq); de ellos, 10.159 recibieron vacuna y 10.010, placebo; el período de vigilancia fue de 9 a 10 meses, hasta el año de edad. El objetivo primario fue determinar la prevención de gastroenteritis grave causada por rotavirus, 14 días después de la segunda dosis, hasta el año de edad. Se definió como gastroenteritis grave todo episodio que requiriera rehidratación oral o endovenosa, según el plan B o C de la OMS, u hospitalización. Los resultados fueron los siguientes (Fig. 4):
Figura 4. Resultados: Eficacia vacunal contra GE grave por RV por serotipo, desde 14 días post dosis 2 hasta los 12 meses de edad. Cohorte de eficacia ATP (Velázquez FR et al. Oral presentation at ESPID 2005, abstract 51)
Es muy importante destacar que se observó 40% de reducción de las hospitalizaciones por gastroenteritis grave de cualquier etiología, lo que incluso supera el componente rotaviral encontrado en nuestro estudio; lo anterior hace pensar que podrían haber ocurrido más diarreas por rotavirus que lo que pudo detectar el método ELISA. Este nivel de protección global contra hospitalización por gastroenteritis significa un impacto importante en el ámbito de la salud pública.
Rotateq ha demostrado protección similar, sobre 85% en los estudios de campo, pero no se ha podido demostrar que proteja contra todos los serotipos aún, porque circularon un número limitado de ellos durante el estudio. Hubo una tendencia con G3, pero no se pudo demostrar protección cruzada en los 5.000 niños que se siguieron para los otros serotipos; pero es probable que produzca el mismo tipo de protección.
La vacuna antirotavirus humana atenuada Rotarix ha demostrado las características siguientes:
La información científica, obtenida primordialmente en las regiones más necesitadas del mundo, avala que estamos frente a una vacuna antirotavirus que protegerá de manera eficaz y segura a los infantes del mundo.
En la fotografía aparece el primer niño que recibió la vacuna antirotavirus en México, fuera del programa de vacunas (Fig. 5).
Figura 5. Primer niño que recibe la vacuna antirotavirus Rotarix (México)








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso Vacunas para el Nuevo Milenio, organizado en Santiago por la Sociedad Chilena de Infectología desde el 8 al 10 de agosto de 2005.
Directora del Curso: Dra. María Teresa Valenzuela.
 Expositor:
Miguel O’Ryan[1]
Expositor:
Miguel O’Ryan[1]

Citación: O’Ryan M. Rotavirus vaccine: at last a reality. Medwave 2006 May;6(4):e3231 doi: 10.5867/medwave.2006.04.3231
Fecha de publicación: 1/5/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión