 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Simposio Problemas Reumatológicos del Adulto Mayor, organizado en Santiago por la Sociedad Chilena de Reumatología los días 28 y 29 de mayo de 2004.
Presidente: Dr. Carlos Fuentealba. Secretario Ejecutivo: Dr. Pedro Miranda.
Los glucocorticoides (GC) son usados frecuentemente en el tratamiento de numerosas enfermedades inflamatorias reumáticas, broncopulmonares, intersticiales, cutáneas o vasculíticas.
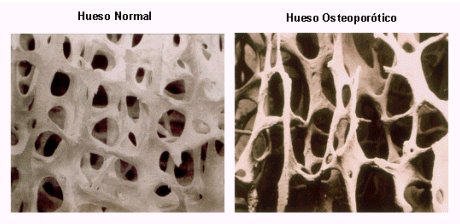
La osteoporosis se define como una enfermedad sistémica caracterizada por baja masa ósea y alteración de la microarquitectura del hueso, con el consecuente aumento de la fragilidad ósea y susceptibilidad a la fractura. En la figura 1 se puede ver la diferencia entre un hueso normal y un hueso osteoporótico.
Figura 1. Arquitectura del hueso normal y osteoporótico.
Se ha demostrado que los GC usados por vía oral y parenteral producen pérdida ósea y aumentan el riesgo de fractura; existe, asimismo, cierta evidencia que demuestra que los GC inhalados en altas dosis podrían tener efectos adversos en el esqueleto. La prevalencia de osteoporosis (OP) en pacientes que reciben GC por más de 6 meses alcanza el 50%, siendo la causa mas común de OP secundaria.
No es fácil evaluar la acción precisa de los GC en el esqueleto y separarla de la enfermedad de base por la cual fueron prescritos; si se suman a esto la presencia de otros factores de riesgo individual, genéticos o ambientales, especialmente cuando estamos analizando una población de adultos mayores, la dificultad aumenta.
Esto se puede ilustrar con la Artritis Reumatoidea, que se asocia a pérdida ósea local y generalizada y a mayor incidencia de fracturas osteoporóticas. En un estudio realizado por nuestro grupo de trabajo en una serie de 177 pacientes con Artritis Reumatoidea, compuesta por 164 mujeres y 13 hombres, con una edad promedio de 51 ± 13 años, analizamos diferentes factores de riesgo y uno de los pocos que fueron significativamente independientes, en el análisis multivariado, fue la dosis acumulativa de GC (prednisona sobre 10 g).
La patogénesis de la OP inducida por GC es multifactorial y no se conoce completamente. Los GC alteran el balance entre formación y resorción ósea; al comienzo, el aumento de la resorción ósea parece ser especialmente responsable de la pérdida acelerada de masa ósea, pero el mecanismo principal del efecto deletéreo de los GC en el hueso, a la larga, sería la disminución de la formación ósea. Estos efectos se atribuyen a la reducción de la secreción de hormonas sistémicas, directa o indirectamente, por el exceso de GC.
Los GC inhiben la absorción intestinal de calcio por una acción independiente de vitamina D, a la vez que aumentan la excreción urinaria del mineral, al reducir su reabsorción tubular, lo que produce un balance negativo de calcio y un aumento de la secreción de hormona paratiroidea, que, a su vez, estimula la reabsorción ósea por los osteoclastos. Por otro lado, los GC disminuyen la secreción de esteroides adrenales y gonadales, al suprimir la secreción de hormonas pituitarias.
Estos cambios ayudan a comprender los hallazgos clínicos y son la base de algunas intervenciones importantes para la prevención y tratamiento de la OP inducida por GC, pero no explican totalmente el proceso a nivel tisular.
Existen evidencias de que los GC pueden alterar la producción de citoquinas y factores de crecimiento a nivel local, produciendo cambios en el equilibrio óseo. Se ha comunicado disminución de la producción de colágeno tipo I, osteocalcina, IGF1 y proteínas de unión (binding proteins) ; los GC bloquean la osteoprogesterina, estimulan la expresión de RANKL en los osteoblastos y prolongan la sobrevida de los osteoclastos, lo que podría explicar la fase inicial de pérdida ósea rápida con el tratamiento con GC.
Una buena noticia es que la pérdida ósea inducida por GC es reversible, lo que ha sido demostrado en pacientes con Síndrome de Cushing; datos epidemiológicos indican que el riesgo de fractura se reduce significativamente en pacientes tratados con GC, al suspender el tratamiento.
Como primera medida es muy importante la medición de densidad ósea en pacientes que comienzan tratamiento prolongado con GC, especialmente si estamos frente a una población mayor, que necesariamente incluye mujeres postmenopáusicas.
Se debe tener en cuenta que no se ha determinado en forma precisa el umbral de fractura, pero claramente se produce a valores de densidad ósea más altos que en las personas que no consumen GC. Algunos investigadores sugieren considerar como T score crítico el valor de -1,5 en vez de -2,5 para pacientes con dosis mayores de 7,5 mg diarios de prednisona, o equivalentes.
Se debe utilizar la menor dosis posible de GC. Con respecto al uso de esquema de días alternos, éste puede ser útil en niños, pero no se ha demostrado lo mismo en adultos. Van Staa, en un estudio realizado en 244.235 pacientes tratados con GC versus 244.235 controles, encontró que el riesgo de fractura de cadera se dobla y el de fractura vertebral se quintuplica cuando se utilizan dosis orales de prednisona sobre 7,5 mg diarios.
Las diferentes intervenciones farmacológicas para la prevención y tratamiento de la OP inducida por GC tienen por objeto aumentar la absorción intestinal y disminuir la excreción urinaria de calcio, disminuir la reabsorción y estimular la formación ósea y, mejor aún, lograr una combinación de todo esto.
Se han publicado pocos estudios bien controlados con respecto al uso de calcio, vitamina D o sus metabolitos y tiazidas; también existen datos limitados sobre el uso de terapia de reemplazo hormonal (TRH) y calcitonina. En cambio, existen estudios bien diseñados con bisfosfonatos (etidronato, alendronato y risedronato) que demuestran la eficacia de estos compuestos en la prevención y tratamiento de la OP inducida por GC.
La hormona paratiroidea es una opción prometedora.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Simposio Problemas Reumatológicos del Adulto Mayor, organizado en Santiago por la Sociedad Chilena de Reumatología los días 28 y 29 de mayo de 2004.
Presidente: Dr. Carlos Fuentealba. Secretario Ejecutivo: Dr. Pedro Miranda.
 Expositora:
Marina Arriagada[1]
Expositora:
Marina Arriagada[1]

Citación: Arriagada M. Glucocorticoid-induced osteoporosis in the elderly. Medwave 2004 Dic;4(11):e3226 doi: 10.5867/medwave.2004.11.3226
Fecha de publicación: 1/12/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 ACR Task Force on Osteoporosis Guidelines: Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheum. 1996 Nov;39(11):1791-801. | CrossRef | PubMed |
ACR Task Force on Osteoporosis Guidelines: Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheum. 1996 Nov;39(11):1791-801. | CrossRef | PubMed | Adachi JD, Bensen WG, Brown J, Hanley D, Hodsman A, Josse R, et al. Intermittent etidronate therapy to prevent corticosteroid-induced osteoporosis. N Engl J Med. 1997 Aug 7;337(6):382-7. | CrossRef | PubMed |
Adachi JD, Bensen WG, Brown J, Hanley D, Hodsman A, Josse R, et al. Intermittent etidronate therapy to prevent corticosteroid-induced osteoporosis. N Engl J Med. 1997 Aug 7;337(6):382-7. | CrossRef | PubMed | Adachi JD, Saag KG, Delmas PD, Liberman UA, Emkey RD, Seeman E, et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial. Arthritis Rheum. 2001 Jan;44(1):202-11.
| CrossRef | PubMed |
Adachi JD, Saag KG, Delmas PD, Liberman UA, Emkey RD, Seeman E, et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial. Arthritis Rheum. 2001 Jan;44(1):202-11.
| CrossRef | PubMed | Amin S. A meta-analysis ranking efficacy of treatments for corticosteroid-induced osteoporosis. Arthritis Rheum 1998;41(suppl 9):5137.
Amin S. A meta-analysis ranking efficacy of treatments for corticosteroid-induced osteoporosis. Arthritis Rheum 1998;41(suppl 9):5137.  Arriagada M. Inflammatory Rheumatic Diseases and Osteoporosis Proceedings. XIX ILAR Congress of Rheumatology Communications Consultants, Singapore 1997:292-296.
Arriagada M. Inflammatory Rheumatic Diseases and Osteoporosis Proceedings. XIX ILAR Congress of Rheumatology Communications Consultants, Singapore 1997:292-296.  Cohen S, Levy RM, Keller M, Boling E, Emkey RD, Greenwald M, Risedronate therapy prevents corticosteroid-induced bone loss: a twelve-month, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Arthritis Rheum. 1999 Nov;42(11):2309-18. | CrossRef | PubMed |
Cohen S, Levy RM, Keller M, Boling E, Emkey RD, Greenwald M, Risedronate therapy prevents corticosteroid-induced bone loss: a twelve-month, multicenter, randomized, double-blind, placebo-controlled, parallel-group study. Arthritis Rheum. 1999 Nov;42(11):2309-18. | CrossRef | PubMed | Dalle Carbonare L, Arlot ME, Chavassieux PM, Roux JP, Portero NR, Meunier PJ. Comparison of trabecular bone microarchitecture and remodeling in glucocorticoid-induced and postmenopausal osteoporosis. J Bone Miner Res. 2001 Jan;16(1):97-103. | CrossRef | PubMed |
Dalle Carbonare L, Arlot ME, Chavassieux PM, Roux JP, Portero NR, Meunier PJ. Comparison of trabecular bone microarchitecture and remodeling in glucocorticoid-induced and postmenopausal osteoporosis. J Bone Miner Res. 2001 Jan;16(1):97-103. | CrossRef | PubMed | Eastell R. Management of corticosteroid-induced osteoporosis. UK Consensus Group Meeting on Osteoporosis. J Intern Med. 1995 May;237(5):439-47. | CrossRef | PubMed |
Eastell R. Management of corticosteroid-induced osteoporosis. UK Consensus Group Meeting on Osteoporosis. J Intern Med. 1995 May;237(5):439-47. | CrossRef | PubMed | Eastell R, Reid DM, Compston J, Cooper C, Fogelman I, Francis RM, et al. A UK Consensus Group on management of glucocorticoid-induced osteoporosis: an update. J Intern Med. 1998 Oct;244(4):271-92. | CrossRef | PubMed |
Eastell R, Reid DM, Compston J, Cooper C, Fogelman I, Francis RM, et al. A UK Consensus Group on management of glucocorticoid-induced osteoporosis: an update. J Intern Med. 1998 Oct;244(4):271-92. | CrossRef | PubMed | Gulko PS, Mulloy AL. Glucocorticoid-induced osteoporosis: pathogenesis, prevention and treatment. Clin Exp Rheumatol. 1996 Mar-Apr;14(2):199-206. | PubMed |
Gulko PS, Mulloy AL. Glucocorticoid-induced osteoporosis: pathogenesis, prevention and treatment. Clin Exp Rheumatol. 1996 Mar-Apr;14(2):199-206. | PubMed | Lane NE, Sanchez S, Modin GW, Genant HK, Pierini E, Arnaud CD. Parathyroid hormone treatment can reverse corticosteroid-induced osteoporosis. Results of a randomized controlled clinical trial. J Clin Invest. 1998 Oct 15;102(8):1627-33. | CrossRef | PubMed | PMC |
Lane NE, Sanchez S, Modin GW, Genant HK, Pierini E, Arnaud CD. Parathyroid hormone treatment can reverse corticosteroid-induced osteoporosis. Results of a randomized controlled clinical trial. J Clin Invest. 1998 Oct 15;102(8):1627-33. | CrossRef | PubMed | PMC | Manolagas SC, Weinstein RS. New developments in the pathogenesis and treatment of steroid-induced osteoporosis. J Bone Miner Res. 1999 Jul;14(7):1061-6. | CrossRef | PubMed |
Manolagas SC, Weinstein RS. New developments in the pathogenesis and treatment of steroid-induced osteoporosis. J Bone Miner Res. 1999 Jul;14(7):1061-6. | CrossRef | PubMed | Reid DM, Hughes RA, Laan RF, Sacco-Gibson NA, Wenderoth DH, Adami S, et al. Efficacy and safety of daily risedronate in the treatment of corticosteroid-induced osteoporosis in men and women: a randomized trial. European Corticosteroid-Induced Osteoporosis Treatment Study. J Bone Miner Res. 2000 Jun;15(6):1006-13. | CrossRef | PubMed |
Reid DM, Hughes RA, Laan RF, Sacco-Gibson NA, Wenderoth DH, Adami S, et al. Efficacy and safety of daily risedronate in the treatment of corticosteroid-induced osteoporosis in men and women: a randomized trial. European Corticosteroid-Induced Osteoporosis Treatment Study. J Bone Miner Res. 2000 Jun;15(6):1006-13. | CrossRef | PubMed | Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-Induced Osteoporosis Intervention Study Group. N Engl J Med. 1998 Jul 30;339(5):292-9. | CrossRef | PubMed |
Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-Induced Osteoporosis Intervention Study Group. N Engl J Med. 1998 Jul 30;339(5):292-9. | CrossRef | PubMed |