 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso de Educación Continua en Obesidad, organizado en Santiago por la Sociedad Chilena de Obesidad desde el 13 de abril al 15 de junio de 2005.
Director del Curso: Dr. Alex Valenzuela.
El tratamiento médico debe ser integral y se apoya en los clásicos pilares fundamentales conocidos por todos (dietoterapia, actividad física, modificación conductual y farmacoterapia, siendo la cirugía opcional sólo para un grupo minoritario seleccionado de pacientes), pero todavía falta mucho para poder decir que contamos con un tratamiento exitoso en términos de reducción de peso, ya que actualmente nos conformamos con una baja de peso corporal de alrededor de 10%, en parte porque es posible lograrla y mantenerla, además de tener un gran impacto positivo en términos de salud. No obstante, el ideal sería poder lograr la normalización completa del peso corporal y mantenerla en el tiempo, sin mayores sacrificios.
La ingesta de calcio y su relación con la obesidad es un aspecto muy interesante de la investigación actual. Muchas publicaciones demuestran una relación inversamente proporcional entre la ingesta de calcio y el peso corporal; es decir, cuando hay déficit de calcio aumenta la ganancia de peso.
El estudio de esta relación comenzó hace alrededor de 10 años, cuando se detectó que los pacientes cuya ingesta de calcio era baja desarrollaban no sólo más hipertensión sino también obesidad. Posteriormente quedó claro que el calcio tiene una acción anti obesidad y que una ingesta deficiente en calcio promueve la ganancia de peso, ya que, paradójicamente, cuanto menos calcio se ingiere, más calcio ingresa a la célula adiposa.
El calcio disminuye la absorción de las grasas intestinales, formando una especie de jabón, una mezcla insoluble. La membrana adipocitaria tiene receptores para la 1,25 dihidroxivitamina D3, que se eleva en respuesta a la baja ingesta de calcio; al unirse esta vitamina con el receptor adipocitario se genera un traspaso rápido de calcio al interior de la célula adipocitaria, estimulándose la lipogénesis y disminuyendo la lipólisis.
Diversos estudios en seres humanos muestran esta relación inversa entre ingesta de calcio y peso corporal. A fines de 2004 el equipo de Zemel, de los Estados Unidos, que es el que más ha estudiado la relación del calcio con la obesidad, publicó un estudio cuyo objetivo fue determinar si la administración de calcio, ya sea dietario o como suplemento (en este caso, como carbonato de calcio), aceleraba la baja de peso inducida por una restricción calórica de alrededor de 600 calorías/día. La muestra fue de 32 personas, adultas, obesas, que fueron estudiadas durante 6 meses.
Los pacientes se separaron en tres grupos (Figura 1). Los del grupo A ingirieron 500 a 600 mg/día de calcio dietario y se les administró una cápsula placebo; los del B ingirieron la misma cantidad de calcio dietario, pero se les administró una cápsula que contenía 800 mg de calcio y los del grupo C ingirieron sólo calcio dietario, 1200 a 1300 mg/día, junto con una cápsula placebo.
Se observó que el grupo A perdió 6,4% de su peso corporal en 6 meses; el grupo B perdió 8,6% del peso, es decir, 26% más que el grupo A; y el grupo C fue el que más bajó de peso, ya que perdió 10,9%, lo que significa un 70% más de pérdida que el grupo A, y, además, en este grupo se alcanzó el objetivo de lograr una baja de peso de 10%, por lo menos. Con estos resultados se concluyó que el aporte de calcio extra es un buen método para potenciar la baja de peso, pero es mejor si proviene de la dieta, probablemente por su mayor biodisponibilidad.
Figura 1. Calcio y Obesidad.
Algunos investigadores piensan que la obesidad infantil está relacionada con la baja ingesta de calcio, ya que el inicio de la epidemia de la obesidad infantil coincidió con el aumento de las bebidas gaseosas de fantasía, concomitante con la disminución de ingesta de leche en el niño; se está investigando esta posibilidad, pues podría haber alguna relación entre la baja ingesta de lácteos en los niños y la obesidad infantil, independiente del consumo elevado de bebidas azucaradas.
La South Beach Diet es una de las dietas de moda, fue creada por un cardiólogo del Centro Monte Sinaí, de Miami. Es una dieta intermedia entre una dieta balanceada, como la que propone la ATP III y la dieta de Atkins, con alto contenido en grasa y cantidades muy reducidas de hidratos de carbono, que no superan 10%. Esta dieta se basa en el principio de las grasas buenas y los hidratos de carbono buenos, a diferencia de la dieta de Atkins, que permite comer todo tipo de grasas saturadas, siempre y cuando no se consuman cantidades importantes de hidratos de carbono, la South Beach Diet privilegia el consumo de grasas poliinsaturadas, ácidos grasos omega 3 y grasas monoinsaturadas. De igual manera, promueve el consumo progresivo de hidratos de carbono, en especial con un bajo índice glicémico y de fibras.
Ya se han vendido millones de copias del libro en el que se explica la forma en que se lleva a cabo (Figura 2). Se realiza en tres fases: la primera dura dos semanas y es bastante estricta en cuanto al consumo de hidratos de carbono simples y azúcares, los que se eliminan casi por completo, pero se puede comer algunas grasas; en las dos fases siguientes se reincorporan las frutas y verduras de manera progresiva. El fundamento de esta dieta es que el consumo de alimentos de bajo índice glicémico impide que se eleve en forma importante la insulina después de las comidas, lo que reduce la acción lipogénica y antilipolítica de la insulina.
El índice glicémico de los alimentos, concepto que fue introducido en el año 1981, se refiere a la capacidad que tiene un determinado alimento para inducir un aumento de la glicemia. Un índice glicémico alto significa que el alimento es absorbido rápidamente y produce una elevación aguda de la glicemia y la insulinemia.
Figura 2. Lo último en dieta: The South Beach.
La prevención farmacológica de la enfermedad cardiovascular es otra novedad. En 2003 el British Medical Journal publicó un estudio de dos investigadores ingleses, quienes analizaron más de 750 trabajos que abarcaban un universo de más de 400.000 sujetos y, basándose en los resultados obtenidos, propusieron el novedoso concepto de prevención del riesgo cardiovascular, no en términos de cambios en el estilo de vida, sino mediante la utilización de fármacos de reconocida eficacia en la prevención de este riesgo.
Los autores proponen que esta combinación de fármacos se administren mediante una cápsula única diaria, a la que denominaron polipíldora (Polypill) y que contendría 3 antihipertensivos (un inhibidor de la enzima convertidora; un betabloqueador y un diurético tiazídico), una estatina, ácido fólico para disminuir la homocisteína; un aminoácido ligado a la arteriosclerosis y a la disfunción endotelial; y el antiagregante plaquetario Aspirina. De acuerdo a los autores la polipíldora debiera administrarse a todos los sujetos mayores de 55 años, con o sin factores de riesgo de enfermedad cardiovascular, en forma preventiva.
La Polypill tiene los siguientes componentes:
Según su análisis computacional, esta medida lograría reducir la enfermedad coronaria en 88% y los accidentes vasculares en 80%, de modo que los sujetos que tomaran este producto tendrían 11 años más de vida libre de enfermedad coronaria y accidentes cerebrovasculares, conclusión que no deja de ser interesante.
El concepto de Polymeal (policomida), nace en analogía a la polipíldora y aparece publicado a finales de 2004 en el British Medical Journal. Consiste en una dieta diseñada para disminuir el riesgo cardiovascular y se basa en 6 alimentos que se conoce que disminuyen el riesgo cardiovascular por separado. El método y los datos de los ingredientes de la policomida se extrajeron de la literatura y la receta, basada en la evidencia, se compone de vino, pescado, chocolate negro, frutas y verduras, ajo y almendras. Se utilizaron los datos del estudio de Framingham y de los trabajos derivados de éste para construir tablas de vida y modelar los beneficios de la policomida en la población general, a partir de los 50 años. Se utilizó el mismo sistema computacional del estudio de la polipíldora, observándose que los episodios de enfermedad cardiovascular se reducían en 76%, esto es muy semejante a los reportados con la polipíldora.
En los hombres, el consumo diario de la policomida supondría un aumento de 6,6 años en la esperanza de vida y de 9 años en la esperanza de vida libre de enfermedad cardiovascular; en las mujeres, la esperanza de vida aumentaría en 4,8 años y la de vida libre de enfermedad cardiovascular en 8,1 años; y concluyen que la policomida promete ser una alternativa no farmacológica, eficaz, segura, barata y sabrosa para reducir la morbilidad cardiovascular y aumentar la esperanza de vida en la población general. A continuación se detallan las cantidades recomendadas, cuyo efecto combinado disminuiría el riesgo de enfermedad cardiovascular en 76%, cifra que baja a 65% si se retira el vino, según el análisis computacional:
Los componentes de la Polymeal son:
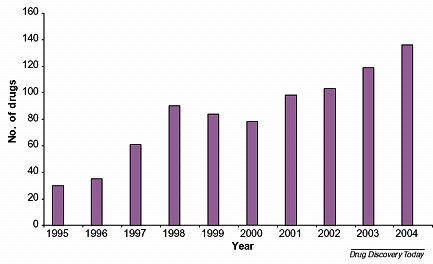
Hace mucho tiempo que no surgen novedades en cuanto a fármacos eficaces para controlar el hambre y el peso corporal en el largo plazo. Los fármacos disponibles en la actualidad son muy poco eficaces, si se les compara con los fármacos disponibles para la hipertensión, la diabetes y el exceso de colesterol; pero, a partir de 2000, la investigación sobre una nueva generación de posibles fármacos antiobesidad se ha incrementado notoriamente (Figura 3).
Figura 3. Fármacos supresores de apetito en activo desarrollo.
El rimonabant (Acomplia) es un nuevo fármaco antiobesidad, próximo a salir al mercado mundial, esperándose su lanzamiento para fines de 2005 o principios de 2006. Este fármaco no sólo está ligado al manejo de la obesidad, sino que también es muy eficaz para dejar de fumar, estando además en investigación su utilidad para el tratamiento del alcoholismo, o sea, actúa sobre varios tipos de adicciones, debido a que interviene en la vía del placer (vía cannabinoide).
El descubrimiento de este fármaco se basó en la observación, bien documentada, que el apetito aumentaba después de fumar marihuana. Se sabe por otra parte, que el responsable es el componente principal de ella, el 9-tetrahidrocannabinol, el cual se está utilizando médicamente para incrementar el apetito en enfermedades caquectizantes como el cáncer o el SIDA. La acción estimulante del apetito por el 9-tetrahidrocannabinol se debe a que nuestro cerebro posee receptores para él, denominados cannabinoides, que en condiciones normales son activados por sustancias endogénas derivadas de los ácidos grasos (cannabinoides endógenos).
El más estudiado de los endocannabinoides endógenos es el anandamide, que tiene el mismo efecto que el 9-tetrahidrocannabinol de la marihuana; si no tuviéramos el receptor para esta sustancia, la marihuana no causaría efectos en el ser humano. El anandamide estimula los receptores cannabinoides tipo CB1 y está demostrado que ratones a los cuales se les anula este receptor mediante ingeniería genética, o sea, ratones knockout para el gen que codifica ese receptor, comen menos que el grupo control y bajan de peso.
Los ratones ob/ob o db/db son modelos de obesidad animal genética; los primeros no sintetizan leptina y los segundos tienen leptina, pero no su receptor. Estos animales están constantemente comiendo y expresan niveles elevados de cannabinoides, lo que demuestra que este sistema está ligado al deseo de comer y estimula la ingesta alimentaria.
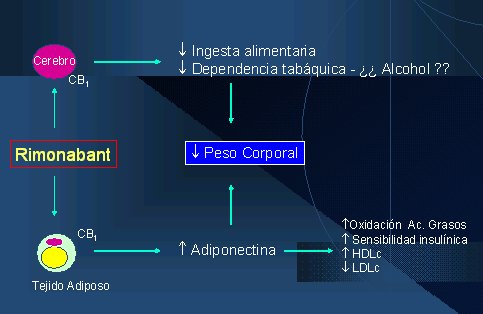
Lo interesante de este fármaco es que bloquea este sistema al antagonizar el receptor cerebral CB1, pero no sólo actúa en el cerebro, sino también en el adipocito, en cuya membrana plasmática se han descubierto receptores CB1 para el sistema canabinoide (Figura 4). Curiosamente, cuando este fármaco se une al receptor, el adipocito aumenta la síntesis de adiponectina, una hormona que está disminuía en la obesidad y en muchas otras patologías que cursan con insulinorresistencia. Por tanto el rimonabant estimularía la secreción adipocitaria de adiponectina, lo que se traduciría en un gran beneficio, ya que se conocen las importantes acciones antiateroscleróticas, insulinosensibilizadoras y antiinflamatorias que posee, independiente de sus efectos inhibidores sobre la ingesta alimentaria. De tal manera que parte de los efectos metabólicos de este fármaco (independiente de los inherentes a la reducción del peso corporal ), se deben al aumento de la adiponectina, la cual estimularía la oxidación de ácidos grasos dentro del músculo y del hígado, mejorando la glicemia y el perfil lipídico.
Figura 4. Mecanismo de acción de Rimonabant.
Hay en este momento cuatro estudios RIO (Rimonabant In Obesity), cuyos resultados se comenzaron a publicar en 2004. El RIO-Lipids es el primero de cuatro estudios de fase 3 que integran el programa RIO, con el objeto de determinar la eficacia y seguridad del rimonabant en la reducción del peso y de los factores de riesgo metabólico, como la diabetes y la dislipidemia, en un universo total de 6.600 pacientes obesos.
Los reportes presentados en 2004 corresponden al estudio de 1.036 pacientes con obesidad abdominal y perfil lipídico anormal, subdivididos en tres grupos tratados con rimonabant 5 mg, rimonabant 20 mg, o placebo, respectivamente, durante un año, con el objetivo de determinar si se lograba una pérdida de peso mayor de 5% y de 10% del peso inicial, y si se producían modificaciones del perfil lipídico (Figura 5).
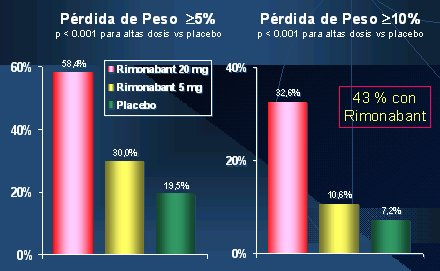
Los resultados fueron los siguientes (Figura 6):
Figura 5. Diseño del estudio RIO-Lipids.
Figura 6. Resultados del estudio RIO-Lipids.
Como conclusión, en los pacientes con obesidad abdominal y perfil lipídico anormal, el uso de rimonabant en dosis de 5 mg o 20 mg se asoció con mayores reducciones de peso después de 1 año de tratamiento, comparado con el placebo: 43% de los sujetos tratados perdieron más de 10% de peso inicial, comparados con 7,2% con placebo. Hubo otros beneficios en el perfil lipídico, la glicemia y la proteína C reactiva. Lo interesante es que la mejoría de los parámetros metabólicos (glicemia, insulina y perfil lipídico) fue mayor que lo esperado por la baja de peso, debido, probablemente, a un aumento de la secreción de adiponectina en el adiposito, por el rimonabant.
Los efectos secundarios fueron leves y transitorios; con la dosis de 20 mg hubo náuseas en 12,7% de los pacientes tratados, versus 3,2% de los del grupo placebo, y se observaron mareos en 10,4% y 6,7%, respectivamente, resultado que se repite en los otros programas RIO. El índice de abandono del estudio por efectos secundarios fue de 15% en el grupo de rimonabant 20 mg frente a 7% en el grupo placebo. Es importante destacar que no se identificó problemas de seguridad en el área cardiovascular.
En 2005 se dio a conocer el estudio RIO-Europe, que comparó tres regímenes: rimonabant 5 mg, rimonabant 20 mg, y placebo, asociados con un régimen deficitario de 600 calorías/día. El universo se compuso de 1.507 pacientes obesos o con IMC mayor de 27, con alguna comorbilidad que no fuera diabetes (hipertensión arterial o dislipidemia). La edad promedio fue de 45 años; la mayor parte de los pacientes eran de raza blanca; 80% eran mujeres; 40% con hipertensión; 60% con dislipidemia; 40% con síndrome metabólico. El tiempo de seguimiento fue de dos años.
Los pacientes con rimonabant perdieron más peso y lo mantuvieron en el tiempo; este efecto fue mucho más marcado con 20 mg, la que será probablemente la dosis con la cual saldrá este fármaco a la venta. La disminución del perímetro de cintura fue mayor con rimonabant 20 mg. Los efectos adversos fueron los mismos que en el estudio de RIO-Lipids: náuseas (13,7%) y mareos (9,3%), los que se asociaron más intensamente con dosis de 20 mg. El síndrome metabólico, después de 1 año de tratamiento, se redujo a la mitad con la dosis de 20 mg.
Otro fármaco interesante, especialmente porque se puede utilizar en los adultos mayores con sobrepeso u obesidad central, quienes habitualmente no tienen muchas alternativas de tratamiento, es la dehidroepiandrosterona (DHEA), también denominada hormona de la juventud, que en los Estados Unidos se puede adquirir sin prescripción médica. Es una hormona masculina secretada por las glándulas suprarrenales, cuya potencia es leve si se compara con la testosterona (que se produce principalmente en los testículos); muchas personas la usan para aumentar la capacidad física, el desarrollo muscular, la memoria, la inmunidad y la líbido, tanto en hombres como en mujeres. Sus niveles comienzan a reducirse rápidamente a partir de los 30 años de edad.
La administración de DHEA en ratas reduce la grasa abdominal y tiene efectos protectores contra la insulinorresistencia secundaria a una dieta hipergrasa. Su mecanismo de acción se ejercería a través del receptor activado de la proliferación peroxisomal (PPAR alfa), el cual estimula la oxidación de los ácidos grasos dentro de la célula, especialmente en el hígado y en algunos músculos, como el cardíaco.
En un trabajo, publicado en noviembre de 2004 en la revista JAMA, la administración de 50 mg/día de DHEA, que es la dosis habitual automedicada, en 28 sujetos con sobrepeso (15 hombres y 13 mujeres) de 71 años de edad en promedio, durante 6 meses, sin modificar dieta ni actividad física, disminuyó la grasa visceral, que es la que se asocia, como sabemos, a insulinorresistencia y síndrome metabólico, en 10,2% en los hombres y en 7,4% en las mujeres. Para determinar este efecto sobre la grasa visceral se utilizó la resonancia magnética, que es un método muy preciso de cuantificación de grasa corporal.
La grasa subcutánea disminuyó en 6%. Hubo un aumento significativo en la sensibilidad a insulina y también aumentó el peso corporal en alrededor de 2 kilos, lo que se debería preferentemente al desarrollo muscular. No hubo efectos adversos, por lo cual podría ser una alternativa para ancianos, aunque existe una incógnita que no está resuelta: la dehidroepiandrosterona es una hormona masculina que tiene la capacidad de transformarse en estradiol y testosterona, y se ignora qué puede suceder a largo plazo en cuanto al cáncer de próstata.
La liposucción es una técnica quirúrgica que permite retirar el tejido adiposo subcutáneo mediante ultrasonido, tumescencia o láser. Hay controversia respecto a los riesgos o beneficios de este procedimiento para la salud. Algunos estudios han demostrado que la eliminación de grandes cantidades de tejido graso abdominal subcutáneo se asocia con mayor riesgo de depositar a nivel visceral los triglicéridos futuros o el exceso de ingesta calórica que ocurra posteriormente; como la grasa visceral es la que se relaciona más estrechamente con el riesgo de enfermedad, el retiro del tejido adiposo subcutáneo podría significar una disminución del sistema de amortiguación otorgado por éste.
Otros estudios demostrarían que la liposucción podría beneficiar la salud al retirar grandes cantidades de grasa subcutánea, la que también tiene un papel en la insulinorresistencia, por tanto la controversia aún continúa.
En 2004, Klein publicó los resultados de un estudio en el que intentó determinar si la liposucción mejoraba los parámetros metabólicos en 15 mujeres obesas (8 con tolerancia normal a la glucosa y 7 diabéticas). El estudio de sensibilidad insulínica se realizó mediante clamp euglicémico hiperinsulinémico, que es la técnica más precisa de cuantificación de insulinorresistencia y también se midieron otras variables, incluyendo marcadores inflamatorios, después de 10 a 12 semanas de la liposucción. La liposucción disminuyó el volumen de tejido adiposo abdominal subcutáneo en 24% en las mujeres normales (o sea, hubo resecciones importantes de grasa subcutánea) y en 28% en las diabéticas. Las primeras perdieron una media de 9 kg de grasa y las segundas, 10,5 kg. Sin embargo, la intervención no modificó de manera significativa ningún parámetro metabólico. La sensibilidad a insulina, la proteína C reactiva, los otros marcadores inflamatorios, la adiponectina, la presión arterial y las concentraciones plasmáticas de glucosa, lípidos e insulina no experimentaron cambios.
El autor llegó a al conclusión de que la liposucción no modifica los parámetros metabólicos ni a favor ni en contra, pero una de las objeciones que originó este trabajo es que el tiempo de estudio fue muy breve y que habría probablemente que estudiar a estos pacientes a más largo plazo, para saber lo que pasa realmente con ellos. En todo caso, en el corto plazo (dos meses y medio) según este estudio, no muestra diferencias pre y postquirúrgicas.
El Marcapaso Gástrico (Implantable gastric stimulator) constituye la última novedad en el campo de la cirugía. Se desarrolló en 1995, en Italia, a partir de estudios en animales en los que se trataba de normalizar la motilidad gástrica, para posteriormente derivar en el tratamiento de la obesidad. Es una técnica ambulatoria, muy sencilla, prácticamente sin morbilidad ni mortalidad. Se trata de un marcapaso gástrico que se basa en el mismo principio que el marcapaso cardíaco; es decir, es un aparato similar a un reloj de bolsillo, que contiene pilas en su interior que duran entre 2 y 5 años; se une mediante uno o dos cables (llamados conductores) a la pared gástrica, cerca del píloro, donde emite pulsaciones eléctricas constantes (Figura 7). La implantación se realiza mediante laparoscopía (menos de una hora). El marcapaso gástrico ya se está usando de manera experimental en Europa, habiéndose efectuado en más de 600 personas y los primeros resultados están publicándose, pero aún es una técnica inicial y uno de sus principales inconvenientes es su alto costo.
No se conoce el mecanismo de acción con certeza, pero se postula que podría producir saciedad por modificación de las hormonas gástricas, ya que el estómago es una fuente importante de sustancias que desencadenan hambre o saciedad; o bien, podría retardar el vaciamiento gástrico desencadenando la sensación de saciedad. También, las pulsaciones eléctricas o contracciones gástricas se podrían transmitir, mediante el nervio vago, hacia los centros hipotalámicos reguladores de la alimentación, y generar así cambios en ciertos neuropéptidos, los que se traducirían también en saciedad.
Un número importante de pacientes con marcapaso gástrico pierden peso en forma significativa y 60% de ellos reducen más de 10% del peso corporal en un plazo de 29 meses. Es muy bien tolerado y tiene escasas complicaciones, por lo que es una técnica novedosa y aparentemente útil, pero está en etapa de experimentación. El dispositivo se implanta en un bolsillo bajo la piel, al lado izquierdo, cerca del píloro, y tiene uno o dos conductores que se atornillan a la pared gástrica.
El paciente sale de alta antes de 24 horas y el marcapasos se activa 2 a 4 semanas después de la intervención, para dejar tiempo a la cicatrización. Una vez activado, va dando pulsaciones eléctricas que se aceleran o desaceleran por medios externos, según el apetito del paciente. De acuerdo a algunos investigadores, esta técnica podría desplazar en un futuro cercano a la cirugía bariátrica en un grupo de pacientes obesos, si bien aún no hay aún evidencia suficiente para asegurarlo.
Figura 7. Marcapaso gástrico.











 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Curso de Educación Continua en Obesidad, organizado en Santiago por la Sociedad Chilena de Obesidad desde el 13 de abril al 15 de junio de 2005.
Director del Curso: Dr. Alex Valenzuela.
 Expositor:
Alex Valenzuela Montero[1]
Expositor:
Alex Valenzuela Montero[1]

Citación: Valenzuela A. Obesity - what's new in treatment?. Medwave 2005 Jun;5(6):e3213 doi: 10.5867/medwave.2005.06.3213
Fecha de publicación: 1/7/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Allison DB, Mentore JL, Heo M, Chandler LP, Cappelleri JC, Infante MC, et al. Antipsychotic-induced weight gain: a comprehensive research synthesis. Am J Psychiatry. 1999 Nov;156(11):1686-96. | PubMed |
Allison DB, Mentore JL, Heo M, Chandler LP, Cappelleri JC, Infante MC, et al. Antipsychotic-induced weight gain: a comprehensive research synthesis. Am J Psychiatry. 1999 Nov;156(11):1686-96. | PubMed | Atkinson RL, Dhurandhar NV, Allison DB, Bowen RL, Israel BA, Albu JB, et al. Human adenovirus-36 is associated with increased body weight and paradoxical reduction of serum lipids. Int J Obes (Lond). 2005 Mar;29(3):281-6. | CrossRef | PubMed |
Atkinson RL, Dhurandhar NV, Allison DB, Bowen RL, Israel BA, Albu JB, et al. Human adenovirus-36 is associated with increased body weight and paradoxical reduction of serum lipids. Int J Obes (Lond). 2005 Mar;29(3):281-6. | CrossRef | PubMed | American Diabetes Association; American Psychiatric Association; American Association of Clinical Endocrinologists; North American Association for the Study of Obesity. Consensus development conference on antipsychotic drugs and obesity and diabetes. Diabetes Care. 2004 Feb;27(2):596-601. | CrossRef | PubMed |
American Diabetes Association; American Psychiatric Association; American Association of Clinical Endocrinologists; North American Association for the Study of Obesity. Consensus development conference on antipsychotic drugs and obesity and diabetes. Diabetes Care. 2004 Feb;27(2):596-601. | CrossRef | PubMed | Bergman RN, Ader M. Atypical antipsychotics and glucose homeostasis. J Clin Psychiatry. 2005 Apr;66(4):504-14. | CrossRef | PubMed |
Bergman RN, Ader M. Atypical antipsychotics and glucose homeostasis. J Clin Psychiatry. 2005 Apr;66(4):504-14. | CrossRef | PubMed | Chen J. Mechanisms of action of the implantable gastric stimulator for obesity. Obes Surg. 2004 Sep;14 Suppl 1:S28-32. | CrossRef | PubMed |
Chen J. Mechanisms of action of the implantable gastric stimulator for obesity. Obes Surg. 2004 Sep;14 Suppl 1:S28-32. | CrossRef | PubMed | Cruz ML, Goran MI. The metabolic syndrome in children and adolescents. Curr Diab Rep. 2004 Feb;4(1):53-62. | CrossRef | PubMed |
Cruz ML, Goran MI. The metabolic syndrome in children and adolescents. Curr Diab Rep. 2004 Feb;4(1):53-62. | CrossRef | PubMed | De Luca M, Segato G, Busetto L, Favretti F, Aigner F, Weiss H, et al. Progress in implantable gastric stimulation: summary of results of the European multi-center study. Obes Surg. 2004 Sep;14 Suppl 1:S33-9. | CrossRef | PubMed |
De Luca M, Segato G, Busetto L, Favretti F, Aigner F, Weiss H, et al. Progress in implantable gastric stimulation: summary of results of the European multi-center study. Obes Surg. 2004 Sep;14 Suppl 1:S33-9. | CrossRef | PubMed | Dhurandhar N. Infectobesity : Obesity Infectious origin. J Nutr. 2001 Oct;131(10):2794S-2797S. | PubMed |
Dhurandhar N. Infectobesity : Obesity Infectious origin. J Nutr. 2001 Oct;131(10):2794S-2797S. | PubMed | Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet. 2005 Apr 16-22;365(9468):1415-28. | CrossRef | PubMed |
Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet. 2005 Apr 16-22;365(9468):1415-28. | CrossRef | PubMed | Encuesta Nacional de Salud de Chile. Ministerio de Salud de Chile, 2004.
Encuesta Nacional de Salud de Chile. Ministerio de Salud de Chile, 2004.  Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. xecutive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001 May 16;285(19):2486-97. | CrossRef | PubMed |
Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. xecutive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001 May 16;285(19):2486-97. | CrossRef | PubMed | Franco OH, Bonneux L, de Laet C, Peeters A, Steyerberg EW, Mackenbach JP. The Polymeal: a more natural, safer, and probably tastier strategy to reduce cardiovascular disease by more than 75%. BMJ. 2004 Dec 18;329(7480):1447-50. | CrossRef | PubMed |
Franco OH, Bonneux L, de Laet C, Peeters A, Steyerberg EW, Mackenbach JP. The Polymeal: a more natural, safer, and probably tastier strategy to reduce cardiovascular disease by more than 75%. BMJ. 2004 Dec 18;329(7480):1447-50. | CrossRef | PubMed | Grundy SM, Brewer HB Jr, Cleeman JI, Smith SC Jr, Lenfant C, American Heart Association, et al. Definition of Metabolic Syndrome. Report of the National Heart, Lung, and Blood Institute/American Heart Association Conference on Scientific Issues Related to Definition. Circulation. 2004 Jan 27;109(3):433-8. | CrossRef | PubMed |
Grundy SM, Brewer HB Jr, Cleeman JI, Smith SC Jr, Lenfant C, American Heart Association, et al. Definition of Metabolic Syndrome. Report of the National Heart, Lung, and Blood Institute/American Heart Association Conference on Scientific Issues Related to Definition. Circulation. 2004 Jan 27;109(3):433-8. | CrossRef | PubMed | Jayaraman KS. ‘Sumo’ rats set researchers on hunt for obesity genes. Nat Med. 2005 Feb;11(2):108. | CrossRef | PubMed |
Jayaraman KS. ‘Sumo’ rats set researchers on hunt for obesity genes. Nat Med. 2005 Feb;11(2):108. | CrossRef | PubMed | Klein S, Fontana L, Young VL, Coggan AR, Kilo C, Patterson BW, et al. Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med. 2004 Jun 17;350(25):2549-57. | CrossRef | PubMed |
Klein S, Fontana L, Young VL, Coggan AR, Kilo C, Patterson BW, et al. Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med. 2004 Jun 17;350(25):2549-57. | CrossRef | PubMed | Lara-Castro C, Garvey WT. Diet, insulin resistance, and obesity: zoning in on data for Atkins dieters living in South Beach. J Clin Endocrinol Metab. 2004 Sep;89(9):4197-205. | CrossRef | PubMed |
Lara-Castro C, Garvey WT. Diet, insulin resistance, and obesity: zoning in on data for Atkins dieters living in South Beach. J Clin Endocrinol Metab. 2004 Sep;89(9):4197-205. | CrossRef | PubMed | Pagotto U, Pasquali R. Fighting obesity and associated risk factors by antagonising cannabinoid type 1 receptors. Lancet. 2005 Apr 16-22;365(9468):1363-4. | CrossRef | PubMed |
Pagotto U, Pasquali R. Fighting obesity and associated risk factors by antagonising cannabinoid type 1 receptors. Lancet. 2005 Apr 16-22;365(9468):1363-4. | CrossRef | PubMed | Valenzuela A. Obesidad. Santiago, Chile: Editorial Mediterráneo, 2002.
Valenzuela A. Obesidad. Santiago, Chile: Editorial Mediterráneo, 2002.  Van Gaal L. 2-year data from the RIO-Europe Study: Metabolic effects of rimonabant in overweight/obese patients. American College of Cardiology Annual Scientific Session 2005, March 6-9, Orlando, Florida. Late Breaking Clinical Trials 2.
Van Gaal L. 2-year data from the RIO-Europe Study: Metabolic effects of rimonabant in overweight/obese patients. American College of Cardiology Annual Scientific Session 2005, March 6-9, Orlando, Florida. Late Breaking Clinical Trials 2.  Van Gaal LF, Rissanen AM, Scheen AJ, Ziegler O, Rössner S; RIO-Europe Study Group. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. Lancet. 2005 Apr 16-22;365(9468):1389-97. | CrossRef | PubMed |
Van Gaal LF, Rissanen AM, Scheen AJ, Ziegler O, Rössner S; RIO-Europe Study Group. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. Lancet. 2005 Apr 16-22;365(9468):1389-97. | CrossRef | PubMed | Villareal DT, Holloszy JO. Effect of DHEA on abdominal fat and insulin action in elderly women and men: A randomized controlled trial. JAMA. 2004 Nov 10;292(18):2243-8. | CrossRef | PubMed |
Villareal DT, Holloszy JO. Effect of DHEA on abdominal fat and insulin action in elderly women and men: A randomized controlled trial. JAMA. 2004 Nov 10;292(18):2243-8. | CrossRef | PubMed | Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ. 2003 Jun 28;326(7404):1419. | CrossRef | PubMed | PMC |
Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ. 2003 Jun 28;326(7404):1419. | CrossRef | PubMed | PMC |