 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en las Jornadas Latinoamericanas de Cáncer de Mama 2002, organizadas por la Escuela Latinoamericana de Mastología, Federación Latinoamericana de Mastología y Sociedad Chilena de Mastología.
Editor Científico: Dr. Hernando Paredes.
De rutina, luego que a una paciente se le diagnostica un cáncer de mama, se la somete a una serie de exámenes y procedimientos de imágenes para determinar la extensión de la enfermedad; es lo que se conoce como estudio de extensión o etapificación de la enfermedad. Se realiza hemograma, perfil bioquímico o pruebas hepáticas, radiografía de tórax, imagen del hígado, cintigrama óseo y a veces TAC de tórax y abdomen.
El motivo del estudio y las personas a quienes se debe hacer este estudio de extensión no siguen, al parecer, una pauta y, generalmente, se extrapola que los exámenes que se solicitan en estudios de investigación clínica, se deben pedir a las pacientes que siguen tratamiento fuera de esos estudios y que, por lo demás, representan la gran mayoría.
Con posterioridad al tratamiento se solicitan exámenes periódicos durante el seguimiento, con el fin de detectar posibles efectos colaterales o secuelas de los tratamientos recibidos, pero, fundamentalmente, para tratar de pesquisar precozmente una recidiva locorregional o enfermedad tumoral a distancia. La intención de esta detección temprana es indicar una terapia de rescate cuando la cantidad de tumor es pequeña aún. Esto determinaría una mejor respuesta a esas terapias, y en lo ideal, una prolongación de la sobrevida e incluso una curación.
Desgraciadamente, la literatura no comparte, al parecer, esta actitud y así las pacientes se ven sometidas a intensos y continuos exámenes que no tienen ningún efecto en su sobrevida.
Se revisa la bibliografía publicada y los niveles de evidencia que fundamentan las recomendaciones para la etapificación y seguimiento de las pacientes con cáncer de mama.
Cintigrama óseo
Al revisar la literatura, no se encuentran trabajos aleatorios que determinen la eficacia de este examen en pacientes con cáncer de mama.
La mayoría de los estudios son retrospectivos y abarcan números pequeños de pacientes.
Las series clínicas señaladas muestran que existe una clara diferencia en la positividad de este examen según el estadio de la enfermedad.
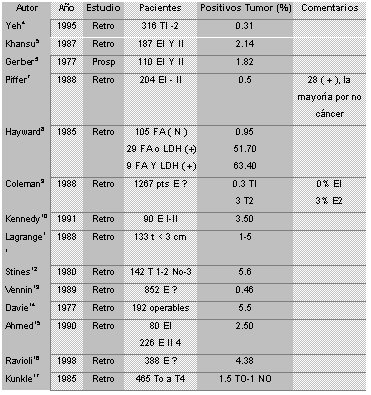
El rango de positividad del cintigrama óseo varía entre 0% y 3%, en las pacientes etapificadas como estadio I y II, como se aprecia en la Tabla 1:
Tabla 1
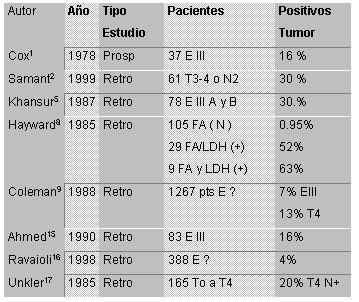
Los porcentajes de compromiso metastásico que detecta el cintigrama óseo son mayores en las pacientes con enfermedad tumoral localmente avanzada, con cifras que varían entre 8% y 30%.
Un estudio publicado por Hayward (8) en 1985 muestra que los niveles de fosfatasas alcalinas y dehidrogenasa láctica, ayudan a predecir el compromiso sistémico por cáncer de mama. Las pacientes con valores normales de ambos parámetros, presentan porcentajes bajos de compromiso metastásico en el cintigrama óseo, pero, en la medida que una de estas enzimas, o ambas, se elevan, las probabilidades de que el cintigrama óseo resulte positivo, aumentan en grado importante.
Lamentablemente, la cantidad de pacientes que abarca este estudio es pequeña y no permite determinar una conducta sobre esa base. La Tabla 2 resume los datos que se analizaron más arriba, incluso los resultados del trabajo de Hayward (se trata de las mismas publicaciones de la tabla anterior, pero separadas por estadíos para una lectura más fácil).
Tabla 2
De acuerdo con la información publicada, la cintigrafía ósea no tiene utilidad en la etapificación de pacientes con cáncer de mama temprano, (estadios I y II) con porcentajes de positividad que varían entre 0,3 % y 5,5%. En los estadios III se encuentra compromiso metastásico en el cintigrama óseo entre 4% y 16%. Hayward y colaboradores encuentran 0,95% de metástasis óseas en las pacientes con fosfatasas alcalinas y LDH normales, elevándose esta cifra a 63% en el caso de que las dos enzimas se encuentren elevadas.
Imagen hepática
Los datos son aún más concluyentes cuando se evalúa el uso rutinario de la imagen hepática en la etapificación de las pacientes con cáncer de mama. La probabilidad de que se detecte enfermedad metastásica por este solo examen, varía entre 0% y un 5.9% en casos de enfermedad estadío III, pero la mayoría de los resultados están en el orden de 1% a 3%, como se resume en la Tabla 3.
Tabla 3
Radiografía de tórax
La radiografía de tórax puede se puede solicitar como parte de un estudio general a una paciente que se va a someter a una operación, independiente de su diagnóstico. En tal caso, es poco probable que el bajo rendimiento de este examen para detectar lesiones metastásicas influya en la decisión de solicitarla (2,13,16,19,26,27,28). Su rendimiento, en la mayoría de los trabajos clínicos, no alcanza a 1 %.
Enzimas
Las fosfatasas alcalinas y la LDH, si bien pueden encontrarse elevadas en e! grupo de pacientes metastásicas, no son específicas; así puede haber enfermedad metastásica con enzimas normales o pueden estar relevadas sin un significado patológico tumoral (29,30,31,32). Cabe observar, sin embargo, que el Grupo Internacional para el Estudio de Cáncer de Mama (Ludwig), en un estudio retrospectivo, entrega resultados semejantes a los que comunica Hayward y col., en el sentido de que la determinación de fosfatasas alcalinas puede ser un buen discriminador de la necesidad de realizar estudios suplementarios en pacientes portadoras de cáncer de mama en alto riesgo de diseminación (33).
Actualmente no se cuenta con terapias capaces de afectar el curso de la enfermedad metastásica en términos de sobrevida, aun cuando ellas se indiquen precozmente. Lo anterior se demostró en dos estudios aleatorios de pacientes en dos grupos: uno cuyo seguimiento se hizo sólo en forma clínica y otro con seguimiento intensivo. Los resultados de estos dos estudios demuestran que, en la mayoría de los casos, las pacientes detectan la recidiva de la enfermedad antes de que lo hagan los exámenes que se les realizan. Además, no se demuestra que el hacer seguimiento intensivo tenga ninguna repercusión en la sobrevida de las pacientes, medida tanto a 5 como a 10 años (37,38). Por lo tanto, el objetivo principal del seguimiento, que es instaurar rápidamente una terapia de rescate, no constituye ningún beneficio.
Tampoco es necesario que se distraigan recursos de las escasas horas de los médicos especialistas en el seguimiento de las pacientes con cáncer de mama, sino que basta con que lo hagan médicos generales adecuadamente capacitados. Un estudio publicado por Grunfeld y colaboradores en British Medical Journal de 1996, demuestra que la mayoría de las recurrencias (69%) se presentan en el intervalo entre los controles y que no existe diferencia en su detección entre médicos generales y especialistas (35).
Un efecto adicional poco deseable de los seguimientos intensivos es que muchas veces los exámenes solicitados arrojan resultados poco claros que no permiten distinguir la etiología de lo que se está observando ( por ejemplo alteraciones en el cintigrama óseo o del ultrasonido de hígado).
Por lo anterior se solicitan más exámenes o la cooperación de otros médicos, para resolver las dudas establecidas (34). Sin embargo, no siempre se determina la real utilidad de este seguimiento y los costos emocionales y económicos resultantes.
De todos modos, cuando se consulta a la paciente sobre su deseo o no de tener controles, en su mayoría prefieren tener un seguimiento cercano.
Los siguientes son los exámenes recomendados por útiles, o no recomendados, en el seguimiento de las pacientes con cáncer de mama.
Anamnesis y examen físico: Nivel de evidencia III. Grado de recomendación B.
El control de la paciente se debe hacer cada tres a seis meses durante los tres primeros años luego de la terapia de su cáncer de mama. y cada seis a doce meses durante los dos años siguientes. Se recomienda un control anual de ahí en adelante.
La anamnesis debe ir dirigida a pesquisar síntomas y signos indicativos de diseminación de la enfermedad y los que indiquen toxicidad por las terapias recibidas.
Varios estudios retrospectivos y al menos dos estudios aleatorios bien diseñados avalan esta posición y demuestran que la propia paciente detecta la mayoría de las recurrencias en los períodos entre controles.
La frecuencia de los controles importantes durante los primeros años post terapia está avalada por la mayor frecuencia de las recidivas durante los primeros años. De acuerdo con los datos de Grunfeld y colaboradores, la paciente es la que señala los síntomas de recurrencia de la enfermedad en 69% de los casos, lo que demuestra claramente la importancia de la anamnesis en el seguimiento de estas pacientes (35). Estos datos están ratificados en diversos estudios (36,37,38,39,40,41,42).
Examen físico
Se recomienda un examen físico cuidadoso de la paciente con los mismos intervalos que se recomiendan para la anamnesis. El examen físico debe estar dirigido a detectar alteraciones que indiquen diseminación de la enfermedad, recurrencia locorregional o secuelas del tratamiento.
Varios estudios retrospectivos y al menos dos estudios prospectivos aleatorios avalan el uso del examen físico como herramienta para la detección de enfermedad diseminada, también para la recidiva local o regional, y de la mama contralateral (36,42).
Un examen físico cuidadoso centrado en los sitios más frecuentes de diseminación puede ser el método de detección de la enfermedad en 15%, aproximadamente, de las recurrencias (39).
Examen mamográfico
En las pacientes con tratamiento conservador, la mama afectada permanece en riesgo de recidiva de la enfermedad. Dewar y cols. han demostrado, en un estudio prospectivo, que la tasa de recidiva permanece constante en alrededor de 1 % anual, con una tasa de 5% a 5 años y de 8% a 10 años (43).
Por otra parte, los estudios de screening han comprobado una reducción de la mortalidad por cáncer de mama en las poblaciones estudiadas. Si bien no hay estudios de screening para la detección de recidiva contralateral, se puede suponer que habrá una tendencia igual. El mismo estudio de Dewar y Cols (43), señala que, en pacientes con cirugía conservadora, fue de 3% y 6% a 5 y 10 años, respectivamente.
Dados la escasa invasión y los grados de detección, tanto en la mama tratada como en la contralateral, se recomienda el uso de la mamografía anual en el seguimiento de estas pacientes.
Dos estudios prospectivos aleatorios, así como varios estudios retrospectivos y las recomendaciones de dos grupos de expertos, al menos, avalan que los únicos exámenes recomendados en el seguimiento de estas pacientes son los que se han reseñado más arriba. Los mismos datos y los mismos grupos desalientan expresamente la realización de otros exámenes en el seguimiento de las pacientes con cáncer de mama (38,42).
Hemograma y VHS
Si bien la radiación y la quimioterapia son factores que de una manera u otra pueden contribuir a la producción de leucemia, su frecuencia es tan baja que el uso rutinario de estos exámenes no se justifica. Tampoco se justifica con el fin de detectar recurrencias en el ámbito de médula ósea. De acuerdo con datos argentinos, en un importante estudio retrospectivo que abarcó a 2111 pacientes, la posibilidad de que ellas presenten un segundo primario es 0.37%. Por lo demás, ningún estudio prospectivo ni retrospectivo ha indicado alguna utilidad de este examen en pacientes con cáncer de mama (44).
Estudios bioquímicos y marcadores tumorales
Las enzimas que pueden corresponder a compromiso metastásico hepático u óseo, entre ellas las fosfatasas alcalinas y la LDH, han demostrado que son inespecíficas. Diversos estudios han representado que ellas pueden elevarse tanto en presencia como en ausencia de metástasis, y que una enfermedad metastásica en dichos territorios puede cursar con enzimas normales.
La Sociedad Estadounidense de Oncología Clínica (ASCO), por medio de un panel de expertos, ha hecho una extensa y bien documentada revisión de la utilidad de distintos marcadores en el manejo del cáncer de colon y mama. Según las recomendaciones de este panel de expertos, ni el CEA, el CA 15-3 ni el CA 27.29 se recomiendan para el seguimiento de las pacientes con cáncer de mama. Si bien se acepta que pueda anticipar la recurrencia de la enfermedad en algunos meses con respecto a las imágenes, esta determinación no produce un cambio clínico, en el sentido de afectar el pronóstico de la enfermedad ni la estrategia de tratamiento.
Radiografía de tórax
Este estudio no se recomienda en el seguimiento ni tampoco, como ya se señaló, en la etapificación de las pacientes con cáncer de mama.
En un estudio publicado por Shapira y cols. en JAMA de 1991, se muestra que con la radiografía de tórax se puede detectar la recurrencia de la enfermedad en un porcentaje promedio de 2,7%, con un rango que varía entre O% y 5,1%. Lo anterior se ve confirmado en un estudio de Moskovic de 1992 en el que se encontró recurrencia tumoral en 0,4% de las radiografías de tórax solicitadas de rutina.
Cintigrama óseo
No se recomienda su uso rutinario en el seguimiento de las pacientes portadoras de cáncer de mama.
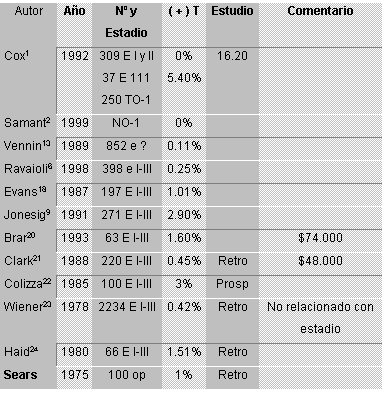
El porcentaje de detección de enfermedad metastásica por este examen es bajo y se acompaña además de un alto porcentaje de falsos positivos dados por numerosos otros procesos no neoplásicos. Los porcentajes que figuran en el capítulo de etapificación valen también en el de seguimiento. Más aún, en un estudio retrospectivo de NSABP en cerca de 2.700 pacientes con ganglios positivos, en las que se realizaron estudios de cintigrafía ósea en forma rutinaria, se observó que solo 0,5% de un total de 7.984 exámenes fueron positivos para enfermedad.
Imagen hepática
No se recomienda su uso rutinario en el seguimiento de las pacientes tratadas por cáncer de mama.
Los datos que se entregan en el capítulo de etapificación valen también en el seguimiento. Ningún estudio avala el uso rutinario de este examen en las pacientes de este tipo.
Recomendados
No recomendados (salvo si existen signos o síntomas que lo ameriten)



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en las Jornadas Latinoamericanas de Cáncer de Mama 2002, organizadas por la Escuela Latinoamericana de Mastología, Federación Latinoamericana de Mastología y Sociedad Chilena de Mastología.
Editor Científico: Dr. Hernando Paredes.
 Expositor:
José Miguel Reyes[1]
Expositor:
José Miguel Reyes[1]

Citación: Reyes JM. Guidelines for staging and monitoring patients treated for breast cancer. Medwave 2003 Oct;3(9):e3191 doi: 10.5867/medwave.2003.09.3191
Fecha de publicación: 1/10/2003

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Cox MR, Gilliland R, Holding-Smee GW, Spence RA. An evaluation of radionuclide bone scaning and liver ultrasonography for staging breast cancer Aust N Z J Surg. 1992 Jul;62(7):550-5. | CrossRef | PubMed |
Cox MR, Gilliland R, Holding-Smee GW, Spence RA. An evaluation of radionuclide bone scaning and liver ultrasonography for staging breast cancer Aust N Z J Surg. 1992 Jul;62(7):550-5. | CrossRef | PubMed | Samant R, Ganguly P. Staging investigations in patients with breast cancer: the role of bone scans and liver imaging. Arch Surg. 1999 May;134(5):551-3; discussion 554. | CrossRef | PubMed |
Samant R, Ganguly P. Staging investigations in patients with breast cancer: the role of bone scans and liver imaging. Arch Surg. 1999 May;134(5):551-3; discussion 554. | CrossRef | PubMed | Creutzig H. Staging of patients with carcinoma of the breast by bone scans. Radiologe. 1978 May;18(5):179-83. | PubMed |
Creutzig H. Staging of patients with carcinoma of the breast by bone scans. Radiologe. 1978 May;18(5):179-83. | PubMed | Yeh KA, Fortunato L, Ridge JA, Hoffman JP, Eisenberg BL, Sigurdson ER. Routine bone sacanning in patients with T1 and T2 breast cancer: a waste of money. Ann Surg Oncol. 1995 Jul;2(4):319-24. | CrossRef | PubMed |
Yeh KA, Fortunato L, Ridge JA, Hoffman JP, Eisenberg BL, Sigurdson ER. Routine bone sacanning in patients with T1 and T2 breast cancer: a waste of money. Ann Surg Oncol. 1995 Jul;2(4):319-24. | CrossRef | PubMed | Khansur T, Haick A, Patel B, Balducci L, Vance R, Thigpen T. Evaluation of bone scan as a screening work-up in primary and loco-regional recurrence of breast cancer. Am J Clin Oncol. 1987 Apr;10(2):167-70. | CrossRef | PubMed |
Khansur T, Haick A, Patel B, Balducci L, Vance R, Thigpen T. Evaluation of bone scan as a screening work-up in primary and loco-regional recurrence of breast cancer. Am J Clin Oncol. 1987 Apr;10(2):167-70. | CrossRef | PubMed | Gerber FH, Goodreau JJ, Kirchner PT, Fouty WJ. Efficacy of preoperative and postoperative bone scanning in the management of breast cancer. N Engl J Med. 1977 Aug 11;297(6):300-3. | CrossRef | PubMed |
Gerber FH, Goodreau JJ, Kirchner PT, Fouty WJ. Efficacy of preoperative and postoperative bone scanning in the management of breast cancer. N Engl J Med. 1977 Aug 11;297(6):300-3. | CrossRef | PubMed | Piffer S, Amichetti M, Valentín A. Skeletal scintigraphy and physical examination in the staging of early breast cancer. Acta Oncol. 1988;27(1):21-4. | CrossRef | PubMed |
Piffer S, Amichetti M, Valentín A. Skeletal scintigraphy and physical examination in the staging of early breast cancer. Acta Oncol. 1988;27(1):21-4. | CrossRef | PubMed | Hayward RB, Frazier TG. A reevaluation of bone scans in breast cancer. J Surg Oncol. 1985 Feb;28(2):111-3. | CrossRef | PubMed |
Hayward RB, Frazier TG. A reevaluation of bone scans in breast cancer. J Surg Oncol. 1985 Feb;28(2):111-3. | CrossRef | PubMed | Coleman RE, Fogelman I, Habibollahi F, North WR, Rubens RD. Selection of patients with breast cancer for routine follow-up bone scans Clin Oncol (R Coll Radiol). 1990 Nov;2(6):328-32. | CrossRef | PubMed |
Coleman RE, Fogelman I, Habibollahi F, North WR, Rubens RD. Selection of patients with breast cancer for routine follow-up bone scans Clin Oncol (R Coll Radiol). 1990 Nov;2(6):328-32. | CrossRef | PubMed | Kennedy H, Kennedy N, Barelay M, Horobin M. Cost efficiency of bone scans in breast cancer. Clin Oncol (R Coll Radiol). 1991 Mar;3(2):73-7. | CrossRef | PubMed |
Kennedy H, Kennedy N, Barelay M, Horobin M. Cost efficiency of bone scans in breast cancer. Clin Oncol (R Coll Radiol). 1991 Mar;3(2):73-7. | CrossRef | PubMed | Lagrange JL, Frenay M, Darcourt J, François E, Héry M, Namer M. et al. Should systematic bone scintigraphy be carried out on breast cancer patients with small tumors. J Gynecol Obstet Biol Reprod (Paris). 1990;19(6):701-8. | PubMed |
Lagrange JL, Frenay M, Darcourt J, François E, Héry M, Namer M. et al. Should systematic bone scintigraphy be carried out on breast cancer patients with small tumors. J Gynecol Obstet Biol Reprod (Paris). 1990;19(6):701-8. | PubMed | Stines J, Stalars J, Dartois D, Chardot C. Is bone scan useful in patients with breast cancer localized on the basis of clinical examination? 143 cases. Bull Cancer. 1980;67(3):319-23. | PubMed |
Stines J, Stalars J, Dartois D, Chardot C. Is bone scan useful in patients with breast cancer localized on the basis of clinical examination? 143 cases. Bull Cancer. 1980;67(3):319-23. | PubMed | Vennin P, Lemaire B, Carpentier P, Cambier L, Besson P, Sulman C, et al. Clinically localized cancers of the breast. Therapeutic consequences of the evaluation of the extension. Presse Med. 1989 May 27;18(21):1057-60. | PubMed |
Vennin P, Lemaire B, Carpentier P, Cambier L, Besson P, Sulman C, et al. Clinically localized cancers of the breast. Therapeutic consequences of the evaluation of the extension. Presse Med. 1989 May 27;18(21):1057-60. | PubMed | Davies CJ, Griffiths PA, Preston BJ, Morris AH, Elston CW, Blamey RW. Staging breast cancer: role of bone scanning. Br Med J. 1977 Sep 3;2(6087):603-5. | CrossRef | PubMed |
Davies CJ, Griffiths PA, Preston BJ, Morris AH, Elston CW, Blamey RW. Staging breast cancer: role of bone scanning. Br Med J. 1977 Sep 3;2(6087):603-5. | CrossRef | PubMed | Ahmed A, Giynne-JonesR, EII PJ. Skeletal scintigraphy in carcinoma of the breast -- a ten year retrospective study of 389 patients. Nucl Med Commun. 1990 Jun;11(6):421-6. | CrossRef | PubMed |
Ahmed A, Giynne-JonesR, EII PJ. Skeletal scintigraphy in carcinoma of the breast -- a ten year retrospective study of 389 patients. Nucl Med Commun. 1990 Jun;11(6):421-6. | CrossRef | PubMed | Ravaioli A, Tassinari D, Pasini G, Polselli A, Papi M, Fattori PP, et al. Staging of breast cancer: what standards should be used in research and clinical practice. Ann Oncol. 1998 Nov;9(11):1173-7. | CrossRef | PubMed |
Ravaioli A, Tassinari D, Pasini G, Polselli A, Papi M, Fattori PP, et al. Staging of breast cancer: what standards should be used in research and clinical practice. Ann Oncol. 1998 Nov;9(11):1173-7. | CrossRef | PubMed | Kunkler IH, Merrick MV, Rodger A. Bone scintigraphy in breast cancer: a nine-year follow-up. Clin Radiol. 1985 May;36(3):279-82. | CrossRef | PubMed |
Kunkler IH, Merrick MV, Rodger A. Bone scintigraphy in breast cancer: a nine-year follow-up. Clin Radiol. 1985 May;36(3):279-82. | CrossRef | PubMed | Evans DM, Wright DJ. The role of bone and liver scans in surveying patients with breast cancer for metastatic disease. Am Surg. 1987 Oct;53(10):603-5. | PubMed |
Evans DM, Wright DJ. The role of bone and liver scans in surveying patients with breast cancer for metastatic disease. Am Surg. 1987 Oct;53(10):603-5. | PubMed | Glynne-Jones R, Young T, Ahmed A, Ell PJ, Berry RJ. How far investigations for occult metastases in breast cancer aid the clinician. Clin Oncol (R Coll Radiol). 1991 Mar;3(2):65-72. | CrossRef | PubMed |
Glynne-Jones R, Young T, Ahmed A, Ell PJ, Berry RJ. How far investigations for occult metastases in breast cancer aid the clinician. Clin Oncol (R Coll Radiol). 1991 Mar;3(2):65-72. | CrossRef | PubMed | Brar HS, Sisley JF, Jonson RH Jr. Value of preoperative bone and liver scans and alkaline phosphatases in the evaluation of breast cancer patients. Am J Surg. 1993 Feb;165(2):221-3; discussion 224. | CrossRef | PubMed |
Brar HS, Sisley JF, Jonson RH Jr. Value of preoperative bone and liver scans and alkaline phosphatases in the evaluation of breast cancer patients. Am J Surg. 1993 Feb;165(2):221-3; discussion 224. | CrossRef | PubMed | Clark CP 3rd, Foreman ML, Peters GN, Cheek JH, Sparkman RS. Efficacy of peroperative liver function test and ultrasound in detecting hepatic metastases in carcinoma of the breast. Surg Gynecol Obstet. 1988 Dec;167(6):510-4. | PubMed |
Clark CP 3rd, Foreman ML, Peters GN, Cheek JH, Sparkman RS. Efficacy of peroperative liver function test and ultrasound in detecting hepatic metastases in carcinoma of the breast. Surg Gynecol Obstet. 1988 Dec;167(6):510-4. | PubMed | Colizza S, Lupattelli R, De Fazio S, Preziosi P, Karakaci F, Cucchiara G. Hepatic staging in operable breast cancer: a reappraisal from a prospective study. J Surg Oncol. 1985 Oct;30(2):113-5. | CrossRef | PubMed |
Colizza S, Lupattelli R, De Fazio S, Preziosi P, Karakaci F, Cucchiara G. Hepatic staging in operable breast cancer: a reappraisal from a prospective study. J Surg Oncol. 1985 Oct;30(2):113-5. | CrossRef | PubMed | Wiener SN, Sachs SH. An assessment of routine liver scanning in patients with breast cancer. Arch Surg. 1978 Feb;113(2):126-7. | PubMed |
Wiener SN, Sachs SH. An assessment of routine liver scanning in patients with breast cancer. Arch Surg. 1978 Feb;113(2):126-7. | PubMed | Haid M, Singh J, Nevinny HB. Liver scanning in newly diagnosed breast carcinoma. J Surg Oncol. 1980;13(3):265-8. | CrossRef | PubMed |
Haid M, Singh J, Nevinny HB. Liver scanning in newly diagnosed breast carcinoma. J Surg Oncol. 1980;13(3):265-8. | CrossRef | PubMed | Sears HF, Gerber FH, Sturtz DL, Fouty WJ. Liver scan and carcinoma of the breast. Surg Gynecol Obstet. 1975 Mar;140(3):409-11. | PubMed |
Sears HF, Gerber FH, Sturtz DL, Fouty WJ. Liver scan and carcinoma of the breast. Surg Gynecol Obstet. 1975 Mar;140(3):409-11. | PubMed | Ciatto S, Pacini P, Azzini V, Neri A, Jannini A, Gosso P, et al. Preoperative staging of primary breast cancer. A multicentric study. Cancer. 1988 Mar 1;61(5):1038-40. | CrossRef | PubMed |
Ciatto S, Pacini P, Azzini V, Neri A, Jannini A, Gosso P, et al. Preoperative staging of primary breast cancer. A multicentric study. Cancer. 1988 Mar 1;61(5):1038-40. | CrossRef | PubMed | Løgager VB, Vestergaard A, Herrstedt J, Thomsen HS, Zedeler K, Dombernowsky P. The limited value of routine chest X-ray in the follow-up of stage II breast cancer. Eur J Cancer. 1990;26(5):553-5. | CrossRef | PubMed |
Løgager VB, Vestergaard A, Herrstedt J, Thomsen HS, Zedeler K, Dombernowsky P. The limited value of routine chest X-ray in the follow-up of stage II breast cancer. Eur J Cancer. 1990;26(5):553-5. | CrossRef | PubMed | Moskovic E, Parson C, Baum M. Chest radiography in the management of breast cancer. Br J Radiol. 1992 Jan;65(769):30-2. | CrossRef | PubMed |
Moskovic E, Parson C, Baum M. Chest radiography in the management of breast cancer. Br J Radiol. 1992 Jan;65(769):30-2. | CrossRef | PubMed | Moro L, Gazzarrini C, Crivellari D, Galligioni E, Talamini R, de Bernard B. Biochemical markers for detecting bone metastases in patients with breast cancer. Clin Chem. 1993 Jan;39(1):131-4. | PubMed |
Moro L, Gazzarrini C, Crivellari D, Galligioni E, Talamini R, de Bernard B. Biochemical markers for detecting bone metastases in patients with breast cancer. Clin Chem. 1993 Jan;39(1):131-4. | PubMed | Mayne PD, Thakrar S, Rosalki SB, Foo AY, Parbhoo S. ldentification of bone and liver metastases from breast cancer by measurement of plasma alkaline phosphatases isoenzyme activity J Clin Pathol. 1987 Apr;40(4):398-403. | CrossRef | PubMed |
Mayne PD, Thakrar S, Rosalki SB, Foo AY, Parbhoo S. ldentification of bone and liver metastases from breast cancer by measurement of plasma alkaline phosphatases isoenzyme activity J Clin Pathol. 1987 Apr;40(4):398-403. | CrossRef | PubMed | Hannisdal E, Gundersen S, Kvaløy S, Lindegaard MW, Aas M, Finnanger AM, et al. Follow-up of breast cancer patients stage I-II: a baseline strategy. Eur J Cancer. 1993;29A(7):992-7. | CrossRef | PubMed |
Hannisdal E, Gundersen S, Kvaløy S, Lindegaard MW, Aas M, Finnanger AM, et al. Follow-up of breast cancer patients stage I-II: a baseline strategy. Eur J Cancer. 1993;29A(7):992-7. | CrossRef | PubMed | Pedrazzini A, Gelber R, Isley M, Castiglione M, Goldhirsch A. First repeated bone sean in the observation of patients with operable breast cancer. J Clin Oncol. 1986 Mar;4(3):389-94. | PubMed |
Pedrazzini A, Gelber R, Isley M, Castiglione M, Goldhirsch A. First repeated bone sean in the observation of patients with operable breast cancer. J Clin Oncol. 1986 Mar;4(3):389-94. | PubMed | Crivellari D, Price KN, Hagen M, Goldhirsch A, Gelber RD, Castiglione M, et al. Routine test during follow-up of patients after primary treatment for operable breast cancer. lntemational (Ludwig) Breast Cancer Study Group. Ann Oncol. 1995 Oct;6(8):769-76. | PubMed |
Crivellari D, Price KN, Hagen M, Goldhirsch A, Gelber RD, Castiglione M, et al. Routine test during follow-up of patients after primary treatment for operable breast cancer. lntemational (Ludwig) Breast Cancer Study Group. Ann Oncol. 1995 Oct;6(8):769-76. | PubMed | Paradiso A, Nitti P, Frezza P, Scorpiglione N. A survey in Puglia: The attitudes and opinions of specialists, general physicians and patients on follow-up practice. Ann Oncol. 1995;6 Suppl 2:53-6. | PubMed |
Paradiso A, Nitti P, Frezza P, Scorpiglione N. A survey in Puglia: The attitudes and opinions of specialists, general physicians and patients on follow-up practice. Ann Oncol. 1995;6 Suppl 2:53-6. | PubMed | Grunfeld E, Mant D, Yudkin P, Adewuyi-Dalton R, Cole D, Stewart J, et al. Routine follow-up of breast cancer in primary care: randomized trial. BMJ. 1996 Sep 14;313(7058):665-9. | CrossRef | PubMed | PMC |
Grunfeld E, Mant D, Yudkin P, Adewuyi-Dalton R, Cole D, Stewart J, et al. Routine follow-up of breast cancer in primary care: randomized trial. BMJ. 1996 Sep 14;313(7058):665-9. | CrossRef | PubMed | PMC | Zwaveling A, Albers GH, Felthuis W, Hermans J. An evaluation of routine follow-up for detection of breast cancer recurrence. J Surg Oncol. 1987 Mar;34(3):194-7. | CrossRef | PubMed |
Zwaveling A, Albers GH, Felthuis W, Hermans J. An evaluation of routine follow-up for detection of breast cancer recurrence. J Surg Oncol. 1987 Mar;34(3):194-7. | CrossRef | PubMed | Roselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. The efficacy of intensive follow-up testing in breast cancer. Ann Oncol. 1995;6 Suppl 2:37-9. | PubMed |
Roselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. The efficacy of intensive follow-up testing in breast cancer. Ann Oncol. 1995;6 Suppl 2:37-9. | PubMed | Liberati A. The GIVIO trial on the impact of follow-up care on survival and quality of life in breast cancer patients. Ann Oncol. 1995;6 Suppl 2:41-6. | PubMed |
Liberati A. The GIVIO trial on the impact of follow-up care on survival and quality of life in breast cancer patients. Ann Oncol. 1995;6 Suppl 2:41-6. | PubMed | Shapira DV, Urban N. A minimalist policy for breast cancer surveillance. JAMA. 1991 Jan 16;265(3):380-2. | CrossRef | PubMed |
Shapira DV, Urban N. A minimalist policy for breast cancer surveillance. JAMA. 1991 Jan 16;265(3):380-2. | CrossRef | PubMed | The periodic health examination. Canadian Task Force on the Periodic Health Examination. Can Med Assoc J. 1979 Nov 3;121(9):1193-254. | CrossRef | PubMed |
The periodic health examination. Canadian Task Force on the Periodic Health Examination. Can Med Assoc J. 1979 Nov 3;121(9):1193-254. | CrossRef | PubMed | Follow-up after treatment for breast cancer: the Steering Committee on Clinical Practice Guidelines for the care and treatment of breast cancer. CMAJ. 1998 Feb 10;158 Suppl 3:S65-70. | PubMed |
Follow-up after treatment for breast cancer: the Steering Committee on Clinical Practice Guidelines for the care and treatment of breast cancer. CMAJ. 1998 Feb 10;158 Suppl 3:S65-70. | PubMed | Dewar JA, Arriagada R, Benhamou S, Benhamou E, Bretel JJ, Pellae-Cosset B, et al. Local relapse and contralateral tumor rates in patients with breast cancer treated with conservative surgery and radiotherapy (Institut Gustave Roussy 1970-1982 Cancer. 1995 Dec 1;76(11):2260-5. | PubMed |
Dewar JA, Arriagada R, Benhamou S, Benhamou E, Bretel JJ, Pellae-Cosset B, et al. Local relapse and contralateral tumor rates in patients with breast cancer treated with conservative surgery and radiotherapy (Institut Gustave Roussy 1970-1982 Cancer. 1995 Dec 1;76(11):2260-5. | PubMed | RONACAM Group, Chacon R, Blajman C, Gálvez C. et al. Second Neoplasms after Adjuvant Therapy for Breast Cancer. Ann Oncol 1996; 7(Suppl 5):14, Abst 57P.
RONACAM Group, Chacon R, Blajman C, Gálvez C. et al. Second Neoplasms after Adjuvant Therapy for Breast Cancer. Ann Oncol 1996; 7(Suppl 5):14, Abst 57P.