Epidemia que Viene?", organizado por Instituto de Nutrición y Tecnología de los Alimentos (INTA) de la Universidad de Chile, a través de su Programa de Obesidad, el día 17 de octubre de 2001.
Directoras: Dra. Cecilia Albala, Prof. Juliana Kain, Prof. Sonia Olivares.
Introducción
Los tejidos sensibles a la insulina se encuentran en la grasa, los músculos y el hígado. Hasta hace poco tiempo se prestaba muy poca atención a la grasa y se pensaba que el tejido graso era simplemente un lugar donde se guardaba el exceso de calorías ingeridas y no gastadas, pero actualmente la grasa está entregando sus secretos y se está descubriendo que allí está lo más importante.
Sensibilidad a la insulina
Es la capacidad de la insulina para reducir los niveles de glucosa circulante, lo que ocurre mediante dos mecanismos: estimula el uso de glucosa por parte del músculo y, en menor proporción, de la grasa, y suprime la producción hepática de glucosa.
Mediante estos dos procesos, la insulina logra reducir los niveles de glicemia. La sensibilidad insulínica se ha definido específicamente en relación al metabolismo de la glucosa y su estimación se ha concentrado en la capacidad de la insulina para estimular el consumo de glucosa a nivel muscular; pero esta es una reducción del problema, ya que las acciones de la insulina son mucho más complejas.
Resistencia a la insulina
Es la condición en que la sensibilidad tisular a la insulina está reducida. Esta definición es cualitativa y no cuantitativa, de manera que falta mucho en ella para dar cuenta cabal de este proceso, el que se puede entender mejor si se analiza a nivel de cuatro tipos de células de distintos órganos:
Durante mucho tiempo se pensó que el adipocito solamente almacenaba los triglicéridos, mediante procesos de lipogénesis y lipólisis que regulaban lo que se acumulaba en su interior, pero actualmente hay evidencias de que, además, es una célula endocrina con múltiples funciones, entre otras, la de informar al SNC la cantidad de calorías que está almacenando.
A medida que el adipocito crece y aumentan sus niveles de triglicéridos, aumenta la secreción de muchas sustancias que inhiben la diferenciación de preadipocitos a adipocitos, dificultan la entrada de triglicéridos a su interior y facilitan la salida de éstos hacia la circulación. Lo más novedoso es que dentro del adipocito se produce una hormona muy importante, que circula en altas concentraciones en la sangre y que se denomina adiponectina, la que tiene la capacidad de sensibilizar los tejidos a la insulina.
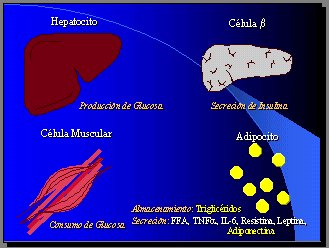
A medida que los adipocitos crecen, secretan los ácidos grasos libres que se producen en la lipólisis, TNF alfa, IL-6, resistina y leptina, que son capaces de producir resistencia a la insulina, y la adiponectina se secreta en menores cantidades (Figura 1).
Figura 1.
El tejido graso es el blanco tisular más sensible a la insulina y existe en tres órganos: la grasa, el hígado y el músculo, representados por el adipocito, el hepatocito y el miocito, respectivamente (1).
El más sensible a la insulina es el adipocito, donde inhibe fuertemente la lipólisis, que es su función fundamental, aun en concentraciones muy bajas. La EC50, que es la concentración de insulina que inhibe la lipólisis en 50%, está entre 7 y 16 microU/ml. En la acidosis diabética, la resistencia a la insulina es tan intensa que no se frena adecuadamente la lipólisis y el hígado se llena de ácidos grasos libres.
El hepatocito está en una posición intermedia, ya que la EC50, para la neoglucogénesis, que es el proceso de formación de glucosa, a partir de precursores no glucosídicos como el lactato, es de 26 microU/ml.
El músculo (miocito) es el tejido menos sensible a la insulina, porque allí se necesita una insulinemia de 58 microU/ml para estimular en 50% la captación de glucosa. Esto es importante, porque permite entender el proceso en forma mucho más lógica.
Estos cuadros pueden ser fisiológicos o patológicos. En los fisiológicos, la resistencia insulínica sirve a un propósito fisiológico, el de permitir el crecimiento acelerado durante la pubertad y el tercer trimestre del embarazo, que es cuando aparece la diabetes gestacional. Ésta se desarrolla en una persona previamente insulinorresistente, en quien la insulinorresistencia es excesiva para la célula pancreática.
Entre los cuadros de resistencia insulínica patológica frecuentes están: la obesidad; el envejecimiento, en el que disminuye la masa magra y aumenta la masa adiposa; la diabetes mellitus tipo II, que es el cuadro clínico más importante en términos conceptuales y que es más frecuente en personas obesas; la hipertensión arterial esencial; el tabaquismo, que produce la resistencia a la insulina mediante la nicotina; el síndrome “X”; y el síndrome de ovario poliquístico, que es uno de los cuadros más frecuentes de expresión clínica de la resistencia a la insulina.
Entre los cuadros menos frecuentes están algunas endocrinopatías, como el síndrome de Cushing, la acromegalia y el hipertiroidismo, la cirrosis hepática, la uremia, la cetoacidosis diabética y la hipertecosis ovárica tipos A y B.
Por último, hay cuadros que son raros, pero que tienen la particularidad de aclarar lo que sucede en ciertos procesos y entregar información acerca de la fisiología y fisiopatología de muchas enfermedades. Entre ellos se encuentran la pseudoacromegalia, el síndrome de Rabson-Mendelhall, las lipodistrofias, el leprechaunismo, el Alström, la ataxia- telangiectasia, algunos medicamentos que se utilizan para el tratamiento del SIDA como los inhibidores de proteasas, que se han asociado con una variación en la resistencia insulínica, y las variantes de la insulinorresistencia tipo A.
El adipocito tiene un sistema de entrada de grasa para producir la lipólisis de las partículas ricas en triglicéridos, que son los VLDL y los quilomicrones de la circulación. Ellos sufren la acción de la lipasa proteica, producida por el adipocito C ancla en el capilar, y luego los ácidos grasos libres entran y se reesterifican en forma de tri-acil glicerol o triglicéridos.
La lipasa hormonosensible es la hormona causante de la lipólisis o de la salida de estos ácidos grasos después de que los triglicéridos sufren el proceso de lipólisis. Hay sustancias que estimulan este proceso, como la estimulación beta 1 y beta 2 adrenérgica y el TNF, y sustancias que lo inhiben, como la estimulación alfa 2 adrenérgica, la adenosina, la prostaglandina E, etc.
En los preadipocitos del tejido adiposo de la grasa intraabdominal, se produce la transformación de un corticoide inactivo, la cortisona, en cortisol, que tiene una fuerte capacidad de estimular la lipólisis y la lipasa lipoproteica.
La insulina estimula la lipasa lipoproteica, pero también inhibe fuertemente la lipasa hormonosensible, el gran freno de la lipólisis. Por eso, si un paciente diabético tipo II se trata en forma poco juiciosa, con cantidades exageradas de insulina, se puede lograr que se controle por un tiempo muy breve, pero posteriormente se volverá tan obeso e insulinorresistente que habrá que aumentar el uso de insulina, lo que va a terminar en un desastre.
Triglicéridos y secreciones adipocitarias
Frente a una sobreingesta calórica asociada con sedentarismo, los adipocitos se expanden con triglicéridos y se vuelven muy voluminosos. Esto provoca una respuesta endocrina adipocitaria que consiste en una caída de la secreción de adiponectina y tiende a inhibir ulteriores depósitos de triglicéridos en estas células, y a facilitar su salida mediante la estimulación de la lipólisis. Al mismo tiempo, inhibe la diferenciación de preadipocitos en adipocitos.
Por otra parte, aumenta la secreción de TNF-alfa, de resistina, cuya existencia está cuestionada desde su descripción en la literatura, hace 10 meses, de leptina y de IL-6. O sea, cuando el adipocito se expande, aumenta la secreción de estas sustancias perjudiciales para la sensibilidad insulínica y disminuye la secreción de la única hormona benéfica que produce el adipocito, que es la adiponectina (Figura 2).
Figura 2.
De las secreciones adipocitarias inductoras de resistencia insulínica, algunas tienen acción autocrina y paracrina, como el TNF alfa y la resistina, y otras tienen acción endocrina, como la leptina y la IL-6, que ha recibido el nombre de “citoquina endocrina”, debido a que se comporta como un mediador inflamatorio del tejido adiposo.
Compartimientos del tejido adiposo
El tejido adiposo normal tiene varios compartimientos:
Diabetes lipoatrófica: síndrome del adipocito vacío
La importancia del recambio del compartimiento visceral queda en evidencia en este cuadro, donde se demuestra que, en ausencia de expansión del tejido adiposo visceral por ausencia de grasa, se producen trastornos graves. Se caracteriza por lo siguiente:
En una paciente portadora de este cuadro, con una gran resistencia a insulina, la grasa se distribuyó por todo el cuerpo y se depositó en hígado, músculos y células beta del páncreas, y, cuando ya no le quedó más espacio, se fue a la piel y le provocó una xantomatosis eruptiva. Este problema se trata con un RU486, un antiglucocorticoide que tiene un efecto tolerante sobre la lipólisis y que demora dos meses y medio, aproximadamente, en lograr que la grasa ingrese nuevamente al adipocito.
En 1987, se determinó que el problema de la diabetes lipoatrófica era que había una lipólisis muy activa y, como en ese momento se sabía muy poco acerca del adipocito, la única posibilidad fue bloquear la acción del cortisol, con lo que se produjo una reentrada de las grasas, desde la sangre, la piel y otros órganos, a los adipocitos. Esta mujer mejoró de su diabetes y posteriormente se le extirparon las glándulas suprarrenales.
Depósitos anómalos de triglicéridos en la resistencia insulínica
Los que ocurren a nivel del hígado son los más peligrosos, ya que si se deposita grasa en el hígado se produce una esteatosis hepática. El hígado se vuelve hiperecogénico, pero, para que esto se pueda apreciar en la ecografía, se necesita que 30% del volumen hepático esté reemplazado por grasa, lo que se traduce en un incremento de la producción de glucosa (neoglucogénesis) por parte del hígado.
La grasa que infiltra el músculo se va a dos subcompartimientos. Uno es el de la grasa extramiocelular, que está en los adipocitos ubicados entre las fibras musculares, los cuales producen TNF-alfa y dificultan la acción insulínica a nivel del miocito, actuando en forma paracrina; y el otro es el de la grasa intramiocelular, que es el más importante y se puede ver con una espectroscopía de resonancia nuclear magnética. Esta grasa intramiocelular disminuye el consumo de glucosa mediado por insulina.
A nivel de la célula beta del páncreas, el infiltrado de grasa aumenta el fenómeno de la apoptosis (muerte celular programada) de dicha célula y aparece una disfunción insular beta característica, que puede llegar a una insuficiencia total y obligar a tratar a un paciente diabético tipo II con insulina, por falta de respuesta a los medicamentos vía oral.
La resistencia insulínica, especialmente visceral, se produce por lo siguiente:
La adiponectinemia aumenta con la baja de peso, la glitazona y la restricción calórica.
Papel de TNF-alfa y glitazona en la resistencia insulínica
O sea, el TNF es muy importante en la génesis de la resistencia insulínica en la obesidad, pero no es el único factor.
Lipotoxicidad
Se refiere a la aparición de resistencia insulínica en el músculo y en el hígado, provocada por los altos niveles de ácidos grasos libres, circulantes, de la obesidad.
Además, los altos niveles de ácidos grasos libres circulantes provocan una disfunción crónica de la célula pancreática beta, caracterizada por:
La típica curva de tolerancia a la glucosa, en un paciente insulinorresistente, parte con altos niveles basales de insulina y con la sobrecarga de glucosa, en vez de mantener el peak de insulina hasta media o una hora, lo tienen hasta las dos horas, es decir, en forma excesiva, lo que demuestra que la célula beta está produciendo insulina en forma anómala. Muchos pacientes insulinorresistentes obesos consultan por hipoglicemias tardías a la cuarta o quinta hora, porque se libera la insulina en un momento indebido.
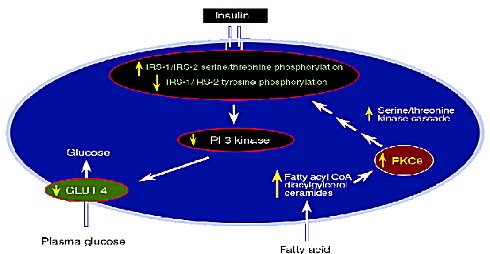
Recientemente, en el Journal Clinical Investigation, se propuso que los ácidos grasos libres circulantes en altas concentraciones, de los obesos y los diabéticos, entran en la célula muscular y provocan un incremento de derivados como la ceramida, el diacylglicerol y la fatty-acylCoA, que estimularían la actividad de la proteina kinasa PKCO. Esta, a su vez, activaría la cascada de la serina/treonina kinasa, que van a fosforilar los IRS-1 e IRS-2 de serina y treonina, que son los aminoácidos incorrectos, en vez de hacerlo en la tirosina, disminuyendo la actividad de la insulina.
Al disminuir la actividad de los IRS-1 e IRS-2, por la menor fosforilación de la tirosina, se produce una disminución de la enzima fosfatil inositol 3 kinasa (PI 3 kinasa), que es una enzima muy importante para la transmisión intracelular de la señal insulínica, lo que produce la traslocación de una mayor cantidad de transportadores de glucosa hacia la membrana, reduciendo la entrada de glucosa a la célula (2)(Figura 3).
Figura 3. Efecto de los ácidos grasos libres sobre la acción insulínica en el músculo.
En consecuencia, lo que realmente estaría sucediendo es que el exceso de ácidos grasos libres en circulación disminuiría la entrada de glucosa en el interior de la célula, pero, una vez dentro, la producción de glicógeno sería normal.
Importancia de los ácidos grasos libres
Obesidad y resistencia insulínica
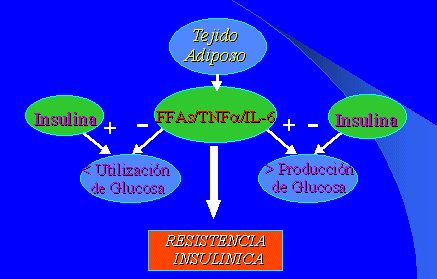
Los ácidos grasos libres, el TNF alfa y la IL-6, claramente, son vínculos entre la obesidad y la resistencia insulínica. El tejido adiposo, a medida que se expande, secreta gran cantidad de estos elementos, que tienen acción antiinsulínica sobre la utilización y producción de glucosa y producen el gran fenómeno de la resistencia insulínica (Figura 4).
Figura 4. Acidos grasos libres y TNFa e IL-6: vínculos entre la obesidad y la resistencia insulínica.
El fenómeno inicial consiste en que el tejido adiposo se repleta de trigicéridos, produciendo una secreción excesiva de sustancias como TNF alfa, IL-6, leptina y resistina.
Además, se produce una disminución de la secreción de adiponectina, que lleva a una lipólisis elevada y a una inhibición de la diferenciación adipocitaria, que está muy unida a la génesis de la resistencia a la insulina.
Al aumentar los ácidos grasos libres circulantes y depositarse como grasa, producirían una disfunción insular beta en la célula pancreática, un incremento de la producción de glucosa en el hígado, disminución del transporte de glucosa y un menor consumo de azúcar en el músculo.
Esta información demuestra que lo más importante no es la grasa de los compartimientos normales, sino la grasa que está fuera de ellos. De los compartimientos normales, el que está más asociado con la resistencia insulínica es el compartimiento visceral, pero es mucho menos importante que la ubicación de grasa en los tres componentes ya mencionados, que son realmente la clave en la génesis de la resistencia insulínica y, finalmente, de la diabetes.





 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Epidemia que Viene?", organizado por Instituto de Nutrición y Tecnología de los Alimentos (INTA) de la Universidad de Chile, a través de su Programa de Obesidad, el día 17 de octubre de 2001.
Directoras: Dra. Cecilia Albala, Prof. Juliana Kain, Prof. Sonia Olivares.
 Expositor:
Patricio Contreras[1]
Expositor:
Patricio Contreras[1]

Citación: Contreras P. Fat and insulin resistance. Medwave 2002 Jun;2(5):e3188 doi: 10.5867/medwave.2002.05.3188
Fecha de publicación: 1/6/2001

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión