Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Simposio Prebióticos en la Alimentación Humana y su Efecto en la Salud, organizado por el Instituto de Nutrición y Tecnología de los Alimentos de la Universidad de Chile (INTA) el día 25 de septiembre de 2003.
Editor científico: Dr. Oscar Brunser.
Introducción
Por definición, los prebióticos forman parte de los alimentos funcionales, que son aquellos que influencian al ser humano en forma positiva más allá de su valor nutricional, es decir, mejoran su salud. Ejemplos de ellos son los alimentos bajos en colesterol y los que contienen probióticos.
Los prebióticos también pertenecen a la categoría de alimentos funcionales ya que representan un ingrediente no digerible que mejora la salud del huésped mediante la estimulación de la cantidad o la actividad de su flora colónica; son en cierto modo un nutriente para la flora del colon.
La diferencia entre un probiótico y un prebiótico es que el primero es un microorganismo vivo, no patógeno, que necesita resistir los procesos de digestión normales para llegar al colon, donde ejerce acciones positivas sobre la salud del huésped. Un sinbiótico es una combinación entre un prebiótico y un probiótico.
Los prebióticos modifican la flora gastrointestinal residente. El tracto gastrointestinal sólo es completamente estéril durante la vida intrauterina; en el momento del parto se comienza a establecer en el recién nacido una microbiota intestinal proveniente de la flora vaginal y perianal de la madre y que es adquirida durante el pasaje por el canal del parto. Esta flora neonatal cambia, pasa a ser infantil y luego a los 5 ó 6 años el niño tiene una flora intestinal de tipo adulto.
Existen en el colon numerosos microorganismos que conviven en un ecosistema muy complejo, formado por más de 400 especies distintas de bacterias; es probable que en nuevos estudios que utilizan la técnica FISH se encuentren más de 1000 especies. Todas ellas conviven juntas, algunas con efectos antagónicos y otras con efectos sinérgicos. Las bacterias del colon son difíciles de estudiar, en parte debido a su gran número y diversidad: un adulto tiene de 10 a 100 veces más células bacterianas en su colon que células propias que conforman su organismo humano; un gramo de deposiciones contiene más de 1010 bacterias. El peso de la flora colónica, podría llegar fácilmente a un kilo y, si el conjunto de estas bacterias fuera considerado como un órgano, sería uno de los órganos más importantes del organismo. Lo anterior ha sido ignorado durante mucho tiempo y sólo hace algunos años se ha comenzado a estudiar en forma seria.
La flora colónica puede ser diferenciada en flora autóctona y flora de transición, que varía de acuerdo con los hábitos dietéticos, el lugar de residencia, los viajes realizados, etc. Según algunos investigadores, la porción autóctona de la flora es tan propia del individuo como su impronta genética (DNA printing) o el genotipo.
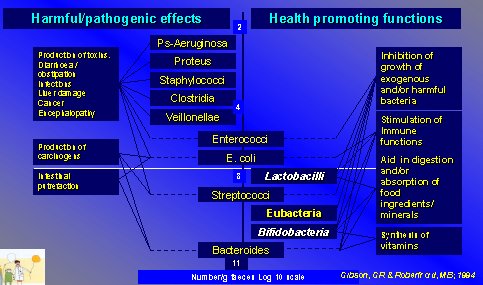
Existen numerosas bacterias en el colon, tanto beneficiosas como patógenas; entre las beneficiosas para el ser humano se cuentan los lactobacilos y las bífidobacterias, que predominan sobre todas las anteriores. Ambas bacterias ejercen distintas funciones en el organismo, las que en la actualidad están bastante bien establecidas: inhiben el crecimiento de bacterias exógenas y de la flora potencialmente patógena, estimulan la función del sistema inmune, favorecen la digestión y la absorción de algunos alimentos o minerales y contribuyen a la síntesis de algunas vitaminas (Figura 1).
Figura 1. Composición de la flora intestinal.
De acuerdo con lo anterior, surge la pregunta acerca de la mejor manera de alimentar a los niños. Indiscutiblemente lo mejor es la lactancia materna, por la duración que sea posible mantener. De acuerdo con la manera en que alimentamos a los niños, ya sea con leche materna o fórmulas lácteas, se establece en ellos una flora bacteriana colónica distinta. Al momento de nacer el tracto digestivo es estéril y, como se manifestara más arriba, adquiere su flora a partir de aquella que reside en la vagina y la región anal materna.
En Bélgica, un país donde 20% de partos ocurren por cesárea, se demostró que estos niños tienen desde los primeros días de vida una flora distinta a los niños nacidos por parto vaginal. Esto es algo que hasta ahora los pediatras no han considerado lo suficiente al estudiar a los niños y su función gastrointestinal.
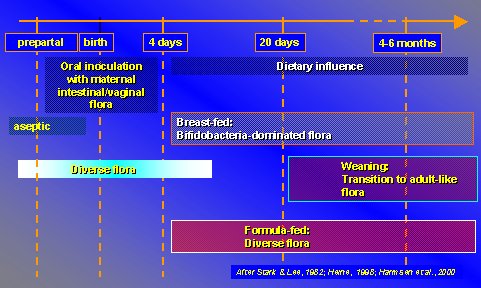
Al estudiar a niños alimentados con lactancia materna exclusiva, las bífidobacterias predominan en su flora gastrointestinal, pero en aquellos alimentados con fórmulas lácteas se establece una microflora más variada. Posteriormente, alrededor de los cuatro a seis meses de edad, se inicia una transición hacia una flora más parecida a la del adulto. La lactancia materna y las fórmulas tienen efectos distintos sobre la flora gastrointestinal (Figura 2).
Figura 2. Efecto de la lactancia materna exclusiva versus alimentación con fórmulas lácteas sobre la flora intestinal.
La importancia de lo anterior radica en que en esta situación la microflora permanece distinta en el tiempo. Un estudio de Hokama demuestra que en 113 lactantes normales y sanos alimentados con leche materna no se detecta Streptococcus beta-hemolítico grupo A, ni existe Streptococcus pneumoniae, Haemophilus influenzae o Moraxella catharralis. En cambio, en aquellos alimentados con fórmulas, Haemophilus y Moraxella formaban parte tanto de la flora colónica como de la faríngea (Hokama T. J Trop Pediatr 1999;45:173-6). De acuerdo con la manera en que se alimenta al niño desde el nacimiento, se encuentran microorganismos diferentes no sólo en el colon, sino también en el tracto respiratorio y/o en la faringe.
Esto trae consecuencias para la salud del niño, ya que existen diferencias claras en la incidencia de algunas patologías al comparar los niños alimentados con fórmula y aquellos amamantados. Un estudio reciente, realizado en los Estados Unidos, evalúa los costos del cuidados de salud durante su primer año de vida de niños alimentados con fórmula láctea. En ese país la salud es cara, pero lo importante no son los costos absolutos de cada atención en sí mismos sino los siguientes datos: por cada 1000 niños alimentados con fórmula, se producen 2000 visitas adicionales al médico, 200 días más de hospitalización, 600 recetas más por infecciones del tracto respiratorio bajo, otitis media y enfermedad gastrointestinal que en igual número de lactantes amamantados (Ball TM. Pediatrics 1999;103:870-6). La diferencia en cuanto al costo total es de 400 dólares en comparación con cada niño amamantado en el primer año de vida; queda en claro además que los niños alimentados con fórmulas sufren más enfermedades infecciosas que los que fueron alimentados con leche materna.
Hay muchas razones que explican esta situación y una de ellas es la composición de la leche materna. Ésta se compone, en cantidades absolutas, en primer lugar de lactosa, en segundo lugar están los lípidos y el tercer ingrediente más importante no son las proteínas, sino los prebióticos. Los prebióticos son oligosacáridos que en la leche materna se encuentran en una concentración de 10 a 12 gr/l. Las proteínas sólo son el cuarto componente principal por peso. Lo anterior demuestra que los prebióticos serían un concepto bastante natural, ya que en términos absolutos son el tercer factor más importante de la leche materna.
El interés por este campo surgió hace mucho tiempo. Hace casi cien años, el ruso Ilya Metchnikoff recibió el Premio Nobel por su idea de usar probióticos en el tratamiento de algunas afecciones. Casi cien años antes de esto, se encuentra la primera descripción en la literatura sobre las bífidobacterias como parte esencial de la flora gastrointestinal, en niños alimentados con lactancia materna. Hace cincuenta años, se describió a los oligosacáridos de la leche materna como factores bifidogénicos (György P, Arch Biochem Biophys 1954, 48, 193-201) y hace sólo una docena de años se describió la presencia en la leche humana de oligosacáridos de alto peso molecular (Stahl B, Anal Biochem 1994, 223, 218-26).
Lo que ocurre en los niños alimentados con formulas basadas en la leche de vaca es que se intenta imitar en ellos los efectos de la leche materna, pero no su composición. No usamos la leche de vaca por que es idéntica a la materna, sino porque “hay muchas vacas con mucha leche”. Para acercarnos a una composición similar a la de la leche materna, debemos cambiar la composición de la leche de vaca en forma sustancial: los oligosacáridos, el tercer componente más importante de la leche materna, no existen en la leche de vaca. Es curioso, entonces, que, conociendo la presencia de oligosacáridos en la leche materna desde hace cincuenta años, sólo hoy se otorga importancia al concepto de la manipulación de la flora gastrointestinal.
En las décadas de 1980 y 1990 la meta de la alimentación artificial de los lactantes era la imitación de la leche materna. Hoy, el concepto ha cambiado: no se pretende imitar la composición de la leche materna, sino sus efectos sobre el lactante. Así, se acepta el empleo de los probióticos, bacterias vivas que se pueden introducir en los alimentos y que tienen algunas ventajas teóricas, aunque también plantean ciertas incógnitas en cuanto a su supervivencia y a la actividad que mantienen después de almacenarlos en productos alimenticios y de su pasaje por el tubo digestivo. Por otra parte, los prebióticos no son bacterias exógenas activas sino que promueven la estimulación y crecimiento de la flora endógena, por lo que no existe el problema de su supervivencia o de su actividad remanente. Los prebióticos estimulan procesos de fermentación en el colon y existen, desde luego, productos que combinan prebióticos y probióticos, y que se engloban en el concepto de sinbióticos.
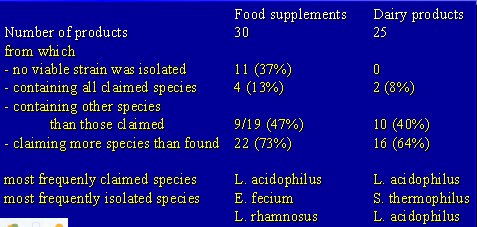
Otro motivo por el cual los prebióticos pueden representar un buen concepto en la alimentación de lactantes, niños y adultos es la calidad de los productos que se están comercializando. La Universidad de Ghent, en Bélgica, realizó un análisis de lo disponible en Europa Occidental, que abarcó treinta y dos suplementos dietéticos en forma de cápsulas que contienen probióticos y que no se expenden como medicamentos sino que pueden ser adquiridos en farmacias o negocios de alimentos. Además, se analizaron veinticinco productos lácteos tipo yogurt. Ocurrió que en ninguno de estos productos se aisló ni una sola cepa viable y aunque todos decían que contenían microorganismos vivos, no se aisló ni una cepa en casi 40% de los suplementos. De manera que el público estaba adquiriendo a un alto precio un polvo inerte pensando que recibía un microorganismo. No ocurría lo mismo con los productos lácteos, de los cuales sólo 10% contenían todas las cepas que decían tener. La mitad de los productos decían que contenían más especies que las que realmente se encontraron en el producto y las cepas predominantes que se detectaron eran distintas de lo que decía la etiqueta (Temmerman R. Innovations in Food Technology 2002; 2:72-73) (Tabla I).
Tabla I. Análisis cualitativo y exactitud del etiquetado de probióticos comerciales.
En este sentido no habría problemas desde el punto de vista legal porque se trata de productos alimenticios y no se les exige tanta exactitud; pero, si se quiere estudiar la eficacia de estos productos en presencia de datos tan incorrectos en las etiquetas, no se puede considerar que esa sea su eficacia terapéutica potencial debido a los problemas de calidad de los productos.
Diferente del concepto acerca del uso de probióticos en la dieta diaria de adultos y niños, existe el concepto de los prebióticos, los que pasan por el estómago, el yeyuno y el íleon sin sufrir modificaciones, cosa que no ocurre con los probióticos. Los prebióticos estimulan el desarrollo de la flora adquirida y autóctona y no estimulan el crecimiento de los patógenos. Tampoco existen problemas respecto de la especificidad de las cepas, como es el caso de los probióticos: cada cepa de probiótico tiene características específicas; si hay un número determinado de cepas, se puede obtener un efecto muy específico, pero no se puede globalizar. Con el conocimiento acerca de los probióticos pasa lo mismo que con el conocimiento respecto de los antibióticos: en un principio se conocía solamente la penicilina, que se usaba para todas las infecciones; pero a medida que se fueron ampliando los conocimientos, aparecieron nuevas familias de antibióticos, específicos según el tipo de agente causal. Probablemente en el futuro, cuando se quiera usar probióticos para algún tipo de tratamiento, va a ocurrir lo mismo en cuanto a su especificidad. Con los prebióticos no es necesario enfrentar problemas de supervivencia: son fáciles de preparar y el concepto es muy fisiológico, porque se basa en lo que se sabe acerca de los oligosacáridos de la leche materna. Los prebióticos son también productos muy naturales porque se encuentran en muchos vegetales, tales como la achicoria donde, por ejemplo, su concentración es de 15% a 20%; también están presentes en otras plantas como el ajo, cebolla, y la alcachofa. Según el lugar donde uno vive, la ingesta diaria de prebióticos es diferente. En los Estados Unidos la ingesta se acerca a 4 gramos; en cambio, en Europa, donde se consumen más verduras, bordea los 11 gramos.
Los fructooligosacáridos son fructanos, que corresponden a una cadena de fructosa que puede tener distintas longitudes. La industria obtiene inulina a partir de la achicoria, la que se trata con agua caliente y se extrae así el oligosacárido. Si la inulina se somete a hidrólisis parcial con enzimas, se obtiene oligofructosa. Ambos son prebióticos pertenecientes a los fructooligosacáridos.
La inulina tiene cierto grado de polimerización, es de cadena relativamente larga, de 20 a 60 moléculas de fructosa, pero la que se emplea, parcialmente hidrolizada, tiene una longitud promedio de diez unidades. La oligofructosa tiene una cadena más corta, de dos a diez moléculas, con un promedio de cuatro. Estos son prebióticos, porque no son digeribles y se puede recuperar casi 90% de ellos en pacientes ileostomizados.
Los fructooligosacáridos tienen distintas funciones: los de cadena corta fermentan rápidamente en el colon proximal y tienen un efecto bastante local sobre las bífidobacterias en el ciego y colon ascendente. La inulina, de cadenas más largas, estimula la fermentación lenta en el resto de colon y así proporciona nutrientes a las bífidobacterias, presentes tanto en el colon ascendente como en los demás segmentos de este órgano. En los productos Nestlé los prebióticos están presentes en una proporción de 70% y 30%. Lo que se hizo fue agregar a estos productos Prebio 1, que es una mezcla de inulina y oligofructosa (Tabla II).
Tabla II. Fructooligosacáridos en productos comerciales.
Efectos bifidogénicos en fórmulas lácteas con suplemento de prebióticos
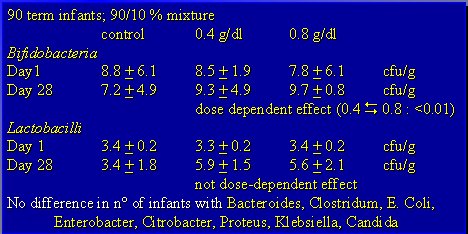
Al evaluar los prebióticos en cuanto a su seguridad, estos productos se consideran muy seguros. El estudio se divide en tres grupos de recién nacidos prematuros: alimentados con leche materna, con fórmula normal para prematuros, o con fórmula con contenido de combinaciones de galactooligosacáridos y fructooligosacáridos. Se observa que, al haber manipulado la flora gastrointestinal, se obtiene un predominio de bífidobacterias; pero lo más importante es que no hubo repercusión en ganancia de peso, estatura ni otros síntomas. Por lo tanto, no se detectan efectos adversos atribuibles a estos oligosacáridos, ni siquiera en los niños cuyo peso bordea el kilo (Boehm G. Arch Dis Child Fetal Neonatal Ed 2002;86:F178-81). Lo antedicho es lógico, puesto que la leche materna es rica en estos componentes (Tabla III).
Tabla III. Efecto de la suplementación de una mezcla de oligosacáridos sobre las bífidobacterias fecales en lactantes de pretérmino.
Está demostrado que los fructooligosacáridos, administrados a razón de 4 gr por día, actúan como importantes factores prebióticos en los adultos, ya que estimulan el crecimiento de bífidobacterias en el colon. Otra cosa muy interesante es que el efecto del prebiótico es inversamente proporcional a la cantidad inicial de bífidobacterias; de hecho, cuanto menor sea el número inicial de bífidobacterias, tanto mayor será el efecto de los prebióticos; el número de bifidobacterias aumenta hasta un cierto nivel que no es sobrepasado, por lo que nunca se alcanzan niveles demasiado altos.
Tanto en el caso de los prebióticos como de los probióticos, al detener su administración, los efectos desaparecen en un período de dos semanas y se regresa a la situación previa de la flora autóctona. Es por eso que la manipulación de la flora gastrointestinal durante la primera etapa de la vida es tan interesante, aunque quizás sea potencialmente peligrosa; por lo tanto, es preciso estudiarla con mucho cuidado, porque la flora que se desarrolle durante el primer mes de la vida es la que el individuo tendrá durante toda la vida. Al manipular a la flora hay que preocuparse de hacerlo en forma correcta.
Estimulación selectiva de bífidobacterias con oligofructosa e inulina
Otro estudio, realizado por Gibson, demuestra que tanto la oligofructosa como la inulina aumentan sustancialmente el número de bífidobacterias aunque el número total de bacterias no cambia (GR Gibson. Gastroenterology 1995; 108: 965 – 82). Esto significa que las demás bacterias disminuyen proporcionalmente. Aumentaron también la masa fecal húmeda y seca, el nitrógeno, la excreción de energía y el hidrógeno en el aire espirado (Tabla IV).
Tabla IV. Estimulación selectiva de bífidobacterias en el colon humano con oligofructosa e inulina.
Importancia de la forma de administrar los prebióticos
En la mayoría de los estudios, el prebiótico es administrado en forma separada, porque así es más fácil estudiarlo; por lo tanto, es administrado en una cápsula o en un sobre, y no está mezclado con los alimentos. Un estudio demostró que si se administra 8 gr de prebióticos por dos semanas en la comida o como fármaco, el aumento de bífidobacterias no cambia. Así, la eficacia de los estudios donde todas las dosis están controladas se puede extrapolar a lo que ocurre en la vida diaria.
La inulina y la oligofructosa promueven el aumento de las bífidobacterias, lo que significa que permiten la fermentación rápida por bacterias colónicas, con aumento del acetato y los demás ácidos grasos de cadena corta, aumento de la masa fecal, captación de amonio para la síntesis proteica bacteriana y mejor biodisponibilidad del calcio (Jenkins DJ et al. J Nutr 1999; 129 (Suppl 17): 1431–3; Roberfroid MB, J Nutr 1999; 129 (Suppl 7): 1398-401; Brommage R. J Nutr 1993; 123: 2186-94)
Efectos de prebióticos sobre el calcio en ratas
En ratas alimentadas con 10% de oligofructosa o 10% de inulina aumenta la masa fecal total, disminuye la excreción fecal de calcio, magnesio y fierro, y aumenta la excreción fecal de nitrógeno (Delzenne N. Life Sci 1995; 57:1579-87).
Efecto sobre las características de las deposiciones
En lactantes alimentados con fórmulas ricas en oligosacáridos se observa nuevamente que las bífidobacterias llegan a predominar y que el lactobacilo aumenta posteriormente.
Para las madrse es importante que las características y el número de deposiciones lleguen a parecerse a las del niño alimentado con una fórmula normal, y que su consistencia se parezca a la de los lactantes amamantados. La suplementación con fructooligosacáridos resulta en recuentos absolutos de bífidobacterias que son más altos que en los niños con lactancia materna (Supplementation of a bovine formula with an oligosaccharide mixture increases counts of faecal bifidobacteria in preterm infants. Boehm G. Arch Dis Child Fetal Neonatal Ed 2002; 86:F178-81)
Prebióticos y absorción de calcio y otros minerales
En un estudio en adolescentes, 54 de ellas, de sexo femenino, fueron sometidas a un periodo de adaptación y a continuación, durante cuatro semanas, recibieron 8 gr de inulina diariamente. La administración de calcio fue de 1400 mg/día y su absorción se evaluó empleando isótopos estables. Se concluyó que la inulina aumenta la absorción de calcio de 31% a 35%, lo que significa que es 20% más eficaz (IJ Griffin et al, Ped Research 2002 ; 51 (4): 188A). El principal beneficio se produjo en aquellos niños cuya absorción o administración de calcio era intrínsecamente más baja; los factores genéticos también podrían cumplir un papel. Si el efecto del prebiótico es mayor, quiere decir que se consigue el mismo efecto con menores ingestas de calcio.
Numerosos otros estudios han evaluado la absorción del calcio y en general su conclusión es que mejora la biodisponibilidad, suben los niveles en el suero y contribuiría a mejorar la estructura ósea. De acuerdo con un estudio, el aporte de 17 g de oligofructosa aumenta la absorción de calcio en 12% mientras que la administración de una dosis alta de inulina (40 gr) aumenta la absorción de calcio en 11%. Esta mayor absorción representa una gran ventaja, especialmente en el caso de las mujeres, en quienes problemas asociados con la osteoporosis son frecuentes.
La disponibilidad del calcio, hierro y zinc de la leche humana es bien conocida, y ha servido de base para estandarizar la absorción de estos micronutrientes en las fórmulas lácteas, la que es muy baja. Por esta razón, el contenido de hierro, zinc y calcio de las fórmulas debe ser mucho más alto que en la leche materna. Al agregar inulina a las fórmulas lácteas la absorción de calcio aumenta de 13% a 17%, lo que se aproxima más a la leche materna y la absorción de zinc aumenta de 9% a 12,2%. La absorción de hierro no varia significativamente. Las observaciones anteriores no han sido comprobadas con otros prebióticos estudiados.
Otro estudio, que no pertenece a la pediatría pues se efectuó en varones maduros y mujeres post menopáusicas, demostró que se obtiene a una mayor absorción de magnesio, que llega a 12% de la cantidad presente en la fórmula, el mismo nivel que para la absorción de calcio.
Los mecanismos que explican lo anterior son varios: los oligosacáridos no digeribles llegan al colon y aumentan selectivamente la fermentación, lo cual incrementa el número de bífidobacterias que aumentan a su vez la producción de ácidos grasos de cadena corta, la que disminuye el pH luminal. Esto tiene como resultado un aumento de contenido cecal, engrosamiento de la pared cecal y solubilización de los minerales presentes en el lumen. En la mucosa del intestino delgado la administración de prebióticos aumenta la altura de las criptas, el número de sus células epiteliales y el flujo venoso, así como el flujo de calcio desde la cara mucosa de la pared hacia la cara serosa, lo que representa un mecanismo pasivo de absorción de este mineral. A nivel celular, los prebióticos incrementan la expresión de la calbindina y, de esta manera aumentan el transporte activo de calcio. Por lo tanto, junto con la observación experimental que la absorción de calcio mejora, hay fundamentos científicos y racionales que apoyan que la observación es cierta (K E Scholz-Ahrens AJCN 2001; 73: 459S-64S).
También existiría evidencia que indica que los prebióticos influyen en el metabolismo de la energía, en la inducción de inmunidad específica e inespecífica y en la maduración del sistema inmune, aspectos que estamos estudiando.
Prebióticos y lípidos
Los fructooligosacáridos tienen efecto sobre la producción de ácidos grasos de cadena corta. Los efectos secundarios negativos producidos por las altas dosis de fructooligosacáridos se deberían al aumento de la formación de gases intestinales. Estos compuestos cambian la composición bacteriana de la flora, y de esta forma previenen la colonización por patógenos y mejoran la absorción de algunos micronutrientes.
Respecto de los ácidos grasos de cadena corta, sabemos que el biturato es una fuente de energía para la flora colónica. Ya he mencionado algunos de los efectos de estos compuestos (aumento del flujo sanguíneo colónico, y estimulación de la absorción de sodio y agua).
Efectos de los prebióticos (inulina y oligofructosa) en la prevención de infecciones
En un estudio se concluyó que, al reconocer el efecto inhibitorio que las bífidobacterias ejercerían sobre patógenos gastrointestinales, uno de los más aspectos importantes del consumo de prebióticos es el condicionamiento de la flora para resistir infecciones agudas. Hay que recordar que una de las diferencias entre los niños alimentados con fórmula y aquellos amamantados es el mayor costo que representan las consultas a pediatras relacionadas con la mayor incidencia de infecciones en los niños que no reciben prebióticos en su alimentación.
Nuevamente, lo anterior se puede explicar por la acidificación del lumen del colon; si la microflora produce más ácido láctico hay un efecto antibacteriano directo sobre los patógenos, lo cual significa que, al haber más bífidobacterias y lactobacilos, los que también compiten por los receptores celulares, se produce una mejoría de la función inmune; de hecho, aumenta la cantidad de células inmunomoduladoras y hay competencia entre las bacterias por nutrientes y otros factores de crecimiento.
En la prevención de una infección intestinal, la diarrea del viajero, a 224 adultos se les administró 10 gr de fructooligosacáridos comparados con un placebo; como lo señalan todos los estudios, los prebióticos aumentan el hábito intestinal, inducen sensación de bienestar general y aumentan la flatulencia. En este estudio la disminución de la diarrea del viajero no fue significativa: afectó a 20% de quienes recibían placebo en comparación con 11% de quienes recibían fructooligosacáridos, pero existen indicios de que habría algún efecto (Cummings JH. Aliment Pharmacol Ther 2001; 15:1139-45).
No me referiré en detalle a los efectos que los prebióticos tienen sobre el colesterol, porque estimo que no tienen tanta importancia en pediatría, pero sus efectos están bien establecidos. La prevención del cáncer, también en niños por problemas de edad que se han mencionado anteriormente, tampoco es tan pertinente a esta discusión pero de hecho es uno de los aspectos más relevantes del uso de prebióticos en la dieta.
Influencia sobre el sistema inmune
En un estudio hecho en Indonesia, en que se administró a lactantes un cereal con Prebio 1 mezclado con 25 gr de cereal (o sin él) desde cuatro semanas antes de la vacunación contra el sarampión, se demostró que la administración de los prebióticos no se asoció con diferencias del aumento de peso ni había evidencias de intolerancia al prebiótico. Lo que resultó interesante fue que el nivel de anticuerpos que desarrollaron los niños contra el virus del sarampión fue mucho más alto en aquellos que habían recibido la dieta con prebióticos. Lo anterior plantea que podría haber un cambio de la respuesta inmune a la vacuna que podría ser debido a los prebióticos (Haschke F. Monatsschr Kinderheilk 2001;149:S66-S70).
En un estudio que está en curso hemos dividido a recién nacidos en tres grupos: uno alimentado con una fórmula estándar, otro con fórmula adicionada con prebióticos y el tercero con lactancia materna. Hemos tomado muestras de sangre en diferentes etapas y cuantificado los diferentes tipos de linfocitos T con el propósito de observar si se producían diferencias.
Por último, quiero referirme a un trabajo de Saavedra, en niños que asisten a un jardín infantil y que reciben alimentos con oligofructosa o sin ella. Se pudo demostrar que no había diferencias en cuanto a la incidencia de diarrea, pero que sí hay diferencias en cuanto a los síntomas relacionados con ella, como fiebre, malestar, vómitos, regurgitación y necesidad de atención médica. También fue muy importante la disminución de episodios febriles, síntomas respiratorios y el menor el uso de antibióticos. Este trabajo que quizás no sea muy relevante científicamente, puede tener gran importancia para los padres. La disminución del ausentismo escolar en estos niños acarrea menos dificultades en cuanto a quién se hará cargo del cuidado del niño si está enfermo. Estos datos, por cierto, necesitan más confirmación, pero los resultados son muy promisorios porque se plantea que, si se administra prebióticos como la mezcla Prebio 1 durante seis meses, disminuye la incidencia de infecciones y disminuyen los síntomas asociados con la diarrea (J. Saavedra, NASPGN1999. J Pediatr Gastroenterol Nutr, 1999;29 A95 / A. Tschernia, NASPGN 1999. J Pediatr Gastroenterol Nutr, 1999;29 A58).
Está demostrado que la inulina, que se extrae de la achicoria con agua caliente, y la oligofructosa (producto de la hidrólisis parcial de la inulina) tiene los siguientes efectos:








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el Simposio Prebióticos en la Alimentación Humana y su Efecto en la Salud, organizado por el Instituto de Nutrición y Tecnología de los Alimentos de la Universidad de Chile (INTA) el día 25 de septiembre de 2003.
Editor científico: Dr. Oscar Brunser.
 Expositor:
Yvan Vandenplas[1]
Expositor:
Yvan Vandenplas[1]

Citación: Vandenplas Y. Use of prebiotics in child products. Medwave 2004 Mar;4(2):e3165 doi: 10.5867/medwave.2004.02.3165
Fecha de publicación: 1/3/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión