 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada de una conferencia dictada en el Curso CEDIP 2007 AUGE Perinatal y Ginecológico, organizado por el Centro de Diagnóstico e Investigaciones Perinatales, Hospital Sótero del Río, Universidad Católica de Chile, durante los días 23, 24 y 25 de Agosto de 2007, cuyos directores fueron los doctores Rogelio González, Ricardo Gómez, Juan Andrés Ortiz e Iván Rojas.
En la siguiente presentación se entregarán los siguientes contenidos:
Las complicaciones fetales pueden ser agudas o crónicas. Dentro de las complicaciones agudas del síndrome hipertensivo del embarazo (SHE) están el desprendimiento de placenta normoinserta (DPNI) y el sufrimiento fetal agudo (SFA); entre las complicaciones a largo plazo, la principal es la restricción del crecimiento intrauterino (RCIU). Con respecto a este punto es importante recordar la hipótesis de Baker, que postula que una nutrición intrauterina pobre, asociada a otros factores, puede alterar el crecimiento normal durante períodos críticos de la vida intrauterina, lo que puede afectar en forma permanente la estructura y fisiología de distintos órganos (1). Esto se asocia a mayor riesgo de desarrollar hipertensión arterial crónica en la vida adulta, asociación que es estadísticamente significativa e independiente del grupo social, hábito de consumo de alcohol y tabaco y grado de obesidad que el paciente llegue a tener (2). Asimismo existe mayor riesgo de desarrollar enfermedad coronaria, ya que la tasa de mortalidad por esta condición disminuye progresivamente a medida que aumenta el peso al nacer. También hay una correlación positiva con las tasas de diabetes mellitus e hiperinsulinemia (3).
De acuerdo con lo anterior, es fundamental pesquisar a tiempo la RCIU asociada al SHE, porque se asocia a daño agudo y también a largo plazo. Para hacer el diagnóstico de RCIU existen varios métodos, pero si hubiera que elegir uno solo habría que escoger el perímetro abdominal, que tiene alta sensibilidad (95%), con especificidad de 60% y valores predictivos positivo y negativo de 21% y 96%, respectivamente (4).
De acuerdo con datos de la OMS, 192 mujeres mueren cada día en el mundo por complicaciones del SHE (5), mientras que cifras provenientes de los Estados Unidos muestran que la preeclampsia (PE) y sus complicaciones son la causa de 20 a 50% de los ingresos obstétricos a UCI y de 12 a 17% de las muertes maternas, de manera que es un problema que se asocia a mortalidad y daño (6). En Chile, el SHE fue la segunda causa de muerte durante el período 1990-1996 y fue la causa de 20% de las muertes maternas. Si se desglosa de acuerdo con los objetivos de la OMS, en los años 1990, 2000 y 2003 alrededor de 30% de las muertes maternas fueron atribuibles a SHE.
Las complicaciones graves del SHE se clasifican, según el órgano comprometido, en: insuficiencia renal aguda, hematoma subcapsular hepático, síndrome HELLP, coagulación intravascular diseminada (CIV) y eclampsia. Por otra parte, existen complicaciones asociadas a hipertensión arterial pura, como el accidente vascular encefálico y el edema pulmonar agudo, y complicaciones asociadas al parto, entre las cuales están las hemorragias post-parto, el DPNI y la eclampsia.
La crisis hipertensiva comprende dos situaciones: la emergencia hipertensiva, en la cual la presión arterial es mayor o igual a 240/140 mmHg, y la hipertensión severa, que se constituye cuando la presión arterial tiene valores mayores o iguales a 160/105 mmHg. La crisis hipertensiva se manifiesta clínicamente con disminución del alerta, estertores, aparición de tercer ruido cardíaco, ascitis, oliguria y mayor frecuencia de complicaciones obstétricas; por lo tanto, es necesario seguir un esquema de tratamiento que incluya la vigilancia materna, vigilancia fetal, estudios de laboratorio y tratamiento farmacológico adecuado. En caso de hipertensión severa, se recomienda tratamiento hipotensor cuando las cifras tensionales llegan a 170/110 o cuando los niveles son menores pero se asocian a síntomas como cefalea, fotopsias, tinitus y excitación neurosensorial. No existe evidencia concluyente que apoye el uso de un hipotensor en lugar de otro, pero se sugiere evitar diazoxide porque podría poner en riesgo a la unidad fetoplacentaria debido a su potente efecto hipotensor.
En la última edición de la base Cochrane se hizo una revisión de los fármacos que se utilizan para tratar la presión demasiado alta del embarazo y se concluyó que no había diferencias entre diferentes esquemas de tratamiento, con diferentes fármacos, con excepción de los bloqueadores del calcio y la hidralazina; esta última fue, durante mucho tiempo, el fármaco de elección para el manejo de la crisis hipertensiva del embarazo, pero en un metaanálisis en que se la comparó con otros fármacos antihipertensivos se encontró que había mayor probabilidad de desarrollar hipertensión persistente después de manejar la crisis hipertensiva con hidralazina y, además, la hipotensión materna fue significativamente más frecuente en las pacientes que recibieron este fármaco. Se concluyó que la hidralazina tiene más efectos colaterales maternos y resultados perinatales más pobres que otros fármacos, como ketanserina, labetalol y nifedipino.
El labetalol es un bloqueador beta no selectivo y alfa 1 post-sináptico selectivo, que disminuye la resistencia vascular sistémica y la frecuencia cardíaca sin modificar el flujo renal, cerebral o coronario; tampoco afecta el flujo úteroplacentario ni la frecuencia cardíaca fetal, por lo tanto es un fármaco seguro y con efectos conocidos. Se administra en dosis de 20 a 40 mg por vía endovenosa (ev) cada 20 minutos, hasta máximo 300 mg; la primera dosis no debe ser mayor de 20 mg. Inicia su acción a los 5 minutos, alcanza su efecto máximo a los 20 minutos y la duración de su acción alcanza a 6 horas. En pacientes con emergencia hipertensiva se puede utilizar en infusión continua, en dosis de 1 mg/k. En la actualidad se considera al labetalol como el fármaco de primera elección cuando se requiere administración endovenosa.
El nifedipino es un bloqueador de calcio que se administra por vía oral; produce una vasodilatación arteriolar y por tanto, reduce la post-carga, sin modificación del flujo úteroplacentario ni de la frecuencia cardíaca fetal. Además aumenta en forma significativa la diuresis, debido a su efecto vasodilatador arteriolar renal. El nifedipino aumenta el índice cardíaco, de modo que en pacientes con PE severa que cursan con disfunción diastólica y función cardíaca disminuida, este fármaco podría tener un efecto deletéreo sobre esta función. El nifedipino se administra en dosis de 10 a 20 mg por vía oral, cada 30 minutos, con un máximo de 50 mg. No se recomienda el uso de tabletas de efecto prolongado, debido a su lento inicio de acción.
En la Fig. 1 se resume el protocolo de acción que se recomienda para el manejo de la crisis hipertensiva del embarazo, el que debe ser conocido por todo el personal de salud de cada maternidad. Frente a una paciente con cifras de presión arterial mayor o igual a 170/110 mmHg, con signos de irritación neurosensorial, se debe avisar al médico, quien debe controlar los signos de irritación neurosensorial y la presión arterial y evaluar la unidad fetoplacentaria. La matrona y auxiliar tienen sus funciones determinadas. Se debe instalar monitor externo, administrar labetalol y controlar en forma seriada la presión arterial por un período de 20 a 30 minutos, junto con la frecuencia respiratoria y la frecuencia cardíaca materna y fetal. De acuerdo con la indicación médica, en casos particulares se puede administrar corticoides, sulfato de magnesio o instalar una sonda Foley. Lo más común es que se llegue a indicar sulfato de magnesio, que se debe administrar en un intervalo de tiempo adecuado para favorecer el efecto mio-relajante, que ayuda a bajar la presión arterial. Los corticoides se administran de acuerdo a la inminencia o no de la interrupción del embarazo. Los bolos de labetalol se repiten de acuerdo con la evolución de la presión arterial. En caso de que no se logre yugular la crisis se debe trasladar a la paciente a la sala de prepartos para proceder al esquema antihipertensivo de segunda línea o la interrupción del embarazo. Cuando aparecen convulsiones se debe administrar sulfato de magnesio. La decisión de la interrupción del embarazo dependerá de las condiciones clínicas de la paciente.
Figura 1. Complicaciones graves del SHE: Manejo de la crisis hipertensiva del embarazo.
En cuanto al tratamiento de segunda línea, en general se cambia la infusión ev por la infusión continua; al beta bloqueador se le agrega un bloqueador del calcio, como el nifedipino o bien se puede interrumpir el embarazo y trasladar a la paciente a la UCI.
La eclampsia es un cuadro clínico que se define como la ocurrencia de convulsiones en una mujer embarazada antes, durante o después del parto, en ausencia de otros trastornos neurológicos y, generalmente, en forma concomitante con síntomas y signos de PE. La incidencia es baja, aproximadamente 1 en 1.600 embarazos; 50% ocurre antes del parto y el resto, intraparto o postparto. La mayoría de los casos postparto ocurren dentro de las primeras 48 horas, por lo que es necesario mantener el sulfato de magnesio durante 24 a 48 horas después del parto según la gravedad del cuadro hipertensivo. Un dato interesante es que 38% de las pacientes no tiene hipertensión arterial ni proteinuria en el momento de la convulsión. El diagnóstico diferencial de estas pacientes se debe hacer con encefalopatía hipertensiva, epilepsia, hemorragia intracraneana, trombosis del seno sagital superior, encefalitis, meningitis o rotura de aneurisma cerebral.
El manejo de la eclampsia consiste en:
El daño cerebral que produce la eclampsia se denomina leucoencefalopatía posterior reversible; corresponde a un edema subcortical reversible en las regiones occipitales, lo que explica muchas veces la aparición de ceguera transitoria. Se puede ver mediante escáner (TC) o resonancia magnética (RM).
El accidente cerebral isquémico de la eclampsia se debe a pérdida de la autorregulación del flujo plasmático cerebral, con disminución del aporte sanguíneo hacia el tejido nervioso debido al súbito aumento de la presión arterial sistémica. Esto genera una vasodilatación forzada y, posteriormente edema vasogénico, por lo que es un cuadro completamente reversible. En este contexto se puede producir hipertensión endocraneana y encefalopatía hipertensiva, que se debe manejar con sulfato de magnesio mientras se controla la presión arterial con labetalol. En la actualidad se está llevando a cabo el protocolo LAMPET, que compara sulfato de magnesio con labetalol oral con el objetivo de determinar el mejor manejo del accidente cerebrovascular en las pacientes eclámpticas. También existe la posibilidad de que el accidente vascular isquémico de la eclampsia se produzca por vasoespasmo, con formación de edema citotóxico e infarto secundario a liberación de sustancias proinflamatorias. Esto conduce a daño irreversible, que se debe tratar como a un accidente vascular, con bloqueadores de calcio y aspirina.
No todas las mujeres que han presentado un cuadro convulsivo van a necesitar estudio de imágenes, sino solamente aquéllas que tengan manifestaciones clínicas asociadas a lesiones corticales cerebrales posteriores, fundamentalmente ceguera y visión borrosa que se mantengan en el tiempo.
El estudio Magpie, cuyos resultados se publicaron en 2002, se diseñó para evaluar el beneficio de utilizar sulfato de magnesio versus placebo en la PE y demostró categóricamente que el tratamiento reduce la mortalidad materna en 50% sin producir daño al feto; además disminuye todos los resultados negativos, tanto de mortalidad como de morbilidad materna, atribuibles a pacientes eclámpticas. Hubo diferencias en los resultados según el grado de desarrollo de los países. Otro aporte importante del estudio Magpie es que se utilizó una dosis de 1 gramo de sulfato de magnesio, por lo que eventualmente se podría reducir la dosis. En resumen, hay sólida evidencia de que el sulfato de magnesio reduce a la mitad el riesgo de eclampsia y muerte materna, sin beneficio sobre la prevención de la muerte fetal o neonatal. Por otra parte, existen diferencias entre países de alto o bajo ingreso per capita (7).
El estudio Magpie también amplía el número de pacientes a las cuales se les puede indicar sulfato de magnesio, ya que recomienda su uso no sólo en aquéllas pacientes que tienen PE y excitación neurosensorial, sino también en pacientes con PE severa. La infusión se puede iniciar durante el parto o inmediatamente después del parto, según lo que recomiendan algunos neonatólogos, debido a que el sulfato de magnesio produce hipotonía y en fetos que han tenido sufrimiento fetal agudo podría desencadenar isquemia de territorios terminales, como el renal o sistema nervioso central.
El sulfato de magnesio se administra en dosis de carga de 4 gramos por vía ev a pasar en 20 a 40 minutos; posteriormente se deja una dosis de mantención de 1 a 2 g/hora, dependiendo de la diuresis. Se deja sonda Foley, se monitoriza la diuresis y la frecuencia respiratoria y se mantiene por al menos 24 horas. Existe información escasa y que produce confusión acerca de la probable interacción entre nifedipino y sulfato de magnesio, porque ambos potenciarían el bloqueo muscular periférico, con el consiguiente riesgo de parálisis respiratoria o paro respiratorio. En dosis terapéuticas y con adecuada supervisión se pueden administrar en forma simultánea, monitorizando especialmente la frecuencia respiratoria y la dificultad respiratoria, ya que no existe evidencia que contraindique la combinación de estos fármacos.
El tratamiento de elección para controlar la crisis convulsiva de la eclapmsia es el sulfato de magnesio, que tiene mejores resultados en cuanto a la presentación de convulsiones posteriores en comparación con diazepam, fenitoína y con el denominado cóctel lítico. Las publicaciones sobre sulfato de magnesio versus diazepam demuestran que es mejor el sulfato de magnesio, porque la vida media del benzodiazepínico es más prolongada y se asocia a riesgo de depresión del sistema nervioso central y a mayor frecuencia de complicaciones por náuseas y vómitos.
La magnesemia normal en una mujer embarazada es de alrededor de 3 a 4 mEq/L, nivel que debe aumentar a 8 a 10 mEq/L después de un bolo de sulfato de magnesio. Se puede estimar la magnesemia en forma clínica, ya que el sulfato de magnesio va aboliendo los reflejos de manera progresiva, primero el reflejo rotuliano y después el aquiliano; lo ideal es que la paciente tenga abolido el reflejo rotuliano y presente el aquiliano; si ambos están abolidos habría que bajar la carga de sulfato de magnesio.
El síndrome HELLP, acrónimo de Hemólisis, Disfunción Hepática y Trombocitopenia, se presenta como complicación de una PE severa en 4 a 12% de los casos y afecta 1 a 6/1.000 embarazos. En 1982 Weinstein describió 29 casos y acuñó la abreviatura; en 1990, Sibai definió y unificó los criterios diagnósticos; y en 1991, Martin clasificó el cuadro según el recuento plaquetario.
Sobre su etiopatogenia, se puede decir que es una presentación multisistémica de una PE severa, constituyendo una enfermedad autoinmune con elevados niveles de autoanticuerpos. Por lo tanto, para pensar en un síndrome HELLP se debe tener síntomas y signos de PE acompañados de hemólisis, disfunción hepática y plaquetas bajas. La hemólisis origina una anemia hemolítica microangiopática y en el frotis es posible apreciar esquistocitos, esferocitos, crenocitos y policromasia. La alteración de las enzimas hepáticas se manifiesta con aumento de la GOT por sobre 70 U/L, LDH mayor de 600 U/L y bilirrubinemia sobre 1,2 mg/dl.
El síndrome HELLP se clasifica según el nivel de trombocitopenia en clases 1, 2 y 3, que se relacionan con el pronóstico y la recuperación de las plaquetas:
En la Tabla I se resume las complicaciones del síndrome HELLP. Entre las complicaciones maternas la más frecuente es la coagulación intravascular diseminada, seguida por el DPNI; también se pueden presentar otras complicaciones médicas, como derrame pleural, edema pulmonar agudo, rotura de hematoma subcapsular hepático y muerte materna. Desde el punto de vista del resultado perinatal, el resultado es la muerte en un tercio de los casos y el riesgo es mayor si la edad gestacional es menor o en caso de asociación con RCIU. Las causas de mortalidad materna secundaria a HELLP son accidente cerebrovascular, coagulación intravascular diseminada y paro cardíaco, de manera que ante una paciente con este síndrome se debe manejar en forma intensiva la crisis hipertensiva y la coagulación intravascular diseminada.
Tabla I. Resultado materno y perinatal del síndrome HELLP.
El síndrome HELLP se manifiesta por dolor abdominal, náuseas, vómitos, cefalea, alteraciones visuales, hemorragias e ictericia. Las manifestaciones son muy inespecíficas y podrían corresponder, por ejemplo, a una gripe; sin embargo, siempre que una mujer embarazada presente hiperemesis asociada a hipertensión arterial se debe pensar en una complicación grave del embarazo, sea HELLP o hígado graso agudo. 70% de los síndromes HELLP se presentan antes del parto y 30% en el post-parto. Generalmente se presentan en el transcurso de una PE severa (20%), pero se pueden observar en una eclampsia (10%) (9).
En relación con la edad gestacional, en la gran mayoría de las pacientes el HELLP se presenta entre las 27 y 36 semanas de gestación (71%), que es la edad en que se presenta la PE. La vía del parto de las pacientes con HELLP es la cesárea en 42% de los casos. La mortalidad perinatal del síndrome alcanza a 35% y la mortalidad materna varía entre 5 y 10%.
Siempre en un síndrome de HELLP es necesario buscar la coagulación intravascular diseminada, cuyo diagnóstico se basa en la trombocitopenia; en nuestro centro también se mide el nivel de fibrinógeno, porque los valores de dímero D son muy erráticos y poco confiables, considerándose de riesgo valores inferiores a 300 mg/dl y diagnósticos, bajo 250 mg/dl. También se determina tiempo de protrombina y TTPK, que están prolongados.
En cuanto a tratamiento, si la paciente tiene más de 34 semanas de gestación, ya se le indujo madurez pulmonar y hay evidente deterioro de la unidad feto-placentaria o presencia de coagulación intravascular diseminada, se debe interrumpir el embarazo de inmediato si lo permiten las condiciones obstétricas. Si la paciente con HELLP tiene menos de 34 semanas de gestación y está estable, se puede inducir la madurez pulmonar con corticoides y proceder a la interrupción a las 48 horas.
En el año 2000, O’Brien publicó un trabajo en el que parecía demostrar que la administración de corticoides en altas dosis a las pacientes con HELLP era muy útil para mejorar el pronóstico, tanto desde el punto de vista del recuento de plaquetas como de las enzimas hepáticas, prolongando el intervalo hasta el parto de manera dosis dependiente (10). Sin embargo, en 2005 se generó un intenso debate en la literatura sobre el uso de corticoides y apareció otro estudio, doble ciego, en que se concluyó que esta medida no mejoraba los resultados (11) y posteriormente Sibai escribió dos editoriales afirmando que los corticoides sí sirven. Por otra parte, si se revisa la literatura se encuentran muchos centros que tienen la recomendación del uso de dexametasona en pacientes con HELLP, independiente del uso de betametasona para inducción de la madurez fetal pulmonar, considerando que la dexametasona está pensada para tratar el compromiso hepático y plaquetario. De hecho, si se revisan todos los trabajos en que se ha evaluado el uso de corticoides en altas dosis en pacientes con síndrome HELLP se encuentra que el único en que no se demostró beneficios fue en el de Fonseca. Finalmente, en un artículo de 2006 James Martin clasificó el síndrome HELLP de acuerdo con el número de plaquetas y recomendó usar los corticoides. En resumen, la evidencia que existe hasta el momento no es categórica, de modo que en el momento de decidir el manejo se debe aplicar el juicio clínico. El esquema habitual es betametasona 12 mg intramuscular cada 12 horas y dexametasona ev cada 12 horas, desde el momento del diagnóstico y hasta 48 horas postparto, principalmente en pacientes con HELLP tipo 1, es decir, con menos de 50.000 plaquetas.
Respecto a la vía del parto y la anestesia, aproximadamente 50% de los partos se resuelve por cesárea en pacientes con menos de 30 semanas de gestación. Por otra parte, sólo se debe intentar el parto vaginal con score de Bishop mayor de 6, unidad feto-placentaria indemne y líquido amniótico normal. 50% de las pacientes con HELLP puede recibir anestesia regional, ya que tienen plaquetas sobre 100.000/ml.
En cuanto a la evolución postparto, las pacientes suelen mejorar antes de 48 horas, pero hay un grupo en que el cuadro persiste más allá de 72 horas. En esos casos se recomienda realizar plasmaféresis con plasma fresco congelado. Estas últimas son las pacientes en las que, usando corticoides en altas dosis con un recuento plaquetario inferior a 50.000, se deberá decidir el uso de plasmaféresis.
Cuando se hace el diagnóstico de HELLP se debe estimar el tiempo de evolución del cuadro, para lo cual es útil saber que las plaquetas se reducen en 40.000 por día, es decir, 35 a 50% en 24 horas. Por otro lado, en ausencia de corticoides 85 a 90% de las pacientes logra un recuento plaquetario sobre 100.000/ml luego de 6 a 8 días del parto o dentro de las 72 horas del nadir plaquetario. Éste es otro fundamento para la administración de corticoides, ya que su objetivo es tratar la trombocitopenia y el compromiso hepático y no la coagulación intravascular diseminada. Las enzimas hepáticas, las transaminasas y la LDH pueden aumentar hasta 2 días después del parto y se normalizan a los 4 días postparto, de manera que está dentro de lo esperado que sus niveles aumenten dentro de 48 horas.
Una paciente que ha presentado un síndrome HELLP tiene 20% de probabilidades de presentar un SHE en el siguiente embarazo y en 2 a 19% de estas pacientes habrá una recurrencia del HELLP. El riesgo de recurrencia es mayor en mujeres con menos de 30 semanas de gestación y en población afroamericana, en las que llega a 40%; mientras más precoz es el HELLP, mayor es riesgo de recurrencia.
El hematoma subcapsular hepático (HSH), descrito por primera vez en el año 1844, es otra complicación grave y propia del SHE. Su incidencia es baja: se ve en 1 de 45.000 a 250.000 embarazos. Necesariamente ocurre en el contexto de un síndrome HELLP y constituye la complicación más frecuente del SHE en multíparas (80%) en la cuarta década de la vida. La mortalidad materna asociada a este cuadro es de 59% y la mortalidad perinatal, alrededor de 62%, con elevada mortalidad maternofetal (50%).
Clínicamente se caracteriza por dolor epigástrico intenso y persistente que se prolonga por horas, acompañado de omalgia ocasional y shock en su grado máximo de expresión. El diagnóstico se confirma por ecografía o TAC. Frente a una paciente con HELLP, la mejor forma de provocar la rotura de un HSH es realizando una exploración quirúrgica en búsqueda del hematoma; por lo tanto, si el HSH no está roto y la hemodinamia es estable se debe efectuar manejo conservador. En cambio, si el HSH está roto y la hemodinamia es inestable se debe realizar de inmediato laparotomía y packing con compresas para que el cirujano efectúe lo antes posible una segmentectomía hepática o bien, una embolización de la arteria hepática.
Otra complicación grave del SHE, el hígado graso agudo, es una entidad rara, de etiología desconocida, cuya frecuencia es de 1 en 13.000 partos. La mortalidad de este cuadro ha descendido desde 85% en la década de los 80 hasta 20% en la década de los 90. En la Fig. 3, en el escáner las flechas muestran las zonas con cambios en la densidad de los tejidos hepáticos, en contraste con el aspecto homogéneo del bazo; abajo se observa una biopsia hepática con hepatocitos edematosos, pálidos, con núcleo central, repletos de microvesículas de grasa, con escasa necrosis hepatocelular e inflamación (Fig. 3).
Figura 3. TAC e histología en el hígado graso agudo del embarazo.
El hígado graso agudo del embarazo es una complicación más bien tardía, que ocurre en promedio a las 36 semanas de gestación. En 50% de los casos se asocia a PE y en 20%, a HELLP. Dentro de las complicaciones derivadas de esta condición están la coagulación intravascular diseminada (73%) y la hipoglicemia (61%), que constituye la principal causa de muerte. La mortalidad materna de este cuadro fluctúa entre 7 y 18% y la mortalidad fetal, entre 14 y 23%. La prematurez se presenta en 70% de los casos debido a la interrupción del embarazo. Se presenta con frecuencia en embarazos múltiples y en primíparas, principalmente en el tercer trimestre del embarazo, pudiendo evolucionar rápidamente hacia insuficiencia hepática con encefalopatía portal.
El cuadro clínico es inespecífico: náuseas y vómitos (70%) y epigastralgia o dolor en el hipocondrio derecho (50-80%). Generalmente las pacientes relatan un cuadro tipo viral con astenia, anorexia e ictericia a las dos semanas de inicio. Una vez que se desencadena el cuadro la paciente evoluciona rápidamente a falla multiorgánica y coagulación intravascular diseminada. La mortalidad materna de este cuadro se debe a la coagulación intravascular diseminada, la insuficiencia renal y la hipoglicemia grave.
El diagnóstico se establece en presencia de leucocitosis sobre 15.000/mm3, transaminasas alrededor de 300 U/L e hiperbilirrubinemia no mayor a 10 mg/dL, es decir, existe compromiso hepático, pero no con patrón de hepatitis. Los hallazgos patognomónicos son la hipoglicemia severa y la amonemia elevada. También se puede encontrar albúmina baja y parámetros de coagulación intravascular diseminada.
El manejo incluye estabilizar a la madre, tratar las complicaciones en la UCI, mientras se procede a la interrupción del embarazo en forma inmediata, independiente de la edad gestacional, por la vía más expedita y de preferencia con anestesia regional, dada la hepatotoxicidad de las drogas anestésicas.
La recurrencia del hígado graso agudo es muy poco frecuente: hasta el momento sólo se han comunicado dos casos. Habitualmente no presenta secuelas a largo plazo y la histología vuelve a la normalidad.
Un aspecto interesante de este cuadro es que los hijos de madres con hígado graso durante el embarazo tienen alteración en la betaoxidación mitocondrial de los ácidos grasos por mutaciones en la 3-hidroxiacil-CoA deshidrogenasa de ácidos grasos de cadena larga. La hipótesis actual para explicar el desarrollo de esta condición plantea que, debido a esta deficiencia fetal de la 3-hidroxiacil-CoA deshidrogenasa, la madre contacta con estos ácidos grasos de cadena larga, que tendrían un efecto hepatotóxico. Es decir, estos ácidos grasos de cadena larga desencadenarían la enfermedad.
En una publicación reciente se habla de los “imitadores” de la PE severa, entre los cuales están el hígado graso agudo del embarazo, las microangiopatías trombóticas como el púrpura trombocitopénico trombótico (PTT) y el síndrome hemolítico urémico (SHU), y la exacerbación del lupus eritematoso sistémico.
El PTT y el SHU son entidades de muy baja incidencia, alrededor de 1/100.000. El PTT puede ser adquirido o congénito y el SHU por lo general es puerperal. La mortalidad de estos cuadros es de alrededor de 10%, con una mortalidad fetal de 20%. El manejo se debe hacer en conjunto con el hematólogo y el nefrólogo. Dentro del tratamiento se debe considerar la plasmaféresis y la transfusión de plasma; a diferencia de las otras patologías descritas, no se debe efectuar la interrupción del embarazo. El PTT se caracteriza por trombocitopenia, anemia hemolítica microangiopática, alteraciones neurológicas, fiebre y falla renal; mientras que en el SHU se encuentra edema, hipertensión arterial, manifestaciones hemorragíparas y falla renal grave. La falla renal es más grave en el SHU y los trastornos neurológicos son más importantes en el PTT, hechos que son útiles para establecer el diagnóstico diferencial.
En la Tabla II se muestra la proporción (%) de síntomas y signos en las distintas condiciones que obligan a hacer diagnóstico diferencial en la PE severa.
Tabla II. Proporción (%) de síntomas y signos en diagnóstico diferencial en PE severa.
En la Tabla III se resume las características de los cuadros que cursan con trombocitopenia en el embarazo.
Tabla III. Trombocitopenia y embarazo.

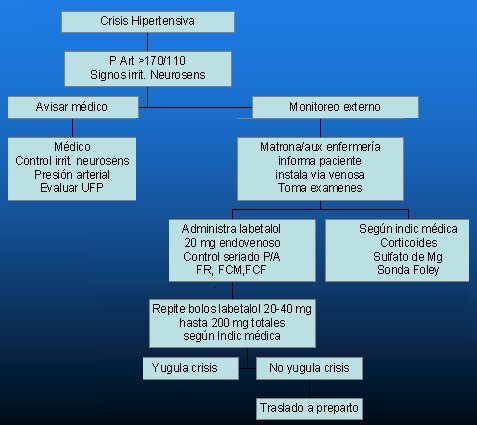 Figura 1. Complicaciones graves del SHE: Manejo de la crisis hipertensiva del embarazo.
Figura 1. Complicaciones graves del SHE: Manejo de la crisis hipertensiva del embarazo.

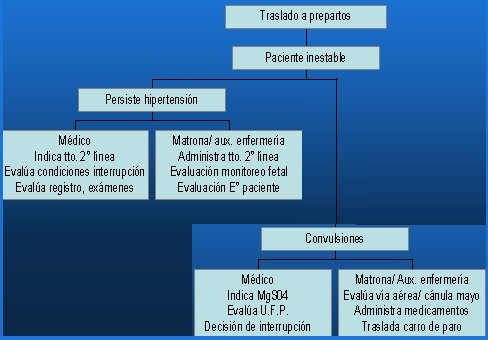 Figura 2. Complicaciones graves del SHE: Manejo de segunda línea de la crisis hipertensiva del embarazo.
Figura 2. Complicaciones graves del SHE: Manejo de segunda línea de la crisis hipertensiva del embarazo.

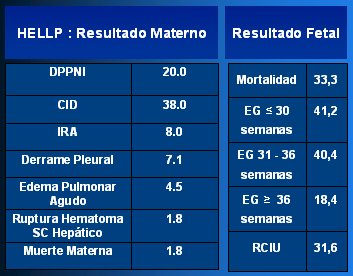 Tabla I. Resultado materno y perinatal del síndrome HELLP.
Tabla I. Resultado materno y perinatal del síndrome HELLP.

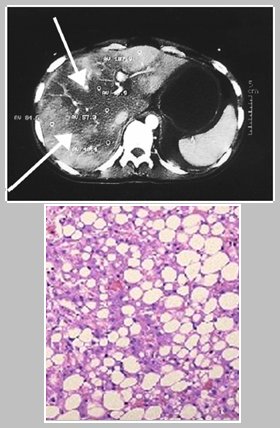 Figura 3. TAC e histología en el hígado graso agudo del embarazo.
Figura 3. TAC e histología en el hígado graso agudo del embarazo.

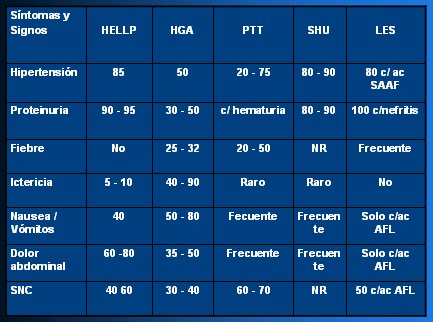 Tabla II. Proporción (%) de síntomas y signos en diagnóstico diferencial en PE severa.
Tabla II. Proporción (%) de síntomas y signos en diagnóstico diferencial en PE severa.

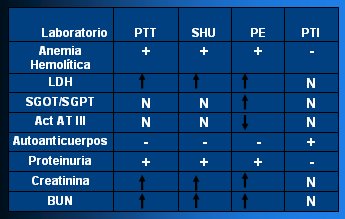 Tabla III. Trombocitopenia y embarazo.
Tabla III. Trombocitopenia y embarazo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada de una conferencia dictada en el Curso CEDIP 2007 AUGE Perinatal y Ginecológico, organizado por el Centro de Diagnóstico e Investigaciones Perinatales, Hospital Sótero del Río, Universidad Católica de Chile, durante los días 23, 24 y 25 de Agosto de 2007, cuyos directores fueron los doctores Rogelio González, Ricardo Gómez, Juan Andrés Ortiz e Iván Rojas.
 Expositor:
José Andrés Poblete L.[1]
Expositor:
José Andrés Poblete L.[1]

Citación: Poblete JA. Severe complications of pregnancy hypertensive syndrome. Medwave 2008 Oct;8(10):e1787 doi: 10.5867/medwave.2008.10.1787
Fecha de publicación: 1/11/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Barker DJ. Fetal origins of coronary heart disease. BMJ. 1995 Jul 15;311(6998):171-4. | CrossRef | PubMed | PMC |
Barker DJ. Fetal origins of coronary heart disease. BMJ. 1995 Jul 15;311(6998):171-4. | CrossRef | PubMed | PMC | Rich-Edwards JW, Stampfer MJ, Manson JE, Rosner B, Hankinson SE, Colditz GA, et al Birth weight and risk of cardiovascular disease in a cohort of women followed up since 1976. BMJ. 1997 Aug 16;315(7105):396-400. | CrossRef | PubMed | PMC |
Rich-Edwards JW, Stampfer MJ, Manson JE, Rosner B, Hankinson SE, Colditz GA, et al Birth weight and risk of cardiovascular disease in a cohort of women followed up since 1976. BMJ. 1997 Aug 16;315(7105):396-400. | CrossRef | PubMed | PMC | Godfrey KM, Barker DJ. Fetal nutrition and adult disease. Am J Clin Nutr. 2000 May;71(5 Suppl):1344S-52S. | PubMed |
Godfrey KM, Barker DJ. Fetal nutrition and adult disease. Am J Clin Nutr. 2000 May;71(5 Suppl):1344S-52S. | PubMed | World Health Organization. Bulletin of the World Health Organization. 2001 Ene-Dic;79(1-12). | Link |
World Health Organization. Bulletin of the World Health Organization. 2001 Ene-Dic;79(1-12). | Link | Lapinsky SE. Cardiopulmonary complications of pregnancy. Crit Care Med. 2005 Jul;33(7):1616-22. | CrossRef | PubMed |
Lapinsky SE. Cardiopulmonary complications of pregnancy. Crit Care Med. 2005 Jul;33(7):1616-22. | CrossRef | PubMed | Altman D, Carroli G, Duley L, Farrell B, Moodley J, Neilson J, et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet. 2002 Jun 1;359(9321):1877-90. | CrossRef | PubMed |
Altman D, Carroli G, Duley L, Farrell B, Moodley J, Neilson J, et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet. 2002 Jun 1;359(9321):1877-90. | CrossRef | PubMed | O'Brien JM, Milligan DA, Barton JR. Impact of high-dose corticosteroid therapy for patients with HELLP (hemolysis, elevated liver enzymes, and low platelet count) syndrome. Am J Obstet Gynecol. 2000 Oct;183(4):921-4. | CrossRef | PubMed |
O'Brien JM, Milligan DA, Barton JR. Impact of high-dose corticosteroid therapy for patients with HELLP (hemolysis, elevated liver enzymes, and low platelet count) syndrome. Am J Obstet Gynecol. 2000 Oct;183(4):921-4. | CrossRef | PubMed | Fonseca JE, Méndez F, Cataño C, Arias F. Dexamethasone treatment does not improve the outcome of women with HELLP syndrome: a double-blind, placebo-controlled, randomized clinical trial. Am J Obstet Gynecol. 2005 Nov;193(5):1591-8. | CrossRef | PubMed |
Fonseca JE, Méndez F, Cataño C, Arias F. Dexamethasone treatment does not improve the outcome of women with HELLP syndrome: a double-blind, placebo-controlled, randomized clinical trial. Am J Obstet Gynecol. 2005 Nov;193(5):1591-8. | CrossRef | PubMed | Martin JN Jr, Rose CH, Briery CM. Understanding and managing HELLP syndrome: the integral role of aggressive glucocorticoids for mother and child. Am J Obstet Gynecol. 2006 Oct;195(4):914-34. Epub 2006 May 2. | CrossRef | PubMed |
Martin JN Jr, Rose CH, Briery CM. Understanding and managing HELLP syndrome: the integral role of aggressive glucocorticoids for mother and child. Am J Obstet Gynecol. 2006 Oct;195(4):914-34. Epub 2006 May 2. | CrossRef | PubMed |