 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia dictada en el Curso Actualizaciones en Dolor e Inflamación en Reumatología, organizado por la Sociedad Chilena de Reumatología, durante los días 5 y 6 de Octubre de 2007, cuyo director fue el Dr. Carlos Fuentealba.
Según palabras del Dr. John Loesser, presidente de la Asociación Internacional para el Estudio del Dolor (IASP), el dolor agudo y el dolor crónico no tienen nada en común, salvo la palabra “dolor”. El significado biológico de ambos es totalmente diferente: el dolor agudo se entiende como una experiencia sensorial y emocional desagradable, mientras que el dolor crónico es una experiencia de sufrimiento subjetiva y compleja, que afecta al individuo en muchas áreas de su vida. En reumatología existen muchas oportunidades de enfrentarse al dolor agudo y, con mayor frecuencia, al dolor crónico.
El dolor agudo es una señal de alerta biológica que activa un sistema diseñado para lograr la curación, mejoría y restauración de la función, en contraposición con el dolor crónico, en el cual se ha perdido la función de alerta biológica y solamente genera daño al individuo en varios aspectos, siendo los emocionales, psicosociales y económicos los de mayor relevancia. La evolución clínica del dolor agudo y crónico es sustancialmente diferente, pero en ambos casos la forma de presentación depende de las áreas afectadas. Según esto, el dolor se clasifica en:
Esta clasificación didáctica no siempre se puede aplicar en la práctica, pues ocasionalmente el dolor musculoesquelético adquiere características de dolor visceral, como la referencia a distancia, haciendo difícil su diferenciación y tratamiento debido al menor componente inflamatorio. En resumen, las principales fuentes de dolor son el somático y el neuropático, aunque se ven muchas formas de dolor mixto, principalmente en dolor de columna vertebral baja.
La fisiología del dolor es compleja. Los aspectos fundamentales son la transmisión del dolor, a través de las vías de la nocicepción, y la modulación de la señal de dolor a nivel del sistema nervioso central, que exacerba o inhibe el estímulo, generándose la percepción consciente del dolor. Posteriormente se produce la expresión conductual del dolor, que es donde el médico tiene un rol terapéutico, ya que da origen a las diversas presentaciones clínicas, según tiempo de evolución (agudo o crónico) y elementos sociales, psicológicos y culturales.
Las vías del dolor tienen tres niveles de modulación: periférico, a nivel del órgano en que se produce el daño (articulación, tendones, etc.), desde donde se transmite el estímulo por los nervios espinales, que luego de pasar por los ganglios espinales llegan al asta posterior de la médula espinal; el nivel medular y el nivel supra segmentario o encefálico (Fig. 1).
Figura 1. Vías del dolor: niveles de modulación.
A nivel periférico, la activación del nociceptor se produce debido a cambios bioquímicos provocados por la lesión tisular; la producción local de mediadores genera mayor excitabilidad de las vías aferentes periféricas, además de vasodilatación y edema, que favorecen un círculo vicioso, ya que generan mayor excitación de los nociceptores periféricos. Las fibras nerviosas sensitivas que transmiten información a la médula se clasifican en fibras A beta, encargadas del tacto y propiocepción, y en aquellas que transmiten el dolor, como las fibras A delta, gruesas, mielinizadas y de transmisión rápida, que transmiten dolor agudo y las fibras C, que son más delgadas, amielínicas y de transmisión lenta, capaces de transmitir el dolor quemante. Los antiinflamatorios actúan inhibiendo la producción de prostaglandinas, por lo que se consideran el tratamiento universal para el dolor; sin embargo, hoy en día se sabe que tienen una capacidad reducida de participar en el fenómeno y presentan muchos efectos adversos, por lo que se prefiere recurrir a la neuromodulación a nivel espinal o a otros medicamentos, como anticonvulsivantes, antidepresivos y opioides (1) (Fig. 2).
Figura 2. Transmisión del dolor desde el nivel periférico y medular.
La llegada de las fibras A delta y C al asta dorsal produce el primer nivel de procesamiento a nivel segmentario, pues allí se encuentran con una multitud de interneuronas que conectan con los centros superiores, a través de los haces espinotalámicos, en su gran mayoría (Fig. 3 A y B). En este proceso existen múltiples células y receptores involucrados, opioérgicos, dopaminérgicos, gabaérgicos, canabinoides, NMDA, NO, entre otros, y es posible pesquisar cambios de volumen en el asta dorsal ante estímulos dolorosos importantes, como por ejemplo, la neuralgia post herpética, mediante microscopía, representando hiperplasia de la glía e hiperactividad local (Fig. 3 C).
La sensibilización nociceptiva es el proceso por el cual se produce un desplazamiento de la percepción del dolor, ante un estímulo de igual intensidad. Cuando se produce un daño y comienza la sensibilización nociceptiva, se presenta hiperalgesia en el foco inflamado y alodinia, especialmente importante en el dolor neuropático, donde estímulos de muy baja intensidad producen gran dolor (2). Esta alteración se produce a nivel periférico, en los nociceptores, y también a nivel central, en el asta posterior de la médula espinal (Fig. 4).
Figura 4. “Sensibilización” nociceptiva.
Las vías ascendentes están representadas en 80% por los haces espinotalámicos laterales que, tras pasar por estaciones de relevo, llegan a la corteza (Fig. 5).
Figura 5. Vías ascendentes: haz espinotalámico lateral.
Sin embargo, antes de que estas vías alcancen la corteza cerebral, en la formación reticular, se modula la respuesta neurovegetativa asociada al dolor agudo y que es la causa de síntomas como taquicardia e hipertensión, entre otros. El dolor crónico carece de respuesta neurovegetativa, por lo que, en la evaluación clínica, el individuo parece experimentar menor dolor. Otras estaciones de relevo previas a la corteza cerebral son el tálamo, que procesa la respuesta emocional que acompaña al dolor y el sistema límbico, asociado a manifestaciones anímicas. La corteza parietal es donde se concentra la mayor parte de la aferencia nociceptiva (Fig. 6).
Figura 6. Procesamiento suprasegmentario.
En la Fig. 7 se muestran las vías inhibitorias descendentes y los lugares en que se efectúa la modulación del dolor, en especial los núcleos productores de aminas, como la sustancia gris periacueductal, el locus ceruleus, la protuberancia y el rafe magno, que son capaces de modular la transmisión del dolor hacia los centros superiores. Por ejemplo, en la protuberancia se pueden ver, mediante microscopía, acopios de noradrenalina; por ello, los nuevos antidepresivos para el manejo del dolor neuropático tienen entre sus características inhibir la recaptura de noradrenalina, lo que les otorgaría ventajas respecto a los antiguos, que solamente inhiben la recaptura de serotonina. En el mecencéfalo existen núcleos de dopamina, que también son parte del sistema inhibitorio descendente.
Figura 7. Vías inhibitorias descendentes y modulación del dolor.
En resumen, el dolor es una percepción subjetiva, en la cual los procesos fisiopatológicos de transducción, transmisión, percepción y modulación del dolor son influidos por factores psicológicos, sociales y culturales del individuo y su entorno; por lo tanto, es fundamental recordar que los factores psicosociales pueden modificar la percepción del dolor y modular la experiencia dolorosa, pero rara vez son la causa del dolor.
El dolor musculoesquelético (DME) se clasifica en dos grandes grupos:
La patología muscular no es bien reconocida como fuente de dolor por los médicos no especialistas.
El dolor miofascial es un fenómeno de dolor regional con historia de sobrecargas repetidas o diversos traumas, de diagnóstico diferencial difícil, pues los pacientes presentan dolor referido a vísceras que simula cuadros de cólico renal o patología pleural. En el examen físico se pesquisan puntos dolorosos asociados a nódulos palpables, que se denominan puntos gatillo (trigger points), porque reproducen el dolor al ser presionados. Es una entidad poco conocida, pese a que se describe una prevalencia de 30% en clínica general, los mecanismos del dolor son complejos y se suele confundir con otras patologías (3).
La fibromialgia tiene una prevalencia de 2% en población general y de 6 a 10% en consultantes de Medicina Interna. Se ve principalmente en población femenina y se caracteriza por un cuadro de dolor generalizado, con palpación de 11 de un total de 18 puntos dolorosos, que se asocia a alteraciones del sueño y factores psicológicos. Hoy existen evidencias que demuestran una alteración de los mecanismos inhibitorios descendentes (4). El modelo de procesamiento del dolor corresponde a dolor de origen cutáneo, existiendo ciertas diferencias respecto a aquel de origen muscular.
Entre los factores que influyen en la cronificación del dolor muscular se cuentan: género; contractura o espasmo muscular; sensibilización de los nociceptores musculares; cambios en la inervación muscular y factores genéticos. A continuación se analizará cada uno de ellos.
En cuanto a género, se sabe que existen diferencias entre hombres y mujeres en la fisiología del dolor y en la respuesta a los analgésicos. Los estudios de algometría demuestran que el umbral del dolor frente a la presión muscular es hasta 50% mayor en las mujeres, especialmente en el grupo de 10 a 40 años, fenómeno que se equilibra a edades mayores y se ha comprobado que las mujeres tienen mayor sensibilidad al dolor, independientemente de factores psicológicos, por lo que no es raro que la prevalencia de fibromialgia sea siete veces mayor en el sexo femenino (5). Asimismo, se ha demostrado que, dentro de la población con cefalea tensional y migraña, ellas tienen menor umbral de dolor; no es que las mujeres se “quejen” más de dolor, sino que tienen verdaderamente una mayor sensibilidad al dolor muscular, probablemente por influencia hormonal (6).
El círculo vicioso dolor-espasmo-dolor, si bien es un modelo teórico, parece reflejar en la práctica a muchas situaciones clínicas. El nociceptor muscular, al enviar señales de isquemia y dolor, gatilla a nivel medular, además de la propagación central del estímulo, un reflejo fisiológico de contracción muscular que inmoviliza el segmento o articulación involucrada y genera dolor por sí mismo.
La sensibilización de los nociceptores parece estar involucrada en la patogénesis de muchos dolores crónicos. Una lesión por trauma, sobrecarga, asimetría o estrés genera liberación de sustancias neurovasoactivas, provocando la sensibilización de los nociceptores, que liberan sustancia P y contribuyen a generar edema, el cual, en conjunto con diversos factores favorece la congestión venosa y la compresión de vasos sanguíneos, determinando isquemia tisular. La isquemia favorece la liberación de mediadores de la inflamación, con lo que se perpetúa el círculo vicioso de sensibilización, edema e isquemia (Fig. 8).
Figura 8. Sensibilización de nociceptores.
La isquemia es el mayor problema para la fibra muscular, pues se asocia a pérdida de los depósitos de ATP, alteración de la función de la bomba de calcio y pérdida de la capacidad de relajación de la fibra, lo que se traduce en una contracción mantenida que explica la persistencia de los puntos gatillo miofasciales. Las fibras nerviosas finas A delta y C, se distribuyen en el músculo en relación a los vasos sanguíneos, envolviendo éstos de modo tal que cualquier fenómeno traumático o inflamatorio producirá vasodilatación, edema, compresión e isquemia y gatillará un dolor mantenido.
Otra posible explicación para la cronificación del dolor muscular es la que se planteó en un estudio realizado en gastrocnemio de rata sometido a inflamación durante doce días, al cabo de los cuales se observaron los cambios en las fibras nociceptivas a través de tinción inmunorreactiva de sustancia P y se encontró mayor visualización de las fibras finas por depósito de sustancia P, lo que determinaría cambios en la densidad de la inervación de estas fibras y conduciría a la hiperalgesia (7).
Otro punto importante en la cronificación del dolor es la alteración de los mecanismos inhibitorios descendentes presente en la fibromialgia, patología en la cual se ha demostrado aumento de la sustancia P en el líquido cefalorraquídeo y disminución de los niveles plasmáticos de serotonina, lo que sugiere que estos mecanismos estarían involucrados en la génesis de ésta y otras condiciones dolorosas (8, 9).
En cuanto a los factores genéticos asociados a dolor crónico, se han identificado los siguientes genes: receptor de 5-HT2A (serotonina); transportador de serotonina; receptor D-4 de dopamina; y COMT (catecolamin o-metil transferasa) o transportador de catecolaminas, lo que apoya la teoría de la existencia de una deficiencia de serotonina en la fibromialgia, que es el modelo más estudiado (10).
Travel y Simon clasifican a los factores que perpetúan el dolor crónico en:


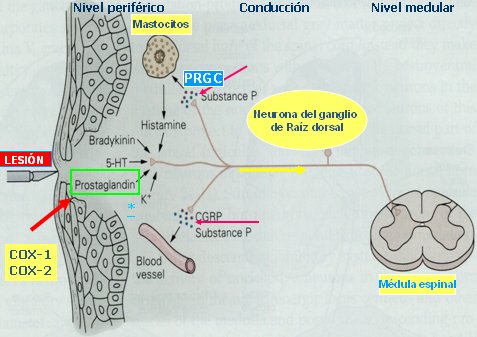 Figura 2. Transmisión del dolor desde el nivel periférico y medular.
Figura 2. Transmisión del dolor desde el nivel periférico y medular.

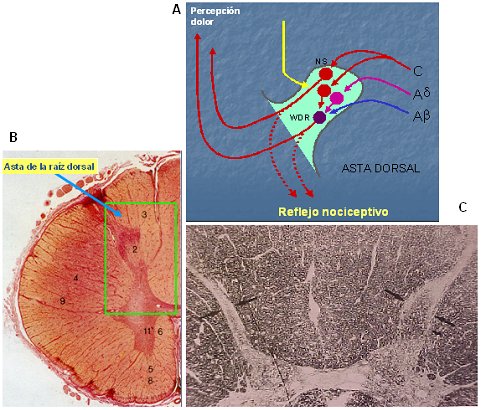 Figura 3. A: procesamiento a nivel segmentario (asta dorsal) B: asta de la raíz dorsal C: cambios centrales en dolor neuropático.
Figura 3. A: procesamiento a nivel segmentario (asta dorsal) B: asta de la raíz dorsal C: cambios centrales en dolor neuropático.

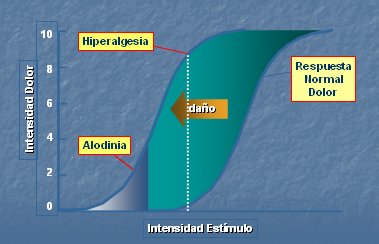 Figura 4. “Sensibilización” nociceptiva.
Figura 4. “Sensibilización” nociceptiva.

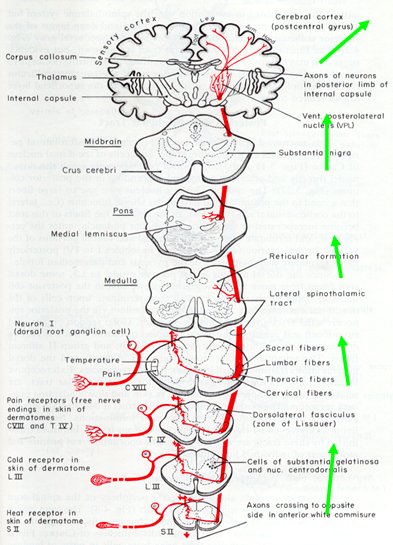 Figura 5. Vías ascendentes: haz espinotalámico lateral.
Figura 5. Vías ascendentes: haz espinotalámico lateral.

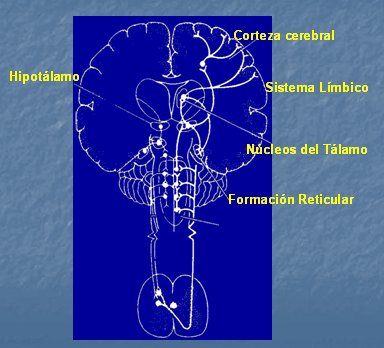 Figura 6. Procesamiento suprasegmentario.
Figura 6. Procesamiento suprasegmentario.

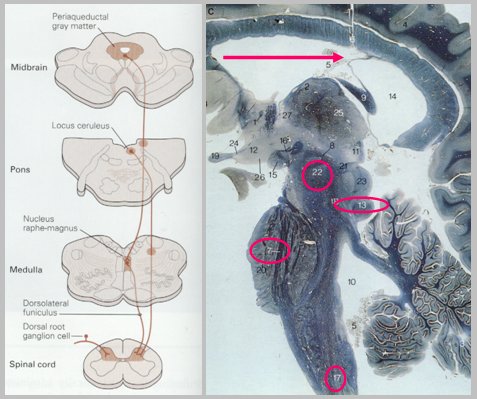 Figura 7. Vías inhibitorias descendentes y modulación del dolor.
Figura 7. Vías inhibitorias descendentes y modulación del dolor.

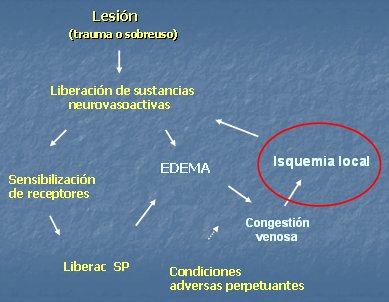 Figura 8. Sensibilización de nociceptores.
Figura 8. Sensibilización de nociceptores.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia dictada en el Curso Actualizaciones en Dolor e Inflamación en Reumatología, organizado por la Sociedad Chilena de Reumatología, durante los días 5 y 6 de Octubre de 2007, cuyo director fue el Dr. Carlos Fuentealba.
 Expositora:
Maria Antonieta Rico P.[1]
Expositora:
Maria Antonieta Rico P.[1]

Citación: Rico MA. Pathophysiology of chronic musculoskeletal pain. Medwave 2008 sep;8(8):e1654 doi: 10.5867/medwave.2008.08.1654
Fecha de publicación: 1/9/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kandel E, Schwartz J, Jessel T. Principles of Neural Science. 4th ed. New York: McGraw-Hill, 2000.
Kandel E, Schwartz J, Jessel T. Principles of Neural Science. 4th ed. New York: McGraw-Hill, 2000.  Gottschalk A, Smith DS. New concepts in acute pain therapy: preemptive analgesia. Am Fam Physician. 2001 May 15;63(10):1979-84. | PubMed |
Gottschalk A, Smith DS. New concepts in acute pain therapy: preemptive analgesia. Am Fam Physician. 2001 May 15;63(10):1979-84. | PubMed | Skootsky SA, Jaeger B, Oye RK. Prevalence of myofascial pain in general internal medicine practice. West J Med. 1989 Aug;151(2):157-60. | PubMed | PMC |
Skootsky SA, Jaeger B, Oye RK. Prevalence of myofascial pain in general internal medicine practice. West J Med. 1989 Aug;151(2):157-60. | PubMed | PMC | Wolfe F, Ross K, Anderson J, Russell IJ, Hebert L. The prevalence and characteristics of fibromyalgia in the general population. Arthritis Rheum. 1995 Jan;38(1):19-28. | CrossRef | PubMed |
Wolfe F, Ross K, Anderson J, Russell IJ, Hebert L. The prevalence and characteristics of fibromyalgia in the general population. Arthritis Rheum. 1995 Jan;38(1):19-28. | CrossRef | PubMed | Jensen R, Rasmussen BK, Pedersen B, Olesen J. Muscle tenderness and pressure pain thresholds in headache. A population study. Pain. 1993 Feb;52(2):193-9. | CrossRef | PubMed |
Jensen R, Rasmussen BK, Pedersen B, Olesen J. Muscle tenderness and pressure pain thresholds in headache. A population study. Pain. 1993 Feb;52(2):193-9. | CrossRef | PubMed | Reinert A, Mense S. Inflammatory influence on the density of CGRP and SP-immunoreactive nerve endings in rat skeletal muscle. Neuropeptides 1993;24:204–205. | CrossRef |
Reinert A, Mense S. Inflammatory influence on the density of CGRP and SP-immunoreactive nerve endings in rat skeletal muscle. Neuropeptides 1993;24:204–205. | CrossRef | Moldofsky H. Rheumatic pain modulation syndrome: the interrelationships between sleep, central nervous system serotonin, and pain. Adv Neurol. 1982;33:51-7. | PubMed |
Moldofsky H. Rheumatic pain modulation syndrome: the interrelationships between sleep, central nervous system serotonin, and pain. Adv Neurol. 1982;33:51-7. | PubMed | Russell IJ, Michalek JE, Vipraio GA, Fletcher EM, Javors MA, Bowden CA. Platelet 3H-imipramine uptake receptor density and serum serotonin levels in patients with fibromyalgia/fibrositis syndrome. J Rheumatol. 1992 Jan;19(1):104-9. | PubMed |
Russell IJ, Michalek JE, Vipraio GA, Fletcher EM, Javors MA, Bowden CA. Platelet 3H-imipramine uptake receptor density and serum serotonin levels in patients with fibromyalgia/fibrositis syndrome. J Rheumatol. 1992 Jan;19(1):104-9. | PubMed |