 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso de Enfermedades Respiratorias 2007, realizado en Pucón los días 7 al 10 de noviembre de 2007. El evento fue organizado por la Sociedad Chilena de Enfermedades Respiratorias.
Presidente Sociedad Chilena de Enfermedades Respiratorias: Dr. Raúl Corrales.
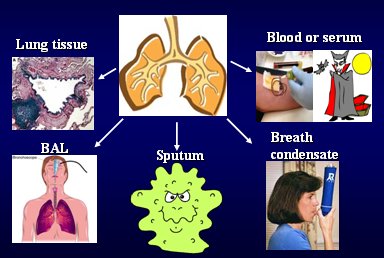
Figura 1. Biomarcadores: ¿Dónde?
El condensado es una técnica en la cual se hace respirar al paciente dentro de un tubo plástico congelado a -70º: el paciente inhala y exhala una y otra vez y el aire exhalado se congela y se deposita en la parte inferior, desde donde se retira para ser analizado; por otra parte, los análisis en sangre tienen la ventaja de que se pueden hacer en forma repetida. Barnes publicó una revisión sobre la utilidad de diversos biomarcadores presentes en esputo, condensado y lavado broncoalveolar y concluyó que ninguno de ellos se usa en forma rutinaria y que se necesita más investigación, con buena fenotipificación.
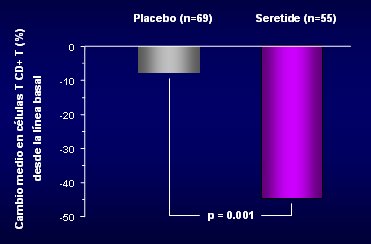
En cuanto al tejido pulmonar, Barnes publicó, en 2006, un estudio en que utilizó la biopsia pulmonar como un biomarcador, porque se efectuó al inicio y a las 16 semanas en cada paciente, para determinar los cambios que se producían en distintas subpoblaciones de linfocitos T CD+ con el uso de Seretide®, comparado con placebo. En dicho estudio se comprobó que la terapia producía una disminución marcada de estas células a nivel tisular (Fig. 2).
Figura 2. Efecto de Salmeterol/Fluticasona sobre la inflamación bronquial en EPOC
Sin embargo, esto no dice nada acerca del efecto en la evolución clínica de los pacientes o su tasa de mortalidad; de hecho, en el TORCH, los pacientes que recibieron Fluticasona sola no tuvieron mayor sobrevida y tuvieron mayor incidencia de neumonía. El hecho de que se observe un efecto sobre éstas células no significa que eso mejore la evolución de la enfermedad.
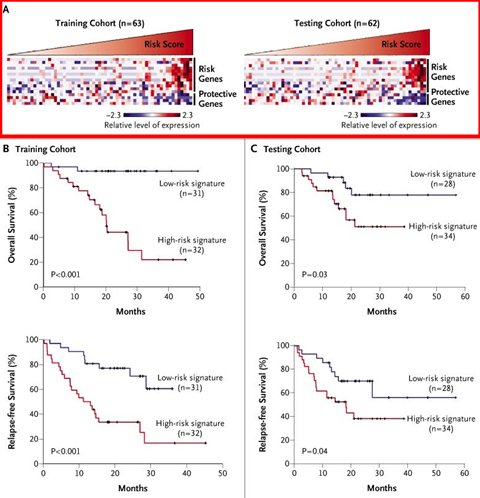
Figura 3. Marcadores genéticos y resultados en pacientes con cáncer pulmonar de células pequeñas
Posteriormente estos autores publicaron un trabajo en el que demostraron que el patrón genético determina la respuesta a la quimioterapia.
En la EPOC no se ha logrado el mismo nivel de desarrollo, en cuanto a marcadores genéticos, que en el cáncer. En un trabajo del Pulmonary Center and Department of Medicine, Boston University School of Medicine, encabezado por Spira, en conjunto con nuestro grupo, se estudió tejido pulmonar de pacientes con enfisema grave, que se obtuvo por cirugía de reducción de volumen, y de pacientes con enfisema leve, que se extrajo de pacientes portadores de nódulos o cáncer y se encontró el mismo patrón de genes sobre-regulados y genes sub-regulados, con predominio de los primeros en los pacientes con enfisema grave (Fig. 4).
Figura 4. Patrón genético según gravedad del enfisema pulmonar.
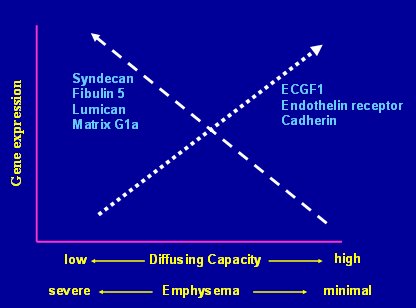
Esto no es suficiente si se correlaciona con una función. En el gráfico de la Fig. 5, a la izquierda están los genes que se asocian con baja capacidad de difusión y, por lo tanto, con enfisema grave y a la derecha, los que se asocian con alta capacidad de difusión y, por lo tanto, con enfisema mínimo.
Figura 5. Expresión genética y capacidad de difusión en pacientes con enfisema pulmonar
Esto significa que es posible predecir el resultado de un paciente con enfisema mediante el estudio de su tejido pulmonar; sin embargo, todavía no se ha llegado al nivel de los oncólogos, en el sentido de encontrar intervenciones que reviertan el deterioro de la capacidad de difusión en los pacientes con enfisema grave. Esto se debe, en gran medida, a que no es posible extraer tejido pulmonar en forma seriada para hacer los estudios: tal como dicen los americanos, “tissue is the issue”, el tejido es el problema.
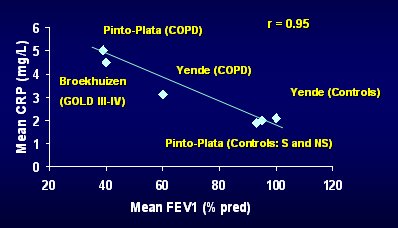
Figura 6. Inflamación, Proteína C Reactiva y EPOC
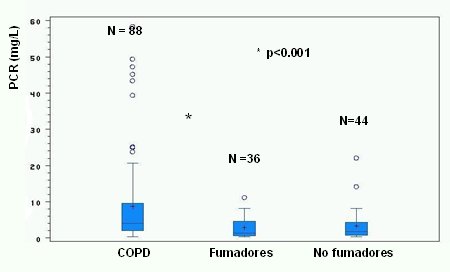
En el estudio de nuestro grupo se hizo dos mediciones de PCR, separadas por un año, en 88 pacientes con EPOC, 36 fumadores sin EPOC y 44 no fumadores, y se encontró un aumento significativo de la PCR en el primer grupo (Fig. 7).
Figura 7. Proteína C Reactiva en pacientes con EPOC y en controles
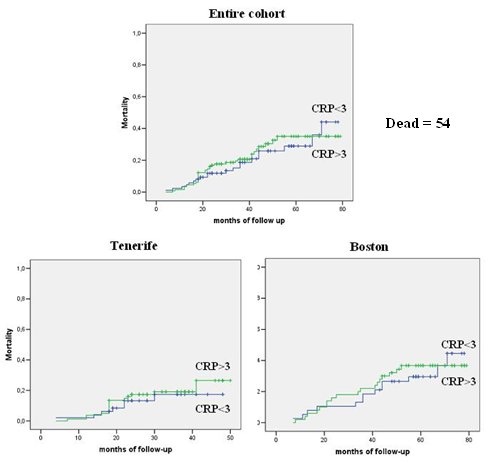
En un estudio poblacional, cuyos resultados se publicaron en 2007, se hizo un seguimiento a 1.302 pacientes durante ocho años; en ese lapso, 14% de los pacientes requirió hospitalización y 6% falleció. Los autores encontraron que, ajustando por edad, VEF1, tabaquismo y enfermedad coronaria, la PCR predice la mortalidad por problemas respiratorios, ya que el hazard ratio (HC) fue 40% más alto en personas con PCR mayor de 3, que en personas con PCR igual o menor de 3. Sin embargo, en los estudios de nuestro grupo, en Boston, del grupo de Tenerife y de la cohorte total, que suma 218 pacientes, la PCR no predijo la mortalidad. Es probable que se necesiten 2000 pacientes para encontrar cambios significativos en la PCR, de modo que es probable que este parámetro no sea útil para los neumólogos (Fig. 8).
Figura 8. PCR como predictor de mortalidad en EPOC (n = 218)
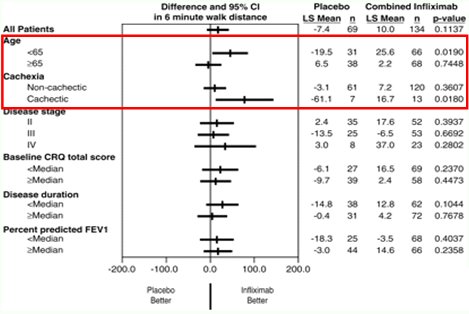
Figura 9. Infliximab (anticuerpo anti TNF alfa) en EPOC
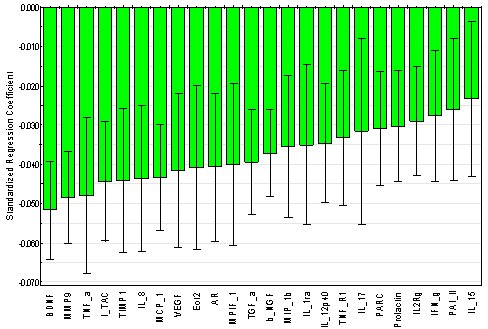
Sir William Osler (1849-1919), un gran clínico en John Hopkins, es el autor de una sabia sentencia: “Si no fuera por la gran variabilidad entre los individuos, la Medicina podría ser una ciencia y no, como lo es, un arte”. En efecto, aunque los individuos compartan un porcentaje muy alto de los genes, ninguno es exactamente igual a otro. Pensando en esto se planteó la posibilidad de utilizar un “panel” de biomarcadores. En un estudio de nuestro grupo, que se acaba de publicar, se utilizó una técnica de análisis proteómico en suero para determinar la asociación entre diversos marcadores sospechosos de estar involucrados en la patogenia de la EPOC y el VEF1; y se encontró un grupo de proteínas relacionadas con menor VEF-1 (Fig. 10).
Figura 10. Asociación de marcadores con VEF-1 (análisis proteómico del suero). Análisis de regresión parcial de cuadrados mínimos
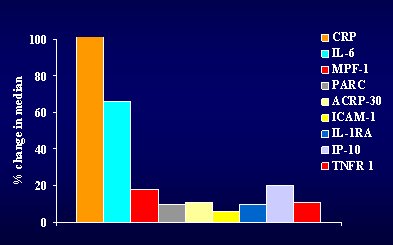
Figura 11. Panel plasmático de biomarcadores en exacerbaciones de EPOC
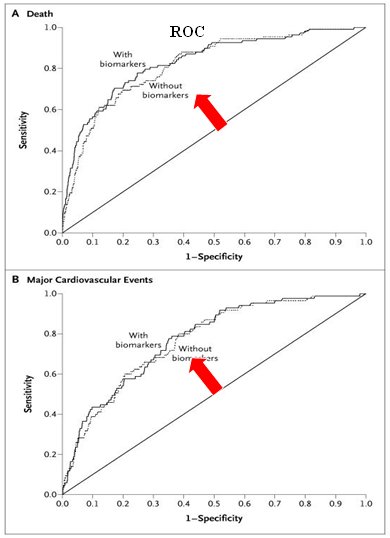
Figura 12. Biomarcadores y resultados en pacientes con EPOC
Esto no quiere decir que los biomarcadores no tengan utilidad en el área de la farmacoterapia y, por otra parte, el colesterol se debió considerar en el grupo de los biomarcadores, y se sabe que si se modifica el colesterol, cambia el pronóstico. Si los neumólogos pudieran encontrar un equivalente al colesterol, quizás podrían desarrollar “las estatinas” de la EPOC.













 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso de Enfermedades Respiratorias 2007, realizado en Pucón los días 7 al 10 de noviembre de 2007. El evento fue organizado por la Sociedad Chilena de Enfermedades Respiratorias.
Presidente Sociedad Chilena de Enfermedades Respiratorias: Dr. Raúl Corrales.
 Expositor:
Bartolomé R. Celli[1]
Expositor:
Bartolomé R. Celli[1]

Citación: Celli BR. Search for biomarkers and new therapeutic strategies in COPD. Medwave 2008 Abr;8(3):e901 doi: 10.5867/medwave.2008.03.901
Fecha de publicación: 1/4/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Barnes PJ, Chowdhury B, Kharitonov SA, Magnussen H, Page CP, Postma D, et al. Pulmonary Biomarkers in COPD. Am J Respir Crit Care Med. 2006 Jul 1;174(1):6-14. Epub 2006 Mar 23. | CrossRef | PubMed |
Barnes PJ, Chowdhury B, Kharitonov SA, Magnussen H, Page CP, Postma D, et al. Pulmonary Biomarkers in COPD. Am J Respir Crit Care Med. 2006 Jul 1;174(1):6-14. Epub 2006 Mar 23. | CrossRef | PubMed | Barnes NC, Qiu YS, Pavord ID, Parker D, Davis PA, Zhu J, et al. Antiinflammatory effects of salmeterol/fluticasone propionate in chronic obstructive lung disease. Am J Respir Crit Care Med. 2006 Apr 1;173(7):736-43. Epub 2006 Jan 19. | CrossRef | PubMed |
Barnes NC, Qiu YS, Pavord ID, Parker D, Davis PA, Zhu J, et al. Antiinflammatory effects of salmeterol/fluticasone propionate in chronic obstructive lung disease. Am J Respir Crit Care Med. 2006 Apr 1;173(7):736-43. Epub 2006 Jan 19. | CrossRef | PubMed | Chen HY, Yu SL, Chen CH, Chang GC, Chen CY, Yuan A, et al. A five-gene signature and clinical outcome in non-small-cell lung cancer. N Engl J Med. 2007 Jan 4;356(1):11-20. | CrossRef | PubMed |
Chen HY, Yu SL, Chen CH, Chang GC, Chen CY, Yuan A, et al. A five-gene signature and clinical outcome in non-small-cell lung cancer. N Engl J Med. 2007 Jan 4;356(1):11-20. | CrossRef | PubMed | Spira A, Beane J, Pinto-Plata V, Kadar A, Liu G, Shah V, et al. Gene Expression Profiling of Human Lung Tissue from Smokers with Severe Emphysema Am J Respir Cell Mol Biol. 2004 Dec;31(6):601-10. Epub 2004 Sep 16. | PubMed |
Spira A, Beane J, Pinto-Plata V, Kadar A, Liu G, Shah V, et al. Gene Expression Profiling of Human Lung Tissue from Smokers with Severe Emphysema Am J Respir Cell Mol Biol. 2004 Dec;31(6):601-10. Epub 2004 Sep 16. | PubMed | Sin DD, Man SF. Skeletal muscle weakness, reduced exercise tolerance, and COPD: is systemic inflammation the missing link? Thorax. 2006 Jan;61(1):1-3. | CrossRef | PubMed | PMC |
Sin DD, Man SF. Skeletal muscle weakness, reduced exercise tolerance, and COPD: is systemic inflammation the missing link? Thorax. 2006 Jan;61(1):1-3. | CrossRef | PubMed | PMC | Dahl M, Vestbo J, Lange P, Bojesen SE, Tybjaerg-Hansen A, Nordestgaard BG. C-reactive protein as a predictor of prognosis in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007 Feb 1;175(3):250-5. Epub 2006 Oct 19. | CrossRef | PubMed |
Dahl M, Vestbo J, Lange P, Bojesen SE, Tybjaerg-Hansen A, Nordestgaard BG. C-reactive protein as a predictor of prognosis in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007 Feb 1;175(3):250-5. Epub 2006 Oct 19. | CrossRef | PubMed | Mahler DA, Huang S, Tabrizi M, Bell GM. Efficacy and safety of a monoclonal antibody recognizing interleukin-8 in COPD: a pilot study.. Chest. 2004 Sep;126(3):926-34. | CrossRef | PubMed |
Mahler DA, Huang S, Tabrizi M, Bell GM. Efficacy and safety of a monoclonal antibody recognizing interleukin-8 in COPD: a pilot study.. Chest. 2004 Sep;126(3):926-34. | CrossRef | PubMed | Rennard SI, Fogarty C, Kelsen S, Long W, Ramsdell J, Allison J, et al. The safety and efficacy of infliximab in moderate to severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007 May 1;175(9):926-34. Epub 2007 Feb 8. | CrossRef | PubMed |
Rennard SI, Fogarty C, Kelsen S, Long W, Ramsdell J, Allison J, et al. The safety and efficacy of infliximab in moderate to severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2007 May 1;175(9):926-34. Epub 2007 Feb 8. | CrossRef | PubMed | Pinto-Plata VM, Livnat G, Girish M, Cabral H, Masdin P, Linacre P, et al. Systemic Cytokines, Clinical and Physiological Changes in Patients Hospitalized for Exacerbation of COPD. Chest. 2007 Jan;131(1):37-43. | CrossRef | PubMed |
Pinto-Plata VM, Livnat G, Girish M, Cabral H, Masdin P, Linacre P, et al. Systemic Cytokines, Clinical and Physiological Changes in Patients Hospitalized for Exacerbation of COPD. Chest. 2007 Jan;131(1):37-43. | CrossRef | PubMed |