 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXI Congreso Chileno de Obstetricia y Ginecología, Viña del Mar, 20-24 de noviembre de 2007.
Presidente SOCHOG: Dr. Eghon Guzmán Bustamante.
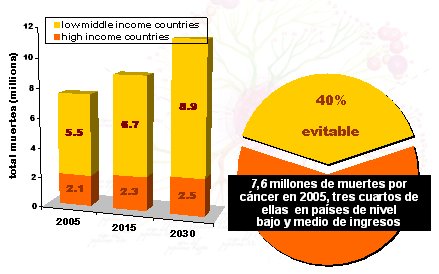
La carga mundial del cáncer divide en forma marcada a los países del orbe, ya que existe una diferencia muy importante entre los países de distinto nivel de ingreso. Según datos publicados por la OMS en el año 2007, más de 70% de los 7,6 millones de muertes por cáncer de cuello uterino que ocurrieron en el mundo durante el año 2005, se produjeron en los países de ingresos medianos o bajos. Esto es especialmente dramático si se considera que 40% de la carga de cáncer está dada por factores de riesgo modificables y/o evitables, como consumo de tabaco y alcohol, obesidad, infecciones y exposición a carcinógenos.
Figura 1. Carga mundial por cáncer (OMS 2007)
Los desafíos que se enfrentan en la actualidad, en el tema del control del cáncer, fueron señalados por Andreas Uldrich, encargado de cáncer de la OMS en Ginebra, que visitó Chile recientemente:
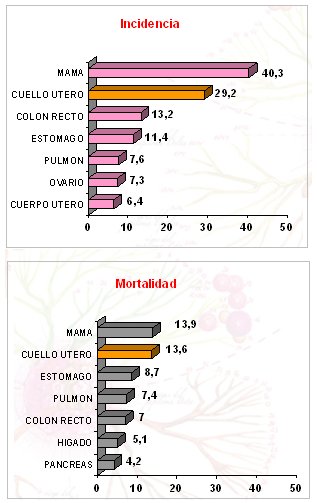
Las cifras de incidencia y mortalidad por cáncer en mujeres en América Central y Sur muestran diferencias con la situación en Chile: en la región el cáncer de cuello uterino ocupa el segundo lugar como causa de muerte y de prevalencia en la mujer, mientras que en Chile ocupa el quinto lugar; además, en Chile el cáncer de mama no ocupa el primer lugar, sino el segundo y el primero es el cáncer de la vía biliar, con una tasa actual superior a la que aparece en la figura (Fig. 2).
Figura 2. Localizaciones más frecuentes del cáncer en mujeres: incidencia y mortalidad en América Central – Sur (Globocan 2002)
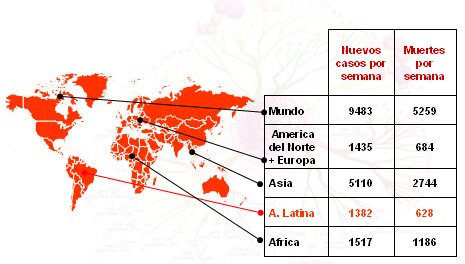
En cuanto a mortalidad global, la Agencia Internacional para la Investigación sobre Cáncer (IARC), que forma parte de la OMS, proporciona periódicamente datos estimados de la incidencia, prevalencia y mortalidad de 27 cánceres en todos los países del mundo, a través de una base de datos conocida como Globocan. Los datos, que corresponden al año 2002, indican que en el mundo muere una mujer por cáncer cervical cada dos minutos (5.259 muertes a la semana) y 83% de esas muertes ocurren en países en vías de desarrollo, aunque en Chile la tasa es menor que en el resto de Latinoamérica y el Caribe; además es la tercera causa de muerte por cáncer en las mujeres del mundo, después del cáncer de mama y de pulmón, y la principal causa de muerte por cáncer entre las mujeres del mundo en vías de desarrollo. La IARC estima que, debido al aumento en la edad promedio de la población, si no se logra una mejoría drástica en la prevención del cáncer cervical, habrá un millón de casos nuevos antes del año 2050, en comparación con los 500.000 que existen hoy en día. En la Fig. 3 se compara el número de casos nuevos por semana, así como las muertes por semana en distintas regiones: se puede ver que America del Norte y Europa suman el mismo número de muertes por esta causa que toda América Latina (1).
Figura 3. Mortalidad global por cáncer de cuello uterino (1)
El parámetro años de vida potencialmente perdidos (AVP) es otra forma de cuantificar el impacto del cáncer de cuello uterino en el mundo. El AVP, como indicador de la carga de enfermedad, pondera datos de mortalidad según la edad de la muerte y es una mejor medida del impacto personal y económico de cáncer cervical que la incidencia o índices de mortalidad, ya que permite evaluar los efectos de la enfermedad sobre la productividad económica de las personas y sus funciones sociales, particularmente el cuidado de los niños. El índice AVP revela cómo la muerte prematura por cáncer cervical afecta a las mujeres en la plenitud de sus vidas, en pleno funcionamiento laboral y familiar.
La falta de prevención y diagnostico precoz en los países en vías de desarrollo, causa una carga desproporcionada de muertes por cáncer cervical y AVP, porque estos cánceres son descubiertos únicamente en una etapa posterior y más avanzada. En mujeres de 25 a 64 años de edad, el cáncer cervical contribuye en más de 2,7 millones de AVP en el mundo, de los cuales sólo 0,3 millones ocurren en países desarrollados. Utilizando comparaciones de AVP se puede ver que el cáncer cervical es la causa principal de AVP relacionados con cáncer en los países en vías de desarrollo de Asia Sudcentral, Latinoamérica y África Sub-Sahariana. En Latinoamérica, por ejemplo, el cáncer cervical causa más AVP que el cáncer mamario, de estómago y pulmonar; y en Latinoamérica, Europa, Japón, Australia y Nueva Zelanda el cáncer cervical es una causa más importante de AVP que el SIDA, la tuberculosis y condiciones maternales.
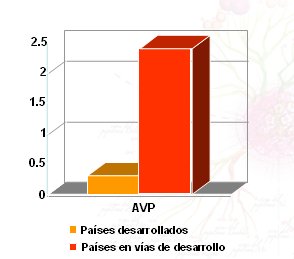
Los datos AVP también permiten confirmar la desproporcionada carga de enfermedad en países en vías de desarrollo, donde hay 4,8 veces más casos y 8 veces más AVP que en los países desarrollados. Según un estudio hecho en Chile en el año 2002, publicado por MIDEPLAN (2), este cáncer es la principal causa de años de vida potencialmente perdidos en la mujer, con un índice de 129 (Fig. 4).
Figura 4. Número de AVP en mujeres, de 25 a 64 años de edad (millones) (2) Mideplan, Chile 2002
La visión global de la OMS establece que el mundo debiera estar libre de cánceres prevenibles y que todos los pacientes debieran tener acceso a las mejores posibilidades de curación y cuidados. Bajo esta visión se han desarrollado los distintos niveles de prevención: prevención primaria, que apunta a evitar las enfermedades; prevención secundaria, que apunta a la detección precoz de éstas; y prevención terciaria, que apunta a la oportunidad y calidad del tratamiento.
En la prevención primaria los elementos más importantes son los hábitos de vida, la alimentación, la educación y algunos fármacos y vacunas, pero a veces es difícil llegar con esos recursos a algunas comunidades y a veces también falta motivación política; en la secundaria están los exámenes para detección precoz de enfermedades, como mamografía, antígeno prostático, otros marcadores tumorales y el Papanicolau, que existe hace más de 60 años; para la prevención terciaria se ha implementado en Chile el plan AUGE, que asegura la oportunidad y calidad del tratamiento.
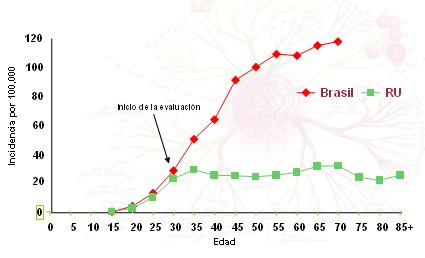
La importancia del tamizaje (o screening) queda en evidencia cuando se observa la diferencia en las incidencias de cáncer cervical entre países con evaluación masiva rutinaria, y aquellos sin programas de evaluación organizados. En la Fig. 5 se muestra el impacto del tamizaje en la población del Reino Unido en comparación con cifras de Brasil, que carece de un programa nacional de prevención con tamizaje y que presenta cifras de incidencia en aumento. Parece haber poco beneficio en la evaluación de mujeres más jóvenes, pero en general estas cifras muestran los beneficios prácticos y directos del examen de Papanicolaou rutinario en toda una población. Nótese que un número de mujeres sigue desarrollando cáncer cervical a pesar del programa de evaluación, como lo representa el área bajo la curva en el Reino Unido.
Figura 5. Incidencia de cáncer cervical estimada, por edades, en Brasil y el Reino Unido (1)
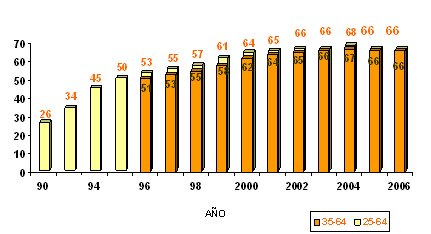
En una publicación reciente, Longato-Filho se refirió al Papanicolau como “demasiado mayor para ser una estrella de rock, pero muy joven para jubilarse” (3), para dar a entender que este examen se va a usar todavía durante mucho tiempo, auque lleve más de 60 años vigente. En Chile, el programa de prevención de cáncer de cuello uterino del sistema público se basa en la citología convencional de Papanicolau, cuya cobertura aumentó desde 26% en el año 90 hasta 66% en 2006. En este punto es justo hacer un reconocimiento público a la labor de las matronas, que recogen más de 90% de los exámenes de la atención primaria. Esta cobertura se ha mantenido estable en los últimos años (Fig. 6).
Figura 6. Cobertura de mujeres beneficiarias de 25 a 64 años de edad con PAP vigente. Chile, 1990-2006 (Fuente: Unidad de Cáncer MINSAL, Chile. Informe Servicios de Salud MMP)
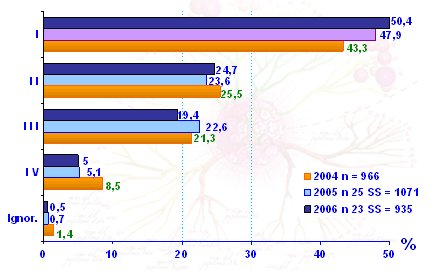
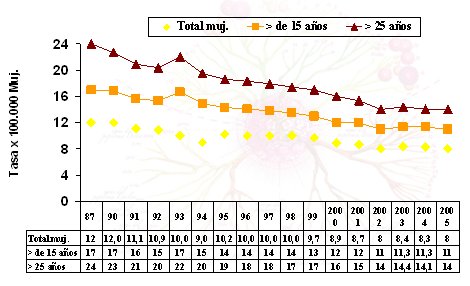
La distribución de los estadios clínicos del cáncer cervical, en el momento del diagnóstico, ha tenido una variación importante entre el año 2004 y el año 2006, esto puede atribuirse al impacto del AUGE en la prevención terciaria, que produjo un aumento en el porcentaje de casos en estadios iniciales. (Fig. 7). Asimismo, la amplia cobertura del Papanicolau ha tenido un gran impacto sobre la mortalidad, que se redujo en alrededor de 48% entre los años 1987 y 2005 (Fig. 8).
Figura 7. Distribución porcentual de casos de cáncer cervicouterino invasor según estadio FIGO en el momento del diagnóstico. Chile, 2004-2006 (Fuente: Servicios de Salud/Unidad de Cáncer/MINSAL MMP)
Figura 8. Mortalidad por cáncer cervicouterino total y específica por edad. Chile, 1987-2005 (Fuente: Unidad de Cáncer/MINSAL MMP)
Pese a los avances destacados, el cáncer de cuello uterino todavía es una causa importante de muerte en Chile y en el mundo, a pesar de que las herramientas para evitar este desenlace están disponibles desde hace tiempo, algunas de ellas desde hace más de medio siglo. Durante los últimos cuarenta años las tasas de cáncer cervicouterino han permanecido altas en la mayoría de los países latinoamericanos, reflejando principalmente la ausencia de programas de tamizaje o la existencia de programas ineficientes. Sólo en Chile y Colombia se han observado tendencias decrecientes de las tasas.
La OMS ha desarrollado el Plan Global de Acción contra el cáncer (Global Action Plan Against Cancer) (GAPAC), que tiene cuatro líneas de avance: prevenir aquellos cánceres susceptibles de prevención; curar las pacientes con cáncer mediante detección precoz y tratamiento adecuado; proporcionar los cuidados paliativos para las pacientes con cáncer en etapas avanzadas; y manejar los programas en forma racional y eficiente, sobre la base de la evidencia. Se sabe que lo que más impactaría en la reducción de la mortalidad, en Chile, sería llegar a una cobertura de Papanicolau superior a 80%, pero existe cierta carencia de información en relación a la metodología que pueda permitir esto, así como factores culturales y sociales en la población con respecto a este examen, el Plan AUGE optó por garantizar el acceso y la calidad del tratamiento con base en la evidencia médica. Hoy en día contamos con la posibilidad de efectuar prevención primaria mediante vacunas, que disminuyen el riesgo de infección por algunos tipos de VPH (condición necesaria) relacionados directamente con esta enfermedad. Esto que hace algunos años nos parecía una atrayente posibilidad es ya una realidad.
Tal como señaló Xavier Bosch en 2003, en el marco del Congreso Mundial de la FIGO realizado en nuestro país, en la actualidad el cáncer de cuello uterino se considera, más que una enfermedad oncológica, una enfermedad infecciosa, debido a que se ha descubierto una relación epidemiológica notablemente sólida entre los factores ambientales y el cáncer humano. Esto se ilustra en la Fig. 9, en la cual el riesgo relativo (RR) es una medida de la solidez de la relación; debajo de la línea base de referencia, la columna del riesgo muestra el grado de protección logrado mediante intervenciones para reducir la exposición específica, por ejemplo, la vacunación contra el virus de hepatitis B, que protege contra cáncer de hígado; por sobre la línea de base, el RR, de acuerdo a algunos estudios, es hasta 500 veces superior en ciertas condiciones de infección por el virus papiloma. La vacuna contra el virus papiloma humano (VPH) es la primera vacuna desarrollada pensando específicamente en cáncer (Fig. 9).
Figura 9. Una relación notablemente sólida en la epidemiología del cáncer (4)
Desde hace mucho tiempo se sabe que los factores sexuales están relacionados con el desarrollo de cáncer de cuello uterino invasor y lesiones preinvasoras. Además, en la actualidad existen evidencias epidemiológicas, clínicas y de laboratorio que demuestran la responsabilidad directa del virus papiloma en la génesis del cambio neoplásico, aunque no necesariamente es el único factor involucrado. Se han descrito como co-factores de riesgo, la edad temprana de inicio de relaciones sexuales, el mantener múltiples parejas, la multiparidad (ya que el riesgo relativo de cáncer invasor aumenta cuando hay más de cinco partos), el tabaquismo, debido a la nicotina; el uso prolongado de anticoncepción oral, que podría estar asociado a mayor incidencia de adenocarcinoma de cuello uterino, aunque en este aspecto existe cierta discusión; y la presencia de enfermedades causadas por agentes de transmisión sexual, como Clamidia trachomatis y VIH.
El factor relacionado y vinculante de todos estos factores es la infección persistente por VPH; todos los factores de riesgo mencionados intervienen en la replicación y/o facilitan la incorporación del ADN viral al genoma celular. Toda mujer sexualmente activa está en riesgo de infectarse con VPH, que se transmite fácilmente mediante el contacto genital piel con piel y no solamente por el coito penetrativo. Se calcula que entre 50 y 80% de las mujeres y hombres adquirirán una infección por algún tipo de VPH durante sus vidas (5, 6, 7) y algunos estudios estiman que hasta 50% de estas infecciones estarán dadas por un tipo de VPH oncogénico (o de alto riesgo), aunque existe una variación regional demostrada en la literatura (8). Sin embargo, sólo un porcentaje minoritario de las mujeres infectadas desarrollará cambios celulares anormales.
Cada tipo de VPH se asocia con diversas manifestaciones clínicas: los tipos oncogénicos se asocian a displasias cervicales de alto grado (LIEAG) y cáncer cervicouterino y los tipos bajo riesgo dan displasias cervicales de bajo grado (LIEBG) y verrugas genitales. Las evidencias demuestran que hay presencia de ADN de HPV en 99,7% de los especímenes de cáncer cervical, indicando una relación causal entre infección por VPH y este tipo de cáncer. La mayoría de las infecciones, tanto en hombres como en mujeres, remiten en forma espontánea y son asintomáticas, pero la infección por VPH oncogénico desencadenará una cascada de eventos que permitirá la progresión a cáncer cervical. Los cofactores tienen un rol relevante en todo este proceso (9).
El diagnóstico citopatológico de “probable infección por VPH” siempre origina una cascada de preguntas que el ginecólogo debe enfrentar: ¿Cómo, cuándo, de quién adquirí HPV? ¿Afectará el HPV al embarazo o al niño? ¿Se puede contagiar por vía oral o por manipulación? ¿Cómo me puedo hacer un test? ¿Siempre tendré el virus? ¿Cómo puedo prevenir el contagio? ¿Pueden las parejas reinfectarse? ¿Qué debo decirle a mi pareja? ¿Cuáles son las mejores opciones terapéuticas?, Estas son las principales preguntas de una mujer ante la sospecha de infección por HPV.
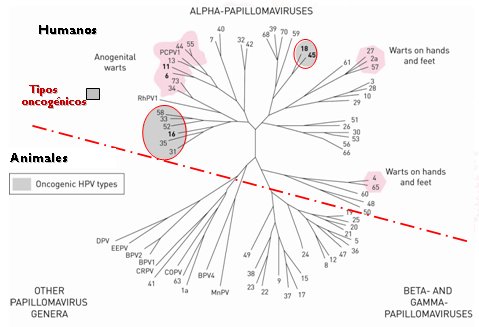
Se ha descrito la infección por virus papiloma, tanto en humanos como animales. Los genotipos animales no se trasmiten a los seres humanos (a diferencia de la gripe aviar). Existe una relación filogenética entre algunos de los diferentes genotipos humanos. Los papilomavirus se clasifican según diferencias en las secuencias en el gene de cápside L1, que es genéticamente estable, y por consiguiente particularmente bien conservado en todos los miembros de la familia de virus de papiloma. Se han descrito más de 200 tipos de virus de papiloma, de los cuales unos 100 infectan a humanos, y por ello se clasifican como VPH.
El diagrama de la Fig. 10 muestra el árbol filogenético del virus de papiloma, que se basa en las similitudes genéticas, utilizando las secuencias de ADN del virus, y muestra todos los tipos de virus de papiloma, incluyendo aquellos que infectan a otros animales. Los tipos mucosales de VPH, que incluyen a los tipos oncogénicos, pertenecen al alfa-virus del género papiloma. Los tipos oncogénicos y de bajo riesgo pertenecen a este género, aunque generalmente forman especies distintas; por ejemplo, los tipos VPH oncogénicos 16, 31 y 52 pertenecen a la especie 9, mientras que los VPH 18 y 45 oncogénicos son de la especie 7. En forma similar, los tipos VPH de bajo riesgo tienden a estar más estrechamente relacionados con otros tipos de bajo riesgo; por ejemplo, VPH 6 y 11, que pueden causar verrugas anogenitales, están estrechamente relacionados (especie 10). Este estrecho agrupamiento de los tipos VPH oncogénicos puede ser importante para la inter-protección potencial que podría proporcionar una vacuna para otros tipos VPH de alto riesgo (10, 11).
Figura 10. Virus papiloma humano (VPH): árbol filogenético
La prevalencia de VPH varía de un tipo a otro. VPH 16 y 18 son los tipos oncogénicos más prevalentes, y aparecen en conjunto en hasta 70% de los cánceres cervicales del mundo (12, 13, 14); los VPH 31, 45 y 52 son también tipos oncogénicos, y aparecen en otro 11,9% de los cánceres cervicales; los tipos VPH 6 y 11 son de bajo riesgo y aparecen en 90% de las verrugas anogenitales (15).
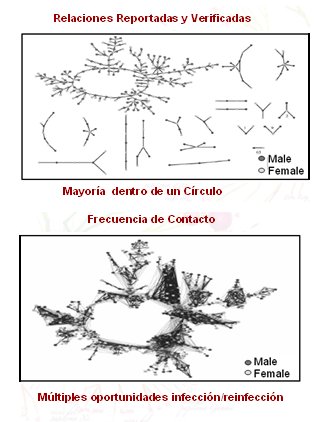
Se ha demostrado que la edad temprana de infección es un factor de riesgo crítico para el cáncer cervicouterino. Bearman publicó, en 2004, un estudio efectuado en una comunidad de adolescentes de un colegio de educación secundaria de los Estados Unidos, con el objetivo de determinar los riegos de la transmisión por contacto piel-piel en este grupo etario, de 17 años de edad promedio, en un lapso de 18 meses (sólo se les preguntó por actividad sexual no necesariamente sexo explícito). Los resultados, que se resumen en la Fig. 11, demuestran que los adolescentes reportan una gran cantidad de relaciones sexuales, la mayoría está dentro de un círculo y existen múltiples oportunidades de infección y re-infección para hombres y mujeres. Esto es muy importante, porque a menor edad en la mujer y sobre todo en la adolescencia, mayor es la susceptibilidad a la infección persistente por el virus papiloma, y sobre todo el virus papiloma de alto riesgo.
Figura 11. Transmisión de HPV: contacto piel-piel. Relaciones en adolescentes, lapso de 18 meses. Adaptado de Bearman et al. (16)
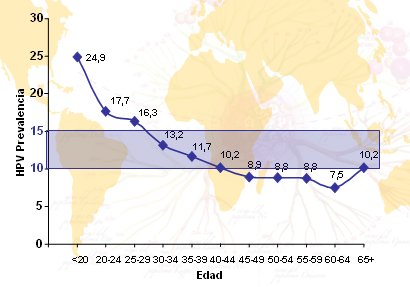
El número de parejas sexuales también se relaciona con la infección por VPH. En cualquier comunidad, este número es mayor en los jóvenes, como lo demuestra el gráfico de la Fig. 12, que corresponde a un estudio de Silvia De Sanjose en el que se encontró una prevalencia de DNA del VPH de casi 25% en mujeres que iniciaron su actividad sexual antes de los 24 años; y el problema es que se sabe que los VPH que afectan a este grupo etario son predominantemente de alto riesgo. Posteriormente hay un pequeño pico de prevalencia, dado por tipos de VPH de bajo riesgo; es lo que aparece en un estudio chileno como la distribución en jota invertida.
Figura 12. Prevalencia mundial HPV-DNA específica por edad, en mujeres de población general (De Sanjose et al, en preparación)
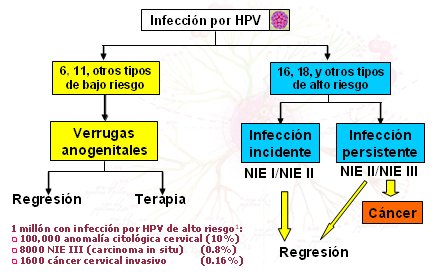
En la Fig. 13 se resumen los resultados de la infección por VPH de bajo y alto riesgo, unidos a los cofactores mencionados. Así como hay infecciones transitorias y persistentes, también hay lesiones de bajo grado y algunas, pero menos, de alto grado, las que también pueden regresar espontáneamente. Algunos estudios indican que hasta 90% de las lesiones de bajo grado, específicamente la neoplasia intraepitelial grado 1 (NIE-1), regresan espontáneamente en mujeres menores de 30 años.
Figura 13. Resultados de la infección por HPV (17)
C. Ferrecio publicó, en 2004, un estudio efectuado por el grupo de la Universidad Católica en una comunidad urbana de Santiago, que incluyó alrededor de 1000 mujeres y encontró una prevalencia de infección por VPH de 13% (18). Por otra parte, en un estudio incluido en la Encuesta Nacional de Salud de 2003 la prevalencia general llegó a 16% (19) y no se encontró diferencia estadísticamente significativa en la prevalencia en poblaciones rurales o urbanas, mujeres de altos recursos o de bajos recursos, mujeres con más o menos educación, es decir, la infección por virus papiloma es transversal y “equitativa”. Finalmente, existe un estudio multicéntrico sobre frecuencia de Virus Papiloma Humano y sus genotipos en carcinomas invasores de cuello uterino, en revisión, que se comentará más adelante.
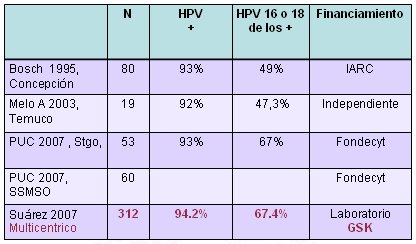
La Tabla I, que se presentó en el marco de la reunión de Vacunas para el Bicentenario, organizada por la Universidad Católica y la Universidad de la Frontera, la Dra. Ferrecio resumió la información publicada hasta agosto de 2007 en cuanto a prevalencia de VPH en cáncer invasor. El trabajo publicado en 1995 por Bosch y colaboradores, realizado en una muestra de 80 pacientes en Concepción, se hizo con una tecnología muy diferente a la actualmente disponible.
Tabla I. VPH en cáncer invasor en Chile (Ferrecio C. Agosto 2007)
La distribución de los genotipos del VPH es diferente en mujeres sanas y en mujeres con cáncer de cuello uterino, por lo cual no extraña que en la publicación chilena de Ferrecio et al. el VPH 56 haya tenido una prevalencia tan alta, muy distinta a otros países: eran mujeres con cuellos uterinos normales, con Papanicolau normal y sin antecedentes de patología cervical.
La edición y publicación de esta conferencia han sido posibles gracias al auspicio de GlaxoSmithKline
Medwave. Año VIII, No. 4, Mayo 2008. Derechos Reservados.















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXI Congreso Chileno de Obstetricia y Ginecología, Viña del Mar, 20-24 de noviembre de 2007.
Presidente SOCHOG: Dr. Eghon Guzmán Bustamante.
 Expositor:
Eugenio Suárez Pacheco[1]
Expositor:
Eugenio Suárez Pacheco[1]

Citación: Suárez E. Human papillomavirus and cervical cancer. Medwave 2008 May;8(4):e890 doi: 10.5867/medwave.2008.04.890
Fecha de publicación: 1/4/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010 Dec 15;127(12):2893-917. | CrossRef | PubMed |
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010 Dec 15;127(12):2893-917. | CrossRef | PubMed | Yang BH, Bray FI, Parkin DM, Sellors JW, Zhang ZF. Cervical cancer as a priority for prevention in different world regions: an evaluation using years of life lost. Int J Cancer. 2004 Apr 10;109(3):418-24. | CrossRef | PubMed |
Yang BH, Bray FI, Parkin DM, Sellors JW, Zhang ZF. Cervical cancer as a priority for prevention in different world regions: an evaluation using years of life lost. Int J Cancer. 2004 Apr 10;109(3):418-24. | CrossRef | PubMed | Moreira MA, Longato-Filho A, Taromaru E, Queiroz G, Jubé LF, Pinto SA, et al. Investigation of human papillomavirus by hybrid capture II in cervical carcinomas including 113 adenocarcinomas and related lesions. Int J Gynecol Cancer. 2006 Mar-Apr;16(2):586-90. | CrossRef | PubMed |
Moreira MA, Longato-Filho A, Taromaru E, Queiroz G, Jubé LF, Pinto SA, et al. Investigation of human papillomavirus by hybrid capture II in cervical carcinomas including 113 adenocarcinomas and related lesions. Int J Gynecol Cancer. 2006 Mar-Apr;16(2):586-90. | CrossRef | PubMed | Bosch FX, Lorincz A, Muñoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002 Apr;55(4):244-65. | CrossRef | PubMed | PMC |
Bosch FX, Lorincz A, Muñoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol. 2002 Apr;55(4):244-65. | CrossRef | PubMed | PMC | Crum CP, Abbott DW, Quade BJ.Cervical cancer screening: From the Papinocolau smear to the vaccine era. J Clin Oncol. 2003 May 15;21(10 Suppl):224s-230s. | CrossRef | PubMed |
Crum CP, Abbott DW, Quade BJ.Cervical cancer screening: From the Papinocolau smear to the vaccine era. J Clin Oncol. 2003 May 15;21(10 Suppl):224s-230s. | CrossRef | PubMed | Tjalma WA. Is the public enough aware to accep a vaccination program against hum papillomavirus? Vaccine. 2005 May 9;23(25):3231. | CrossRef | PubMed |
Tjalma WA. Is the public enough aware to accep a vaccination program against hum papillomavirus? Vaccine. 2005 May 9;23(25):3231. | CrossRef | PubMed | Baseman JG, Koutsky LA. The epidemiology of human papillomavirus infections. J Clin Virol. 2005 Mar;32 Suppl 1:S16-24. | CrossRef | PubMed |
Baseman JG, Koutsky LA. The epidemiology of human papillomavirus infections. J Clin Virol. 2005 Mar;32 Suppl 1:S16-24. | CrossRef | PubMed | Bosch FX, de Sanjose S. Chapter 1: Human papillomavirus and cervical cancer – burden and assessment of causality. J Natl Cancer Inst Monogr. 2003;(31):3-13. | CrossRef | PubMed |
Bosch FX, de Sanjose S. Chapter 1: Human papillomavirus and cervical cancer – burden and assessment of causality. J Natl Cancer Inst Monogr. 2003;(31):3-13. | CrossRef | PubMed | Giuliano AR, Harris R, Sedjo RL, Baldwin S, Roe D, Papenfuss MR, et al Incidence, prevalence, and clearance of type-specific human papillomavirus infections: The Young Women's Health Study. J Infect Dis. 2002 Aug 15;186(4):462-9. Epub 2002 Aug 2. | CrossRef | PubMed |
Giuliano AR, Harris R, Sedjo RL, Baldwin S, Roe D, Papenfuss MR, et al Incidence, prevalence, and clearance of type-specific human papillomavirus infections: The Young Women's Health Study. J Infect Dis. 2002 Aug 15;186(4):462-9. Epub 2002 Aug 2. | CrossRef | PubMed | de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology. 2004 Jun 20;324(1):17-27. | CrossRef | PubMed |
de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology. 2004 Jun 20;324(1):17-27. | CrossRef | PubMed | Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev. 2003 Jan;16(1):1-17. | CrossRef | PubMed | PMC |
Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev. 2003 Jan;16(1):1-17. | CrossRef | PubMed | PMC | Clifford GM, Rana RK, Franceschi S, Smith JS, Gough G, Pimenta JM. Human papillomavirus genotype distribution in low-grade cervical lesions: comparison by geographic region and with cervical cancer. Cancer Epidemiol Biomarkers Prev. 2005 May;14(5):1157-64. | CrossRef | PubMed |
Clifford GM, Rana RK, Franceschi S, Smith JS, Gough G, Pimenta JM. Human papillomavirus genotype distribution in low-grade cervical lesions: comparison by geographic region and with cervical cancer. Cancer Epidemiol Biomarkers Prev. 2005 May;14(5):1157-64. | CrossRef | PubMed | Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer.N Engl J Med. 2003 Feb 6;348(6):518-27. | CrossRef | PubMed |
Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer.N Engl J Med. 2003 Feb 6;348(6):518-27. | CrossRef | PubMed | Muñoz N, Bosch FX, Castellsagué X, Díaz M, de Sanjose S, Hammouda D, et al. Against which human papillomavirus types shall we vaccinate and screen? The international perspective. Int J Cancer. 2004 Aug 20;111(2):278-85. | CrossRef | PubMed |
Muñoz N, Bosch FX, Castellsagué X, Díaz M, de Sanjose S, Hammouda D, et al. Against which human papillomavirus types shall we vaccinate and screen? The international perspective. Int J Cancer. 2004 Aug 20;111(2):278-85. | CrossRef | PubMed | von Krogh G. Management of anogenital warts (condylomata acuminata). Eur J Dermatol. 2001 Nov-Dec;11(6):598-603; quiz 604.
| PubMed |
von Krogh G. Management of anogenital warts (condylomata acuminata). Eur J Dermatol. 2001 Nov-Dec;11(6):598-603; quiz 604.
| PubMed | Bearman PS, Moody J, Stovel K. Chains of Affection: The Structure of Adolescent Romantic and Sexual Networks. American Journal of Sociology. 110(1): 44-91
Bearman PS, Moody J, Stovel K. Chains of Affection: The Structure of Adolescent Romantic and Sexual Networks. American Journal of Sociology. 110(1): 44-91  McIntosh N. JHPIEGO. Strategy paper, 2000.
McIntosh N. JHPIEGO. Strategy paper, 2000.  Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Population-based prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev. 2004 Dec;13(12):2271-6. | PubMed |
Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Population-based prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev. 2004 Dec;13(12):2271-6. | PubMed | Chile, Ministerio de Salud. Encuesta nacional de salud chile 2003, enfermedades transmisibles: prevalencia de virus de hepatitis,hantavirus y virus del papiloma humano (informe corregido). Santiago: MINSAL, 2003. | Link |
Chile, Ministerio de Salud. Encuesta nacional de salud chile 2003, enfermedades transmisibles: prevalencia de virus de hepatitis,hantavirus y virus del papiloma humano (informe corregido). Santiago: MINSAL, 2003. | Link |