Este texto completo es la trancripción editada y revisada de la conferencia dictada en la XIV Reunión Científica de la Sociedad Interamericana de Hipertensión, 25-29 de marzo de 2001, Santiago.
Editora Científica: Dra. Gloria Valdés.
Antes de abordar este tema es importante establecer ciertos puntos, pues muchas personas saben bastante sobre preeclampsia, pero pocas entienden realmente la relación entre los sistemas vasculares materno y fetal. Nuestro trabajo ha demostrado que la placenta es una red vascular nueva, de modo que todo lo que se expondrá está enfocado a este punto.
Anatomía placentaria
La anatomía de la placentación es una “caja negra” que resulta clave para entender la relación entre embarazo e hipertensión.
Las células trofoblásticas son las células especializadas de la placenta y en las vellosidades coriónicas constituyen el sincicio y el citotrofoblasto velloso. Estas células, en su mayor parte, permanecen en los compartimientos fetales, formando las vellosidades flotantes, estructuras perfundidas por la sangre materna en el espacio intervellositario. Esta es la porción de la placenta que se elimina en el postparto.
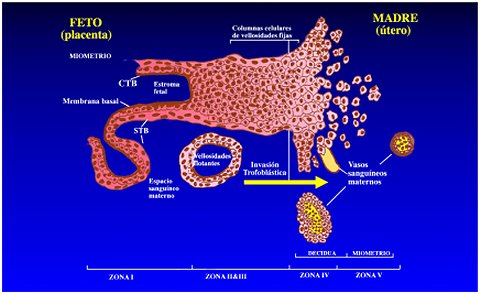
Existen otros subgrupos de células placentarias. En la base de las vellosidades, el citotrofoblasto forma las columnas de anclaje, en las que las células se agregan entre sí y luego adquieren un fenotipo invasor, e invaden para penetrar la decidua materna (citotrofoblasto invasor). Este mecanismo del citotrofoblasto se puede considerar como un proceso neoplásico, ya que las células que invaden la pared del útero se asemejan a células tumorales. De estas columnas de anclaje, un grupo de células, equipadas con mecanismos que les permiten alcanzar las arterias y no las venas, migra en el estroma uterino e invade las arterias, donde se transforma en citotrofoblasto intraarterial (Figuras 1 y 2). Estas células desempeñan un papel importante en el gobierno de la hipertensión durante el embarazo. Durante el embarazo en humanos, las arterias espirales del útero materno ya no están revestidas por sus propias células endoteliales sino que la pared de todos los vasos está revestida por células trofoblásticas. Así, es fácil imaginar por qué la disfunción de estas células produce problemas vasculares catastróficos, como los que se ven en algunas patologías del embarazo.
Figura 1 y Figura 2. Distintos tipos celulares en la placentación, e invasión de las arterias espirales.
En la interfaz maternofetal radica lo importante. Uno de los logros de nuestro laboratorio es haber reunido una gran colección de tejidos de esta área. En estas secciones tisulares, las células trofoblásticas son reactivas para un anticuerpo (anticitoqueratina), que las hace sobresalir del fondo de células maternas. En nuestro laboratorio, no sólo nos hemos enfocado al estudio de secciones tisulares, sino que también hemos desarrollado modelos de estudio in vitro de este proceso, cultivando estas células en matrices de células madre (stem cells) para conseguir que se desarrollen y recapitular el fenotipo tumoral y, a partir de éste, el fenotipo vascular. También hemos utilizado metodología tumoral para cuantificar la invasión de estas células. Mediante microfotografía electrónica de barrido se puede apreciar que, si se cultivan estas células en filtros recubiertos de matriz, ellas invaden los filtros y se puede cuantificar la invasión contando procesos celulares. En un segundo modelo in vitro se disecan las vellosidades que poseen columnas celulares de anclaje, las que in vivo dan origen a las células invasoras. Luego se colocan en matrices, y al hacer secciones tisulares se puede observar que estas vellosidades también pueden dar origen a las células invasoras que invaden la matriz en los filtros.
Es importante tener esta visión general de los mecanismos moleculares que están detrás de estas asombrosas transformaciones. Recordemos que se trata de células epiteliales fetales, en particular de la placenta, que invaden la pared uterina y se transforman, de ser células epiteliales, como las de la epidermis, en un fenotipo vascular. Esto, obviamente, es un concepto nuevo.
Reguladores moleculares
En los últimos años se han estudiado varios reguladores moleculares de este proceso; se revisarán someramente algunos de ellos antes de comentar la parte vascular. Se han estudiado factores de transcripción considerados como reguladores generales, metaloproteinasas y moléculas de adhesión, las que se relacionan con el crecimiento tumoral y con el fenotipo invasor ya mencionado.
Aún resulta asombroso ver cómo estas células poseen fenotipo vascular, pero tienen un genotipo antigénico diferente; son hemialogénicas, lo que significa que la mitad de su genotipo lo aporta el padre, a pesar de lo cual no las rechaza la madre.
En estudios de invasión, como se describió al comienzo, con los procesos celulares en los filtros de matriz, se ve que, si se inhibe la metaloproteinasa-9 (MMP9) con un anticuerpo antiMMP9, también se inhibe la invasión y, en alto grado, la transformación vascular.
En el análisis fenotípico global de este cambio, en la interfaz maternofetal, se encontró que las células presentan supresión de la expresión de las E-caderinas, moléculas de adhesión epitelial que mantienen las células unidas entre sí. En cambio, presentan estimulación de moléculas de adhesión que sólo se expresan en las células vasculares. Así, estas moléculas se constituyen en un marcador del momento en que las células se transforman al fenotipo vascular. También se ha descrito aumento en la expresión de otro tipo de molécula de adhesión, integrina alfa1, que fija las células a la pared vascular subyacente.
Respecto del sistema inmune, nuestro grupo ha observado que un antígeno de trasplante, que se expresa únicamente en estas células trofoblásticas invasoras, pertenece a la misma familia del MHC clase I (A, B y C), y es un nuevo miembro de la familia que se pensó que era un gen llamado HLA-G, el cual se estimula mientras el trofoblasto invade la pared vascular.
Es interesante considerar que estas células no sólo se transforman en células vasculares, sino que también desarrollan mecanismos para transplantarse ellas mismas dentro de la pared uterina.
Preeclampsia
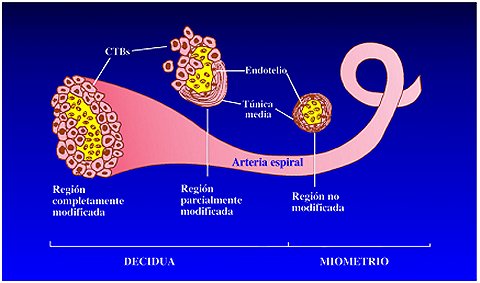
Una vez que se comprendió lo que ocurría en el embarazo normal, el paso siguiente fue averiguar lo que ocurriría en los embarazos anormales, especialmente en la preeclampsia, por la naturaleza hipertensiva de este trastorno. En la preeclampsia, el fenotipo celular se puede analizar mediante el mismo esquema de células que invaden la pared uterina y modifican la pared vascular, que se mencionó al comienzo, pero en este caso las células no pueden invadir los vasos maternos y son incapaces de modificarlos y de formar las asociaciones correspondientes. Esta incapacidad de invadir normalmente y de formar asociaciones llevó a pensar que las moléculas de adhesión celular cumplían un papel importante en este fenómeno.
Si se observa, en secciones histológicas de la interfaz maternofetal, una vellosidad de anclaje con columnas trofoblásticas en un embarazo normal, se puede apreciar que los vasos sanguíneos están invadidos por estas células trofoblásticas. En la preeclampsia, las células trofoblásticas están cerca de los vasos, pero no los invaden, de manera que éstos mantienen su revestimiento original de células maternas, lo que traerá problemas durante el embarazo.
Al observar las moléculas de adherencia epitelial de la pared uterina en mujeres con una preeclampsia grave, se pudo detectar que las células retienen su calidad epitelial y no adquieren el fenotipo vascular. Esto permite concluir que existe una falla en la expresión de las moléculas de adhesión celular y sugiere una falla en la vía invasora. Esta falla de la transformación involucra a muchas otras moléculas, como MMP-9 y su inhibidor tisular, la metaloproteinasa-3.
En los dos últimos años se han determinado muchas secuelas que se producen por esta falta de transformación. Una de ellas es que las células de la pared uterina sufren muerte celular programada, o apoptosis, en un número importante de células, lo que probablemente se relaciona con el establecimiento súbito de los síntomas.
Pseudo-vasculogénesis
Se denomina así el proceso por el cual las células trofoblásticas son capaces de transformarse en células de tipo vascular. Hay, naturalmente, mucho interés en saber cómo se regula esto. Hemos buscado factores que los biólogos vasculares no considerarían factores fisiológicos, tales como el oxígeno, y moléculas como el factor de crecimiento endotelial (Vascular Endothelial Growth Factor o VEGF) que se relacionan con el crecimiento vascular en otras áreas. Los factores fisiológicos se estudiaron en cultivos de células en hipoxia. Como es de suponer, cuando estas células son incapaces de invadir permanecen hipóxicas, porque no son perfundidas correctamente.
Se han estudiado muchos de estos factores con las células en condiciones de cultivo normales (tensión de oxígeno de 20%) y con una tensión de oxígeno de 2%, y se encontró que sólo bajo hipoxia hubo un aumento de la incorporación de la timidina tritiada, un marcador de división celular.
En las secciones tisulares de la pared uterina materna se observó una relación similar in vivo. Se marcaron estas células con anticuerpos que reconocen células en proliferación mientras sufren mitosis, invaden el útero y permanecen en hipoxia. Una vez que las células alcanzan el útero y su irrigación sanguínea, desaparece la tinción de estos factores.
Esto fue recreado in vivo, analizando la proliferación celular masiva marcada por la incorporación de BrdU (3H thymidine and 5-bromo-2'-deoxyuridine) en hipoxia (tensión de oxígeno de 2%), con lo cual no hubo cambio en la mayoría de los procesos celulares básicos, pero sí hubo una marcada incorporación de BrdU. En esta situación las células no pudieron invadir los sustratos de la matriz.
Estos cambios son similares a muchas de las alteraciones de la diferenciación y la invasión del citotrofoblasto que ocurren en la preeclampsia, lo que sugiere que la tensión de oxígeno cumple un papel muy importante en la regulación de estos procesos in vivo (J Clin Invest 1996 Jan 15;97(2):540-50).
Para estudiar esto a nivel bioquímico con marcadores de ciclo celular, se utilizó P21, un marcador de ciclo mitótico. P21 está en niveles altos en condiciones de alta tensión de oxígeno y en niveles bajos frente a oxígeno bajo, pero las moléculas con progresión propia dentro del ciclo, que controlan este fenómeno, comprueban que estas células presentan altos niveles de estos marcadores con 2% de oxígeno.
Asimismo, se demostró un efecto sobre la diferenciación de las células. Con oxígeno al 2% no hay expresión de integrina alfa1, que es una molécula de adhesión tipo vascular, la que sí se expresa en un ambiente con oxígeno al 20%. También se pudo demostrar que en las células endoteliales las propiedades fundamentales de proliferación y diferenciación están controladas por la tensión de oxígeno.
También hemos trabajado sobre la cascada reguladora, buscando el sensor de oxígeno en estas células. El último de estos trabajos, que se encuentra en prensa, ha proporcionado datos sobre los dos fenómenos que comenzamos a estudiar, que son la naturaleza tumoral de estas células y sus cualidades vasculares. La molécula que reunió estos dos aspectos fue la proteína producida por el gen supresor tumoral de von Hippel-Lindau (VHL), que recibe el nombre de los dos patólogos que describieron esta familia de proteínas en tumores vasculares del sistema nervioso central en ratas. Los tumores se originan por una mutación en la línea germinal de un alelo y una mutación somática del segundo alelo, y así el complejo entero se pierde en ciertos tejidos. El foco se centró en el VHL en ratones knock-out, los que se generaron como modelo tumoral en vez de presentar un fenotipo placentario. Desde que se clonó el VHL, en 1992, se sabe que controla las respuestas celulares a la tensión de oxígeno. El VHL forma complejos con los factores de transcripción principales del factor inducido por hipoxia (HIF), el que regula la capacidad celular de suprimir genes “aguas abajo” en la cascada, como el VEGF y los transportadores de glucosa. Con tensiones de oxígeno bajas, el VHL no forma complejos con los factores de transcripción de HIF, de manera que éstos actúan libremente y suprimen los genes “aguas abajo” (Dev Biol 2001 May 15;233(2):526-36). Se ha localizado la expresión de VHL y actualmente se sabe que, en la placenta, el VHL está regulado con la diferenciación y con la tensión de oxígeno, y no genéticamente.
Un aspecto sorprendente que ha demostrado nuestro trabajo es que la expresión de estos supresores tumorales está autorregulada por la tensión de oxígeno.
Conclusiones
Se ha demostrado que, normalmente, el citotrofoblasto placentario sigue la vía de diferenciación llamada pseudo-vasculogénesis, la que lo lleva a adquirir el fenotipo vascular. Se sabe que hay una falla de este proceso en la preeclampsia, pero no se sabe cómo se relaciona con otras complicaciones del embarazo. Este es un estudio de grandes dimensiones que estamos realizando en este momento.
Se sabe que la pseudo-vasculogénesis está regulada por una combinación de tensión de oxígeno y factores génicos vasculogénicos comunes y poco comunes, y, por supuesto, se está trabajando en la búsqueda de la relación con desórdenes hipertensivos como la preeclampsia.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la trancripción editada y revisada de la conferencia dictada en la XIV Reunión Científica de la Sociedad Interamericana de Hipertensión, 25-29 de marzo de 2001, Santiago.
Editora Científica: Dra. Gloria Valdés.
 Expositora:
Susan Fisher[1]
Expositora:
Susan Fisher[1]

Citación: Fisher S. Pathogenic mechanisms in preeclampsia: current knowledge. Medwave 2001 Sep;1(09):e777 doi: 10.5867/medwave.2001.09.777
Fecha de publicación: 1/9/2001

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión