Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIV Congreso Chileno de Nutrición, realizado en Viña del Mar entre los días 24 al 27 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Nutrición, Bromatología y Toxicología.
Presidente: MSc. Juan Ilabaca.
El tema de esta exposición es una pregunta: ¿Está relacionado el peso de nacimiento con el metabolismo posterior de la glucosa e insulina? La respuesta es afirmativa, pero en este caso la situación es aún más interesante que la de la cardiopatía coronaria y otras enfermedades del adulto, por cuanto existe mayor riesgo de diabetes tipo 2 y de resistencia a la insulina en ambos extremos del peso de nacimiento.
El feto con retraso del crecimiento intrauterino desarrolla resistencia a la insulina en la vida adulta y probablemente presente sutiles alteraciones en la secreción de insulina, debido a una reducción de la masa pancreática de células beta; pero también hay un problema al otro extremo de la escala de peso de nacimiento, por cuanto el recién nacido macrosómico, hijo de madre con diabetes gestacional, también presenta un riesgo aumentado de intolerancia a la glucosa y diabetes en la vida futura. El defecto del metabolismo de la insulina no está tan bien definido en este caso, pero sí estaría claro que en años posteriores estos pacientes presentan secreción disminuida de insulina.
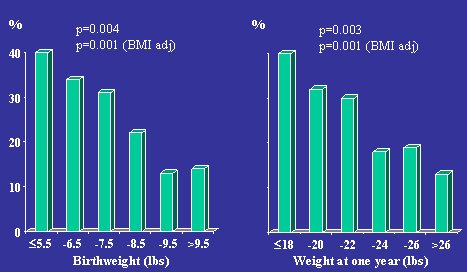
En la Figura 1 se muestra un gráfico que resume los datos del estudio de cohorte de Hertfordshire, en el Reino Unido, sobre la prevalencia de intolerancia a la glucosa y diabetes tipo 2 en hombres de 60 a 70 años, en relación al peso al nacer y al año de vida. Como se puede ver, la prevalencia de intolerancia a la glucosa y diabetes tipo 2 fue mayor en los individuos de menor peso al nacer y fue disminuyendo a medida que iba aumentando dicho peso, de tal manera que la prevalencia de estos trastornos fue de 40% en los nacidos con bajo peso y 12% en los de mayor peso de nacimiento. La misma tendencia se observa en el peso al año de vida; el poco aumento de peso a esa edad también es un factor de riesgo para tener estos problemas en la vida posterior (BMJ 1991;303:1019-22).
Figura 1. Prevalencia de intolerancia a la glucosa y diabetes tipo 2. Hertfordshire, hombres de 60 a 71 años de edad, n=370.
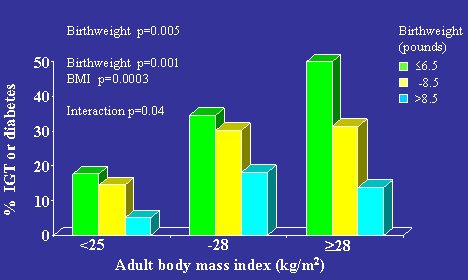
En la Figura 2 se señala que hay interacción entre peso fetal restringido y desarrollo de obesidad posterior; el peor resultado se da en hombres que nacieron con peso bajo y fueron obesos de adultos. Se ve que el hecho de ser pequeño al nacer, por sí solo, no es un factor de riesgo importante de diabetes adulta; hace falta el factor adicional de la obesidad para que surja el alto riesgo de enfermedad.
Figura 2. Prevalencia de intolerancia a la glucosa y diabetes tipo 2 (%). Hertfordshire, hombres de 60 a 71 años de edad, n=370.
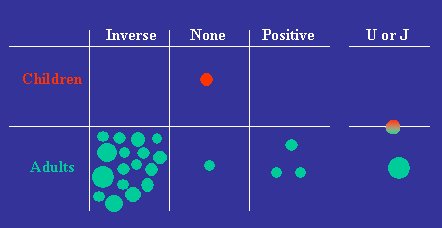
El año 2003 publicamos una revisión sistemática de todos los estudios disponibles acerca de la relación entre el peso de nacimiento y el metabolismo de glucosa-insulina posterior, evaluado a través de la tolerancia a la glucosa y la resistencia a la insulina; lamentablemente, no pudimos presentar los datos en la forma habitual, porque en los diferentes estudios se utilizaron una serie de resultados como criterios de comparación; por ejemplo, la glucosa se midió a distintos intervalos luego de administrar la carga de glucosa y la resistencia a la insulina se midió de diferentes maneras. Por eso, la revisión sistemática se presenta en un formato poco habitual (véase Figura 3).
Figura 3. Dirección de la relación entre peso al nacer y concentración plasmática de glucosa 2 horas después de una carga de glucosa. 20 de 38 artículos describieron esta relación (Newsome C. Diabetic Medicine 2003;23:339-348).
Cada uno de los círculos representa un estudio publicado y el tamaño de los círculos se relaciona con el tamaño de la muestra que se utilizó en cada estudio, desde los más pequeños, con 50 participantes, hasta los más grandes, con miles de personas. Algunos estudios describieron una relación inversa con el peso de nacimiento, como ocurrió en Hertfordshire; otros no encontraron ninguna relación con el peso de nacimiento; otros encontraron una relación positiva o una relación en U, que se verá más adelante.
Como se ve, en la gran mayoría de estos estudios se describe una relación similar entre el bajo peso de nacimiento y el desarrollo posterior de intolerancia a la glucosa, como en Hertfordshire, con el mayor riesgo en el grupo de bajo peso de nacimiento. En la mayor parte de la población que se siguió estudiando, esta relación se mantuvo: el efecto predominante fue el riesgo aumentado en los sujetos de bajo peso de nacimiento. Algunos de los estudios realizados en adultos no presentaron relación alguna, ni positiva ni en U. Sólo se realizó un estudio en niños, que no mostró ninguna relación con el peso de nacimiento.
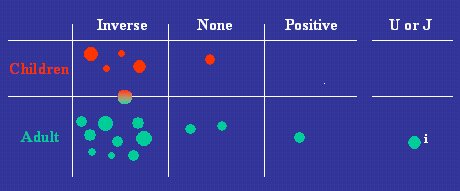
En la Figura 4 se pueden ver los resultados relativos a la resistencia insulínica, que en la mayoría de los estudios fueron similares a los de Hertfordshire, es decir, los hombres y mujeres que nacieron con bajo peso presentaron más resistencia a la insulina en la vida adulta, con algunas excepciones, pero el peso de la evidencia lleva la misma dirección.
Figura 4. Dirección de la relación entre peso al nacer y resistencia a la insulina (Newsome C. Diabetic Medicine 2003;23:339-348).
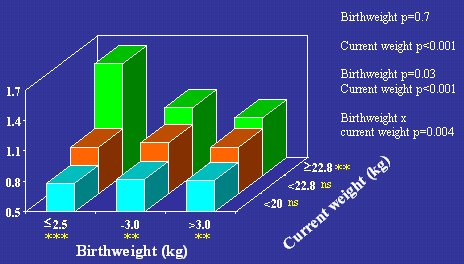
Hubo algunos estudios en niños en los que también se midió la resistencia a la insulina y en ellos también se observó esta relación inversa, como por ejemplo, un estudio realizado en India, en el que me tocó participar, en niños de ocho años. En la Figura 5 se muestran los valores de resistencia a la insulina, medida con la ecuación HOMA, en relación con el peso de nacimiento y con el peso actual de los niños a los ocho años. Se observa el mismo tipo de patrón que en los adultos de Hertfordshire: los niveles más altos de resistencia a la insulina corresponden a los niños que nacieron pequeños, pero que luego subieron de peso y alcanzaron los niveles más altos de peso a la edad de ocho años. Varios estudios de resistencia a la insulina en niños arrojan el mismo resultado, pero parece que los niños de bajo peso de nacimiento pudieron mantener la tolerancia a la glucosa durante la niñez y sólo vinieron a sufrir intolerancia a la glucosa y diabetes en la vida adulta.
Figura 5. Resistencia insulínica relativa (HOMA) en niños de 8 años de edad, Pune, India, n=477 (Bavdekar et al. Diabetes 2000; 48:2422-9).
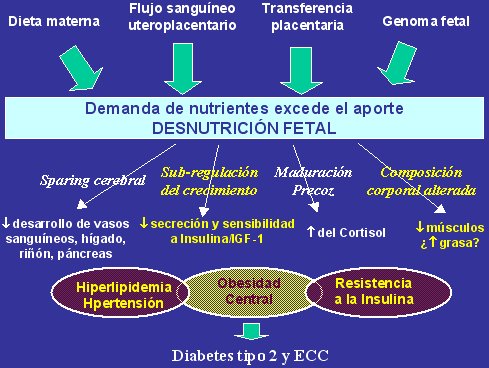
En la Figura 6 se presenta una versión muy concisa de la hipótesis del origen fetal de las enfermedades, que expresa nuestra interpretación de la relación entre el bajo peso de nacimiento y el desarrollo posterior de alteraciones del metabolismo de glucosa/insulina. El bajo peso de nacimiento representa la desnutrición del feto in utero y sabemos que el feto desnutrido desarrolla una serie de mecanismos de adaptación que van a facilitar su sobrevivencia frente a esta condición. Estos distintos mecanismos de adaptación tienen efectos metabólicos y fisiológicos que promueven la resistencia a la insulina:
Figura 6. Mecanismos adaptativos frente a la desnutrición fetal.
Todo lo anterior tiende a alterar el metabolismo de glucosa/insulina y, según lo que plantea la hipótesis del origen fetal, estos cambios que ocurren durante la vida fetal persisten en la etapa post natal y conducen a enfermedad en el adulto. Cada uno de estos efectos está demostrado en adultos y niños de bajo peso de nacimiento y también en estudios de animales; por ejemplo, en Hertfordshire observamos que los hombres con antecedente de bajo peso de nacimiento presentaban niveles compensatorios de cortisol más altos y respuesta exagerada y prolongada a ACTH, características que en estas personas se asociaron también con aumento de la resistencia a la insulina y diabetes.
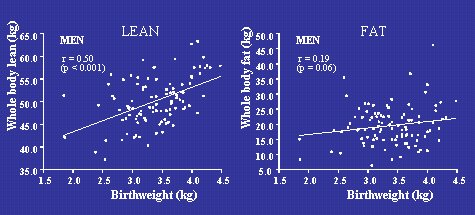
En la Figura 7 se ve la relación entre peso de nacimiento y composición corporal en la vida adulta, no en Hertfordshire, sino en Suffolk, en el Reino Unido, en hombres de edad avanzada a quienes se midió masa magra y masa grasa con la técnica de absorciometría radiológica doble (DEXA). Se ve que a medida que aumenta el peso de nacimiento también aumenta el porcentaje de masa magra, a la edad de 70 a 75 años, junto con escaso aumento de la masa grasa, dentro del mismo rango de pesos de nacimiento. En otras palabras, los hombres de bajo peso de nacimiento, tendían a presentar menos masa muscular en relación con su masa grasa, y como la masa magra o muscular es clave en la sensibilidad a la insulina, una menor masa muscular aumentaría la resistencia a la insulina.
Figura 7. Masa magra y masa grasa (DEXA) en hombres de 70 a 75 años de edad nacidos en Sheffield, UK, n=102 (Gale et al, JCEM 2001;86:267-272).
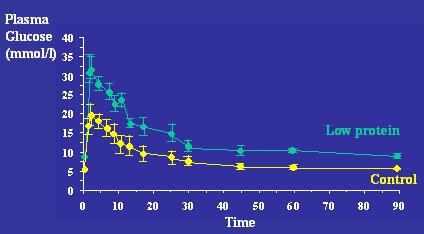
Los datos humanos plantean que la resistencia a la insulina en los individuos de bajo peso de nacimiento es un fenómeno multifactorial que tiene efectos en varios sistemas distintos. La hipótesis del origen fetal de las enfermedades se apoya en modelos animales en los que se ha observado el efecto de la desnutrición materna duarnte la gestación, sobre la vida adulta de las crías. En la Figura 8 se muestran datos de Nick Hales y Sue Ozanne, de Cambridge, que estudiaron un modelo de ratas sometidas a carencia proteica durante la preñez, cuyas crías, aunque recibieron alimentación postnatal normal, en la edad adulta (a los 15 meses), presentaban una intolerancia a la glucosa relativa, en comparación con las crías controles, a causa de la resistencia a la insulina.
Figura 8. Glucose tolerance in rats at 15 months. Mothers fed normal or low protein diet in pregnancy (Hales. Biochem Soc Trans. 1996; 24:341-50).
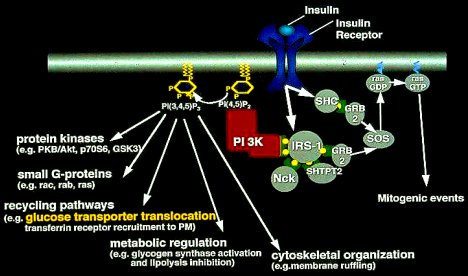
En una serie de estudios muy acuciosos, Hales y Ozanne mostraron dónde, exactamente, se encuentra el defecto de estas crías de madres privadas de proteína. Cuando la insulina interactúa con la célula, hay una serie de etapas enzimáticas que median la acción de la insulina al interior de la célula, las que se resumen en la Figura 9. Los autores demostraron que cada una de estas etapas es normal, salvo la P13quinasa, que está reducida en las crías de madres privadas de proteína; también demostraron que la expresión del gen que codifica para esta enzima está reducida en forma permanente en esas crías.
Figura 9. Vías de las señales insulínicas a nivel intracelular.
Esto no significa que el vínculo entre bajo peso de nacimiento y el posterior desarrollo de diabetes en seres humanos se deba a falta de proteínas en la dieta de la madre; tampoco quiere decir que éste sea el defecto principal en estos casos, pero sí que este defecto es uno, entre varios defectos posibles, que son causados por la desnutrición intrauterina. Probablemente, diversas agresiones nutricionales pueden conducir a resistencia a la insulina; la importancia de este estudio es que demuestra que una intervención nutricional transitoria en la madre, durante el embarazo, tiene un efecto permanente en una parte precisa de la vía insulínica, y que ejerce dicho efecto al afectar la expresión genética. Se podría decir que se trata de una interacción entre gen y ambiente.
Los estudios realizados en animales, lo mismo que en seres humanos, han demostrado que la resistencia a la insulina que se desarrolla como consecuencia de la desnutrición fetal, tiene su origen en varios mecanismos diferentes. En los estudios con el modelo de la rata obesa y perezosa, la madre está desnutrida durante la gestación y las crías reciben dieta hipercalórica al nacer; estas crías exhiben una amplia gama de anomalías, además de resistencia a la insulina: obesidad, masa muscular escasa y diferencias conductuales que las caracteriza como sedentarias y poseedoras de un apetito anormalmente intenso.
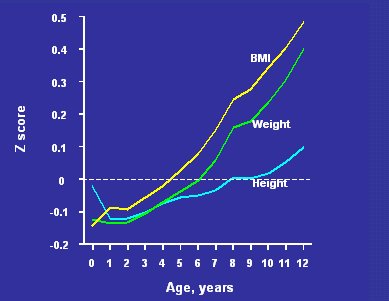
Esta exposición trata principalmente del peso de nacimiento, pero no estaría completa sin hacer referencia también a la etapa postnatal de crecimiento, que es muy importante para resaltar los efectos del bajo peso al nacer. En la Figura 10 se muestran datos de una cohorte de Finlandia, muy numerosa, compuesta por 8760 individuos de ambos sexos, de los cuales, 290 tenían diabetes tipo 2 cuando se les examinó como adultos. Lo excepcional de esta cohorte es que a los participantes se les midió talla, peso e IMC no sólo al nacer, sino durante toda la niñez, lo que permite tener una imagen del desarrollo de las personas que desarrollaron diabetes más adelante en la vida.
Las cifras corresponden a la desviación estándar del IMC, peso y talla de estos 290 hombres y mujeres con respecto a la línea 0, que representa al total de la cohorte. Se aprecia que, al nacer, el peso y el IMC de estas personas fueron más bajos, como era de esperar, que durante la infancia siempre pesaron menos que el resto de la cohorte, pero una vez pasada esa etapa su tasa de crecimiento cambió notablemente y comenzaron a subir de peso en relación con el resto de la cohorte. Año tras año fueron trepando regularmente por los centiles de peso e IMC, manteniendo sus tallas similares a las del resto de la cohorte.
Figura 10. Crecimiento en la infancia de 290 hombres y mujeres con diabetes tipo 2, provenientes de una cohorte de 8760 personas de Finlandia (Eriksson JG et al. Diabetologia 2003;46:190-194).
De adultos, los pacientes con diabetes eran significativamente más obesos que el resto de la cohorte, pero de niños, hasta la edad de cinco o seis años, eran más delgados que el conjunto de ésta. Si se hubiese examinado a estos pacientes en la niñez, con el fin de detectar a los niños de alto riesgo, estos niños no habrían sido identificables como obesos; lo que los caracterizó fue este aumento constante del z-score a medida que pasaban los años.
Esto es muy importante desde el punto de vista de la obesidad en la niñez; tal vez no sea acertada la estrategia de centrarnos sólo en los niños obesos. Los niños obesos están mal, por cierto, pero si nos limitamos sólo a ellos, estamos pasando por alto a un gran número de niños en riesgo de sufrir de diabetes en el futuro. Lo que necesitamos es una forma de identificar a los niños que van trepando por los centiles, mediante la realización de mediciones seriadas y la aplicación de una norma de referencia para evaluarlos. Podría ser más eficaz identificar a los niños en esta etapa de la patología, para tratar de impedir que lleguen a la obesidad, que intervenir cuando la obesidad ya es visible.
En el gran estudio estadounidense de enfermera realizado por Rich-Edwards, que contó con 70.000 participantes, se observó que había más riesgo de diabetes tipo 2 en las personas con bajo peso de nacimiento, como en Hertfordshire, y que el riesgo disminuía a medida que aumentaba dicho peso, pero con pesos de nacimiento muy altos volvía a aumentar el riesgo. Al eliminar a los hijos de madres que habían tenido diabetes gestacional, este aumento del riesgo desaparecía, lo que demostró que el mayor riesgo en los niños de alto peso de nacimiento se encontraba en los hijos de madres diabéticas (Rich-Edwards et al. Ann Int Med 1999;130:278).
En Hertfordshire no se observó este patrón, sino sólo la relación inversa, probablemente por dos motivos: primero, la cohorte de Hertfordshire tenía más edad y en ese tiempo hubiera sido improbable que los hijos de madres diabéticas hubieran sobrevivido hasta la adultez; en cambio, en esta cohorte de madres jóvenes, un número significativo de hijos de madres diabéticas sobrevivieron hasta alcanzar la edad adulta. El segundo factor es el tamaño de la muestra, que en este estudio permite que aparezcan suficientes casos de diabetes gestacional como para percibir este efecto, que no fue visible en Hertfordshire.
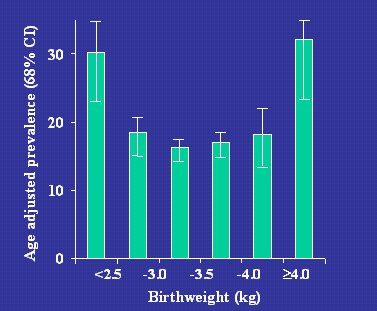
El grado en que el riesgo aumenta con el alto peso de nacimiento va a depender de la prevalencia de diabetes gestacional en la población estudiada. En una población con alta prevalencia de diabetes gestacional, como la de los indios pima, el riesgo que ocurre en el extremo superior del espectro de peso de nacimiento está mucho más claro, apareciendo una curva en U simétrica, como se puede ver en la Figura 11.
Figura 11. Prevalencia de diabetes tipo 2 en 1179 indios pima de 20 a 39 años de edad (McCance DR et al. BMJ 1004;308:942-5).
Los indios pima han sido objeto de extensos estudios, especialmente en relación con la diabetes gestacional. Al comparar los hijos de madres no diabéticas, los hijos de madres que no tuvieron diabetes durante ese embarazo, pero que fueron diabéticas más adelante (prediabéticas) y los hijos de mujeres diabéticas, se observó que los hijos de estas últimas tenían mayor riesgo de diabetes y obesidad en la edad adulta. Además, se encontró una gran diferencia entre los hijos de mujeres que tuvieron diabetes durante el embarazo y los de mujeres que desarrollaron la diabetes más adelante, lo que se atribuye a un efecto del entorno: la hiperglicemia materna causa hiperglicemia fetal e hiperestimulación pancreática fetal, de manera que los fetos son hiperinsulinémicos, lo que induciría una especie de “agotamiento pancreático” de las células beta en la vida adulta, con alteración de la secreción de insulina y alto riego de diabetes tipo 2 (Dabelea, J. Maternal-Fetal Med 2000;9:83-88).
El efecto que más se observa en la mayoría de las poblaciones es el del bajo peso de nacimiento, no el del alto peso de nacimiento debido a diabetes gestacional, pero es muy probable que ésta, como factor de riesgo de diabetes tipo 2, se convierta más adelante en un problema más grave, a medida que la población mundial se vaya haciendo más obesa y vaya aumentando la prevalencia de obesidad e intolerancia a la glucosa en las mujeres embarazadas. En India, donde realizo gran parte de mi trabajo, la prevalencia de diabetes gestacional en las poblaciones urbanas es alrededor de 6 a 10%; en Chile, la incidencia de diabetes gestacional en poblaciones urbanas llega a 18% y las tasas de diabetes gestacional y de todos los tipos de diabetes están subiendo.
La hipótesis del origen fetal propone que la nutrición intrauterina deficiente tiene un efecto directo sobre el crecimiento fetal y da origen a mecanismos de adaptación en el feto que conducen a la resistencia a la insulina y, más adelante, a enfermedad. La teoría más importante que se opone a la del origen fetal es la teoría de la insulina fetal, propuesta por Hattersley, que plantea que los genes que causan la resistencia a la insulina van a afectar el crecimiento fetal por su naturaleza, porque la insulina es una hormona de crecimiento fetal; por lo tanto, los mismos genes causarán resistencia a la insulina y enfermedades en la vida adulta (Hattersley, Lancet 1999;353:1789-92). Hay mucha controversia y debate en este momento acerca de cuál de estas hipótesis sería la explicación correcta del vínculo entre bajo peso de nacimiento y enfermedad posterior.
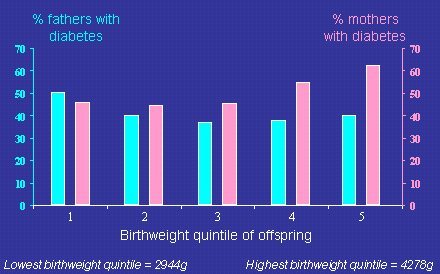
Según la hipótesis de la insulina fetal, los padres (varones) de los niños de bajo peso de nacimiento deberían tener mayor riesgo de diabetes tipo 2 y resistencia a la insulina, y los datos que se muestran en la Figura 12 lo comprueban. En una muestra de indios pima adultos, divididos según cuartiles de peso de nacimiento, se observa que el padre tenía diabetes en un mayor porcentaje de los individuos del cuartil más bajo de peso de nacimiento, en comparación con los integrantes de las categorías de mayor peso al nacer. En el caso de las madres ocurre lo contrario, debido al efecto de la diabetes gestacional ya descrito (Lindsay RS. Diabetes 2000;49:445-449).
Figura 12. Diabetes tipo 2 en padres según peso de nacimiento de su descendencia (grupo de indios pima).
Es difícil integrar todas estas informaciones, pero la explicación más simple del patrón descrito en los indios pima es que habría un gen que se transmite por lo menos desde el padre y que causa la resistencia a la insulina y el bajo peso de nacimiento. Estos datos apoyan la hipótesis de la insulina fetal.
Los datos que apoyan la hipótesis del origen fetal provienen de estudios en gemelos, la forma clásica de decidir si la causa de una patología es genética o ambiental. Los datos del registro danés de gemelos, en el que se estudiaron 302 pares de gemelos de 55 a 74 años de edad, se encontró un mayor número de pares discordantes (es decir, que uno de los gemelos tenía diabetes tipo 2 y el otro no) entre los dicigóticos que entre los monocigóticos. Según la hipótesis del origen fetal, el gemelo de menor peso de nacimiento debería tener mayor riesgo de diabetes tipo 2, y eso fue lo que se encontró, ya que en los pares de gemelos monocigóticos, el peso de nacimiento medio de los que tuvieron diabetes fue aproximadamente 200 gramos más bajo que el de los que no tuvieron diabetes (Vaag et al. Endocrinol Diabetes 1996; 1004(Suppl 2):182).
Cada día llega más información en apoyo de la hipótesis del origen fetal y también de la hipótesis de la insulina fetal. Finalmente, el acalorado debate acerca de si el fenómeno es genético o ambiental no tiene sentido, porque ambas hipótesis contienen elementos de verdad y no son mutuamente excluyentes.
El entorno nutricional de la madre podría actuar sobre los genes por un efecto epigenético, como lo sugiere un estudio de Wolf, que se publicó en Nature en 2004, realizado en ratones agutí, portadores de una anomalía genética que determinan su color amarillo dorado y que también le transmiten obesidad, resistencia a la insulina y diabetes cuando adultos. Este efecto se atribuye al gen agutí, que está bien caracterizado. En ese estudio, Wolf demostró que si se alimenta a las madres con una dieta rica en ácido fólico, la expresión del gen agutí se elimina completamente y las crías son normales en color, composición corporal y sensibilidad a la insulina. Se piensa que el ácido fólico de la madre tiene un efecto epigénetico sobre la expresión del gen agutí y no sólo eso, sino que también se observan efectos epigenéticos per se en las generaciones siguientes. Éste puede ser el punto de encuentro entre la hipótesis del origen fetal y la hipótesis de insulina fetal.
Se anuncia una epidemia mundial de diabetes tipo 2 en los próximos 10 a 20 años, con un aumento de 50% en su prevalencia a nivel mundial, lo que se traducirá en un incremento del número de diabéticos, desde 150 millones a más de 200 millones. Se estima que el mayor aumento ocurrirá en Asia (57%), África (50%) y América del Sur (44%), más que en los Estados Unidos, Europa y Australia (23, 24 y 33% respectivamente), a pesar de que los niveles de obesidad de las últimas tres regiones son muy inferiores. Esto se explica porque en Asia, Africa y Sudamérica existe más desnutrición materna y mayores tasas de bajo peso de nacimiento y de crecimiento fetal restringido, y además, la transición de bajo peso de nacimiento a obesidad es cada vez más frecuente en el adulto. Esta combinación es la que está disparando esta gravísima epidemia en dichas regiones (Zimmet P. Nature 2001; 414:782787).
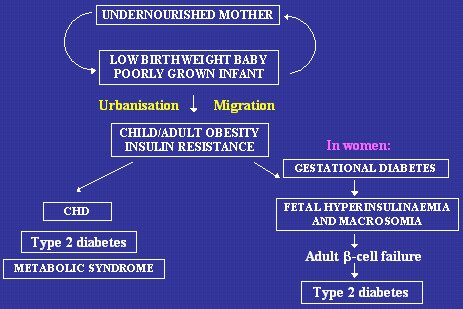
En la Figura 13 se muestra un resumen de la situación. En ella aparecen los extremos del espectro, tanto alto como bajo peso de nacimiento. En el caso de un país en desarrollo, tal vez una población rural que vive de la agricultura de subsistencia, hay un ciclo perpetuo: madre desnutrida, hijo de bajo peso de nacimiento, lactante de escaso crecimiento, madre desnutrida, ciclo que se repite una y otra vez. Esa situación se relaciona con gran número de resultados perjudiciales en la salud, pero la diabetes no es frecuente entre ellos, porque las poblaciones que se encuentran en esa situación tienden a mantenerse delgadas toda la vida y a tener niveles más altos de actividad física.
El problema surge con la urbanización y, hasta cierto punto, con la migración hacia situaciones de mayor riqueza, que se asocian a la aparición de obesidad infantil y adulta, con un trasfondo de bajo peso de nacimiento, lo que origina resistencia a la insulina, que se manifiesta en un mayor riesgo de enfermedades como cardiopatía coronaria, diabetes tipo 2 y síndrome metabólico, en la edad adulta. En las mujeres aparece una complicación más, porque la obesidad, contra un fondo de bajo peso de nacimiento, acrecienta el riesgo de diabetes gestacional, pero también causa problemas en el feto, con hiperinsulinemia y macrosomía; estos individuos también están en riesgo de enfermedad ulterior.
En ambas situaciones, la causa aparente del problema es la obesidad, tanto en la niñez como en la vida adulta, pero, desde nuestra perspectiva, el antecedente de bajo peso de nacimiento agrava el efecto de la obesidad infantil y adulta, lo que explica la situación particularmente seria de algunos países en desarrollo, que están mostrando indicios de una epidemia creciente de diabetes tipo 2.
Figura 13. Relación entre mejoría socioeconómica de las poblaciones y mayor riesgo de cardiopatía coronaria, diabetes tipo 2 y síndrome metabólico en la edad adulta.
Medwave. Año V No. 8 Septiembre 2005. Derechos Reservados.













 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIV Congreso Chileno de Nutrición, realizado en Viña del Mar entre los días 24 al 27 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Nutrición, Bromatología y Toxicología.
Presidente: MSc. Juan Ilabaca.
 Expositora:
Caroline Fall[1]
Expositora:
Caroline Fall[1]

Citación: Fall C. Birth weight and glucose/insulin metabolism. Medwave 2005 Sept;5(8):e753 doi: 10.5867/medwave.2005.08.753
Fecha de publicación: 1/9/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión