Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del IV Congreso Asociación Chilena de Nutrición Clínica, realizado en Santiago entre los días 28 al 30 de abril de 2005. El evento fue organizado por la Asociación Chilena de Nutrición Clínica.
Presidente Asociación Chilena de Nutrición Clínica: Dra. Julieta Klaassen.
Edición Científica: Dra. Eliana Reyes.
A pesar del arsenal terapéutico disponible en la actualidad, algunos pacientes fracasan, por lo que continúa la búsqueda de nuevas opciones.
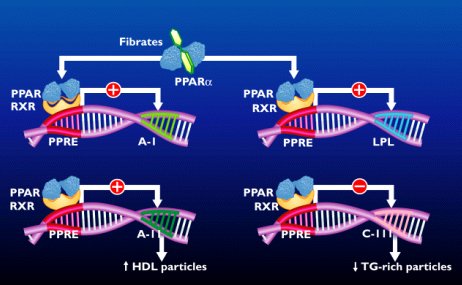
El PPAR alfa agonista conocido como fibrato, que se une a este receptor y modula respuestas genéticas relacionadas principalmente con el metabolismo de lípidos, aumenta la producción de Apo A-I; estimula la producción de la liproteinlipasa; estimula la producción de HDL; e inhibe la producción de la Apo C-III, por lo cual disminuyen los triglicéridos. Si se estimula el PPAR alfa, se provoca un impacto en los lípidos que no tienen las glitazonas convencionales; por lo tanto, se está trabajando en agonistas duales, es decir, que estimulan PPAR alfa y gamma, por lo que deberían tener un efecto significativo en los lípidos y una eventual sinergia en los efectos antidiabéticos (Figura 1).
Figura 1. PPAR alfa agonista.
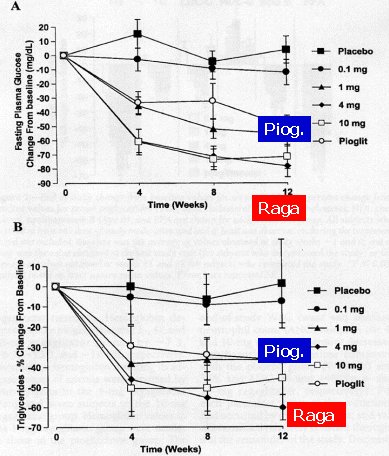
El agonista dual PPAR alfa/gamma ragaglitazar es una molécula en estudio de Novo Nordisk (Figura 2) con efecto sobre la glicemia y los triglicéridos; se compara con pioglitazona, la que, por lo general, se utiliza en los estudios porque su efecto sobre los lípidos es mayor que el de la rosiglitazona. En cuanto a glicemia de ayuno, las dosis de 4 mg y 10 mg de ragaglitazar son superiores a la dosis de 45 mg de pioglitazona; por lo tanto, es mejor para reducir la glicemia. En cuanto a los triglicéridos, las dosis de 4 mg y 10 mg fueron superiores a la pioglitazona en la reducción de triglicéridos. En otras palabras, es como dar un fibrato con una glitazona.
Figura 2. Ragaglitazar: efectos sobre glicemia y triglicéridos.
El ragaglitazar también reduce el LDL, lo que no sucede con la pioglitazona, tiene mejor efecto sobre el HDL y efecto mucho más marcado sobre los ácidos grasos libres. Por tanto, sería una droga superior, pero tiene efectos adversos. La incidencia de edema y alza de peso es similar a la de las glitazonas, luego no hay beneficio a ese nivel; se provoca anemia y leucopenia, las que pueden ser dilucionales. Algunos agonistas tendrían toxicidad hepática: nosotros trabajamos en un protocolo con una molécula que se retiró por este problema. Modelos animales con estos fármacos han presentado cáncer renal, vesical y otros. Por estos motivos, la FDA recomienda estudios humanos de sólo 6 meses, hasta que los estudios sobre el potencial neoplásico en animales completen los dos años. Si no hay inconvenientes al respecto, estaría disponible en 2007 ó 2008.
El glucagon-like peptid o GLP-1:
Este sería el fármaco ideal, pero su utilidad clínica es escasa, porque si se inyecta a un ser humano, sano o diabético, la vida media es de 5 minutos, debido a la enzima DPP-IV, que lo degrada muy pronto (J Clin Endocrinol Metab 2003;88: 220–224). Por esto, se han desarrollado otras alternativas.
Exendina-4 es un agonista aislado de la saliva del monstruo de Gila, 10 veces más potente que GLP-1; es inyectable y se administra en dos dosis diarias; puede generar anticuerpos y ya existe un equivalente sintético en el mercado, el exenatide, que ha tenido muy buenos resultados, según algunas publicaciones.
El análogo de GLP-1, liraglutida, del laboratorio Novo Nordisk, tiene 97% de homología con GLP-1 y 3% de diferencia, lo que lo hace resistente a la enzima. Cuando se inyecta liraglutida, en comparación con placebo, se causa una disminución significativa en los niveles de glicemia plasmática, durante 24 horas (Degn et al. Diabetes 2004; 53: 1187-1194).
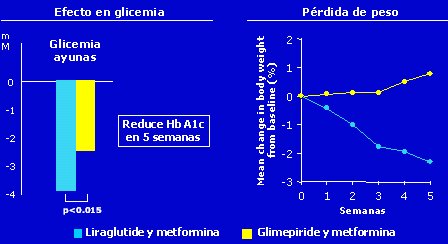
También se puede asociar con otros fármacos. Los estudios clínicos demuestran que la asociación liraglutida-metformina es mejor que la asociación glimepirida-metformina, tanto para reducir la glicemia de ayuno como para controlar el peso corporal. Según datos de un estudio doble ciego y aleatorio fase 2, que incluyó a 144 pacientes con HbA1c promedio de 9,4-9,5%, los pacientes con liraglutida y metformina bajan de peso; con la otra asociación, el peso se incrementa (Figura 3).
Figura 3. Liraglutida: estudios clínicos.
El inhibidor de DPP-IV, LAF237, del laboratorio Novartis, es la opción más reciente. Al comparar los niveles de GLP-1, del grupo de diabéticos con pioglitazona, versus el grupo con pioglitazona más el inhibidor, los niveles aumentan de manera significativa.
Estas tres opciones están en estudio en este momento y los análisis ya están en fase 3, así que, probablemente, se conocerá los resultados pronto.
En cuanto a reacciones adversas:
Pramlintide, una molécula cercana a GLP-1, es un análogo de amilina, hormona que se secreta en el páncreas junto con la insulina e inhibe la secreción de glucagón. Este análogo se diseñó para utilizarlo en combinación con la insulina, con el fin de potenciarla. En un estudio realizado en diabéticos tipo 2, al agregar pramlintide a pacientes que recibían insulina, la hemoglobina glicosilada disminuyó de manera significativa, casi 0,8%; pero causa náuseas, sobre todo en los primeros meses y algunas comunicaciones mencionan hipoglicemias graves.
La insulina oral se encuentra en un futuro más distante. Se obtiene al unir un oligopéptido con un preparado de insulina recombinante, lo que la torna resistente a la digestión enzimática y se absorbe con rapidez vía portal. Al comparar la reducción de la glicemia con la insulina oral frente a la inyección subcutánea, el resultado es muy similar, pero los niveles de insulina plasmática de la subcutánea son superiores a los de la insulina oral. Ésta tiene el mismo perfil glicémico que la insulina subcutánea corriente, pero sin inducir hiperinsulinemia periférica, lo que podría ser un beneficio (Kipnes, Dandona et al. Diab Care, 26:421-426, 2003).
Por último, es importante saber que hipoglicemiante no es sinónimo de antidiabético. Según el diccionario de la Real Academia Española:
Es importante dejar de tratar sólo la glicemia y tratar la diabetes en forma integral.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del IV Congreso Asociación Chilena de Nutrición Clínica, realizado en Santiago entre los días 28 al 30 de abril de 2005. El evento fue organizado por la Asociación Chilena de Nutrición Clínica.
Presidente Asociación Chilena de Nutrición Clínica: Dra. Julieta Klaassen.
Edición Científica: Dra. Eliana Reyes.
 Expositor:
Felipe Pollak Cornejo[1]
Expositor:
Felipe Pollak Cornejo[1]

Citación: Pollak F. Pharmacotherapy of diabetes mellitus type 2 (Part II). Medwave 2005 Nov;5(10):e711 doi: 10.5867/medwave.2005.10.711
Fecha de publicación: 1/11/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión