Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del IV Congreso Asociación Chilena de Nutrición Clínica, realizado en Santiago entre los días 28 al 30 de abril de 2005. El evento fue organizado por la Asociación Chilena de Nutrición Clínica.
Presidente Asociación Chilena de Nutrición Clínica: Dra. Julieta Klaassen.
Edición Científica: Dra. Eliana Reyes.
Actualmente se dispone de una serie de hipoglicemiantes orales o antidiabéticos (términos que no son sinónimos), que se pueden clasificar como sigue:
La capacidad hipoglicemiante de los diferentes fármacos varía (Tabla I). Los más potentes son la sulfonilurea y la metformina, que pueden reducir la glicemia de ayuno en 60 a 70 mg/dl y la hemoglobina glicosilada hasta en 2%. Las glitazonas son menos potentes; en la mayoría de los estudios se demuestra una disminución de 1% a 1,5% en la hemoglobina glicosilada. La acarbosa es la menos potente, con una reducción que no supera 1% de la hemoglobina glicosilada. Las meglitinidas disminuyen la hemoglobina glicosilada en alrededor de 1,5%, pero sólo con efecto sobre la glicemia postprandial y con un discreto efecto sobre la glicemia en ayuno.
Tabla I. Tabla comparativa de hipoglicemiantes orales (De Fronzo Ann Intern Med 1999;131:281-303).
La metformina es el fármaco más antiguo de este grupo; pero sus mecanismos de acción recién se están dilucidando. Todavía es el fármaco de primera línea en un diabético tipo 2 en quien fracasan las medidas no farmacológicas: la indicación se basa en el estudio UKPDS, en el cual se observó que en el subgrupo de los pacientes diabéticos tipo 2 con sobrepeso, tratados con metformina, los episodios cardiovasculares y la mortalidad por esta causa disminuyeron en forma significativa, en comparación con la terapia convencional. El mismo fenómeno no se produjo en los grupos tratados en forma intensiva con hipoglicemiantes.
Los efectos de la metformina explican estos resultados: disminuye la glicemia en 20% a 30%; reduce el colesterol LDL hasta en 10%; disminuye los triglicéridos hasta en 30%; reduce la insulinemia hasta en 10% y en un porcentaje similar mejora la sensibilidad insulínica; disminuye la actividad del PAI-1; mejora la fibrinolisis en 20% a 25% y puede disminuir el fibrinógeno y la reactividad plaquetaria. Por tanto, la metformina impacta en factores de riesgo cardiovascular, que son un problema imprtante en los diabéticos tipo 2, por lo que debe ser la droga que se utilice de preferencia.
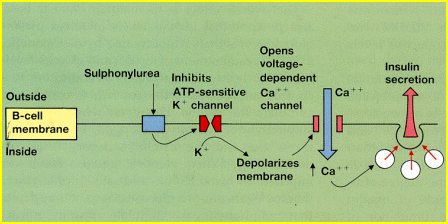
En las sulfonilureas, el mecanismo de acción está claramente identificado (Figura 1). Poseen un receptor específico en la célula beta y la unión de la sulfonilurea con ese receptor inhibe un canal de potasio; la membrana se despolariza; ingresa calcio y se estimula la secreción de insulina preformada. Sin embargo, este mismo receptor se ha descrito en los cardiomiocitos y en las células musculares lisas de los vasos sanguíneos, y la mayoría de las sulfonilureas no se unen en forma selectiva a la célula beta; por lo tanto, se piensa que las sulfonilureas reducirían el flujo coronario y prolongarían el tiempo de repolarización miocárdica en situaciones de isquemia, de modo que frente a una isquemia podrían ser proarrítmicas. En los estudios clínicos, en especial el UKPDS, no se ha corroborado esta hipótesis, pero es una posible reacción deletérea secundaria al uso de sulfonilureas.
Figura 1. Mecanismo de acción de las sulfonilureas.
Las sulfonilureas no son todas iguales (Tabla II). En resumen:
Tabla II. Tabla comparativa de sulfonilureas (Drugs 2005; 65).
La dosis terapéutica de clorpropamida es de 100 a 500 mg y se puede administrar una vez al día, aunque por lo general no se indica de esa manera. Es el hipoglicemiante oral más potente, pero determina mayor riesgo de hipoglicemia; hay casos descritos de daño hepático, pero es controvertido. El Departamento de Nutrición y Diabetes, de la Universidad Católica, realizó hace varios años un estudio con biopsias hepáticas y demostró que no había daño, pero el fármaco está en desuso debido al importante riesgo de hipoglicemia; no obstante, aún se utiliza en algunos consultorios, porque es una droga muy eficaz.
La glibenclamida se puede administrar en dosis de 2,5 mg hasta 15 ó 20 mg. Es la más eficaz y es la sulfonilurea de referencia en la mayoría de los estudios clínicos.
La dosis terapéutica de glipizida está entre 2,5 mg y 20 mg. Es menos potente que la glibenclamida, pero tiene un patrón de glicemia postprandial comparable con las metiglinidas, lo que marca una diferencia importante con la glibenclamida. Es menos potente para disminuir la glicemia de ayuno, pero es mejor para la postprandial.
La glimepirida, que se puede administrar en dosis de 1 a 6 mg, es menos potente que la glibenclamida, pero se une de manera selectiva al receptor de la célula beta pancreática, por lo que no tendría efecto proarrítmico a nivel de los cardiomiocitos y podría tener efecto cardioprotector, aunque esto último no está demostrado en trabajos clínicos con episodios
En la glicazida, la dosis terapéutica oscila entre 40 mg y 320 mg; depende de si se utiliza la forma corriente o la forma de acción retardada. La diferencia con el resto es que tendría efectos antiplaquetarios y antifibrinolíticos. Por tanto, no da lo mismo cuál sulfonilurea se indique.
Las meglitinidas también difieren entre sí. Actúan por medio de receptores específicos en la célula beta, restablecen la secreción precoz de insulina y controlan con eficacia la glicemia postprandial, pero, cuando se compara la glicemia de ayuno, hay una diferencia notoria entre la repaglinida y la nateglinida, a favor de la primera, cosa que se comprueba en la práctica diaria (Rosenstock. Diab Care, 27. Nº 6, 2004).
En cuanto a los inhibidores de la alfa glucosidasa, en un metaanálisis publicado en 2005 sobre el uso de inhibidores de la alfa glucosidasa (acarbosa, miglitol, voglibosa), en que se compara solamente monoterapia con placebo, en 41 estudios, se observó que no tienen efectos en la mortalidad; principalmente disminuyen la glicemia e insulinemia postprandial y disminuyen la hemoglobina glicosilada A1c en 0,68% a 0,77%, o sea, son poco potentes. Sobre 50 mg/dosis tienen efectos adversos fundamentalmente a nivel gastrointestinal, y no surten efecto sobre los lípidos sanguíneos. Por tanto, son fármacos que se pueden utilizar en diabéticos de tipo muy específico y tienen importancia secundaria, por lo menos hasta ahora (Floris, Lucassen et al. Diab Care, 28: 166-175, 2005).
Son los fármacos más nuevos que se encuentran en el mercado y actúan mediante terapia génica. Su mecanismo de acción está bien dilucidado; son agonistas del receptor nuclear PPAR gamma y por medio de la unión con este receptor, modulan la transcripción genética, especialmente a nivel adiposo. Así provocan una disminución significativa en los ácidos grasos y en el factor de necrosis tumoral, que son importantes mediadores de la resistencia a insulina. Además, disminuyen los triglicéridos en el tejido adiposo y producen un aumento de la adiponectina. Estos cambios desencadenan una serie de efectos:
En un estudio de Lebovitz se demostró que la rosiglitazona provoca una reducción moderada de la hemoglobina glicosilada (1,5% en 26 semanas) y una gran disminución de la insulinorresistencia; o sea, las glitazonas, más que hipoglicemiantes son insulinosensibilizantes. Calculando el HOMA, se observó un decremento de la resistencia a la insulina de 33% (Lebovitz, J Clin Endocrinol Metab 2001; 86:280-288).
La ventaja de las glitazonas, que no tienen otras drogas, es que mejoran en forma dramática la función de la célula beta, independiente de la glucotoxicidad. Antes se decía que la mejoría de la glucotoxicidad es lo que más mejora la función de la célula beta, pero el efecto de la glitazona es independiente.
Al comparar troglitazona, que fue retirada del mercado, con gliburida, se encontró que la glitazona presenta su efecto máximo a las 24 semanas; su acción es lenta porque es terapia génica, pero, una vez logrado su efecto máximo, mantiene el control metabólico hasta 94 semanas. En cambio, con gliburida o glibenclamida baja con mucha rapidez la glicemia, pero empieza a subir paulatinamente la hemoglobina glicosilada (Ghazzi. Diabetes 1997; 46:433-439).
El estudio UKPDS demostró que los hipoglicemiantes convencionales no protegen la célula beta de su deterioro progresivo. Al comparar glipizida, como mo~oterapia en pacientes bien controlados, la función de la célula beta mejoró en 5%; en cambio, al agregar rosiglitazona, mejoró en 54%. Por lo tanto este fármaco tiene una ventaja adicional muy importante en proteger la célula beta, ventaja que otros fármacos no tendrían (Rosenstock. Diabetes Metab 2003; 29:4S27-4S248, Abstract 2278 y poster).
Lo anterior podría tener aplicación importante en la prevención de la Diabetes, además de introducir cambios intensivos en el estilo de vida. En el estudio TRIPOD (TRoglitazone In the Prevention Of Diabetes), que duró alrededor de dos años, se administró troglitazona a mujeres que presentaron diabetes gestacional. Durante la realización de este estudio, la troglitazona fue retirada del mercado porque se observó que causaba daño hepático, pero al analizar los resultados se comprobó que el fármaco prevenía la diabetes en 56%, es decir, disminuía el riesgo de presentar la enfermedad en un porcentaje similar al que se debe a cambios intensivos de estilo de vida, según el estudio DPP (Diabetes Prevention Program) (Buchanan, ADA 2001).
Al analizar el estudio DPP, en el que se trató a cuatro grupos de pacientes, con placebo, metformina, troglitazona y cambios intensivos en el estilo de vida, respectivamente, se observó que la metformina previno la diabetes en 35%; los cambios del estilo de vida, en 58% y la troglitazona, que cuando se retiró había sido recibida durante una media de 0,9 años, la previno en 75%. No hubo diferencias significativas entre el grupo con cambio intensivo en el estilo de vida y el grupo con glitazona. En la incidencia acumulativa, la troglitazona resultó comparable a los cambios del estilo de vida; por lo tanto, la protección que da a la célula beta sería superior a la de otros fármacos (DPP Research Group. Diabetes 2005; 54:1150-56).
Cuando se comparó la rosiglitazona con la pioglitazona, se demostró que no son iguales y que hay una diferencia significativa en el metabolismo de lípidos. En una revisión publicada en 2004 se observó que la pioglitazona tiene mejor efecto en los niveles de LDL; en cambio, en la mayoría de los estudios, la rosiglitazona aumenta este lípido, aunque aumenta también su tamaño, por lo cual resulta menos aterogénico. El efecto sobre HDL es similar con ambos fármacos, pero la pioglitazona reduce más los triglicéridos, porque tiene un discreto efecto PPAR alfa; en consecuencia, no son iguales (Yki-Järviken. N Engl J Med, 2004;351:1106-18).
No obstante, estas diferencias no serían importantes, porque en un estudio de 2004 se observó que la rosiglitazona previene la reestenosis post stent, en pacientes con diabetes tipo 2. Se sabe que 50% de los coronarios diabéticos con stent se reestenosan, por lo que se hizo un seguimiento a estos pacientes desde el momento de implantar el stent, en que la estenosis es casi 0%. Se los separó en forma aleatoria en dos grupos: uno con tratamiento convencional y otro con rosiglitazona. A los 6 meses, 50% de los pacientes del primer grupo tenían estenosis y 20% en el grupo con rosiglitazona. Se concluyó que la rosiglitazona otorga 50% de protección frente a la reestenosis (Donghoon, Soo-Kyung et al. Diab Care, 27:2654-2660, 2004).
No hubo diferencias en el control metabólico y hubo diferencias mínimas en los triglicéridos; pero hubo dos diferencias importantes: con la rosiglitazona disminuyeron en forma importante los ácidos grasos libres, lo cual significa menos resistencia a la insulina y al final del estudio la proteína C reactiva fue significativamente menor (1,79 en el grupo control y 0,62 en el grupo con rosiglitazona). Por lo tanto, las glitazonas son antiinflamatorios potentes que pueden proteger al paciente contra la aterosclerosis, pero faltan estudios con eventos cardiovasculares.
En cuanto a las reacciones adversas, si se las cuantifica con cruces se observa lo siguiente (Joslin’s Diabetes Mellitus, 14 Ed. 2005):
Con respecto a la metformina, en un metaanálisis que acaba de aparecer se demuestra que, en ausencia de contraindicación formal, como sería daño renal, uso de medio de contraste de eliminación renal, enfermedad grave concomitante (síndrome coronario agudo, sepsis) o cirugía reciente, el riesgo de acidosis láctica con este fármaco es casi cero.
En el momento de elegir un fármaco, se debe considerar varios criterios:





 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del IV Congreso Asociación Chilena de Nutrición Clínica, realizado en Santiago entre los días 28 al 30 de abril de 2005. El evento fue organizado por la Asociación Chilena de Nutrición Clínica.
Presidente Asociación Chilena de Nutrición Clínica: Dra. Julieta Klaassen.
Edición Científica: Dra. Eliana Reyes.
 Expositor:
Felipe Pollak Cornejo[1]
Expositor:
Felipe Pollak Cornejo[1]

Citación: Pollak F. Pharmacotherapy in type 2 diabetes mellitus. Medwave 2005 Nov;5(10):e710 doi: 10.5867/medwave.2005.10.710
Fecha de publicación: 1/11/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión