 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Simposio Hiperglicemia Postprandial, Factor Emergente de Riesgo Cardiovascular en la Diabetes Tipo 2, realizado el 11 de abril de 2002. El evento fue organizado por Novartis.
Desde que se describió la hiperglicemia como factor de riesgo independiente de enfermedad cardiovascular, se empezaron a elaborar propuestas de manejo e hipótesis de trabajo, y a partir de ellas se diseñaron los correspondientes estudios prospectivos que están en curso y que, a su término, deberían entregar suficientes resultados basados en evidencias para efectuar un manejo adecuado de la hiperglicemia postprandial.
En el manejo de la diabetes tipo 1, la peor contribución en toda la historia de la insulinoterapia fue la aparición de la insulina NPH; si ésta no hubiera aparecido, muchos diabéticos estarían usando cuatro inyecciones de insulina corriente por día y estarían quizá más incómodos, pero se habrían librado de todas las complicaciones que se produjeron como consecuencia del criterio de que era mejor administrar la medicación la menor cantidad de veces posible, a pesar de que el acontecer fisiológico es totalmente inverso, pues el organismo cambia permanentemente frente a las distintas comidas.
Tanto en diabetes tipo 1 como en diabetes tipo 2, hay que tener en claro el concepto de que existe una secreción de insulina basal y periprandial, que puede estar alta o baja, pero que existe, y, si se pretende que la glicemia se mantenga lo más normal posible, habría que tratar de imitar este hecho.
En todos los países, tanto en la ciudad de Pisa como en Santiago de Chile o en distintos lugares de la Argentina, el fenotipo del paciente que utiliza las unidades de cuidados intensivos es parecido: una persona de edad mediana, con algún grado de obesidad predominantemente central, que debuta con un infarto agudo al miocardio y que muchas veces no sabe que es portador de diabetes. Dos tercios de estos pacientes fallecerán inexorablemente por enfermedad cardiovascular.
Los conocimientos actuales indican que la hiperglicemia produce una toxicidad crónica que determina la aparición y desarrollo de las complicaciones microangiopáticas. Esto lo demostraron el DCCT (Diabetes Control and Complications Trial), el Kumamoto e incluso el UKPDS (U.K. Prospective Diabetes Study), y se sabe que la lesión tisular que produce da lugar a la aparición de las clásicas complicaciones de la diabetes. Sin embargo, la hiperglicemia, probablemente en picos y mediante una toxicidad aguda, produciría la lesión que acompaña o desarrolla las enfermedades macrovasculares.
Para evitar las complicaciones, tanto micro como macrovasculares, en el diabético, es necesario manejar los dos aspectos que normalmente se presentan en la diabetes: por un lado, disminuir los niveles y mejorar de alguna manera la sensibilidad insulínica para disminuir los niveles preprandiales de glucosa, y, por otro, restaurar los picos de secreción de insulina para evitar la hiperglicemia en pico postprandial, dado que la asociación de ambas va a llevar a la aparición de las complicaciones, tanto micro como macrovasculares. Este segundo punto no se debe olvidar.
La evolución de la diabetes tipo 2 tiene dos fases y es importante conocerlas para luego estudiar lo que se debe hacer frente a cada una de ellas. Se sabe que la resistencia insulínica aparece y se desarrolla con rapidez, y permanece exactamente igual durante toda la enfermedad; en cambio, el fenotipo bioquímico de la enfermedad se manifiesta mediante hiperglicemia postprandial antes del diagnóstico clásico.
Al principio, se produce un estado de hiperinsulinismo compensatorio, pero si la célula beta está dañada va a perder, en un plazo variable, la capacidad de secretar insulina en el momento necesario, y entonces va a aparecer la hiperglicemia basal. Esto significa que, cuando se hace el diagnóstico de diabetes por hiperglicemia basal, el paciente ya tiene, probablemente,10, 12 ó 15 años de evolución de la enfermedad, como lo demostró Ferrannini extrapolando los resultados del UKPDS.
El conocimiento médico común establece que la diabetes tipo 1 aparece entre los 5 y 30 años de edad y la diabetes tipo 2, alrededor de los 50 años, pero es un error, porque esta última también aparece a los 20 ó 30 años, sólo que se diagnostica a los 50, y precisamente en ese largo tiempo se instala la enfermedad macrovascular, que es la que va a matar a este tipo de pacientes.
Por lo tanto, existe una etapa muy precoz en la que la resistencia a la insulina ya está instalada y existe un déficit en la secreción de insulina por parte de la célula beta, lo que determina la aparición de la hiperglicemia postprandial. Si este déficit sigue, aparece la hiperglicemia basal.
En la etapa dos de la diabetes tipo 2, ya está totalmente instalada la insulinopenia y existen glicemias altas, tanto basales como postprandiales, y vienen una tercera etapa y una cuarta etapa, por las que el paciente pasa en forma secuencial.
El ideal es tratar al paciente en el período de prediabetes, o etapa de la disglicemia. Los médicos de las diferentes especialidades, endocrinólogos, internistas, etc., reciben al paciente en distintos momentos y, probablemente, muchos estén acostumbrados a recibirlo en etapa tres y cuatro, cuando ya necesita un tratamiento mixto o un tratamiento insulinoterápico. El médico internista es el que tiene más oportunidad de actuar sobre la etapa precoz. Como es obvio, lo ideal sería actuar en la etapa de prevención, es decir, en prediabetes, como lo han demostrado los resultados del DPP (Diabetes Prevention Program).
Las bases del tratamiento de la diabetes son clásicamente conocidas y, dentro de ellas, la que depende del profesional es el uso de fármacos, pero antes de eso habría que recomendar el cambio de los hábitos de vida y ocuparse del manejo de la obesidad.
También se puede mejorar la sensibilidad a la insulina a nivel hepático, fundamentalmente, con las biguanidas, aunque las tiazolidinadionas también tienen este efecto, o se puede modificar la absorción de glucosa o de ácidos grasos, porque también es conocida la lipotoxicidad sobre esa masa de células, que puede ir dañándose de a poco (1). El tejido adiposo y el músculo también desempeñan un papel de control muy importante (Figura 1).
Avances en el manejo farmacológico de la diabetes tipo 2
La diabetes se puede y se debe controlar, y para ello frecuentemente es necesario utilizar complejas asociaciones farmacológicas, ya que hay terapéuticas para controlar tanto las glicemias de ayuno como las postprandiales. La idea es lograr niveles glicémicos casi normales durante todo el día, lo que va a exigir terapéuticas específicas para controlar las fluctuaciones glicémicas postprandiales.
Esta conferencia se centrará sobre la forma de simular o mimetizar los picos de secreción de insulina, lo que en teoría se podría hacer con el simple reemplazo de insulina, pues si bien no es malo utilizar insulina para tratar la diabetes, si se utiliza cuando no corresponde, en etapas en que sirven métodos mucho más simples, también puede producir daño.
Actualmente existen nuevos fármacos, derivados de la fenilalanina, que estimulan la secreción rápida de insulina y que también pueden frenarla rápidamente para evitar las consecuencias posteriores. Para comparar este tipo de fármacos con los que regularmente están en plaza, es necesario recordar que la glucosa también necesita la presencia de insulina para ingresar a la célula beta mediante los transportadores, igual que en cualquier otra célula insulino-dependiente, y luego sigue todo el ciclo de la fosforilación, la producción de ATP y el cierre del canal de potasio ATP-dependiente, lo que produce despolarización de la membrana y apertura de los canales de calcio, permite el ingreso de éste y la liberación de insulina desde los gránulos que están ya preformados en el citoplasma.
Esta dinámica se puede sintetizar en una curva que presenta un primer pico de secreción de insulina y, si el estímulo de glucosa sigue, presenta un segundo pico de secreción. Esto, que es tan simple desde el punto de vista fisiológico, está alterado en el paciente diabético, que no puede cumplir con todas estas etapas porque tiene disminuida la síntesis o la producción de insulina preformada en el citoplasma, de modo que cuando se produce el estímulo no puede responder con el primer pico de secreción de insulina, que es fundamental para que, en el momento postprandial inmediato, el hígado deje de producir glucosa y no se sumen el ingreso de glucosa por la alimentación y la producción endógena de ella.
Si es cierto que la hiperglicemia postprandial es nociva, restituir este primer pico sería el objetivo fundamental para tratar de corregirla.
Todos saben que el control de la glucosa es tremendamente estable y que la insulina se segrega con una dinámica destinada a conseguir este objetivo, de modo que se producen picos de insulina frente a cada una de las comidas y además existe una secreción de insulina basal que permite mantener los niveles glicémicos preprandiales. Todo fármaco que intente reproducir esto actúa en forma más fisiológica que la simple ingesta en la mañana de algo que produzca una secreción de insulina, pero que no siga los cánones fisiológicos.
Exagerando un poco esta situación, la secreción basal de insulina en un diabético tipo 2 está aumentada en términos absolutos, pero la secreción de respuesta está disminuida, es decir, sus picos periprandiales están truncos, de manera que existe un estado de hiperinsulinemia basal y una falta relativa de secreción de insulina frente al estímulo de las comidas; o sea, es una situación paradójica en la que el individuo dispone de gran cantidad de insulina, pero no en el momento adecuado ni con la dinámica adecuada.
Se puede pensar que esto no es tan importante, porque la mayor parte del día el individuo está en estado de ayuno, pero es exactamente lo opuesto: la cantidad de horas en ayunas son sólo cuatro a seis horas al día; el resto del tiempo corresponde a un período postprandial inmediato o postabsortivo que dura hasta que la glicemia vuelve al estado previo al de cada comida. Los momentos postprandiales tienen una relevancia mucho mayor que lo que se pensaba si se quiere controlar la glicemia basal.
En 1999 publicamos un trabajo de seguimiento de pacientes sometidos a tratamiento intensivo, en el que se vio que, a pesar de que la hemoglobina glicosilada de estos pacientes era normal, durante los siete años de tratamiento, 15%, aproximadamente, de sus glicemias estaban por encima de 160-180 mg/dL, y tenían 5%, aproximadamente, de niveles de glucosa menores de 60. O sea, la hemoglobina estaba en niveles normales, a pesar de que 20% de las glicemias estaban fuera del rango normal.
Por tanto, la hemoglobina se transforma en un excelente método para indicar que el paciente está descontrolado siempre que esté alta, pero si está normal no significa que el paciente está bien controlado. Además, habría que demostrar que tiene sus glicemias postprandiales también en valores normales y habría que discutir el objetivo o target que se buscaría.
Ejercicio
Lo primero que se le indica a un paciente diabético es dieta y actividad física. Los datos del DPP, publicados hace muy poco, demuestran claramente que un paciente con intolerancia a la glucosa sin ningún tipo de tratamiento tiene muy alto riesgo de pasar a diabetes y que la dieta y la actividad física disminuyen el riesgo casi en 60%; en cambio, con fármacos como la metformina se reduce sólo en 30% (2).
El mejor tratamiento intensivo para la intolerancia a la glucosa es salir a correr y caminar, sobre todo si se considera que la metformina tiene mejor resultado cuanto más joven y más obesa es la persona, aunque sumando las dos cosas tal vez podría haber mejor resultado.
Sin embargo, cuando se trata de una diabetes ya instalada, los resultados son un tanto frustrantes. En un metaanálisis que apareció en JAMA el año pasado, que abarcó alrededor de 14 estudios que analizaban el efecto de la dieta y la actividad física en un diabético establecido, se comprobó que estas medidas podían bajar la hemoglobina glicosilada hasta en 1%, es decir, si parte en 9% podría bajar hasta 8, pero este nivel de hemoglobina está muy por encima del nivel recomendado para prevenir enfermedad macrovascular (3).
Fármacos
Otra posibilidad teórica de tratamiento es utilizar un fármaco que actúe selectivamente en la célula beta, cuyo efecto sea de inicio rápido y que actúe solamente cuando la glucosa esté alta, no cuando esté normal, lo que significa que se debe desligar rápidamente del receptor, si la glicemia baja, para no provocar hipoglicemia.
La nateglinida apareció hace varios años, ya pasó por distintas fases de investigación y en este momento está en plena etapa de utilización. Es un derivado de la D-fenilalanina que mimetiza el primer pico de la secreción de insulina con un mecanismo similar a las sulfonilureas, es decir, actuando en su receptor cercano a los canales de potasio ATP-dependientes, pero con una característica muy importante: el tiempo de contacto que tiene con el receptor es de muy pocos segundos, a diferencia de los otros compuestos, que es de minutos. Al parecer, esa es la clave: la posibilidad de estimular y dejar de estimular rápidamente, provocar la liberación de un primer pico y evitar la hipoglicemia posterior.
La hipótesis de trabajo, con este tipo de drogas, es restaurar el primer pico de secreción en forma similar a lo que ocurre en la persona no diabética, logrando un pico casi superpuesto al de un individuo normal.
Los fármacos tradicionales no tienen buen resultado en relación a los picos de secreción de insulina y las glicemias, ya que tanto el placebo como la monoterapia con metformina o con sulfonilurea distan mucho de corregir los niveles glicémicos y ponerlos en igualdad con el individuo normal (Figura 2).
Con respecto a las glitazonas, que son fármacos diseñados para otro tipo de acción, pueden bajar un poco el pico postprandial, porque bajan todo el nivel glucémico y mejoran la sensibilidad, pero distan mucho de emular el pico postprandial de glucosa (Figura 3).
Por otra parte, los inhibidores de la alfa-glucosidasa están especialmente formulados para esto y de alguna manera dan resultado en muchos pacientes. Son los que más se acercan a un pico, pero aun así distan mucho de conseguir lo que pasa en un individuo normal (Figura 4).
Nateglinida
Una de las características importantes del uso de nateglinida es que si se mide el área bajo la curva de insulina, después de la administración, y se compara con el nivel glicémico en el momento de aquélla, se puede ver que, si no hay ingestión de comida y no hay pico hiperglicémico, el placebo produce una liberación de insulina similar a la nateglinida, lo que es tranquilizador, ya que significa que, si el paciente no está hiperglicémico, este fármaco no actúa. En cambio, cuando se produce el pico postprandial, la nateglinida libera significativamente más insulina que el placebo (4), tal como se aprecia en el gráfico correspondiente (Figura 5).
Si se compara lo que ocurre al administrar 120 mg de nateglinida tres o cuatro veces por día, se puede ver que los picos de insulina que se producen son significativamente más altos que con placebo (5).
La farmacocinética de nateglinida se caracteriza por un primer pico de secreción de insulina muy rápido, casi vertical, un tiempo de vida media de una hora y media, aproximadamente, y una concentración plasmática que no supera las cuatro horas. Un aspecto muy interesante es su estabilidad farmacocinética, gracias a la cual actúa en forma muy similar en individuos sanos, en diabéticos, en sujetos con una moderada hepatopatía e incluso nefropatía, y en distintas etnias (6, 7, 8 y 9).
Si se observa el efecto de nateglinida frente a una comida compuesta principalmente de carbohidratos, proteínas o grasa, la concentración plasmática de insulina es muy parecida. Sin embargo, aparece una diferencia muy importante si se administra antes o después de la comida: si se administra 10 a 15 minutos antes, se produce el pico de secreción y, si se toma después, se produce un pico mucho menor (10).
Frente a esto, habría que pensar qué es más cómodo para un paciente, si tomar un medicamento cada vez que va a cumplir un proceso fisiológico o tomarlo en la mañana sin pensar en estos procesos. Es un tema para discutir posteriormente.
En cuanto a las interacciones farmacológicas, nateglinida se une en forma intensa y no específica con las proteinas plasmáticas y, aunque el uso de otras drogas es muy frecuente en un paciente con diabetes tipo 2, dado que suele tener comorbilidades, la nateglinida no interactúa significativamente con la mayoría de las drogas que usan estos pacientes, entre las cuales las más comunes son furosemida, propranolol, captopril, nicardipina, pravastatina, glibenclamida, warfarina, ácido acetilsalicílico, tolbutamida y metformina.
Si se compara la potenciación de la secreción de insulina entre nateglinida y la sulfonilurea más utilizada en estos momentos, la glibenclamida, frente a placebo, se puede ver que estas drogas producen un pico mucho más elevado (11) (Figura 6).
Otra ventaja de este fármaco es que no somete al paciente al estado de hiperinsulinismo que provoca la glibenclamida, cuya consecuencia más importante es la gran incidencia de hipoglicemia, sobre todo cuando se utiliza en el estadio uno del diagrama que se propuso anteriormente. Es cierto que se debe tratar temprano al diabético, pero, si se utilizan drogas que producen un estado de hiperinsulinismo superior al necesario, probablemente se producirán hipoglicemias y secundariamente habrá un importante aumento de peso.
Comparando nateglinida con metformina, como monodrogas, mediante la evaluación de las hemoglobinas glicosiladas, durante 6 meses, se puede ver que no existen diferencias significativas en el descenso de esta hemoglobina con ambas drogas y que ambas son eficaces a medias (Figura 7). La asociación entre ambas duplica prácticamente el descenso, ya que la hemoglobina glicosilada baja en 1,6%, aproximadamente (12).
Lo mismo se observa al comparar nateglinida con troglitazona y esto es extrapolable a las otras tiazolinedionas: el efecto se duplica con el tratamiento combinado. Es probable que esto sea importante en la segunda etapa de ese primer período o en el comienzo del segundo período, en el tratamiento de la diabetes tipo 2 (13).
Al analizar el efecto de nateglinida en relación con la edad de los pacientes, se ve que no hay mayor diferencia (Figura 8), por lo que se puede utilizar tranquilamente en pacientes mayores de 65 años, que son los de mayor riesgo de hipoglicemia y en quienes el objetivo es evitarla (14).
La repaglinida es otro secretor precoz de insulina, de estructura molecular diferente, que puede caracterizarse como una sulfonilurea modificada, con efecto rápido y con un efecto residual más alto en cuanto a la concentración de insulina (15) (Figura 9).
Si se administra esta droga en una etapa temprana de la enfermedad, uno de los riesgos que presenta es la mayor incidencia de hipoglicemia que con nateglinida, lo que no quiere decir que sean fármacos antagónicos, ya que en realidad comparten el mismo espectro y la misma etapa de tratamiento, pero cada una tiene características propias y muy diferentes de las sulfonilureas tradicionales.
Con respecto al aumento de peso, se puede producir, pero es de muy pequeña monta y casi superpuesto con la metformina, menos que con tiazolinedionas y mucho menor que con glibenclamida e insulina (16).
Diferencias entre nateglinida y sulfonilureas (SU)
Uno de los elementos más considerados en cuanto al efecto de las sulfonilureas es el preacondicionamiento cardíaco y el eventual impacto que podría tener una sulfonilurea en el bloqueo de los canales de potasio a nivel miocárdico. Más allá de que este concepto sea efectivo o no, y si esto tiene real importancia en la recuperación de miocardio, lo que aparentemente es así, nateglinida tiene una afinidad trescientas veces superior con los canales de potasio y con los receptores cercanos a los canales de potasio de la célula beta que con los canales de potasio de los miocitos cardíacos, o sea, es una droga altamente selectiva de la célula beta en cuanto a su lugar de unión (Figura 10).
Con respecto a la hipoglicemia con la sulfonilurea más utilizada, que es la glibenclamida, en todos los pacientes, mayores y menores de 65 años, hay una diferencia significativa en la incidencia de este problema, y es muy parecida a la que produce la metformina (Figura 11).
Estudios en seres humanos con nagletinida
Los estudios farmacocinéticos demuestran que la droga se absorbe y se elimina con rapidez, especialmente cuando se administra antes de las comidas, y que el tiempo anterior a las comidas para la administración de la dosis es flexible, debido al mecanismo de absorción y de acción del fármaco.
La dosis de nateglinida que sugieren todos los trabajos de investigación farmacológica pertinentes es de 120 mg administrados entre uno y treinta minutos antes de cada una de las principales comidas. Si no se hace la comida, es mejor no ingerir el fármaco, pero, aunque no se siga esta recomendación, el riesgo de hipoglicemia es muy bajo.
Se han realizado más de 25 estudios clínicos en Europa y América del Norte, y los
estudios clínicos iniciales de dosis/respuesta demuestran que estimula precozmente la insulina y reduce las oscilaciones de la glucosa prandial en estudios a corto plazo y de 12 semanas.
Además, estimula la primera fase de secreción de insulina tras una prueba de tolerancia intravenosa a la glucosa, reduce la HbA1c en los diabéticos tipo 2, potencia su actividad cuando se combina con metformina, se tolera bien y tiene un buen perfil de seguridad.
Nateglinida como monoterapia
La nateglinida reduce efectivamente los niveles de HbA1c, considerado como el patrón de oro de la exposición global a los niveles glicémicos. Esta reducción se logra principalmente a través del control de las excursiones postprandiales de glucosa y es más eficaz que glibenclamida, repaglinida y metformina.
Las reducciones en la HbA1c en pacientes sin tratamiento previo con hipoglicemiantes orales, son comparables con metformina como monodroga y la nateglinida, además, es eficaz en pacientes mayores e incluso en obesos, con la ventaja de que no estimula el incremento de peso.
Nateglinida en combinación
Con respecto a la nateglinida en combinación con otras drogas, la situación hipotética de utilizar nateglinida en forma similar a una insulina de acción ultra rápida y de dar una sulfonilurea como estímulo a la secreción básica no ha dado resultados en la investigación. Rosenstock ha publicado trabajos en que se demuestra claramente que la asociación no produce ningún efecto aditivo, por lo tanto no tiene sentido utilizar sulfonilureas junto con nateglinida.
En cambio, sí se potencia con metformina y con otros sensibilizadores insulínicos, como las tiazolinedionas, con los que tiene modos de acción complementarios, el resultado es un mejor control glicémico (HbA1c, GG y GPP) que el observado con cada uno de estos agentes en monoterapia.
En cuanto a nateglinida más sensibilizadores insulínicos, se ha visto mayor reducción de la HbA1c con troglitazona que la observada con cada uno en monoterapia, y algo parecido ocurre en cuanto a la eficacia predecible con rosiglitazona y pioglitazona.
En la práctica clínica, esta droga estaría indicada:
Es importante recordar que nateglinida no se debe utilizar en combinación con sulfonilureas o luego del uso prolongado de ellas.
En resumen, la diabetes tipo 2 comienza con hiperglicemia postprandial y las glicemias elevadas, una o dos horas postsobrecarga, constituyen, en personas normales, en intolerantes y en diabéticos, un factor de riesgo independiente de enfermedad cardiovascular.
La normalización de las glicemias postprandiales constituye en este momento un objetivo terapéutico muy importante, pero no solamente al principio, sino en todas las etapas de esta enfermedad.
Extrapolando los hallazgos del UKPDS, en cuanto al riesgo de progreso de enfermedad macrovascular, se puede deducir que si todos los pacientes con glicemias postprandiales mayores de 200 mg/dL fueran tratados con éxito, el riesgo de enfermedad macrovascular bajaría en 30% y se agregaría 20% más si partieran en no más de 140 mg/dL postprandial. Habría que estudiar cuáles serían los valores normales que se esperaría conseguir en etapa postprandial.
Uno de los trabajos más grandes realizados para analizar la evidencia disponible es el estudio NAVIGATOR, basado en el HOPE, en el que se comprobó que el uso de los inhibidores de enzima convertidora bajaba en 30% el paso de la intolerancia a la glucosa a diabetes, con lo que comenzó a aparecer evidencia de un enlace entre el trastorno metabólico y la hipertensión arterial.
Una hipótesis que podría explicar esto es que, en la punta del eje angiotensina I-angitensinógeno-angiotensina II, están los receptores AT1, que son deletéreos y producen hipertensión, y todos los efectos indeseables; en cambio, los AT2 serían receptores más bien protectores de la pared vascular.
Los bloqueadores del receptor AT1 serían mucho más selectivos, pero parece que el estímulo del receptor AT1 produce insulinorresistencia en la pared vascular. Este mecanismo explicaría lo dicho, dado que hoy por hoy no es tan claro que sea el hiperinsulinismo el que produce el daño de la pared vascular sino, por el contrario, la resistencia de la pared vascular al efecto de la insulina produciría el aumento de ésta. Es probable que un estímulo exagerado del receptor AT1 sea lo que determine esa resistencia y comprometa mucho más la actividad del óxido nítrico a nivel de la pared vascular.
Lo que intenta conseguir el estudio multicéntrico NAVIGATOR, que sigue un modelo prospectivo, aleatorio y doble ciego, y que va a hacer un seguimiento de 7.500 pacientes, es evaluar el efecto de la administración de placebo-placebo, Starlix-placebo, Starlix-Diovan o placebo-Diovan en pacientes intolerantes a la glucosa.
Esto va a permitir determinar hasta qué punto la asociación puede evitar el paso a diabetes y enfermedad cardiovascular, porque estos van a ser los puntos finales. Quizá no se va a encontrar ninguna diferencia y ambos placebos van a tener los mismos resultados.
Los trabajos de este tipo van a dar las respuestas que estamos esperando. Va a ser un estudio muy interesante y hay muchos países latinoamericanos que están participando en él.

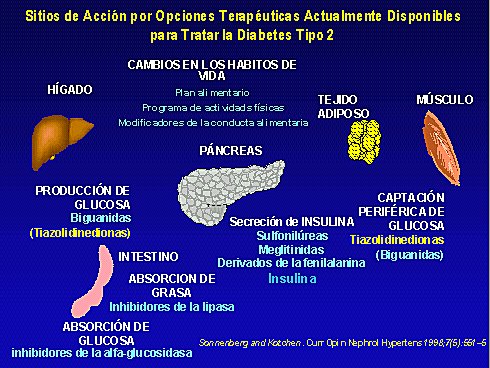 Figura 1.
Figura 1.

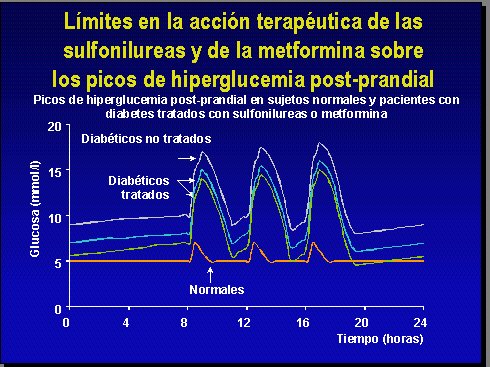 Figura 2.
Figura 2.

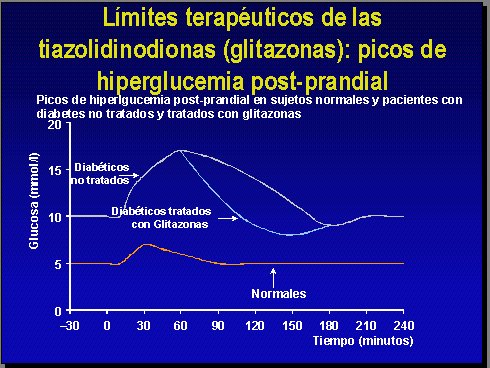 Figura 3.
Figura 3.

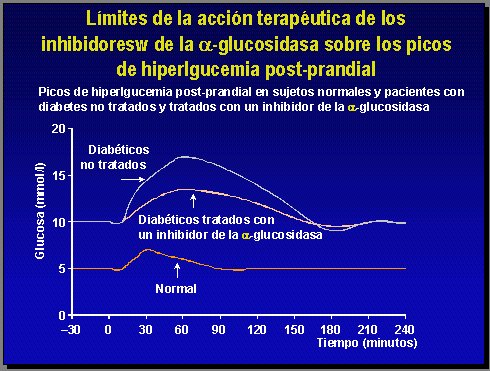 Figura 4.
Figura 4.

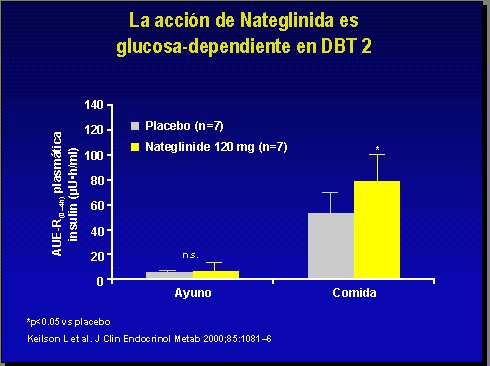 Figura 5.
Figura 5.

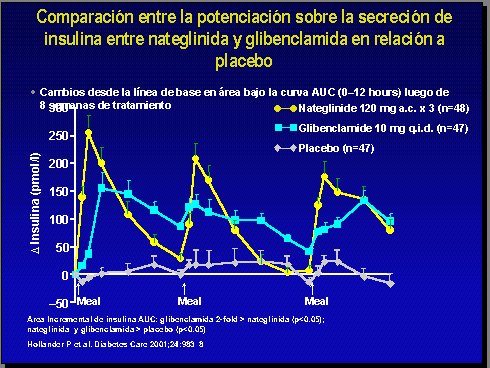 Figura 6.
Figura 6.

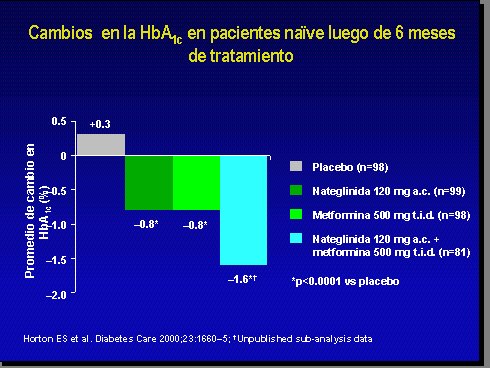 Figura 7.
Figura 7.

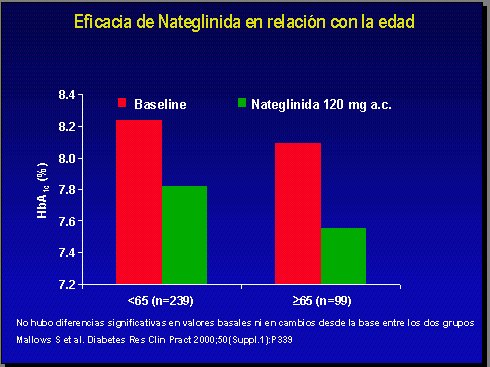 Figura 8.
Figura 8.

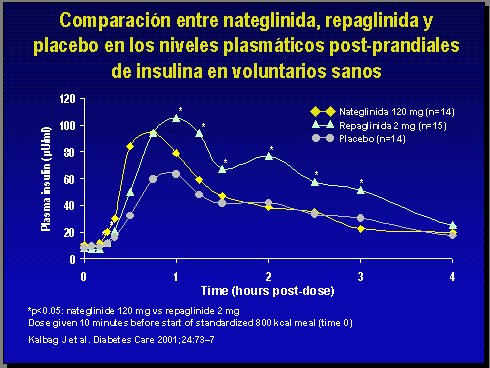 Figura 9.
Figura 9.

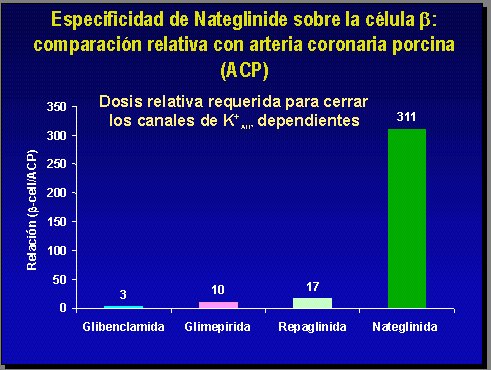

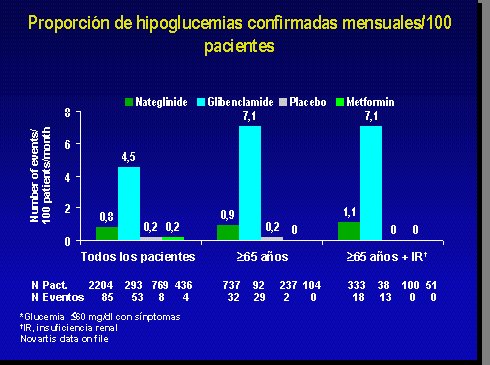 Figura 11.
Figura 11.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Simposio Hiperglicemia Postprandial, Factor Emergente de Riesgo Cardiovascular en la Diabetes Tipo 2, realizado el 11 de abril de 2002. El evento fue organizado por Novartis.
 Expositor:
León Litwak[1]
Expositor:
León Litwak[1]

Citación: Litwak L. Postprandial hyperglycemia, an emerging cardiovascular risk factor in type 2 diabetes. Medwave 2002 Jun;2(5):e601 doi: 10.5867/medwave.2002.05.601
Fecha de publicación: 1/6/2002

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Sonnenberg GE, Kotchen TA. New therapeutic approaches to reversing insulin resistance. Curr Opin Nephrol Hypertens. 1998 Sep;7(5):551-5. | CrossRef | PubMed |
Sonnenberg GE, Kotchen TA. New therapeutic approaches to reversing insulin resistance. Curr Opin Nephrol Hypertens. 1998 Sep;7(5):551-5. | CrossRef | PubMed | Boulé NG, Haddad E, Kenny GP, Wells GA, Sigal RJ. Effects of Exercise on Glycemic Control and Body Mass in Type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA. 2001 Sep 12;286(10):1218-27.
| CrossRef |
Boulé NG, Haddad E, Kenny GP, Wells GA, Sigal RJ. Effects of Exercise on Glycemic Control and Body Mass in Type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA. 2001 Sep 12;286(10):1218-27.
| CrossRef | Keilson L, Mather S, Walter YH, Subramanian S, McLeod JF. Synergistic effects of nateglinide and meal administration on insulin secretion in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2000 Mar;85(3):1081-6. | CrossRef |
Keilson L, Mather S, Walter YH, Subramanian S, McLeod JF. Synergistic effects of nateglinide and meal administration on insulin secretion in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2000 Mar;85(3):1081-6. | CrossRef | Walter YH, Spratt DI, Garreffa S, McLeod JF. Mealtime glucose regulation by nateglinide in type-2 diabetes mellitus. Eur J Clin Pharmacol. 2000 May;56(2):129-33. | CrossRef | PubMed |
Walter YH, Spratt DI, Garreffa S, McLeod JF. Mealtime glucose regulation by nateglinide in type-2 diabetes mellitus. Eur J Clin Pharmacol. 2000 May;56(2):129-33. | CrossRef | PubMed | Karara AH, Dunning BE, McLeod JF The effect of food on the oral bioavailability and the pharmacodynamic actions of the insulinotropic agent nateglinide in healthy subjects J Clin Pharmacol. 1999 Feb;39(2):172-9. | CrossRef | PubMed |
Karara AH, Dunning BE, McLeod JF The effect of food on the oral bioavailability and the pharmacodynamic actions of the insulinotropic agent nateglinide in healthy subjects J Clin Pharmacol. 1999 Feb;39(2):172-9. | CrossRef | PubMed | Weaver ML, Orwig BA, Rodriguez LC, Graham ED, Chin JA, Shapiro MJ, Pharmacokinetics and metabolism of nateglinide in humans. Drug Metab Dispos. 2001 Apr;29(4 Pt 1):415-21. | PubMed |
Weaver ML, Orwig BA, Rodriguez LC, Graham ED, Chin JA, Shapiro MJ, Pharmacokinetics and metabolism of nateglinide in humans. Drug Metab Dispos. 2001 Apr;29(4 Pt 1):415-21. | PubMed | Keilson L, Mather S, Walter YH, Subramanian S, McLeod JF. et al. Synergistic effects of nateglinide and meal administration on insulin secretion in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2000 Mar;85(3):1081-6. | CrossRef |
Keilson L, Mather S, Walter YH, Subramanian S, McLeod JF. et al. Synergistic effects of nateglinide and meal administration on insulin secretion in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2000 Mar;85(3):1081-6. | CrossRef | Choudhury S, Hirschberg Y, Filipek R, Lasseter K, McLeod JF Single-dose pharmacokinetics of nateglinide in subjects with hepatic cirrhosis. J Clin Pharmacol. 2000 Jun;40(6):634-40. | CrossRef | PubMed |
Choudhury S, Hirschberg Y, Filipek R, Lasseter K, McLeod JF Single-dose pharmacokinetics of nateglinide in subjects with hepatic cirrhosis. J Clin Pharmacol. 2000 Jun;40(6):634-40. | CrossRef | PubMed | Luzio SD, Anderson DM, Owens DR. Effects of timing of administration and meal composition on the pharmacokinetic and pharmacodynamic characteristics of the short-acting oral hypoglycemic agent nateglinide in healthy subjects J Clin Endocrinol Metab. 2001 Oct;86(10):4874-80.
| CrossRef |
Luzio SD, Anderson DM, Owens DR. Effects of timing of administration and meal composition on the pharmacokinetic and pharmacodynamic characteristics of the short-acting oral hypoglycemic agent nateglinide in healthy subjects J Clin Endocrinol Metab. 2001 Oct;86(10):4874-80.
| CrossRef | Hollander PA, Schwartz SL, Gatlin MR, Haas SJ, Zheng H, Foley JE, et al. Importance of early insulin secretion: comparison of nateglinide and glyburide in previously diet-treated patients with type 2 diabetes. Diabetes Care. 2001 Jun;24(6):983-8. | CrossRef | PubMed |
Hollander PA, Schwartz SL, Gatlin MR, Haas SJ, Zheng H, Foley JE, et al. Importance of early insulin secretion: comparison of nateglinide and glyburide in previously diet-treated patients with type 2 diabetes. Diabetes Care. 2001 Jun;24(6):983-8. | CrossRef | PubMed | Horton ES, Clinkingbeard C, Gatlin M, Foley J, Mallows S, Shen S. Nateglinide alone and in combination with metformin improves glycemic control by reducing mealtime glucose levels in type 2 diabetes. Diabetes Care. 2000 Nov;23(11):1660-5.
| CrossRef | PubMed |
Horton ES, Clinkingbeard C, Gatlin M, Foley J, Mallows S, Shen S. Nateglinide alone and in combination with metformin improves glycemic control by reducing mealtime glucose levels in type 2 diabetes. Diabetes Care. 2000 Nov;23(11):1660-5.
| CrossRef | PubMed |