Resumen
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del II Congreso Chileno de Medicina Nuclear, realizado en Viña del Mar entre los días 6 al 11 de noviembre de 2006. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Presidente de la Sociedad: Dr. Juan Carlos Quintana Fresno.
Presidente Comité Científico: Dra . Teresa Masssardo Vega.
Definición y objetivos
La medicina nuclear consiste en la administración sistémica de un radionúclido dirigido, con emisión beta o de electrones, de corto alcance y con un objetivo terapéutico clínicamente relevante, a un paciente con un tumor maligno primario o secundario (1).
Los requisitos que debe cumplir una terapia con radionúclidos son los siguientes: debe ser efectiva en el contexto clínico; idealmente se debe administrar en forma ambulatoria; debe tener toxicidad mínima, sobre todo hematológica y escasos efectos secundarios; debe ser asociable y no excluyente frente a terapias concurrentes. Los objetivos son distintos si se trata de una enfermedad avanzada, en la que se va a aplicar sólo con fines paliativos, o si se trata de una enfermedad limitada en la que se persigue obtener una reducción del volumen y actividad tumorales o, incluso, la remisión completa. Cuando se trata a título paliativo una enfermedad avanzada, que es lo más común, se intenta obtener control sintomático, mejorar la calidad de vida, reducir necesidades de analgesia y estabilizar la enfermedad.
Mecanismo de acción de los radionúclidos
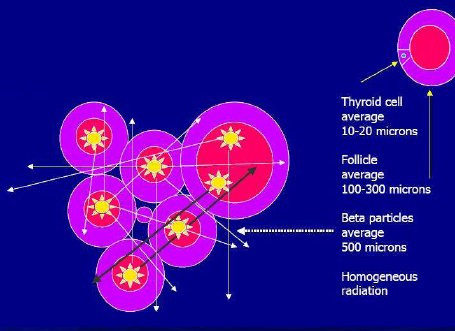
Tomando como ejemplo la emisión beta del yodo 131, se debe tener presente, en el caso de este radionúclido en particular, que una célula tiroidea promedio tiene 10 a 20 micrones de diámetro; que los folículos son acúmulos celulares funcionales del tiroides, con un diámetro promedio de 100 a 300 micrones; y que el rango promedio de una radiación beta con yodo 131 tiene alrededor de 500 micrones, por lo que cada célula tiroidea queda sometida a un campo radiante homogéneo. Los mecanismos que actúan en la destrucción celular por radionúclidos se basan en la necrosis celular directa y en la inducción de mecanismos de apoptosis, a través de causar daño irreversible, acelerar la senescencia, diferenciar las líneas celulares más viables y someter las células a dos tipos de radiación. Uno de ellos es el fuego cruzado: al llegar el radionúclido por vía hemática, se irradian las células desde distintos puntos; el otro tipo es la radiación por célula espectadora, que ocurre cuando la célula está secundariamente dispuesta en el camino de la radiación (Fig. 1).
Figura 1. Mecanismo de acción de los radionúclidos
Hoy se cuenta con emisores de radiación beta de distintas características, en cuanto a su vida media, energía, en kilo-electrón voltios (kVe), rangos de penetración, en milímetros y otros parámetros importantes en la planificación de una terapia. Entre los diferentes radionúclidos conocidos destacan lutecio 177, yodo 131 e itrio 90, que son actualmente los que más se usan. La penetración tisular es muy importante para elegir un radionúclido respecto del volumen y masa tumorales. En cuanto a los emisores alfa, destacan entre sus características la vida media corta y la intensidad de energía relativamente alta, que permite una terapia muy dirigida e intensa, con pocos efectos secundarios. La mayor parte de estos radionúclidos recién están en desarrollo y todavía no se usan en el ámbito clínico amplio (2).
En el futuro se utilizarán radionúclidos emisores de electrones Auger, entre los cuales el yodo 125 y el yodo123 tendrán aplicación, probablemente, en el tratamiento del cáncer de tiroides. Estos radionúclidos emisores de electrones son de penetración corta y alta tasa de entrega de energía, por lo que son ideales para tratar tumores pequeños.
Clasificación de los radionúclidos con aplicaciones terapéuticas
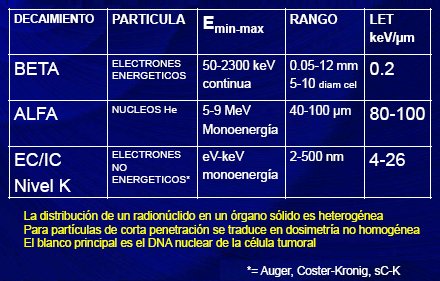
Si se dividen por su decaimiento, se pueden separar en radionúclidos de emisión beta, de emisión alfa y de emisión de electrones de conversión isomérica o conversión interna. Los electrones, el alcance de penetración y la tasa de entrega de energía (LET) son muy variables; se ha observado, por ejemplo, que en los emisores alfa el LET es más alto y el alcance de penetración es corto, por lo que serían ideales como emisores de electrones Auger. Se sabe que la distribución de un radionúclido en un órgano sólido es heterogénea, que es función de la vascularización y que en los tumores hay áreas hipóxicas o de escasa vascularización, a las cuales la llegada del radionúclido es difícil. Se estima que al utilizar partículas de penetración corta, la dosimetría tumoral, a pesar de no ser homogénea, será muy alta y por lo tanto destruirá la célula, al dañar irreversiblemente su DNA (3) (Tabla I).
Tabla I. Radionúclidos con uso terapéutico (3)
Cuando se utilizan estos radionúclidos en forma sistémica, si bien el blanco principal es la cadena de DNA, se origina irradiación general, por lo que la toxicidad de la médula ósea es el factor limitante actual de la terapia. Es probable que el segundo órgano afectado sea el riñón, por sus mecanismos de eliminación. En consecuencia, se requieren cálculos dosimétricos relativamente complejos e individuales para derivar la máxima dosis permisible en un paciente determinado, teniendo presente tres grandes aspectos: la radiosensibilidad del tumor, la tasa de proliferación y la dosis absorbida, que se puede calcular (4). Todavía la terapia se encuentra dando sus primeros pasos y la obtención de fórmulas de cálculo adecuadas es un aspecto importante para que esta terapia se vuelva más común en la práctica clínica.
Terapia del dolor óseo neoplásico
La paliación del dolor óseo es un objetivo importante en el manejo clínico de pacientes con cáncer. El cáncer de mama y el de próstata tienen la mayor incidencia de metástasis óseas: casi 75% de los pacientes tendrán metástasis óseas en algún punto de su evolución clínica; les siguen el cáncer pulmonar, el de tiroides y el carcinoma de células renales. El dolor óseo refractario, la compresión neural, la mielosupresión, las fracturas y la hipercalcemia son las complicaciones más frecuentes de las metástasis óseas; los sitios más comúnmente afectados son el esqueleto axial (en 70% de los casos), la pelvis (40%) y el fémur proximal (25%).
El enfoque del dolor óseo oncológico es multiprofesional y exige la participación de oncólogos, traumatólogos, médicos nucleares, unidades de control del dolor y psicólogos. Al mismo tiempo, se dispone de múltiples armas para la terapia de este dolor, entre ellas la analgesia, radioterapia, quimioterapia, cirugía, los fosfonatos y radionúclidos. El objetivo primario es disminuir el dolor y mejorar la calidad de vida de los pacientes (5, 6).
Sobre los principales radionúclidos que se utilizan en la terapia del dolor óseo:
- En la década de 1940 se utilizó ortofosfato sódico de fósforo 32, que se caracteriza por: vida media, 14,3 días; energía, 1,71 milielectronvoltios (MeV); penetración, 8 mm; administración, 3 a 12 milicuries (mCi), con un máximo de 20, por vía endovenosa u oral; alta irradiación medular y significativa respuesta clínica, pero con nivel elevado de efectos secundarios.
- En la década de 1950 se desarrolló el cloruro de estroncio 89, con vida media de 50,5 días; energía beta de 1.46 MeV; 6 mm de penetración; dosis de 10 a 30 mCi/kg, con promedio de 4 mCi, por vía endovenosa; mielosupresión importante, aunque menor que la que se obtenía con fósforo 32; y 70% de respuesta en 3 a 6 meses.
- En la actualidad se encuentra en uso el etidronato de renio 186, que se caracteriza por: vida media corta, de 3,8 días; energía beta de 1,07 MeV; penetración de 5 mm; dosis endovenosa de 30 a 35 mCi; 80% de respuesta y baja toxicidad medular. Es útil y presenta mejor respuesta clínica que sus antecesores (7, 8).
Las características ideales de un radioisótopo que se aplique para la paliación del dolor óseo son las siguientes: cinética selectiva para metástasis osteoblásticas; rápida depuración de sangre y tejidos no blancos, para reducir los efectos secundarios; producción accesible y estable, de bajo costo; disponibilidad según demanda; vida media física mayor que su vida media biológica; energía beta entre 0,8 y 2,0 MeV, ideal para el efecto terapéutico; rango de penetración tisular inferior a 10 mm (entre 2-8 mm); energía gamma útil para obtención de imágenes de control en gammacámara; y cinética similar a la de los fosfonatos marcados con tecnecio 99, para que sea trazable.
El samario EDTMP (Etilen Diamino Tetra Metilen Fosfónico) cumple con estos requisitos del radioisótopo ideal: tiene energía beta de 640, 710 y 810 keV; energía gamma de 103 keV, que facilita sus imágenes con gammacámara estándar; vida media corta, de 46 horas y penetración de 3,0 mm. El protocolo de terapia consiste en efectuar un cintigrama óseo con Tc99m-MDP previo, para la localización de metástasis óseas, y administración parenteral de 1,0 a 2,5 mCi/kg, endovenosa, lenta. El samario (Sm153) EDTMP se une a la hidroxiapatita por quemisorción e hidrólisis; tiene baja toxicidad medular, la que se observa en su efecto máximo al mes de la administración; se requiere reserva hematopoyética; se presenta un efecto paradójico inicial en casi 10% de los pacientes, en quienes el dolor se acentúa; y se puede administrar múltiples dosis. En el estudio multicéntrico OIEA, que abarcó a 417 pacientes, se obtuvo una tasa de respuesta de 62% a 83%, evidenciada por disminución del dolor, mejoría del estado clínico y menor necesidad y uso de analgesia. Este trabajo fue publicado en 2003 por Olea y colaboradores (8).
Clasificación del estado clínico del paciente
Hay dos formas de clasificar el estado clínico del paciente. La primera y más usada es la que propone el ECOG (
Eastern Cooperative Oncology Group), conocida como
ECOG performance status, en la que se clasifica al paciente de cero a cinco (9):
- 0 = totalmente activo, sin restricciones, mismas actividades pre-enfermedad;
- 1 = actividad física extrema restringida, ambulatorio y capaz de actividad liviana;
- 2 = ambulatorio, capaz de autocuidado, en pie más de 50% de horas diurnas pero incapaz de trabajar;
- 3 = autocuidado limitado, confinado a cama o silla más de 50% de horas diurnas;
- 4 = totalmente incapacitado, incapaz de autocuidado,100% del tiempo en cama o silla;
- 5 = muerto.
La segunda corresponde a la escala porcentual de Karnofsky-Burchenal, (10) que es más antigua:
- 100% normal
- 90% síntomas menores
- 80% actividad normal con algún esfuerzo
- 70% incapaz de actividad normal. Capaz de autocuidado
- 60% requiere ayuda ocasional con autocuidado
- 50% incapacitado
- 40% requiere considerable asistencia con autocuidado
- 30% severamente incapacitado, hospitalizado
- 20% muy enfermo, requiere soporte activo
- 10% moribundo
- 0% muerto
Terapia paliativa del dolor óseo con radioisótopos
Las
indicaciones de terapia paliativa del dolor óseo están dadas por la presencia de dolor óseo recurrente refractario a terapia habitual, o en el que esté aumentada la necesidad de analgesia. El dolor debe provenir de metástasis óseas osteoblásticas, en general multifocales o que ya no se presten a terapia con radiación externa, y el paciente debe presentar una evidente falta de respuesta a las terapias convencionales.
Las
precauciones que se deben tomar antes de iniciar la terapia con radionúclidos en dolor óseo son las siguientes: evaluar la reserva medular, teniendo presente que toda terapia previa con efecto mielotóxico se debe separar de los radionúcleos al menos por dos meses; hemograma con recuento de plaquetas sobre 100.000, recuento de neutrófilos sobre 2000 y valor de hemoglobina sobre 10 g/dl; el paciente debe tener reserva funcional hepática y renal, con
clearance de creatinina mayor de 30 ml/min; sobrevida previsible de al menos 2 meses; dolor causado por lesiones osteoblásticas y fracaso previo de las terapias convencionales. Además, se debe contar con la autorización del paciente, quien debe comprender que se trata de una terapia de carácter paliativo. Los pacientes que presentan incontinencia u obstrucción urinaria se deben manejar con las precauciones correspondientes.
Las
contraindicaciones son: estado clínico muy bajo, ya sea por
ECOG performance status o por Karnofsky; ausencia de reserva hematológica; presencia de embarazo; insuficiencia renal; compresión medular; fractura patológica; recuento de glóbulos blancos menor de 2500; recuento de plaquetas menor de 60.000; coagulación intravascular diseminada; metástasis extensas en tejidos blandos y quimioterapia mielotóxica simultánea o posterior.
La
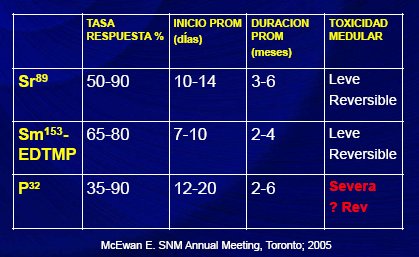
dosimetría debe considerar que, tanto para el estroncio 89 como el samario 153, la superficie ósea es el órgano crítico. La dosimetría del estroncio es más elevada que la del samario, por cuya razón está fuera del uso clínico actual (11). Al comparar samario con estroncio y fósforo 32, se observa que la tasa de respuesta e inicio del efecto es muy similar, la duración del samario es un poco más corta, su efecto se mantiene durante dos a cuatro meses y la toxicidad medular es relativamente leve y reversible (12) (Tabla II).
Tabla II. Comparación de radionúclidos utilizados en la terapia del dolor óseo (12)
Las terapias con radionúclidos se utilizan poco en clínica por diversos motivos: en parte, porque en el último tiempo ha habido un desarrollo importante de unidades del dolor en hospitales y clínicas, lo que permite una estrategia muy efectiva de escalada en el manejo del dolor óseo y ha sido poco necesario recurrir a estas terapias. También hay que destacar que a los pacientes generalmente se les refiere cuando su enfermedad está muy avanzada y presentan una gran masa tumoral activa, lo que determina que las probabilidades de éxito o control sean muy bajas. A pesar de esto, la terapia con radionúclidos es una alternativa que es preciso tener presente y debe estar disponible cuando los médicos clínicos la soliciten.
Terapia y medicina nuclear
- Las terapias con radionúclidos, junto con las técnicas de imagen con positrones, constituyen el futuro de la especialidad de medicina nuclear.
- Se debe aprender a trabajar con emisores beta, alfa y de electrones.
- Hay que integrarse a los equipos de atención oncológica.
- El especialista en medicina nuclear debe salir del laboratorio e integrarse a la atención de los pacientes.
- Debe ser capaz de asumir el manejo clínico del paciente y contribuir a este manejo con su conocimiento y experiencia en medicina nuclear.
Referencias
- Neagley Fl. Radionuclide therapy of the past. SNM Annual Meeting handouts, Toronto 2005.
- Mulford DA, Scheinberg DA, Jurcic JG. The promise of targeted alpha-particle therapy. J Nucl Med 2005; 46: 199S-204S.
- Kassis AI, Adelstein SJ. Radiobiologic principles in radionuclide therapy. J Nucl Med 2005; 46: 4S-12S.
- Sgouros G. Dosimetry of internal emitters. J Nucl Med 2005; 46: 18S-27S.
- Hamdy NA, Papapoulos SE. The palliative management of skeletal metastases in prostate cancer: use of bone-seeking radionuclides and biphosphonates. Semin Nuc Med 2001; 31: 62-68.
- Coronado M, Redondo A, Coya J et al.Clinical role of Sm-153 EDTMP in the treatment of painful bone metastatic disease. Clin Nucl Med 2006; 31: 605-610.
- Tian JH, Zhang JM, Hou QT et al. Multicentre trial on the efficacy and toxicity of single-dose samarium-153-ethylene diamine tetrametylene phophonate as a palliative treatment for painful skeletal metastases in China. Eur J Nucl Med 1999; 26:2-7.
- Olea E et al en: Medicina Nuclear: Aplicaciones clínicas, Masson, Barcelona, 2003.
- Oken MM, Creech RH, Tormey DC et al. Toxicity and response Criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-55.
- Karnofsky D, Abelmann W, Craver L, Burchenal J. The use of nitrogen mustard in the palliative treatment of cancer. Cancer. 1948;1:634–656.
- Silverstein EB et al. SNM: Procedure guideline manual 2001-2002; 112: For bone pain treatment 2.
- McEwan AJB. Current practice in bone pain palliation with radioisotopic therapy . SNM Annual Meeting handouts, Toronto; 2005.
- Dillehay Gl. The future of radionuclide therapy 2005. SNM Annual Meeting handouts, Toronto; 2005




Esta
obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.






 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
José Canessa[1]
Expositor:
José Canessa[1]

