 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de la conferencia que se dictó en el Congreso Chileno de Climaterio, realizado en Viña del Mar los días 26 y 27 de Junio de 2009. El congreso fue organizado por la Sociedad Chilena de Climaterio bajo la presidencia del Dr. Juan Enrique Blümel.
La terapia hormonal con gestágenos y tibolona se utiliza menos en la actualidad que hace diez años, a pesar de que hoy se sabe mucho más sobre su seguridad. Esto se debe principalmente a la mala comunicación que existe entre los médicos y entre éstos y sus pacientes, tanto a nivel global como a nivel de cada médico en particular.
Los gestágenos son necesarios porque: tienen el papel importante de mantener el embarazo; son antiestrogénicos en el endometrio, disminuyen las contracciones y la ansiedad; son anti mineralocorticoides, por lo tanto previenen la retención de agua y sodio; y son antiandrogénicos.
Los gestágenos tienen los siguientes usos:
Los progestágenos tienen cuatro acciones fundamentales sobre el endometrio: lo transforman a la fase secretora; lo preparan para la nidación; reducen la actividad mitótica; y reducen la cantidad de estroma, de lo contrario habría muchas hemorragias e hipermenorreas. Lo descrito constituye las bases fisiológicas del uso de gestágenos.
Los estudios más controvertidos son el Million Women Study (MWS) y el Women's Health Initiative (WHI). En el primero, que como su nombre lo indica se incluyó a un millón de mujeres, se encontró que las mujeres que recibieron terapia continua con gestágenos tuvieron menos carcinoma de endometrio que el grupo placebo y las que los utilizaron en forma secuencial tuvieron mucho menos que las que sólo recibieron estrógenos (Fig. 1).
El paradigma clínico de los gestágenos surgió después de la publicación de los resultados del estudio WHI. En la Tabla I se resume los resultados de este estudio, que indica que la incidencia de cáncer de mama por grupos de edad es mayor con el uso de terapia hormonal sustitutiva, es decir estrógenos con gestágenos, aunque el aumento es pequeño.
Tabla I. Resultados del cáncer de mama (porcentaje anual) pesquisado por grupos de edad (WHI).
En la siguiente imagen se muestra el gráfico en que surgió el paradigma: los datos de la rama sólo de estrógenos mostraron menor incidencia de cáncer de mama, lo que implicaba como culpable directo al gestágeno, ya que con estrógenos solos la incidencia fue menor; luego, era necesario aclarar si el problema era el gestágeno en general o el gestágeno que se utilizó en el estudio WHI, el acetato de medroxiprogesterona (Fig. 2).
Figura 2. Análisis de sensibilidad para cáncer de mama invasivo.
En la siguiente imagen se observa la clasificación actual de los progestágenos, que se ha desarrollado en la búsqueda del compuesto con menor riesgo y mejor nivel de protección del endometrio (Fig. 3).
Figura 3. Clasificación de los progestágenos.
Todos los gestágenos tienen una potencia diferente; si se asigna a la progesterona el valor 1, las potencias varían entre 50 y 1000 unidades, según la dosis (Fig. 4).
Figura 4. Potencia de distintos progestágenos.
Asimismo, cada gestágeno tiene un efecto metabólico diferente dependiendo de la acción sobre otros receptores esteroideos, lo que explica que durante mucho tiempo se haya tenido que especificar qué gestágeno es, qué dosis, qué potencia tiene y cómo actúa, ya que todos son diferentes (Fig. 5).
Figura 5. Efecto antiandrogénico de distintos progestágenos.
En la actualidad se está analizando las estructuras de los gestágenos para entender el mecanismo de acción molecular de la progesterona; asimismo se están investigando los diversos receptores sobre los cuales actúan los gestágenos, para entender el efecto específico de cada uno de ellos (Tabla II).
Tabla II. Efectos en los receptores de distintos derivados de la progestrona.
Las nuevas sustancias tienen un efecto predominante; entre ellas están drospirenona (DRSP), antimineralocorticoide; dienogest (DNG), potente antiandrogénico; nestorona, (NES) potente anovulatorio y trimegestona (TMG), muy progestacional. Ninguna es androgénica ni estrogénica. Esto quiere decir que existe una amplia gama de posibilidades de elección. El problema es que en el estudio WHI sólo se utilizó acetato de medroxiprogesterona, por lo que se desconoce cuál es el mejor; sólo se sabe que el compuesto no debe ser androgénico ni estrogénico y que se debe determinar el beneficio práctico de cada uno de ellos; por ejemplo, la DRSP reduce la presión arterial por su efecto antimineralocorticoide (Fig. 6).
Otro aspecto fundamental de los gestágenos es el análisis de sus efectos hemostáticos y metabólicos, que hasta ahora no se conocen completamente ya que cada uno es completamente diferente de los otros. En el siguiente gráfico se muestra que el acetato de medroxiprogesterona reduce la incidencia de diabetes (Fig. 7). Esto constituye un beneficio adicional, abriendo un interesante campo de búsqueda de gestágenos de mayor poder de protección endometrial y menor riesgo de cáncer de mama (1).
En el estudio CDC sobre el efecto de gestágenos como acetrato de ciprotrerona (CPA) y acetato de medroxiprogesterona (MPA) se encontró que éste baja en forma muy agresiva el colesterol HDL, lo que implica una influencia negativa sobre el riesgo cardiovascular, mientras que el CPA no tiene este efecto (2). (Tabla III).
Tabla III. Estudio CDC sobre lipoproteínas
Existen dos conceptos importantes. Por un lado, se sabe que el uso de gestágenos transdérmicos no aumenta el riesgo de trombosis venosa (3) y, por otro, que dosis bajas mejoran el perfil de seguridad (4).
La tibolona es una molécula sintética diferente que elimina los síntomas de la menopausia, mejora el humor y la sexualidad, tiene baja incidencia de tensión mamaria, posee efecto cardiovascular neutral, no produce proliferación endometrial, mejora la atrofia vaginal y previene la osteoporosis postmenopáusica. Cuando se metaboliza se divide en tres: 3 alfa OH tibolona, 3 beta OH tibolona y el isómero delta 4, los cuales se unen a los receptores de estrógenos, progesterona y andrógenos. Se sabe poco de su mecanismo de acción, pero desde que apareció el raloxifeno se ha ido ampliando el conocimiento sobre este aspecto (5).
En el año 2005 Kenemans, a la cabeza del Grupo Internacional para el Consenso de Tibolona, publicó en Maturitas las recomendaciones clínicas y guías prácticas de este grupo de expertos, con base en lo que sabía hasta ese momento (6).
En el estudio THEBES (Tibolone Histology of Endometrium and Breast Endpoints Study), el objetivo fue confirmar la seguridad endometrial de esta hormona en 3240 mujeres; se encontró que la tibolona no induce hiperplasia ni carcinoma endometrial, por lo tanto, cumple su propósito de seguridad endometrial (7).
El objetivo del estudio TOTAL (TOlerabilit Trial Comparing Activelle with Livial) fue comparar la eficacia en cuanto a reducción de sangrados (spotting) y la tolerabilidad de la tibolona en comparación con la combinación de mayor uso en Europa, estradiol más NETA (E2/NETA), en 572 mujeres; este estudio demostró que tibolona es tan efectiva como E2/NETA, pero produce menos sangrados y tensión mamaria, por lo tanto también se cumple el objetivo (8).
En el estudio LIFT (Long Term Intervention on Fractures with Tibolone), un estudio de intervención en el que se evaluó a 4538 mujeres con la hipótesis de que la tibolona reduce el número de fracturas vertebrales, se administró esta hormona en dosis de 1,25 mg y se logró una reducción de 45% de las fracturas vertebrales y de 26% de las fracturas no vertebrales en comparación con placebo, además de una reducción del riesgo de cáncer de mama y colon; sin embargo la tibolona podría aumentar el riesgo de stroke o ictus, aunque esto es motivo de controversia (9). Esto sitúa a la tibolona como la terapia hormonal sustitutiva en mujeres menores de 60 a 65 años, en las cuales el riesgo de trombosis es bajo.
El estudio STEP (Study of Tibolone's Effects on osteoPenia) comparó los efectos de tibolona y raloxifeno sobre la densidad mineral ósea (DMO) en 308 mujeres osteopénicas y concluyó que la tibolona es superior (10).
El estudio LISA (Livial International Study in Sexual Arousal disorders), que trató de comparar los efectos de la tibolona en comparación con E2/NETA, gestágeno con carácter androgénico, en relación a la disfunción sexual. Se demostró que tanto tibolona como E2/NETA mejoraron la función sexual, pero la tibolona fue significativamente superior en todos los parámetros sexuales, como deseo, excitación, lubricación, orgasmo, dolor y satisfacción (11).
Por último el estudio LIBERATE (Livial Intervention following Breast cancer; Efficacy, Recurrence, And Tolerability Endpoints), muy bien diseñado, es probablemente el más estricto con la tibolona y el más difícil de interpretar. El objetivo primario de este estudio fue demostrar que la tibolona no era inferior a placebo en cuanto a recidivas del cáncer de mama; pero fue complejo buscar mujeres postmenopaúsicas operadas hace menos de cinco años, que podían tener hasta dos nódulos pero sin metástasis, es decir, T1-3, N0-2 y M0 y con síntomas vasomotores. Participaron 3585 pacientes de 31 países diferentes, incluido Chile. Los resultados demostraron que existía mayor riesgo con tibolona que con placebo (1,4), por lo que no se puede administrar esta hormona a mujeres con cáncer de mama, así como tampoco la TRH; sin embargo la mortalidad fue la misma con tibolona y con placebo, lo cual también se ha descrito para la TRH.
En el estudio LIBERATE se concluyó que tibolona, administrado durante tres años en promedio a las mujeres con síntomas vasomotores e historia de cáncer de mama, tuvo:
En suma, se ha demostrado que la tibolona mejora los bochornos y posiblemente mejora la sexualidad; y también se ha demostrado que disminuye la tensión mamaria. En cuanto al efecto neutral cardiovascular, hay datos que parecen demostrar esto, pero todavía no existe ningún estudio que se haya enfocado específicamente en este aspecto. Se ha demostrado la seguridad en el endometrio, en el sentido de que no se asocia a proliferación endometrial, y sobre el tratamiento de la atrofia vaginal. Finalmente se ha demostrado su eficacia en la prevención de fracturas osteoporóticas, de modo que es un producto de gran consistencia.
El Grupo de Consenso estableció que algunos grupos especiales de mujeres se podrían beneficiar en forma importante con el uso de tibolona y son aquellas con:

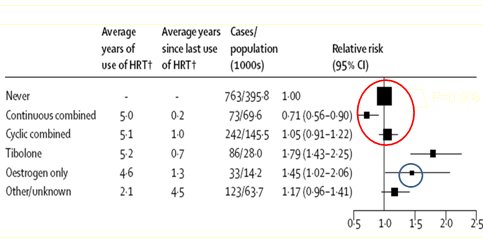 Figura 1. Riesgo relativo de cáncer endometrial (CI 95%) de acuerdo al último tipo de Terapia de Reemplazo Hormonal (Million Woman Study).
Figura 1. Riesgo relativo de cáncer endometrial (CI 95%) de acuerdo al último tipo de Terapia de Reemplazo Hormonal (Million Woman Study).

 Tabla I. Resultados del cáncer de mama (porcentaje anual) pesquisado por grupos de edad (WHI).
Tabla I. Resultados del cáncer de mama (porcentaje anual) pesquisado por grupos de edad (WHI).

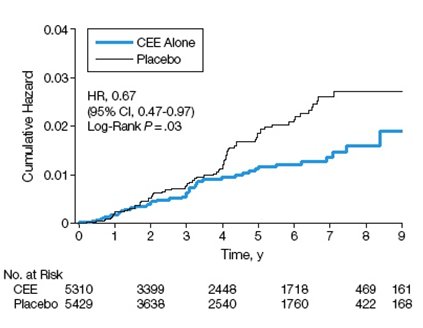 Figura 2. Análisis de sensibilidad para cáncer de mama invasivo.
Figura 2. Análisis de sensibilidad para cáncer de mama invasivo.

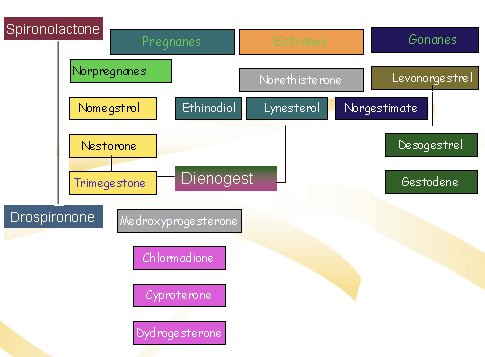 Figura 3. Clasificación de los progestágenos.
Figura 3. Clasificación de los progestágenos.

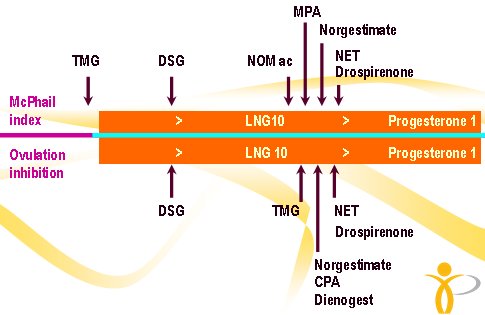 Figura 4. Potencia de distintos progestágenos.
Figura 4. Potencia de distintos progestágenos.

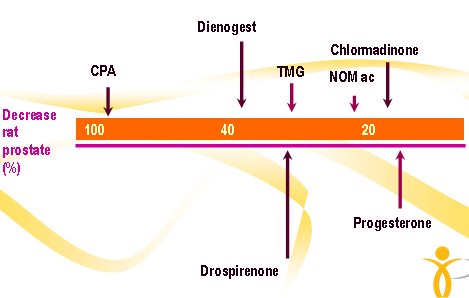 Figura 5. Efecto antiandrogénico de distintos progestágenos.
Figura 5. Efecto antiandrogénico de distintos progestágenos.

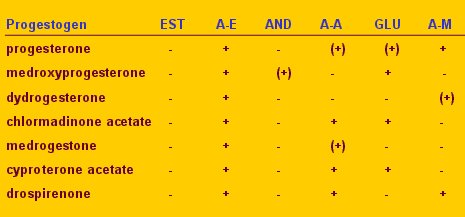 Tabla II. Efectos en los receptores de distintos derivados de la progestrona.
Tabla II. Efectos en los receptores de distintos derivados de la progestrona.

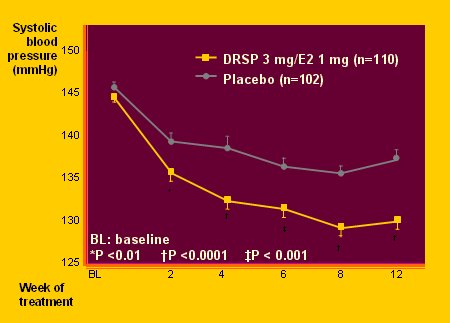 Figura 6. Efecto de drosperidona (DRSP) sobre la presión arterial en mujeres postmenopásicas con hipertensión sistólica.
Figura 6. Efecto de drosperidona (DRSP) sobre la presión arterial en mujeres postmenopásicas con hipertensión sistólica.

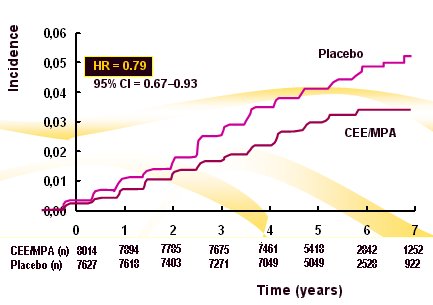 Figura 7. Incidencia de diabetes en el Estudio WHI con estrógenos equinos conjugados (CEE) más acetato de medroxiprogesterona MPA.
Figura 7. Incidencia de diabetes en el Estudio WHI con estrógenos equinos conjugados (CEE) más acetato de medroxiprogesterona MPA.

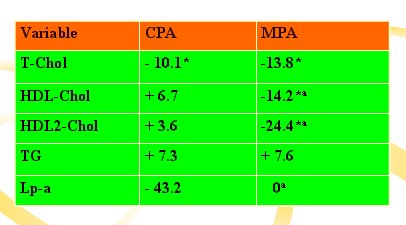 Tabla III. Estudio CDC sobre lipoproteínas
Tabla III. Estudio CDC sobre lipoproteínas
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de la conferencia que se dictó en el Congreso Chileno de Climaterio, realizado en Viña del Mar los días 26 y 27 de Junio de 2009. El congreso fue organizado por la Sociedad Chilena de Climaterio bajo la presidencia del Dr. Juan Enrique Blümel.
 Autor:
Santiago Palacios[1]
Autor:
Santiago Palacios[1]

Citación: Palacios S. Update on progestins and tibolone. Medwave 2009 Dic;9(12):e4314 doi: 10.5867/medwave.2009.12.4314
Fecha de publicación: 1/12/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Ludwin Ãngel Núñez
Fecha/date:
Comentario/comment:
En cuanto a los estudios de seguridad endometrial y mamaria de Tibolona flata resaltar que no duraron más de tres años, debemos recordar que los resultados del WHI fueron más notorios a partir de los 5 años.
Respecto a la protección contra fracturas, Tibolona no es superior a ECE, sobretodo considerando riesgos absolutos y el añadido del costo - beneficio.
Se debe mencionar que la mama que es hipodensa "per se" tiene menos riesgo de cáncer, esto no se extrapola a la disminución de densidad mamaria producida por tibolona.
Creo que no se están progrmando estudios de seguridad (de ningún esquema de TRH)que dure más de 5 años ¿Por qué?.
Gracias.
Nombre/name: Pedro Hernández
Fecha/date: 2011-09-08 15:23:39
Comentario/comment:
Importante la actualización para el manejo de los gonanos de acuerdo a su clasificación.
Se sugiere que los graficos puedan bajarse en pdf.
atte,
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Margolis KL, Bonds DE, Rodabough RJ, Tinker L, Phillips LS, Allen C, et al. Effect of oestrogen plus progestin on the incidence of diabetes in postmenopausal women: results from the Women's Health Initiative Hormone Trial. Diabetologia. 2004 Jul;47(7):1175-87. Epub 2004 Jul 14. | PubMed |
Margolis KL, Bonds DE, Rodabough RJ, Tinker L, Phillips LS, Allen C, et al. Effect of oestrogen plus progestin on the incidence of diabetes in postmenopausal women: results from the Women's Health Initiative Hormone Trial. Diabetologia. 2004 Jul;47(7):1175-87. Epub 2004 Jul 14. | PubMed | Andersen LF, Gram J, Skouby SO, Jespersen J. Effects of hormone replacement therapy on hemostatic cardiovascular risk factors. Am J Obstet Gynecol. 1999 Feb;180(2 Pt 1):283-9. | CrossRef | PubMed |
Andersen LF, Gram J, Skouby SO, Jespersen J. Effects of hormone replacement therapy on hemostatic cardiovascular risk factors. Am J Obstet Gynecol. 1999 Feb;180(2 Pt 1):283-9. | CrossRef | PubMed | Canonico M, Oger E, Plu-Bureau G, Conard J, Meyer G, Lévesque H, et al. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation. 2007 Feb 20;115(7):840-5. | CrossRef | PubMed |
Canonico M, Oger E, Plu-Bureau G, Conard J, Meyer G, Lévesque H, et al. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation. 2007 Feb 20;115(7):840-5. | CrossRef | PubMed | Panay N, Ylikorkala O, Archer DF, Gut R, Lang E. Ultra-low-dose estradiol and norethisterone acetate: effective menopausal symptom relief. Climacteric. 2007 Apr;10(2):120-31. | CrossRef | PubMed |
Panay N, Ylikorkala O, Archer DF, Gut R, Lang E. Ultra-low-dose estradiol and norethisterone acetate: effective menopausal symptom relief. Climacteric. 2007 Apr;10(2):120-31. | CrossRef | PubMed | Kloosterboer HJ. Tibolone: a steroid with a tissue-specific mode of action. J Steroid Biochem Mol Biol. 2001 Jan-Mar;76(1-5):231-8. | PubMed |
Kloosterboer HJ. Tibolone: a steroid with a tissue-specific mode of action. J Steroid Biochem Mol Biol. 2001 Jan-Mar;76(1-5):231-8. | PubMed | Kenemans P, Speroff L; International Tibolone Consensus Group. Tibolone: clinical recommendations and practical guidelines. A report of the International Tibolone Consensus Group. Maturitas. 2005 May 16;51(1):21-8. | CrossRef | PubMed |
Kenemans P, Speroff L; International Tibolone Consensus Group. Tibolone: clinical recommendations and practical guidelines. A report of the International Tibolone Consensus Group. Maturitas. 2005 May 16;51(1):21-8. | CrossRef | PubMed | Archer DF, Hendrix S, Gallagher JC, Rymer J, Skouby S, Ferenczy A, et al. Endometrial effects of tibolone. J Clin Endocrinol Metab. 2007 Mar;92(3):911-8. Epub 2006 Dec 27. | CrossRef | PubMed |
Archer DF, Hendrix S, Gallagher JC, Rymer J, Skouby S, Ferenczy A, et al. Endometrial effects of tibolone. J Clin Endocrinol Metab. 2007 Mar;92(3):911-8. Epub 2006 Dec 27. | CrossRef | PubMed | Hammar ML, van de Weijer P, Franke HR, Pornel B, von Mauw EM, Nijland EA, et al. Tibolone and low-dose continuous combined hormone treatment: vaginal bleeding pattern, efficacy and tolerability. BJOG. 2007 Dec;114(12):1522-9. | CrossRef | PubMed |
Hammar ML, van de Weijer P, Franke HR, Pornel B, von Mauw EM, Nijland EA, et al. Tibolone and low-dose continuous combined hormone treatment: vaginal bleeding pattern, efficacy and tolerability. BJOG. 2007 Dec;114(12):1522-9. | CrossRef | PubMed | Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008 Aug 14;359(7):697-708. | CrossRef | PubMed |
Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P. The effects of tibolone in older postmenopausal women. N Engl J Med. 2008 Aug 14;359(7):697-708. | CrossRef | PubMed | Delmas PD, Davis SR, Hensen J, Adami S, van Os S, Nijland EA. Effects of tibolone and raloxifene on bone mineral density in osteopenic postmenopausal women Osteoporos Int. 2008 Aug;19(8):1153-60. Epub 2008 Feb 7. | CrossRef | PubMed |
Delmas PD, Davis SR, Hensen J, Adami S, van Os S, Nijland EA. Effects of tibolone and raloxifene on bone mineral density in osteopenic postmenopausal women Osteoporos Int. 2008 Aug;19(8):1153-60. Epub 2008 Feb 7. | CrossRef | PubMed | Nijland EA, Weijmar Schultz WC, Nathorst-Boös J, Helmond FA, Van Lunsen RH, Palacios S, et al Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trial. J Sex Med. 2008 Mar;5(3):646-56.
| CrossRef | PubMed |
Nijland EA, Weijmar Schultz WC, Nathorst-Boös J, Helmond FA, Van Lunsen RH, Palacios S, et al Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trial. J Sex Med. 2008 Mar;5(3):646-56.
| CrossRef | PubMed |