 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de la conferencia que se dictó en el Congreso Chileno de Climaterio, realizado en Viña del Mar los días 26 y 27 de Junio de 2009. El congreso fue organizado por la Sociedad Chilena de Climaterio bajo la presidencia del Dr. Juan Enrique Blümel.
Por varios motivos, es importante predecir el momento en que va a ocurrir la menopausia:
De los cuatro métodos que más se utilizan para evaluar a la paciente potencialmente perimenopáusica, tres se basan principalmente en la clínica y uno en análisis de laboratorio, a los cuales se referirá gran parte de esta presentación (Tabla I).
Síntomas: Alrededor de 30 a 40% de las mujeres llega a la menopausia sin síntomas; en las demás se pueden presentar molestias vasomotoras (bochornos), sequedad vaginal, interés sexual variable, incontinencia urinaria, depresión, tensión nerviosa e irritabilidad, olvidos y alteraciones del sueño. Algunos estudios epidemiológicos prospectivos sugieren que existe cierta correlación entre estos síntomas y las variaciones hormonales, pero no permiten predecir exactamente cuándo va a ocurrir la menopausia.
Historia familiar y médica: La edad materna en el momento de la menopausia, el hábito de fumar y la presencia de factores de riesgo cardiovasculares se asocian con la edad esperada para la menopausia, pero no permiten predecir la fecha de la última regla (FUR). Recientemente se publicó un trabajo prospectivo con base en los datos de Framingham en el que se muestra cómo la edad esperada para la menopausia en una mujer se reduce a medida que acumula parámetros de síndrome metabólico, aunque esto tampoco permite predecir cuándo ocurrirá la menopausia: con esos datos se puede decir a una mujer que su menopausia se adelantará en cierta cantidad de años, pero no cuándo ocurrirá ni en qué etapa se encuentra (2).
Signos físicos: La deficiencia de estrógenos se puede medir a través del índice de madurez del epitelio vaginal o el pH en ausencia de infección, pero no existe ningún estudio prospectivo que demuestre una asociación entre estos signos y la llegada de la menopausia.
Métodos de laboratorio: Por lo expuesto, la única manera que existe de predecir el momento de la menopausia es analizar los cambios de la regla, es decir, del pattern de sangrado y asociarlo eventualmente con alguna de las hormonas involucradas con el proceso ovulatorio.
En la siguiente imagen se puede apreciar la distribución normal de la edad de la última regla de la vida de las mujeres, con una dispersión entre 45 y 57 años. Un aumento del peso corporal en 5% se traduce en un acortamiento de la edad de la menopausia en alrededor de siete años; asimismo, el aumento del colesterol total en 20 mg/dl acorta la fecha prevista para la menopausia en dos años y la disminución en 20 mg/dl la retrasa. La hipertensión sistólica adelanta la fecha de menopausia y al contrario, tener la presión 10 mmHg más baja la retarda levemente; lo mismo sucede con la presión diastólica. Por lo tanto, frente a una paciente que presente elementos del síndrome metabólico se debe considerar la posibilidad de que su menopausia se presente a una edad más temprana de la que se había previsto (Fig. 1).
Uno de los primeros intentos serios por establecer el patrón de sangrado que precede a la menopausia es el trabajo de Treloar, que se publicó a principios de la década de los 80 y demostró que la frecuencia de las menstruaciones disminuye entre dos y ocho años antes de la menopausia (3). A fines de la década de los 90 los datos epidemiológicos demostraron que la edad y el retardo menstrual predicen la menopausia: Hall demostró que en mujeres mayores de 45 años, la presencia de 60 días de amenorrea predice la menopausia dentro de los siguientes cuatro años y si la amenorrea dura más de 90 días, la menopausia ocurre dentro de los próximos dos años. La primera asociación es más sensible y la segunda, más específica (4). En este contexto es importante conocer uno de los elementos fisiopatológicos más importantes de la premenopausia: la fase lag, que dura alrededor de siete días en una mujer que posee folículos sensibles y niveles normales de hormona folículo estimulante (FSH) e inhibinas. En ese caso el reclutamiento del óvulo funciona bien hasta que se produce el evento denominado ETO (estrogen-take-off), punto de inflexión en el cual el nivel de estrógeno sube, lo que marca el momento en que el ovario responde con una actividad folicular eficaz. A medida que avanza la edad, por causa desconocida, la mayoría de los ciclos se “alarga” a expensas de un retardo en la activación folicular, pero una vez que ésta aparece el resto del ciclo suele seguir un curso relativamente normal. Esto indica que ya hay una resistencia de los folículos para madurar como respuesta a la FSH (5) (Fig. 2).
Figura 2. Lag Fase o retardo en la activación folicular. Adaptado de Hale GE et al (5).
El tiempo de respuesta del ovario está retrasado en los ciclos largos (6). En la Fig. 3 se representa un ciclo menstrual de una mujer en edad fértil, donde se requiere poca FSH en comparación con un ciclo largo en la perimenopausia, donde se requiere mayor nivel de FSH para lograr el punto ETO, con diversas formas de respuesta, por lo general de reclutamiento múltiple (Fig. 3).
Con base en lo anterior se han diseñado tres o cuatro modelos predictivos de menopausia según las alteraciones menstruales (5, 7). En la Tabla II se resumen los criterios STRAW (Stages of Reproductive Aging Workshop), según los cuales una diferencia de siete días con la frecuencia normal de la mujer indica que existe un evento de transición menopáusica, o perimenopausia inicial o temprana, mientras que la ausencia de dos ciclos asociada a un intervalo de amenorrea mayor de 60 días es propio de la fase avanzada. En el momento en que se produce la amenorrea se debe esperar un año para declarar que la mujer tiene 100% de probabilidades de estar definitivamente menopáusica. En los primeros estudios se encontró una inflexión en los niveles de FSH de la fase folicular de estas pacientes y un grupo de ellas no tenía alteración del pattern de sangrado, pero ya tenía elevación de la FSH, lo que corresponde a la etapa tardía de la premenopausia, que es la última parte de la vida reproductiva y se caracteriza por valores de FSH entre 10 y 30. No existe acuerdo sobre el punto en que comienza la fase de postmenopausia, pero estaría establecida cuando los niveles de FSH se encuentran sobre 40 (Tabla II).
Tabla II. Criterios STRAW para etapificar la perimenopausia. Modificado de Hale GE et al.
Freeman corroboró lo anterior al publicar un estudio en el que se establece que las etapas de transición temprana, avanzada y postmenopausia se caracterizan por niveles de FSH alrededor de 10, 20 y 35 respectivamente (8), medidos en la fase folicular, en amenorrea o al término del período de descanso de los anticonceptivos. La inhibina B es una hormona mayoritariamente folicular, que colabora con el estradiol para mantener frenada la producción de FSH y que comienza a decrecer antes de que ésta se altere en forma lineal: a medida que la mujer avanza hacia la menopausia la inhibina disminuye de 64,7 a 17,8, de modo que esta hormona podría ser un buen marcador para definir los estadios de la premenopausia. Sin embargo, si una persona tiene un índice de masa corporal (IMC) entre 25 y 30 puede tener bajos niveles de inhibina B por el sólo hecho de tener obesidad; por esta razón no se ha incorporado este parámetro dentro del STRAW (4) (Tabla III).
Tabla III. Correlación entre patrón de sangrado y marcadores. Adaptado de Freeman (8).
En la siguiente imagen se muestra cómo se regula la función ovárica. El folículo produce estradiol, inhibina A en bajos niveles e inhibina B; la fase lútea se produce por la acción de inhibina A, estradiol y progesterona; en la etapa premenopáusica se va produciendo gradualmente incompetencia lútea y ciclos anovulatorios, con aumento de los niveles de FSH por incapacidad para mantener la frenación y a la vez, para mantener la producción de estradiol hasta la última fase de la premenopausia (Fig. 4).
Figura 4. Regulación de la función ovárica. Modificado de Hall (4).
A medida que la mujer avanza hacia la menopausia la FSH aumenta y la inhibina B disminuye en la fase menstrual, que es la fase previa al desarrollo folicular. En la fase folicular la inhibina B disminuye y la FSH aumenta a medida que se aproxima la menopausia; en cambio la hormona luteinizante (LH) varía poco y los cambios se deben más bien a que son datos estadísticos obtenidos en pacientes con y sin anovulación, de tal forma que el nivel de LH no es útil como índice predictivo de menopausia. El estradiol no disminuye en la mayoría de las pacientes, pero sí en aquellas que desarrollan anovulación; los cambios que ocurren con el estradiol explican la disparidad de cuadros clínicos que se observa en estas pacientes (5). La inhibina B disminuye linealmente a medida que se avanza desde fases fértiles tardías hasta la menopausia; esto ocurre en todas las fases del ciclo menstrual, pero las mediciones se deben realizar en la fase folicular (Fig. 5).
Figura 5. La inhibina B disminuye linealmente en la premenopausia. Hale et al (5).
El nivel de hormona antimulleriana se mantiene constante durante la edad fértil y decrece en forma muy precoz, incluso antes que la inhibina B (5). La caída es tan notable que esta hormona podría ser un excelente marcador, muy precoz, de la proximidad de la menopausia y podría ser muy útil en el manejo de la infertilidad (Fig. 6).
Figura 6. Hormona Antimulleriana. Hale et al (5).
Después del evento de la hormona antimulleriana se produce un segundo evento, que es la caída de la inhibina B seguida de caída en inhibina A (poco específica) y aumento de la FSH (9). El estradiol en algunas pacientes disminuye y en otras aumenta, pero una vez que desaparece por completo se produce amenorrea definitiva, nula capacidad de respuesta folicular y FSH definitivamente elevada (Fig. 7).
Los criterios de SWAN (Study of Women’s Health Across the Nation), STRAW y Pensilvania (PENN-5) son lo que más se utilizan para describir los pattern de sangrado. PENN-5 es casi igual a los ya mencionados, sólo agrega un estadio con el objetivo de obtener mayor precisión. En la siguiente imagen se muestran los valores de premenopausia, transición temprana, tardía y postmenopausia de inhibina B, que son idénticos en una serie prospectiva que comparó SWAN y STRAW; se puede apreciar que los niveles de estradiol no disminuyen con el tiempo sino hasta llegar a las etapas tardías de la transición temprana y avanzada. En las mujeres que tienen siete días de retardo en su ciclo menstrual y 60 días de amenorrea los niveles de estradiol tienden a subir y posteriormente caen, una vez que se establece la menopausia. También se puede apreciar los que sucede con la FSH, que va aumentando. En PENN-5 se encuentra una curva casi idéntica y el estadio intermedio que describe este grupo de investigadores es casi igual al promedio de los estadios anterior y posterior, por lo que, aunque se diga que esta nueva etapa podría tener importancia en cuanto a fertilidad, para efectos de manejo de la menopausia funciona de manera similar a los anteriores (Fig. 8).
Figura 8. Comparación entre SWAN, STRAW y PENN-5. Adaptado de Gracia C et al (10).
En la siguiente imagen se apreciar una serie de gráficos que tienen en el eje de las abcisas los patrones hormonales que se observan en los distintos tipos de ciclo, con la situación hormonal en el período ovulatorio en el centro de cada gráfico. En la columna 3 se observa un período que no tiene progesterona y tiene una elevación un poco más alta de la LH, por lo tanto es una insuficiencia lútea, un ciclo anovulante, pero monofásico, mientras que en la última columna se ve un verdadero ciclo anovulante. Estos distintos patrones de sangrado se acompañan de alteraciones características de las gonadotropinas: la FSH es más elevada en el patrón tipo 3 con insuficiencia lútea, la inhibina B es más baja en los dos y la hormona antimulleriana es veinte veces más baja en el patrón 1, que no tiene ningún tipo de trastorno del sangrado ni de los niveles de hormonas, lo que demuestra que es el marcador más precoz que se conoce hasta ahora y sigue bajando a medida que pasa el tiempo (11) (Fig. 9).
Figura 9. Patrones hormonales y tipos de ciclo (11).
Robertson y Burger, los investigadores con más experiencia en este tema, plantean la posibilidad de utilizar la relación FSH/Inhibina B, en forma similar a lo que se hace con testosterona y SHBG, para obtener un efecto amplificado (11). Como en este caso los valores son divergentes se obtiene una expresión más potente de la alteración, ya que la FSH sube y la inhibina B disminuye. La combinación de hormona antimulleriana y relación FSH/Inhibina B tendría gran valor predictivo de la menopausia, como se observa en el siguiente gráfico, en el que los ciclos tipo 2, que tienen alteraciones del patrón de sangrado pero todavía son ovulantes, están hacia abajo, mientras que las mujeres que ovulan normalmente o que tienen ciclos tipo 1 se encuentran en la parte superior porque no tienen insuficiencia de hormona antimulleriana (Fig. 10).
Lo importante es que el tipo de ciclo se correlaciona con los estadios de STRAW, como se demuestra en la Tabla IV: 20% de las pacientes que se encuentran en STRAW -2 tiene patrón tipo 1, es decir, solamente hormona antimulleriana alterada y 67% tiene tipo 2, es decir, poseen progesterona, LH normal, FSH alta e inhibina B baja y 3% tiene patrón tipo 3 con insuficiencia lútea. Se aprecia la dispersión de las pacientes que están en STRAW -1, a las que les falta muy poco para llegar a la menopausia: 36% de ellas tiene patrón de sangrado tipo 2 con la alteración hormonal correspondiente: FSH elevada, inhibina B baja o relación entre las dos alterada (Tabla IV).
Sólo una minoría de las pacientes presenta disminución de los niveles de estradiol a medida que se acercan a la menopausia; en la mayoría de ellas se produce un aumento transitorio de esta hormona en las dos últimas etapas premenopáusicas. Esto se puede explicar por varias razones. Se ha demostrado que en las mujeres postmenopáusicas obesas el nivel de estradiol disminuye menos, pero antes de que se instale la menopausia el nivel es algo más bajo que en pacientes de la misma edad con IMC normal (8). Con la FSH ocurre algo similar, en espejo (Fig. 11).
Figura 11. Niveles de Estradiol y FSH según estatus menstrual e Índice de Masa Corporal.
Dennerstein y su grupo buscaron asociaciones entre los síntomas de las pacientes y sus niveles de estrógenos, en 204 mujeres (The 13 year prospective Melbourne Women’s Midlife Health Project). Encontraron asociación con rango y pendiente (tendencia a disminución) de esta hormona para bochornos, sudoraciones nocturnas, problemas de sueño, sequedad vaginal y score de autocalificación del estado de salud; el valor final de estradiol más bajo se asoció a mayor riego cardiovascular y alteraciones de la respuesta sexual; y no encontraron asociación entre nivel de estrógenos y estado de ánimo y sensación de bienestar o frecuencia de actividad sexual (12). No obstante, en otras series se ha descrito resultados diferentes. Según Freeman, la menor prevalencia de atrofia genital es consistente con estrógenos normales o aumentados en muchas mujeres perimenopáusicas, aunque al menos 20% de las pacientes, independiente del status de estradiol, tienen sequedad vaginal o disminución de la libido (13). Por otra parte, en el estudio SWAN fueron más sintomáticas las mujeres en las que no aumentó el nivel de estrógenos en la premenopausia (14). Asimismo, el grupo de Randolf estudió la correlación entre el cambio en las hormonas reproductivas y los síntomas vasomotores en la transición menopáusica y sus resultados también sugieren que los estrógenos y la FSH tienen relación con los síntomas, pero no son el único factor (15).
El grupo japonés de Yasui hizo una contribución interesante en este tema al intentar definir el rol en la carencia de estradiol de una serie de citoquinas: IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IL-13, IL-17, TNF, granulocyte colony-stimulating factor, granulocyte/macrophage colony-stimulating factor, IFN, macrophage inflammatory protein (MIP)- 1 y monocyte chemotactic protein-1 (16). Los autores encontraron asociación entre IL-8 y presencia de bochornos en mujeres pre, peri y posmenopáusicas y en ooforectomizadas, lo que demuestra que el bochorno es una manifestación compleja del estadio perimenopáusico y no solamente refleja un déficit de estradiol, sino también otras alteraciones, tanto en gonodatropinas como en interleuquinas (15). Freeman observó lo mismo con todos los demás síntomas: trastornos del sueño, dolores o “achaques” y depresión, que se encuentran en alrededor de 20 a 30% de las pacientes en la premenopausia, cuando lo único que está alterado es el factor antimulleriano (Fig. 12).
Figura 12. Síntomas en la perimenopausia. (Adaptado de Freeman).
Freeman trató de encontrar correlaciones significativas entre niveles hormonales y síntomas en la perimenopausia y encontró que los bochornos se correlacionan con los niveles de estradiol, FSH e inhibina B. Los dolores articulares no se relacionan en forma significativa con estrógenos. La depresión y el mal dormir se relacionan con la inhibina B y la disminución de la libido, con el estradiol. Se habría esperado que estos estudios hubieran entregado una gran cantidad de datos que explicaran la presencia de síntomas en la premenopausia, incluyendo la disminución de los estrógenos, pero esto no fue así (Fig. 13).
La disparidad clínica se explica en parte por la coexistencia de pacientes con ciclos ovulantes, pacientes con ciclos anovulantes y pacientes con estado hiperestrogénico, que se podría deber a exceso de reclutamiento. Aunque no existen estudios prospectivos, es probable que las pacientes hiperestrogénicas presenten trastornos uterinos disfuncionales, miomas, adenomiosis y todas las patologías propias de esta etapa de la vida, pero no tengan ningún síntoma; mientras que las pacientes con algún déficit estrogénico expresarían los síntomas como sequedad vaginal, bochorno y depresión. En el estudio de Hale se demostró que 6% de las pacientes en estadio STRAW -2 y 9% de las pacientes en STRAW-4 tienen ciclos anovulantes, mientras que la cifra aumenta a 40% en pacientes en STRAW -1 (5).
Asimismo, se ha demostrado que existe insuficiencia lútea en el último año premenopáusico en alrededor de 60% de los casos (17). En el siguiente gráfico se observa lo que sucede en las pacientes a medida que se aproximan a la menopausia y el porcentaje de ellas que llega ovulando. Las columnas blancas indican que, en esta serie, hasta 40% de las pacientes alcanzó la menopausia sin haber presentado ningún tipo de molestias y que 60% de las pacientes llegó a la menopausia con insuficiencia lútea (Fig. 14).
Los médicos deben estar preparados para detectar los signos y síntomas en la perimenopausia sintomática por anovulación y, eventualmente, por exceso de estrógenos secundario a falta de oposición progestativa cuando existe insuficiencia lútea. La anovulación provoca alteraciones menstruales como oligomenorrea, polimenorrea o amenorrea y crecimiento de miomas. Cuando además existe falta de oposición a los estrógenos se presentan trastornos endometriales como sangrados disfuncionales, displasia endometrial y adenomiosis.
En resumen:
Con base en los estudios descritos, Castracane estableció en 1995 la recomendación que se utiliza actualmente para determinar el estado de fertilidad y realizar con seguridad la transición desde anticonceptivos orales (ACO) a terapia de reemplazo hormonal (TH), aunque falta comprobación prospectiva (18):
Finalmente, se recalca la importancia de utilizar los criterios STRAW para etapificar la perimenopausia y la necesidad de reconocer los síntomas asociados tanto a déficit como a exceso de estrógenos.

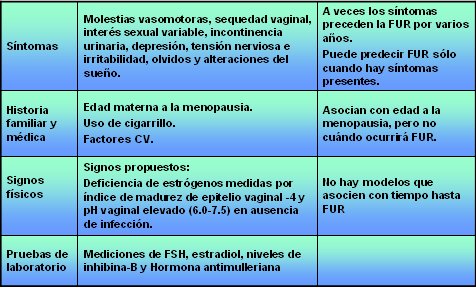 Tabla I. Métodos para evaluar a la paciente potencialmente perimenopáusica. Modificado de Santoro (1).
Tabla I. Métodos para evaluar a la paciente potencialmente perimenopáusica. Modificado de Santoro (1).

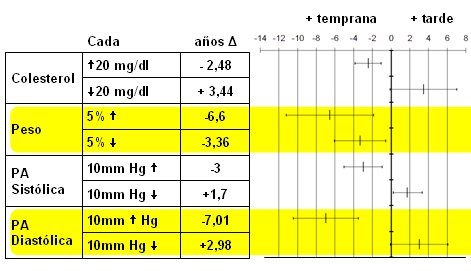 Figura 1. Influencia de factores de riesgo CV sobre edad esperada de la menopausia (Framingham, n= 695). Adaptado de Kok HS et al (2).
Figura 1. Influencia de factores de riesgo CV sobre edad esperada de la menopausia (Framingham, n= 695). Adaptado de Kok HS et al (2).

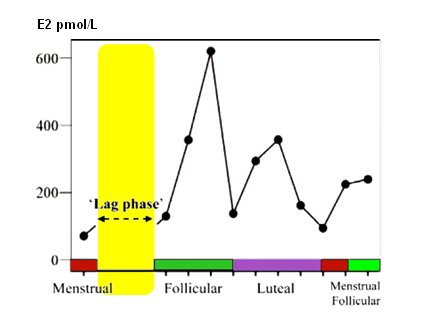 Figura 2. Lag Fase o retardo en la activación folicular. Adaptado de Hale GE et al (5).
Figura 2. Lag Fase o retardo en la activación folicular. Adaptado de Hale GE et al (5).

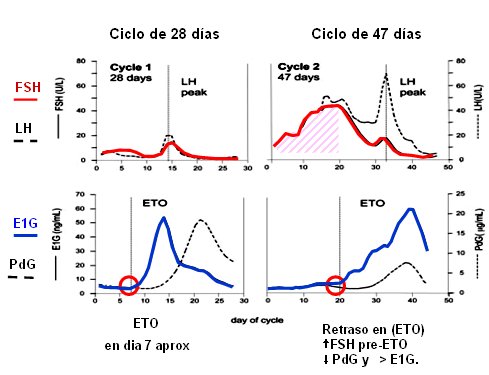 Figura 3. El tiempo de respuesta del ovario está retrasado en los ciclos largos (ETO o E1-take-off o día de despegue del Estrona 1 Glucuronido).
Figura 3. El tiempo de respuesta del ovario está retrasado en los ciclos largos (ETO o E1-take-off o día de despegue del Estrona 1 Glucuronido).

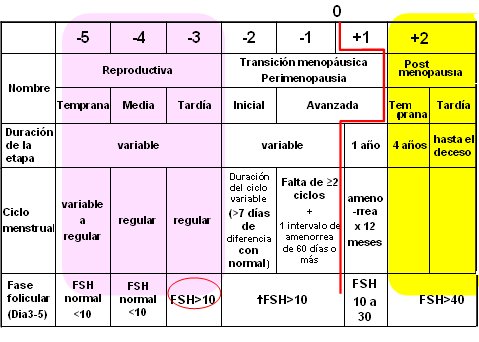 Tabla II. Criterios STRAW para etapificar la perimenopausia. Modificado de Hale GE et al.
Tabla II. Criterios STRAW para etapificar la perimenopausia. Modificado de Hale GE et al.

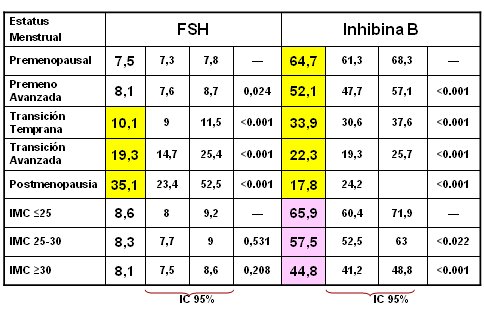 Tabla III. Correlación entre patrón de sangrado y marcadores. Adaptado de Freeman (8).
Tabla III. Correlación entre patrón de sangrado y marcadores. Adaptado de Freeman (8).

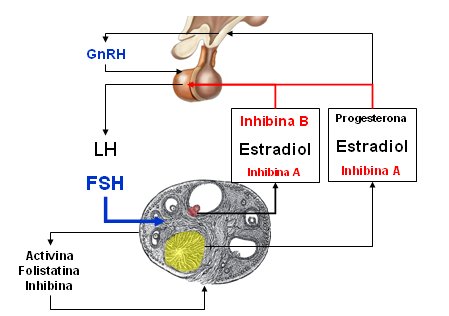 Figura 4. Regulación de la función ovárica. Modificado de Hall (4).
Figura 4. Regulación de la función ovárica. Modificado de Hall (4).

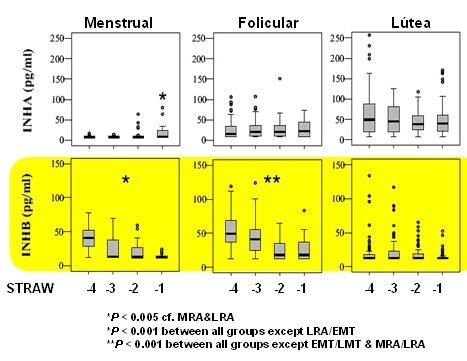 Figura 5. La inhibina B disminuye linealmente en la premenopausia. Hale et al (5).
Figura 5. La inhibina B disminuye linealmente en la premenopausia. Hale et al (5).

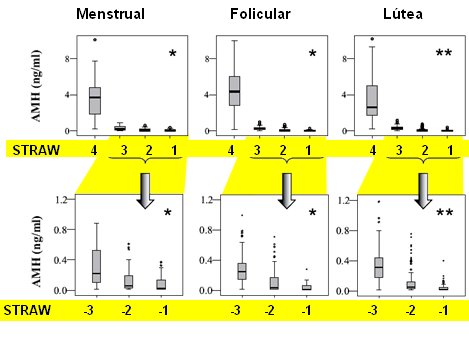 Figura 6. Hormona Antimulleriana. Hale et al (5).
Figura 6. Hormona Antimulleriana. Hale et al (5).

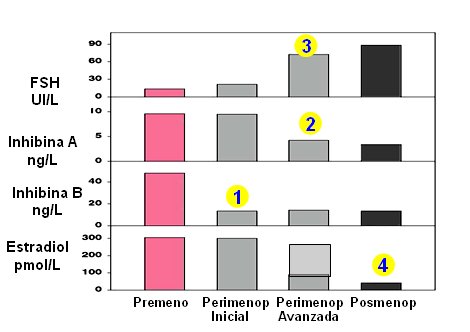 Figura 7. Segundo evento: caída de inhibina B, seguida de caída en Inhibina A y aumento de FSH. Modificado de Burger et al (9).
Figura 7. Segundo evento: caída de inhibina B, seguida de caída en Inhibina A y aumento de FSH. Modificado de Burger et al (9).

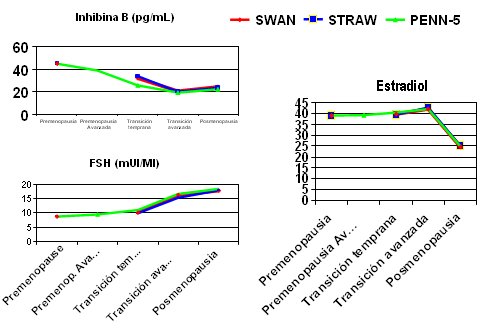 Figura 8. Comparación entre SWAN, STRAW y PENN-5. Adaptado de Gracia C et al (10).
Figura 8. Comparación entre SWAN, STRAW y PENN-5. Adaptado de Gracia C et al (10).

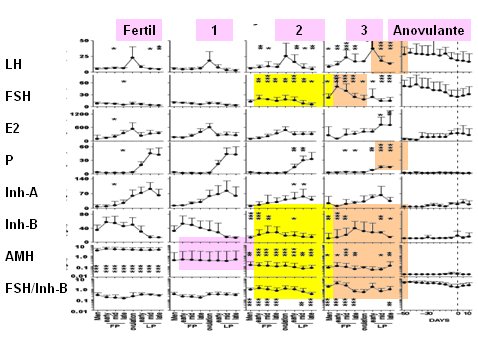 Figura 9. Patrones hormonales y tipos de ciclo (11).
Figura 9. Patrones hormonales y tipos de ciclo (11).

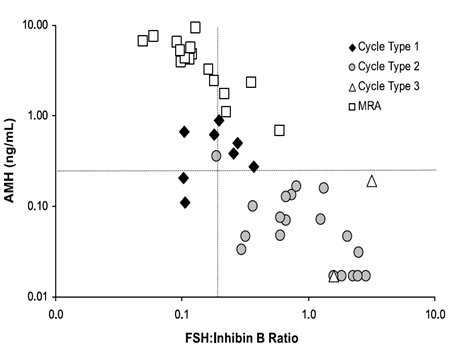 Figura 10. Propuesta de Robertson y Burger: combinar H. Antimulleriana y relación FSH/Inhibina-B (11).
Figura 10. Propuesta de Robertson y Burger: combinar H. Antimulleriana y relación FSH/Inhibina-B (11).

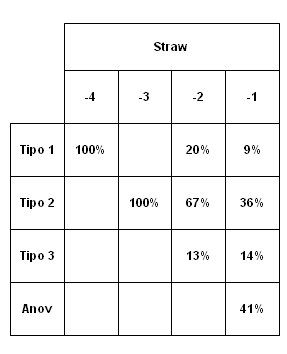 Tabla IV. Propuesta de Robertson y Burger: combinar H. Antimulleriana y relación FSH/Inhibina-B (11).
Tabla IV. Propuesta de Robertson y Burger: combinar H. Antimulleriana y relación FSH/Inhibina-B (11).

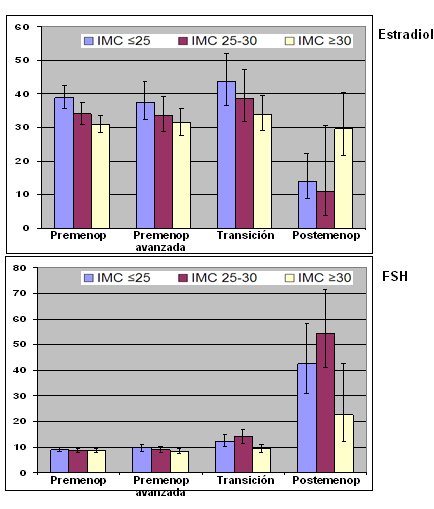 Figura 11. Niveles de Estradiol y FSH según estatus menstrual e Índice de Masa Corporal.
Figura 11. Niveles de Estradiol y FSH según estatus menstrual e Índice de Masa Corporal.

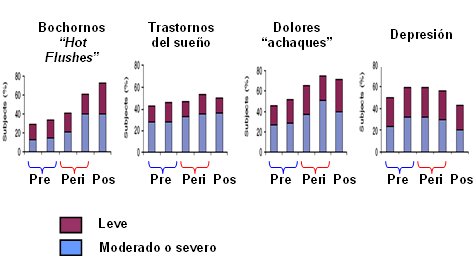 Figura 12. Síntomas en la perimenopausia. (Adaptado de Freeman).
Figura 12. Síntomas en la perimenopausia. (Adaptado de Freeman).

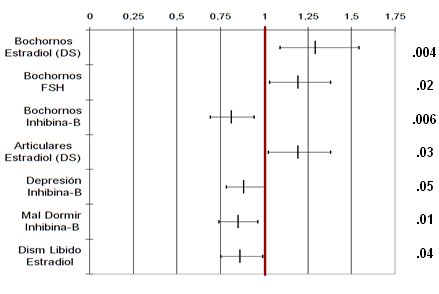 Figura 13. Correlaciones significativas entre Niveles Hormonales y Síntomas en la Perimenopausia (Adaptado de Freeman).
Figura 13. Correlaciones significativas entre Niveles Hormonales y Síntomas en la Perimenopausia (Adaptado de Freeman).

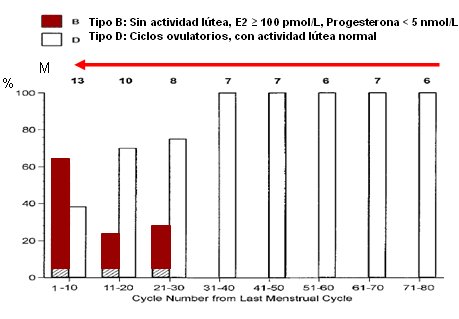 Figura 14. Insuficiencia lútea en el último año premenopáusico en alrededor de 60% de los casos. (Adaptado de Landgren).
Figura 14. Insuficiencia lútea en el último año premenopáusico en alrededor de 60% de los casos. (Adaptado de Landgren).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de la conferencia que se dictó en el Congreso Chileno de Climaterio, realizado en Viña del Mar los días 26 y 27 de Junio de 2009. El congreso fue organizado por la Sociedad Chilena de Climaterio bajo la presidencia del Dr. Juan Enrique Blümel.
 Autor:
Sergio Brantes Glavic[1]
Autor:
Sergio Brantes Glavic[1]

Citación: Brantes S. Current concepts in the diagnosis of perimenopause. Medwave 2009 Dic;9(11):e4264 doi: 10.5867/medwave.2009.11.4264
Fecha de publicación: 1/11/2009
Citaciones asociadas
1. Parra I. Anticoncepción en la perimenopausia. Sociedad española de contracepción. sec.es [on line] | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Santoro N. Women want to know: Predicting the final menses. Menopause SRM 5(2): 6-10.
Santoro N. Women want to know: Predicting the final menses. Menopause SRM 5(2): 6-10.  Kok HS, van Asselt KM, van der Schouw YT, van der Tweel I, Peeters PH, Wilson PW, et al. Heart disease risk determines menopausal age rather than the reverse. J Am Coll Cardiol. 2006 May 16;47(10):1976-83. Epub 2006 Apr 24. | CrossRef | PubMed |
Kok HS, van Asselt KM, van der Schouw YT, van der Tweel I, Peeters PH, Wilson PW, et al. Heart disease risk determines menopausal age rather than the reverse. J Am Coll Cardiol. 2006 May 16;47(10):1976-83. Epub 2006 Apr 24. | CrossRef | PubMed | Treloar AE. Menstrual cyclicity and the pre-menopause. Maturitas. 1981 Dec;3(3-4):249-64. | CrossRef | PubMed |
Treloar AE. Menstrual cyclicity and the pre-menopause. Maturitas. 1981 Dec;3(3-4):249-64. | CrossRef | PubMed | Hall JE. Neuroendocrine physiology of the early and late menopause. Endocrinol Metab Clin North Am. 2004 Dec;33(4):637-59. | CrossRef | PubMed |
Hall JE. Neuroendocrine physiology of the early and late menopause. Endocrinol Metab Clin North Am. 2004 Dec;33(4):637-59. | CrossRef | PubMed | Hale GE, Zhao X, Hughes CL, Burger HG, Robertson DM, Fraser IS. Endocrine features of menstrual cycles in middle and late reproductive age and the menopausal transition classified according to the Staging of Reproductive Aging Workshop (STRAW) staging system. J Clin Endocrinol Metab. 2007 Aug;92(8):3060-7. Epub 2007 Jun 5. | CrossRef | PubMed |
Hale GE, Zhao X, Hughes CL, Burger HG, Robertson DM, Fraser IS. Endocrine features of menstrual cycles in middle and late reproductive age and the menopausal transition classified according to the Staging of Reproductive Aging Workshop (STRAW) staging system. J Clin Endocrinol Metab. 2007 Aug;92(8):3060-7. Epub 2007 Jun 5. | CrossRef | PubMed | Miro F, Parker SW, Aspinall LJ, Coley J, Perry PW, Ellis JE, et al. Origins and consequences of the elongation of the human menstrual cycle during the menopausal transition: the FREEDOM Study. J Clin Endocrinol Metab. 2004 Oct;89(10):4910-5. | CrossRef | PubMed |
Miro F, Parker SW, Aspinall LJ, Coley J, Perry PW, Ellis JE, et al. Origins and consequences of the elongation of the human menstrual cycle during the menopausal transition: the FREEDOM Study. J Clin Endocrinol Metab. 2004 Oct;89(10):4910-5. | CrossRef | PubMed | Soules MR, Sherman S, Parrott E, Rebar R, Santoro N, Utian W, et al. Stages of Reproductive Aging Workshop (STRAW). J Womens Health Gend Based Med. 2001 Nov;10(9):843-8. | CrossRef | PubMed |
Soules MR, Sherman S, Parrott E, Rebar R, Santoro N, Utian W, et al. Stages of Reproductive Aging Workshop (STRAW). J Womens Health Gend Based Med. 2001 Nov;10(9):843-8. | CrossRef | PubMed | Freeman EW, Sammel MD, Gracia CR, Kapoor S, Lin H, Liu L, et al. Follicular phase hormone levels and menstrual bleeding status in the approach to menopause. Fertil Steril. 2005 Feb;83(2):383-92. | CrossRef | PubMed |
Freeman EW, Sammel MD, Gracia CR, Kapoor S, Lin H, Liu L, et al. Follicular phase hormone levels and menstrual bleeding status in the approach to menopause. Fertil Steril. 2005 Feb;83(2):383-92. | CrossRef | PubMed | Burger HG, Cahir N, Robertson DM, Groome NP, Dudley E, Green A, et al. Serum inhibins A and B fall differentially as FSH rises in perimenopausal women. Clin Endocrinol (Oxf). 1998 Jun;48(6):809-13. | CrossRef | PubMed |
Burger HG, Cahir N, Robertson DM, Groome NP, Dudley E, Green A, et al. Serum inhibins A and B fall differentially as FSH rises in perimenopausal women. Clin Endocrinol (Oxf). 1998 Jun;48(6):809-13. | CrossRef | PubMed | Gracia CR, Sammel MD, Freeman EW, Lin H, Langan E, Kapoor S, et al. Defining menopause status: creation of a new definition to identify the early changes of the menopausal transition. Menopause. 2005 Mar;12(2):128-35. | CrossRef | PubMed |
Gracia CR, Sammel MD, Freeman EW, Lin H, Langan E, Kapoor S, et al. Defining menopause status: creation of a new definition to identify the early changes of the menopausal transition. Menopause. 2005 Mar;12(2):128-35. | CrossRef | PubMed | Robertson DM, Hale GE, Fraser IS, Hughes CL, Burger HG. A proposed classification system for menstrual cycles in the menopause transition based on changes in serum hormone profiles. Menopause. 2008 Nov-Dec;15(6):1139-44. | CrossRef | PubMed |
Robertson DM, Hale GE, Fraser IS, Hughes CL, Burger HG. A proposed classification system for menstrual cycles in the menopause transition based on changes in serum hormone profiles. Menopause. 2008 Nov-Dec;15(6):1139-44. | CrossRef | PubMed | Dennerstein L, Lehert P, Burger HG, Guthrie JR. New findings from non-linear longitudinal modelling of menopausal hormone changes. Hum Reprod Update. 2007 Nov-Dec;13(6):551-7. Epub 2007 Jul 6. | CrossRef | PubMed |
Dennerstein L, Lehert P, Burger HG, Guthrie JR. New findings from non-linear longitudinal modelling of menopausal hormone changes. Hum Reprod Update. 2007 Nov-Dec;13(6):551-7. Epub 2007 Jul 6. | CrossRef | PubMed | Freeman EW, Sammel MD, Lin H, Gracia CR, Pien GW, Nelson DB, et al. Symptoms associated with menopausal transition and reproductive hormones in midlife women. Obstet Gynecol. 2007 Aug;110(2 Pt 1):230-40. | CrossRef | PubMed |
Freeman EW, Sammel MD, Lin H, Gracia CR, Pien GW, Nelson DB, et al. Symptoms associated with menopausal transition and reproductive hormones in midlife women. Obstet Gynecol. 2007 Aug;110(2 Pt 1):230-40. | CrossRef | PubMed | Weiss G, Skurnick JH, Goldsmith LT, Santoro NF, Park SJ. Menopause and hypothalamic-pituitary sensitivity to estrogen. JAMA. 2004 Dec 22;292(24):2991-6. | CrossRef | PubMed |
Weiss G, Skurnick JH, Goldsmith LT, Santoro NF, Park SJ. Menopause and hypothalamic-pituitary sensitivity to estrogen. JAMA. 2004 Dec 22;292(24):2991-6. | CrossRef | PubMed | Randolph JF Jr, Sowers M, Bondarenko I, Gold EB, Greendale GA, Bromberger JT, et al. The relationship of longitudinal change in reproductive hormones and vasomotor symptoms during the menopausal transition. J Clin Endocrinol Metab. 2005 Nov;90(11):6106-12. Epub 2005 Sep 6. | CrossRef | PubMed |
Randolph JF Jr, Sowers M, Bondarenko I, Gold EB, Greendale GA, Bromberger JT, et al. The relationship of longitudinal change in reproductive hormones and vasomotor symptoms during the menopausal transition. J Clin Endocrinol Metab. 2005 Nov;90(11):6106-12. Epub 2005 Sep 6. | CrossRef | PubMed | Yasui T, Uemura H, Tomita J, Miyatani Y, Yamada M, Kuwahara A, et al. Association of interleukin-8 with hot flashes in premenopausal, perimenopausal, and postmenopausal women and bilateral oophorectomized women. J Clin Endocrinol Metab. 2006 Dec;91(12):4805-8. Epub 2006 Oct 3. | CrossRef | PubMed |
Yasui T, Uemura H, Tomita J, Miyatani Y, Yamada M, Kuwahara A, et al. Association of interleukin-8 with hot flashes in premenopausal, perimenopausal, and postmenopausal women and bilateral oophorectomized women. J Clin Endocrinol Metab. 2006 Dec;91(12):4805-8. Epub 2006 Oct 3. | CrossRef | PubMed |