 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada de la conferencia que se dictó en el XLVIII Congreso Chileno de Pediatría, realizado en Viña del Mar entre el 26 y el 29 de Noviembre de 2008. El congreso fue organizado por la Sociedad Chilena de Pediatría bajo la presidencia de la Dra. Lidya Tellerías C.
La infección urinaria (ITU) es una causa frecuente de morbilidad aguda: es la infección bacteriana más común en el lactante menor y ocasiona 6% de los cuadros febriles en el menor de dos años de edad. Su importancia radica en que puede determinar la producción de una cicatriz renal que la mayoría de las veces no tiene mayor relevancia desde el punto de vista clínico, pero en un pequeño porcentaje de niños con infecciones urinarias múltiples o reflujo vesicoureteral (RVU) grave se puede asociar a complicaciones como hipertensión arterial, morbilidad en el embarazo y disminución de la función renal. Alrededor de 9% de los pacientes pediátricos con enfermedad renal crónica tienen como principal etiología la infección urinaria o nefropatía por reflujo.
Esta patología se presenta en todas las edades con predominio en el sexo femenino, excepto en los menores de un mes en los cuales es más frecuente en hombres. Hasta 8% de las mujeres y 2% de los varones presenta una ITU antes de la pubertad (Fig. 1).
Figura 1. Incidencia de infección urinaria en la edad pediátrica, según sexo.
El factor de riesgo de daño renal más importante es la edad, especialmente en menores de un año. Otros factores son: retraso en el inicio de una terapia antibiótica eficaz; obstrucción anatómica o neurogénica; RVU grave; displasia renal y episodios recurrentes de pielonefritis aguda (PNA) clínica, independiente de la edad. A medida que aumenta el número de episodios de PNA aumenta el riesgo de daño renal, en forma independiente de la existencia de RVU, hasta llegar a 60% cuando el paciente ha tenido cinco episodios (1) (Fig. 2).
Figura 2. Curva de riesgo de daño renal.
El diagnóstico de ITU es bacteriológico y constituye un gran desafío en el grupo de lactantes, porque los síntomas son inespecíficos y se requiere de métodos invasivos para obtener el diagnóstico de certeza. Por otra parte es fundamental lograr el diagnóstico exacto, tanto para identificar a los pacientes con riesgo de daño renal como para evitar tratamientos innecesarios y evaluaciones costosas y potencialmente dañinas en niños sin riesgo.
El cuadro clínico es inespecífico y varía según la edad de presentación. La fiebre es un factor común en todas las edades y se considera el síntoma cardinal, aunque en lactantes su ausencia no descarta el compromiso renal. Los síntomas más frecuentes en el recién nacido son: ictericia, sepsis, mal incremento ponderal, vómitos, fiebre, orina de mal olor; en lactantes y preescolares: diarrea, mal incremento ponderal, vómitos, fiebre, orina de mal olor, disuria, dolor abdominal o en flanco, incontinencia urinaria; en el escolar: vómitos, fiebre, orina de mal olor, dolor abdominal o en flanco, incontinencia urinaria, disuria y/o polaquiuria y urgencia miccional. En los exámenes de laboratorio destaca el aumento de los parámetros inflamatorios de fase aguda, tales como recuento de glóbulos blancos, niveles de proteína C reactiva (PCR) y velocidad de hemosedimentación (VHS) y alteración del cintigrama renal con ácido dimercaptosuccínico marcado con tecnecio-99 (Tc99 DMSA).
Una vez que se realiza el diagnóstico de ITU se debe proseguir con un estudio de imágenes, con el objetivo de identificar anomalías del tracto urinario o vejiga susceptibles de tratamiento médico o quirúrgico. Dentro de los exámenes de imágenes destacan la ecotomografía renal y vesical, la uretrocistografía radiológica, la cistografía isotópica y el cintigrama renal con Tc99 DMSA. La medicina nuclear tiene muchas ventajas: es una técnica de diagnóstico que entrega información funcional y no tiene contraindicaciones, por lo que se puede usar a cualquier edad, incluso en el recién nacido; utiliza bajas dosis de radiación en comparación con la radiología convencional; y no requiere sedación, lo que es muy útil en lactantes. En medicina nuclear se utilizan radiofármacos como tecnecio 99, que se detectan mediante gammacámara y se leen mediante aplicación de softwares computacionales especializados.
Los exámenes de medicina nuclear disponibles para nefrourología son: cintigrafía cortical, también llamada cintigrama renal estático (CR estático), que se realiza con DMSA-Tc99; la cistografía isotópica, que puede ser directa o indirecta; el renograma con o sin furosemida, conocido también como cintigrama renal dinámico, donde destaca el estudio a través de compuestos marcados con Tecnecio como mercaptoacetiltriglicina (Mag3-Tc99m), etilendicisteina (EC-Tc99m) y ácido dietiltriaminopentaacético (DTPA-Tc99m). Además la medicina nuclear permite efectuar estudios de clearance plasmáticos.
Este examen, que utiliza como trazador Tc99 marcado con DMSA, tiene 84% de sensibilidad y 88% de especificidad para detectar lesiones corticales renales agudas producidas por pielonefritis y para lesiones secuelares (cicatrices); estas cifras son mejores que las de la pielografía endovenosa y la ecotomografía con método doppler. Otra ventaja es la alta reproducibilidad interobservador, con una correlación de 92%, lo que significa que es un examen poco dependiente del operador en comparación con la ecografía. El trazador se introduce por vía endovenosa; dos a tres horas después se captan imágenes en dirección posteroanterior; el DMSA es transportado al riñón por los capilares peritubulares, es captado por las células del túbulo proximal y a continuación se fija en las células, conformando la imagen de corteza renal.
El DMSA en ITU se puede indicar en fase aguda o en fase tardía. La primera comprende las primeras dos semanas desde el diagnóstico de pielonefritis hasta que se realiza el examen; pasado este límite de tiempo puede que no se encuentre ninguna alteración, lo que no descarta la presencia de compromiso parenquimatoso. En esta fase el DMSA está indicado:
La fase tardía de la ITU se define como aquel período entre seis a doce meses después de la infección, en cuyo caso el DMSA es el mejor método para detectar secuelas (cicatrices) renales.
El DMSA permite evaluar forma, tamaño y situación renal, si bien la ecografía es mejor para estos parámetros; permite evaluar el parénquima renal funcionante mediante el cálculo de la función renal relativa; y permite detectar lesiones corticales en PNA, que es su gran indicación, tanto en pielonefritis aguda como cicatrices renales. La función renal relativa, o función renal por separado, se obtiene mediante la división de la actividad de cada riñón por separado, medida durante la segunda fase, por la suma de la actividad de ambos. Lo normal es que cada riñón contribuya con 50 +/- 5%; cuando la función de un riñón se encuentra afectada su función relativa es inferior a 45% y se considera que no es recuperable por debajo de 10%.
El DMSA normal entrega una imagen en dirección posteroanterior en la que se aprecia ambos riñones, con el riñón derecho normalmente ubicado más abajo que el izquierdo debido a la presencia del hígado. La distribución del radiotrazador permite diferenciar claramente la corteza de la médula y observar los contornos renales, para detectar la presencia de lesiones (Fig. 3).
La imagen de un DMSA normal no es homogénea; si lo es, significa que la calidad técnica de la imagen es deficiente, salvo en niños muy pequeños en que esto puede ocurrir debido a la inmadurez de los órganos Sin embargo existe una serie de variantes normales, por lo que es muy importante que el cintigrama sea evaluado por médicos nucleares con experiencia en nefrología (Fig. 4).
Además de la imagen postero-anterior se debe contar con una placa oblicua posterior derecha para evaluar el riñón derecho, una oblicua posterior izquierda para el órgano izquierdo y una placa anteroposterior para evaluar riñones que no se encuentren en el mismo plano, es decir, uno delante de otro. No obstante, también se puede encontrar distintas variantes anatómicas, como el riñón en herradura o riñones ectópicos (Fig. 5).
Figura 5. DMSA, variantes anatómicas. A: Riñón en herradura. B: Riñón ectópico.
La función renal diferencial se calcula dividiendo el número de cuentas de la curva renográfica de un riñón por el número de cuentas totales; el valor normal es 50 +/- 5%. La siguiente imagen muestra un valor de 74% para la función del riñón derecho y de 26% para el izquierdo. Se puede apreciar además que el riñón izquierdo es de menor tamaño, está menos contrastado y tiene un contorno irregular, con aumento de la captación a nivel medular compatible con cierto grado de hidronefrosis, lo que permite concluir que existe daño renal izquierdo con alteración de la función, sin determinar si el daño es agudo o crónico (Fig. 6).
Figura 6. Función renal diferencial en DMSA. RI: 26%, RD: 74%.
Si la diferencia no es tan marcada, los riñones se pueden apreciar sin problemas con contornos netos y precisos y la distribución del radiofármaco es homogénea, lo más probable es que uno de los riñones sea más grande que el otro o que uno sea hipoplásico sin tener daño alguno; por lo tanto, además de la función relativa es importante ver las características del parénquima y las imágenes (Fig. 7).
Figura 7. Función renal diferencial en DMSA. RI: 42%, RD: 58%.
En la fase aguda de la pielonefritis se pueden ver elementos característicos, pero es poco frecuente encontrarlos: riñón grande, hipocontrastado difusamente e irregular, aunque tal como ya se mencionó, nunca se puede asegurar que las alteraciones descritas sean agudas (Fig. 8).
Figura 8. Lesiones de PNA en fase aguda en DMSA.
En la PNA se puede evaluar el riñón con imágenes de alta calidad si se utiliza un dispositivo estenopeico o pinhole. Las lesiones aparecen como áreas hipoactivas, pero no siempre es posible diferenciar entre lesiones agudas transitorias y lesiones crónicas o secuelas; en general un área polar grande hipoactiva, sin deformidad de contornos y de márgenes difusos probablemente evolucionará hacia la curación, mientras que contornos deformados con pérdida de volumen, probablemente corresponde a una cicatriz (Fig. 9).
Figura 9. Lesiones de PNA en fase aguda en DMSA.
No hay consenso en el tiempo que debe pasar para definir que la lesión es secuelar: el mayor porcentaje de los pacientes (70,2%) mejora a los seis meses, pero algunos pacientes se normalizan más tardíamente y alrededor de 23,8% de ellos queda con cicatriz al año.
Para determinar el desarrollo de secuelas se debe realizar un cintigrama entre seis meses y un año después de la infección; si las alteraciones de la captación son persistentes, se catalogan como cicatriz. (Fig. 10).
Figura 10. Secuelas renales en DMSA.
En resumen, el cintigrama con DMSA es una herramienta sensible y específica para detectar lesiones corticales; no es necesario hacerlo si el diagnóstico de PNA es claro o si la conducta de seguimiento o tratamiento no van a cambiar con el resultado del DMSA; este examen está indicado en caso de duda acerca del diagnóstico de PNA y para identificar grupos de alto riesgo y realizar detección de secuelas.
En un trabajo realizado en el hospital San Juan de Dios se estudiaron 143 niños que ingresaron por un primer episodio de ITU; la mayoría eran lactantes, puesto que los niños mayores en general no se hospitalizan, con una edad promedio de 14 meses (rango entre 8 días y 12 años); 66% eran mujeres. Todos presentaron cuadro febril con leucocitosis, VHS elevada, aumento de PCR, examen de orina alterado y urocultivo positivo. A todos se les realizó un cintigrama durante la primera semana y además se estudiaron con ecografía y uretrocistografía. Los resultados fueron concordantes con lo que se describe en la literatura: de los 143 niños con diagnóstico clínico categórico de PNA, 113 tuvieron un cintigrama anormal (79%) sin diferencias por edad o sexo. Esto significa que en alrededor de 20% de las infecciones urinarias febriles el cintigrama es normal, probablemente porque las lesiones son mínimas (< 5%) o porque no se alcanza a producir compromiso del parénquima renal propiamente tal. En estos casos el cintigrama no determina un cambio de conducta, pero permite asegurar que el paciente no presentará secuelas renales en el futuro.
De los parámetros evaluados: fiebre, aumento de PCR, aumento de VHS y leucocitosis; sólo el valor de PCR fue significativo para predecir que el cintigrama renal estaría alterado: en los pacientes con cintigrama normal la PCR fue 54,1 mg/dl en promedio, en cambio en los pacientes con cintigrama alterado el valor fue 137,6 mg/dl. No hubo correlación con la ecografía renal, lo que era esperable ya que ésta sirve para confirmar la presencia de ambos riñones, descartar obstrucción urinaria y pesquisar complicaciones como abscesos renales. El modo doppler ayuda a detectar disminución de la vascularización en las zonas de pielonefritis, pero el DMSA es la herramienta más sensible. De los pacientes con cintigrama alterado, 81% tenía ecografías renales normales y del total de 27 pacientes con cintigrama normal, 22 tuvieron ecografía normal y en sólo 5 pacientes resultaron alteradas. Tampoco se encontró correlación con reflujo, lo que también era esperable ya que el daño renal se produjo por infección: la mayoría de los pacientes con reflujo tenía un cintigrama anormal, a excepción de un paciente cuyo examen fue normal; sin embargo, un porcentaje importante de los pacientes sin reflujo también tuvo cintigramas anormales, lo que demuestra que la pielonefritis es en sí misma un factor de riesgo para tener alteración renal (2).
Los 84 niños con DMSA alterado durante la primera semana y sin malformaciones urinarias, salvo el reflujo vesicoureteral (RVU), se controlaron con DMSA a los seis meses y se encontró que en 70% de ellos el cintigrama se había normalizado y en 30% permanecía alterado. En éstos se volvió a repetir el cintigrama a los doce meses y en ese momento 6% de ellos tuvo un resultado normal y el 24% restante quedó con cicatrices renales. En resumen, al año de evolución 76% de los niños con DMSA alterado normalizó el cintigrama y 24% quedó con secuelas (Figura 11).
Figura 11. Estudio con DMSA en pielonefritis aguda. Experiencia en Hospital San Juan de Dios.
La uretrocistografía radiológica y la cistografía isotópica, directa o indirecta, son los exámenes útiles para evaluar RVU, que se define como el paso retrógrado de orina desde la vejiga al tracto urinario superior a través de una unión vesicoureteral incompetente. Es la anomalía urológica más frecuente en los niños, aumenta el riesgo de PNA y su frecuencia es desconocida, pero se estima en 0,5% a 3% en niños asintomáticos, 30% a 50% en lactantes con PNA y 10% en aquellos recién nacidos con diagnóstico prenatal de hidronefrosis.
La uretrocistografía radiológica es una técnica de exploración del tracto urinario inferior que se realiza a través de una sonda colocada en el extremo distal de la uretra a través de la cual se introduce medio de contraste; posteriormente se obtienen radiografías seriadas, tanto cuando se introduce el contraste como cuando el paciente realiza una micción. Entre sus ventajas, permite graduar la magnitud del reflujo y determinar la anatomía de la vejiga y la uretra, a diferencia de las técnicas isotópicas. Entre sus desventajas están la elevada exposición a radiación de la zona gonadal y un mayor porcentaje de falsos negativos, debido a que los episodios de reflujo son intermitentes. Este estudio se debe realizar en todo paciente de sexo masculino para evaluar la vía urinaria inferior; en caso de trastornos miccionales y en presencia de ecografías anormales.
La cistografía isotópica directa es un procedimiento en que se cateteriza la vejiga y se infunde suero fisiológico con un radiotrazador que utiliza tecnecio, lo que permite obtener una imagen continua en forma de película, que es más sensible para reflujo y con menor cantidad de radiación. Requiere dos a tres ciclos miccionales para aumentar su sensibilidad. Su desventaja es que no sirve para evaluar la anatomía, no permite graduar el reflujo; además tiene baja sensibilidad en reflujos leves. Está indicada para controlar RVU en pacientes de ambos sexos, especialmente en mujeres con ecografía normal y sin trastorno miccional.
La cistografía isotópica indirecta utiliza como técnica un renograma habitual como MAG 3, DTPA o ECTc99m. Entre sus ventajas se cuentan: es una técnica no invasiva; permite evaluar funcionalidad del riñón; tiene menor exposición de radiación, porque el radiofármaco se inyecta por vía endovenosa y se elimina por el riñón hacia la vejiga, la cual se debe vaciar apenas alcance su capacidad máxima para observar el RVU en todo el ciclo, por lo que se requiere que el niño tenga control del esfínter. Entre sus desventajas, es difícil de interpretar, se requiere colaboración por parte del paciente y tiene baja sensibilidad para evaluación del reflujo, la cual disminuye aún más si existen alteraciones en el vaciamiento y/o dilatación del sistema excretor. En un trabajo realizado por De Sadeleer en el que se comparó las técnicas de radiografía isotópica directa e indirecta en forma sincrónica en los mismos pacientes, se observó que de aquellos que tenían reflujo diagnosticado por técnica directa, la mayoría no se diagnosticaron por la técnica indirecta. Por otra parte, del total de pacientes a los que no se les diagnosticó reflujo con la técnica directa, sólo un paciente fue diagnosticado por la técnica indirecta. Por lo tanto, la cistografía indirecta tiene pocas indicaciones (3). En la Tabla I se resumen las características de los exámenes de medicina nuclear disponibles para el diagnóstico de RVU.
El renograma con diuréticos (CR dinámico) Mag3-Tc99m; EC-Tc99m; DTPA-Tc99m es una técnica que utiliza radiofármacos que deben ser excretados por el riñón en forma exclusiva sin retención por parte de las células, como DTPA, que se elimina por filtración glomerular y MAG3 o EC, que se eliminan por secreción tubular. La técnica provee imágenes secuenciales de la distribución del radioisótopo durante un período de 20 a 30 minutos. Este procedimiento permite estimar la función relativa y la excreción renal; sus principales indicaciones son: evaluación de una obstrucción de posible origen anatómico; pacientes con trasplante renal; y en aquellos adultos con hipertensión renovascular. No está indicado para evaluar daño cortical renal.

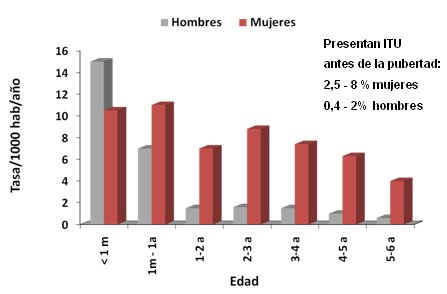 Figura 1. Incidencia de infección urinaria en la edad pediátrica, según sexo.
Figura 1. Incidencia de infección urinaria en la edad pediátrica, según sexo.

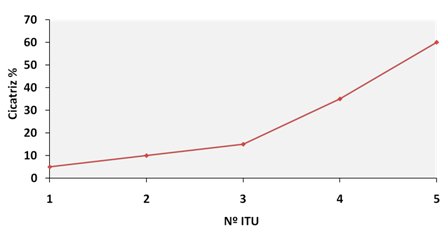 Figura 2. Curva de riesgo de daño renal.
Figura 2. Curva de riesgo de daño renal.

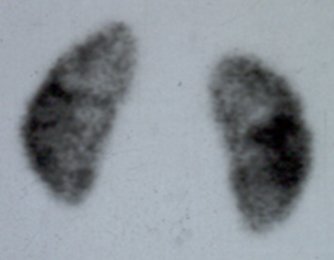 Figura 3. DMSA normal.
Figura 3. DMSA normal.

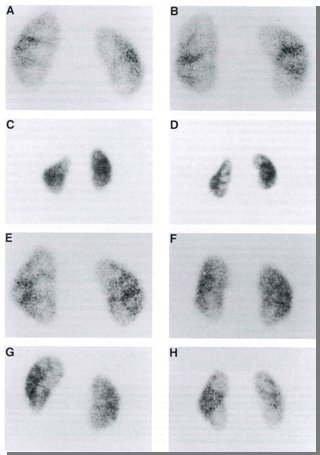 Figura 4. DMSA, variantes normales: A. Borde redondeado (izq). B. Borde rígido (izq). C. Bazo. D. Bazo. E. Triangular. F. Alargado. G. Forma de pera. H. Polos hipoactivos.
Figura 4. DMSA, variantes normales: A. Borde redondeado (izq). B. Borde rígido (izq). C. Bazo. D. Bazo. E. Triangular. F. Alargado. G. Forma de pera. H. Polos hipoactivos.

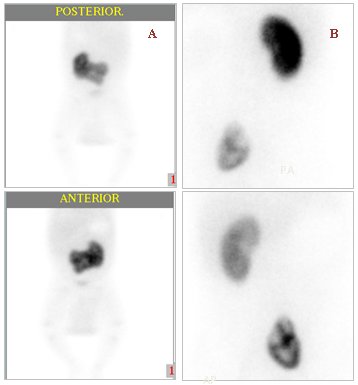 Figura 5. DMSA, variantes anatómicas. A: Riñón en herradura. B: Riñón ectópico.
Figura 5. DMSA, variantes anatómicas. A: Riñón en herradura. B: Riñón ectópico.

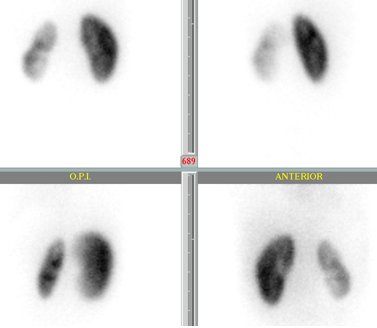 Figura 6. Función renal diferencial en DMSA. RI: 26%, RD: 74%.
Figura 6. Función renal diferencial en DMSA. RI: 26%, RD: 74%.

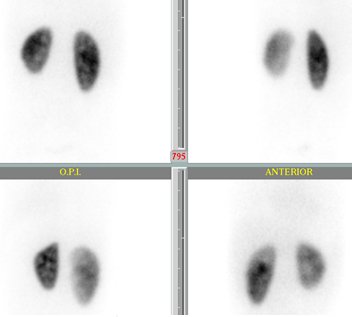 Figura 7. Función renal diferencial en DMSA. RI: 42%, RD: 58%.
Figura 7. Función renal diferencial en DMSA. RI: 42%, RD: 58%.

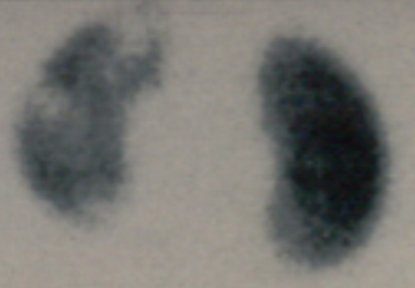 Figura 8. Lesiones de PNA en fase aguda en DMSA.
Figura 8. Lesiones de PNA en fase aguda en DMSA.

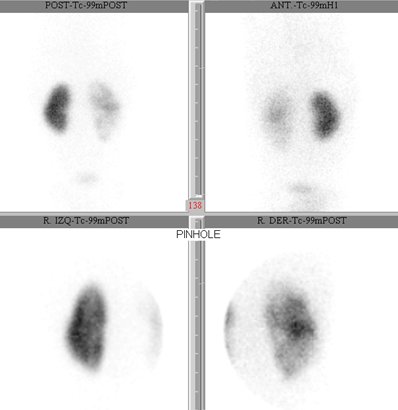 Figura 9. Lesiones de PNA en fase aguda en DMSA.
Figura 9. Lesiones de PNA en fase aguda en DMSA.

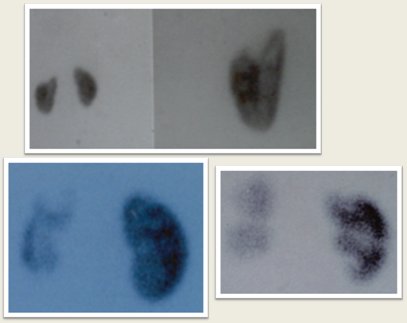 Figura 10. Secuelas renales en DMSA.
Figura 10. Secuelas renales en DMSA.

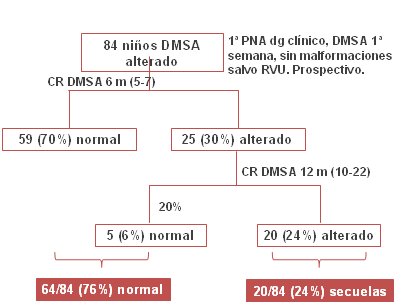 Figura 11. Estudio con DMSA en pielonefritis aguda. Experiencia en Hospital San Juan de Dios.
Figura 11. Estudio con DMSA en pielonefritis aguda. Experiencia en Hospital San Juan de Dios.

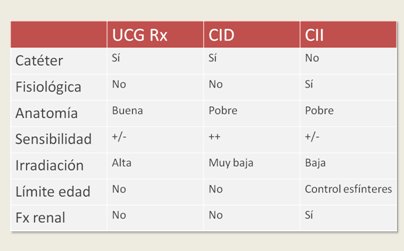 Tabla I. Características de la uretrocistografía radiológica (UCG Rx) y de la cistografía isotópica directa e indirecta (CID y CII) para el diagnóstico de RVU.
Tabla I. Características de la uretrocistografía radiológica (UCG Rx) y de la cistografía isotópica directa e indirecta (CID y CII) para el diagnóstico de RVU.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada de la conferencia que se dictó en el XLVIII Congreso Chileno de Pediatría, realizado en Viña del Mar entre el 26 y el 29 de Noviembre de 2008. El congreso fue organizado por la Sociedad Chilena de Pediatría bajo la presidencia de la Dra. Lidya Tellerías C.
 Autora:
Pilar Hevia Juricic[1]
Autora:
Pilar Hevia Juricic[1]

Citación: Hevia P. Nuclear medicine, urinary tract infection and kidney damage. Medwave 2009 Nov;9(11):e4256 doi: 10.5867/medwave.2009.11.4256
Fecha de publicación: 1/11/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Jodal U. The natural history of bacteriuria in childhood. Infect Dis Clin North Am. 1987 Dec;1(4):713-29. | PubMed |
Jodal U. The natural history of bacteriuria in childhood. Infect Dis Clin North Am. 1987 Dec;1(4):713-29. | PubMed | Donoso G, Lobo G, Arnello F, Arteaga MP, Hevia P, Rosati P, et al. Cintigrama renal DMSA en niños con primera pielonefritis aguda: correlación con exámenes de laboratorio, ecografía y la presencia de reflujo vesicoureteral. Rev Med Chil. 2004 Jan;132(1):58-64. | PubMed |
Donoso G, Lobo G, Arnello F, Arteaga MP, Hevia P, Rosati P, et al. Cintigrama renal DMSA en niños con primera pielonefritis aguda: correlación con exámenes de laboratorio, ecografía y la presencia de reflujo vesicoureteral. Rev Med Chil. 2004 Jan;132(1):58-64. | PubMed | De Sadeleer C, De Boe V, Keuppens F, Desprechins B, Verboven M, Piepsz A. How good is technetium-99m mercaptoacetyltriglycine indirect cystography? Eur J Nucl Med. 1994 Mar;21(3):223-7. | PubMed |
De Sadeleer C, De Boe V, Keuppens F, Desprechins B, Verboven M, Piepsz A. How good is technetium-99m mercaptoacetyltriglycine indirect cystography? Eur J Nucl Med. 1994 Mar;21(3):223-7. | PubMed |