 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el XVI Congreso Chileno de Osteología y Metabolismo Mineral realizado en Santiago el 18 y el 19 de abril de 2008. El congreso fue organizado por la Sociedad Chilena de Osteología y Metabolismo Mineral presidida por la Dra. Claudia Campusano.
En los últimos años se ha acumulado amplia evidencia que demuestra que los esteroides sexuales son importantes no sólo en la maduración, desarrollo y establecimiento de la función reproductiva en la mujer, sino también en funciones tan importantes como el mantenimiento de la función cognitiva, habilidades motrices, conducta afectiva, orientación espacial, estabilidad emocional y tolerancia al dolor, entre otras funciones.
El conocimiento actual, que se ha obtenido principalmente en modelos experimentales de roedores o primates, demuestra que desde el período embrionario los esteroides sexuales tienen una influencia importante en la citoarquitectura del sistema nervioso central (SNC) y en la diferenciación funcional de las áreas cerebrales, induciendo procesos de crecimiento, diferenciación neuronal y formación de conexiones sinápticas e iniciando la expresión de sus receptores específicos, esenciales en la vida adulta. Además se ha demostrado que participan activamente en la bioquímica cerebral, regulando la expresión de prácticamente todos los neurotramisores y neuromoduladores. En los primates, desde el período embrionario el cerebro contiene suficiente aromatasa para permitir la conversión extragonadal de testosterona en estrona (1, 2).
El efecto de los esteroides sexuales, en especial de los estrógenos, se ejerce principalmente por medio de receptores específicos, es decir, por mecanismos genómicos, que se han identificado con mucha certeza en distintas regiones de la corteza cerebral; no existe una región cerebral que no tenga receptores estrogénicos tipo alfa o beta, con las diferentes connotaciones que tienen éstos en la expresión biológica de los estrógenos. A nivel del SNC los estrógenos tienen efectos proliferativos, neuroprotectores, neuro-reparadores y participan en la plasticidad del circuito neuronal, la bioquímica cerebral y la regulación inmunológica (3, 4, 5). Sin embargo, también pueden actuar a través de una vía no genómica, lo que explica el rápido efecto de los estrógenos después de su administración y su participación en fenómenos tan importantes como la plasticidad y la reparación neuronal (6, 7) (Fig. 1).
Figura 1. Mecanismos no genómicos de la acción estrogénica en el SNC.
En cuanto a la evidencia experimental disponible, un trabajo clásico de Brinton (8) demostró que el agregado de estrógenos conjugados de equino en dosis de 1pg/ml al cultivo de neuronas de roedores por nueve días incrementa el número de prolongaciones dendríticas, que es un marcador del efecto proliferativo de los estrógenos (Fig. 2).
Figura 2. Los estrógenos incrementan el crecimiento de las dendritas.
En la siguiente imagen se observa, mediante un medio de contraste, cómo se facilitan las sinapsis entre dos neuronas cercanas una hora después de la exposición a estrógenos (Fig. 3).
Figura 3. Los estrógenos incrementan el crecimiento de las dendritas (círculo).
Gould describió lo mismo en una publicación de 1990: la adición de estrógenos a un cultivo neuronal aumentó en forma significativa las prolongaciones, especialmente en el área C1 del hipocampo (9). En el estudio de Brinton se demostró que los estrógenos también aumentan en forma significativa la longitud de los axones, que constituyen los nervios centrales o periféricos que se benefician con la administración de estas hormonas.
El circuito neuronal es el elemento más importante para la adecuada función cognoscitiva del ser humano y se ha demostrado que la administración de estrógenos mejora este circuito. En un estudio reciente, del año 2004, se ratificó el efecto positivo que tienen los estrógenos en la formación de nuevas espinas dendríticas en las neuronas del hipocampo: cuando al medio de cultivo se adicionó letrozole, un inhibidor de la aromatasa que disminuye las concentraciones de estradiol sintetizado por la propia neurona, disminuyó también la formación de nuevas dendritas (Fig. 4) (10).
Figura 4. Estrógenos y circuito neuronal.
Antes se pensaba que las neuronas tenían sólo una vida y no podían aumentar en número; sin embargo, en un estudio en cultivos de neuronas de ratas la administración de estrógenos se asoció a aparición de nuevas neuronas; éstas no tuvieron una vida prolongada y desaparecieron rápidamente, pero se demostró la alta capacidad regenerativa que inducen los estrógenos, al menos en animales de experimentación (Fig. 5) (11).
Figura 5. Los estrógenos inducen la capacidad regenerativa neuronal.
Las noxas más dañinas para el cerebro son las que incrementan los procesos oxidativos. Brinton, en un interesante estudio en el que evaluó el efecto del peróxido de hidrógeno sobre medios de cultivo neuronales (12), demostró que la adición de estrógenos disminuye la muerte neuronal (Fig. 6).
Thomas (13) demostró que el beta-mieloide, uno de los elementos característicos de la enfermedad de Alzheimer, está involucrado en la destrucción neuronal mientras que la adición de 17-beta estradiol incrementa significativamente la sobrevida de estas células (Fig. 7). Otros autores han observado el mismo efecto.
Figura 7. Efecto protector de la inflamación por los estrógenos.
Los estrógenos también reducen la isquemia cerebral. En un estudio realizado en un modelo animal se destruyó la arteria cerebral anterior en animales a los que se les había administrado estrógenos previamente y en controles. Se encontró daño neuronal significativamente mayor en las ratas que no recibieron el tratamiento hormonal (14).
Entre los mecanismos de neuroprotección propuestos para los estrógenos se cuentan: estabilización de la actividad mitocondrial (15); prevención de la pérdida de ATP; regulación mitocondrial del calcio (16); sinergia con factores neurotróficos como TGF-beta1-DA e IGF-1- DA, estimulando su síntesis (17); incremento de la síntesis de receptores estrogénicos en los astrocitos, haciéndolos más sensibles al efecto de estas hormonas (18); e inhibición de los receptores de NMDA (19).
Los factores neurotróficos de mayor interés en la actualidad son elementos de tipo proteico secretados por varios tipos de neuronas; existen muchos, pero los más importante son: NGF (factor de crecimiento neuronal), BDNF (factor neurotrófico derivado del cerebro), NT-3 (neurotrofina-3) y NT 4/5 (neurotrofina 4/5), todos ellos muy importantes en la reparación, plasticidad y supervivencia del circuito neuronal y de las neuronas, en general (20, 21). Estos factores neurotróficos se han identificado no sólo en las células del SNC: neuronas, astrocitos, microglia y oligodendrocitos, sino también en células endoteliales, células T, B y monocitos, macrófagos, mononucleares y plaquetas.
Se sabe que los estrógenos actúan en la bioquímica cerebral modulando la acetilcolina a través del incremento de la colina-acetil-transferasa, que favorece su síntesis; además disminuyen la acetilcolinesterasa, que facilita su degradación y aumentan los receptores muscarínicos, es decir, todo apunta a que la acetilcolina aumenta en la mujer que recibe estrógenos. Por otra parte se ha encontrado que los estrógenos disminuyen la monoaminoxidasa, enzima que degrada a la serotonina, importante neurotransmisor implicado en diversas funciones como la regulación del apetito y la conducta; además incrementan la albúmina y el triptofano, que es el precursor de la serotonina y aumentan sus receptores a nivel del SNC. Con respecto a la dopamina, los estrógenos disminuyen la catecol-O-metiltransferasa, enzima que degrada a la dopamina, al tiempo que incrementan sus receptores (22, 23, 24). A nivel de la actividad noradrenérgica los estrógenos disminuyen la catecolmetiltransferasa, que es la enzima que degrada a la noradrenalina y modula la sensibilidad a sus receptores (25, 26). Finalmente los estrógenos aumentan las endorfinas, con su correspondiente acción sobre el estado de ánimo y la regulación de algunas actividades neurológicas (27).
En cuanto a la vascularización del SNC, que representa alrededor de un tercio del volumen del cerebro, se sabe que los estrógenos producen vasodilatación sostenida, lo que favorece la llegada de mayor flujo de sangre y por lo tanto, de oxígeno y nutrientes, básicamente glucosa (28). Los estudios demuestran que los estrógenos incrementan el transporte y metabolismo de la glucosa en el territorio cerebral (29, 30).
De las células que existen en el cerebro sólo una de cada diez es una neurona; las demás componen la sustancia glial, destacando los astrocitos y la microglía. Los astrocitos intervienen en la remodelación sináptica sintetizando factores de crecimiento y factores neurotróficos. La células de la microglía sintetizan citoquinas, óxido nítrico, radicales libres y factores de crecimiento, pero aparentemente su función más importante es producir las proteínas Fas/Fas L y C40, que se unen a células como los linfocitos y migran al parénquima neuronal a través de la circulación, pudiendo causar problemas inflamatorios (31, 32, 33), como se resume en la Fig. 8.
Figura 8. Correlación hormonal e inmunológica en el SNC.
En suma, los esteroides sexuales tienen las siguientes funciones en el SNC:
En un metaanálisis en el que se incluyó a los estudios epidemiológicos más importantes sobre terapia estrogénica y prevención de la enfermedad de Alzheimer se encontró que prácticamente todos ellos demostraban efectos beneficiosos (34). Asimismo, en el Cache County Study, cuyos resultados se publicaron en 2001, se observó que la terapia de reemplazo hormonal se asociaba a menor deterioro cognitivo que el placebo en un seguimiento de 3 años (35). Otro estudio aleatorio, también publicado en 2001 en el que se administró estrógenos por vía oral y por vía transdérmica, se observó mantención de la función cognoscitiva y menor prevalencia de enfermedad de Alzheimer y demencia senil en las mujeres tratadas (36). Sin embargo, en una de las ramas del estudio WHI no se encontró disminución del riesgo de demencia con la administración de estrógenos conjugados de equino más medroxiprogesterona acetato; incluso fue más peligroso este tratamiento que el placebo (Fig. 9). El efecto sobre la función cognoscitiva mostró la misma tendencia, con disminución de dicha función en comparación con las mujeres que sólo recibieron placebo (37).
Figura 9. WHIMS: riesgo de demencia.
En otro estudio se administró sólo estrógenos, pensando que tal vez no se hubiera obtenido el efecto esperado en el WHI debido a la asociación con progestinas, pero tampoco se encontró una mejoría de la función cognoscitiva (38). En el estudio MIRAGE, en el que se siguió a una cohorte de mujeres que recibieron tratamiento hormonal de la menopausia con estrógenos por más de seis meses, el análisis por grupos de edad demostró que mientras más joven es la paciente menor es su riesgo de presentar enfermedad de Alzheimer (30). Los autores, Sheerwin y Henderson, consideran que existe una ventana de oportunidad dentro de la cual se debe comenzar el tratamiento, ya que en ese momento no hay daño en el SNC, de modo que el tratamiento hormonal tendrá efectos positivos sobre la mantención de la estructura neurológica, función bioquímica y flujo cerebral. Esta ventana de oportunidad se ubica en los cinco primeros años de la menopausia, cuando se presentan los síntomas vasomotores, se precipitan los cambios lipídicos, se inicia la pérdida acelerada del contenido mineral óseo y comienza el deterioro neurológico (Fig. 10).
Figura 10. Ventana de oportunidad.

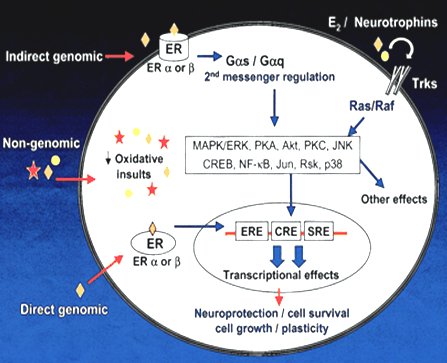 Figura 1. Mecanismos no genómicos de la acción estrogénica en el SNC.
Figura 1. Mecanismos no genómicos de la acción estrogénica en el SNC.

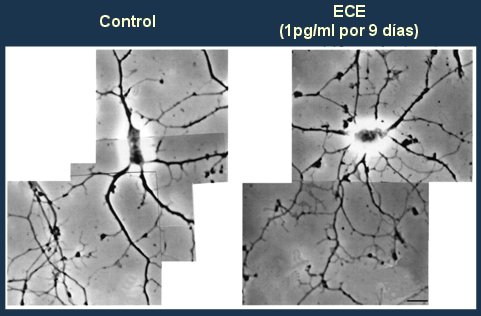 Figura 2. Los estrógenos incrementan el crecimiento de las dendritas.
Figura 2. Los estrógenos incrementan el crecimiento de las dendritas.

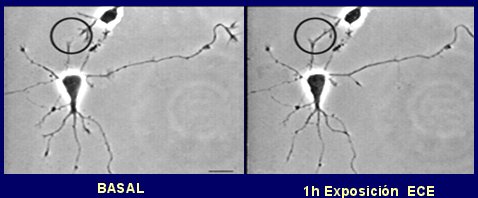 Figura 3. Los estrógenos incrementan el crecimiento de las dendritas (círculo).
Figura 3. Los estrógenos incrementan el crecimiento de las dendritas (círculo).

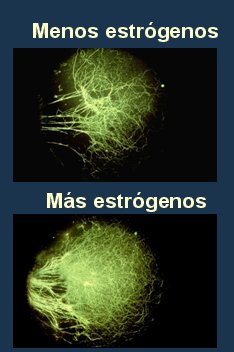 Figura 4. Estrógenos y circuito neuronal.
Figura 4. Estrógenos y circuito neuronal.

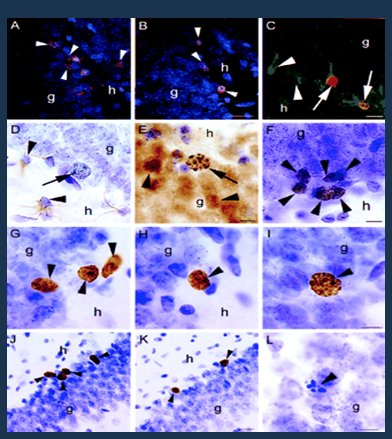 Figura 5. Los estrógenos inducen la capacidad regenerativa neuronal.
Figura 5. Los estrógenos inducen la capacidad regenerativa neuronal.

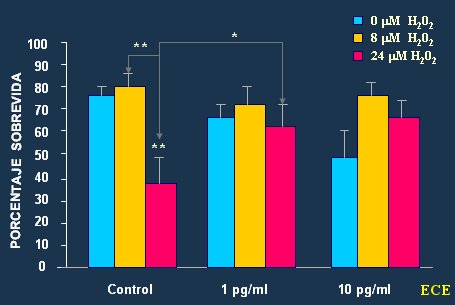 Figura 6. Prevención del daño oxidativo en neuronas corticales mediante la administración de estrógenos conjugados (ECE).
Figura 6. Prevención del daño oxidativo en neuronas corticales mediante la administración de estrógenos conjugados (ECE).

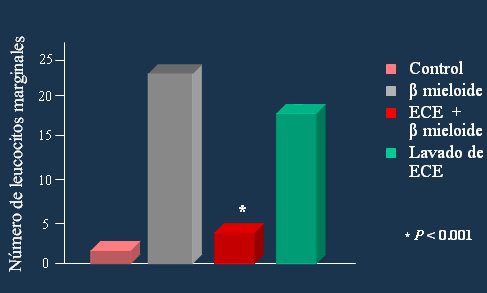 Figura 7. Efecto protector de la inflamación por los estrógenos.
Figura 7. Efecto protector de la inflamación por los estrógenos.

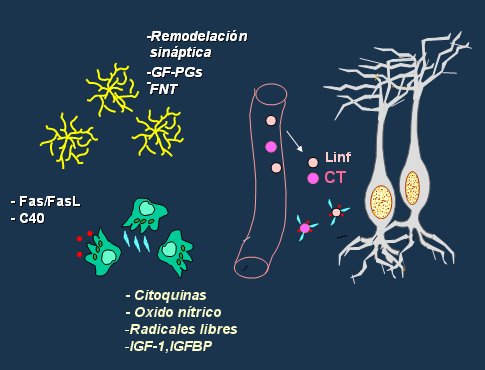 Figura 8. Correlación hormonal e inmunológica en el SNC.
Figura 8. Correlación hormonal e inmunológica en el SNC.

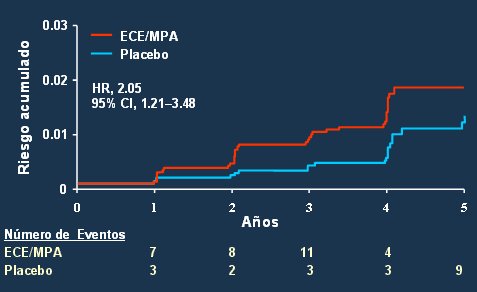 Figura 9. WHIMS: riesgo de demencia.
Figura 9. WHIMS: riesgo de demencia.

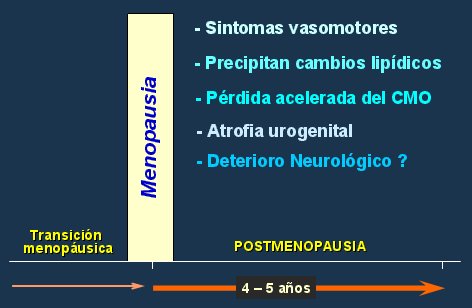 Figura 10. Ventana de oportunidad.
Figura 10. Ventana de oportunidad.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el XVI Congreso Chileno de Osteología y Metabolismo Mineral realizado en Santiago el 18 y el 19 de abril de 2008. El congreso fue organizado por la Sociedad Chilena de Osteología y Metabolismo Mineral presidida por la Dra. Claudia Campusano.
 Autor:
Wellington Aguirre[1]
Autor:
Wellington Aguirre[1]

Citación: Aguirre W. Sex steroids and central nervous system. Medwave 2009 May;9(5):e3916 doi: 10.5867/medwave.2009.05.3916
Fecha de publicación: 1/5/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Romeo RD, McCarthy JB, Wang A, Milner TA, McEwen BS. Sex differences in hippocampal estradiol-induced N-methyl-D-aspartic acid binding and ultrastructural localization of estrogen receptor-alpha. Neuroendocrinology. 2005;81(6):391-9. Epub 2005 Nov 4. | CrossRef | PubMed |
Romeo RD, McCarthy JB, Wang A, Milner TA, McEwen BS. Sex differences in hippocampal estradiol-induced N-methyl-D-aspartic acid binding and ultrastructural localization of estrogen receptor-alpha. Neuroendocrinology. 2005;81(6):391-9. Epub 2005 Nov 4. | CrossRef | PubMed | Toran-Allerand CD. Sex steroids and the development of the newborn mouse hypothalamus and preoptic area in vitro. II. Morphological correlates and hormonal specificity. Brain Res. 1980 May 12;189(2):413-27. | CrossRef | PubMed |
Toran-Allerand CD. Sex steroids and the development of the newborn mouse hypothalamus and preoptic area in vitro. II. Morphological correlates and hormonal specificity. Brain Res. 1980 May 12;189(2):413-27. | CrossRef | PubMed | Gruber CJ, Tschugguel W, Schneeberger C, Huber JC. Production and actions of estrogens. N Engl J Med. 2002 Jan 31;346(5):340-52. | CrossRef | PubMed |
Gruber CJ, Tschugguel W, Schneeberger C, Huber JC. Production and actions of estrogens. N Engl J Med. 2002 Jan 31;346(5):340-52. | CrossRef | PubMed | Henderson VW, Paganini-Hill A, Emanuel CK, Dunn ME, Buckwalter JG. Estrogen replacement therapy in older women. Comparisons between Alzheimer's disease cases and nondemented control subjects. Arch Neurol. 1994 Sep;51(9):896-900. | PubMed |
Henderson VW, Paganini-Hill A, Emanuel CK, Dunn ME, Buckwalter JG. Estrogen replacement therapy in older women. Comparisons between Alzheimer's disease cases and nondemented control subjects. Arch Neurol. 1994 Sep;51(9):896-900. | PubMed | Loy R, Gerlach JL, McEwen BS. Autoradiographic localization of estradiol-binding neurons in the rat hippocampal formation and entorhinal cortex. Brain Res. 1988 Apr 1;467(2):245-51. | PubMed |
Loy R, Gerlach JL, McEwen BS. Autoradiographic localization of estradiol-binding neurons in the rat hippocampal formation and entorhinal cortex. Brain Res. 1988 Apr 1;467(2):245-51. | PubMed | Herrick SP, Waters EM, Drake CT, McEwen BS, Milner TA. Extranuclear estrogen receptor beta immunoreactivity is on doublecortin-containing cells in the adult and neonatal rat dentate gyrus. Brain Res. 2006 Nov 22;1121(1):46-58. Epub 2006 Oct 5. | CrossRef | PubMed |
Herrick SP, Waters EM, Drake CT, McEwen BS, Milner TA. Extranuclear estrogen receptor beta immunoreactivity is on doublecortin-containing cells in the adult and neonatal rat dentate gyrus. Brain Res. 2006 Nov 22;1121(1):46-58. Epub 2006 Oct 5. | CrossRef | PubMed | Milner TA, McEwen BS, Hayashi S, Li CJ, Reagan LP, Alves SE. Ultrastructural evidence that hippocampal alpha estrogen receptors are located at extranuclear sites. J Comp Neurol. 2001 Jan 15;429(3):355-71. | CrossRef | PubMed |
Milner TA, McEwen BS, Hayashi S, Li CJ, Reagan LP, Alves SE. Ultrastructural evidence that hippocampal alpha estrogen receptors are located at extranuclear sites. J Comp Neurol. 2001 Jan 15;429(3):355-71. | CrossRef | PubMed | Brinton RD. Investigative models for determining hormone therapy-induced outcomes in brain: evidence in support of a healthy cell bias of estrogen action. Ann N Y Acad Sci. 2005 Jun;1052:57-74. | CrossRef | PubMed |
Brinton RD. Investigative models for determining hormone therapy-induced outcomes in brain: evidence in support of a healthy cell bias of estrogen action. Ann N Y Acad Sci. 2005 Jun;1052:57-74. | CrossRef | PubMed | Gould E, Woolley CS, Frankfurt M, McEwen BS. Gonadal steroids regulate dendritic spine density in hippocampal pyramidal cells in adulthood. J Neurosci. 1990 Apr;10(4):1286-91. | PubMed |
Gould E, Woolley CS, Frankfurt M, McEwen BS. Gonadal steroids regulate dendritic spine density in hippocampal pyramidal cells in adulthood. J Neurosci. 1990 Apr;10(4):1286-91. | PubMed | Kretz O, Fester L, Wehrenberg U, Zhou L, Brauckmann S, Zhao S, et al. Hippocampal synapses depend on hippocampal estrogen synthesis. J Neurosci. 2004 Jun 30;24(26):5913-21. | CrossRef | PubMed |
Kretz O, Fester L, Wehrenberg U, Zhou L, Brauckmann S, Zhao S, et al. Hippocampal synapses depend on hippocampal estrogen synthesis. J Neurosci. 2004 Jun 30;24(26):5913-21. | CrossRef | PubMed | Tanapat P, Hastings NB, Reeves AJ, Gould E. Estrogen stimulates a transient increase in the number of new neurons in the dentate gyrus of the adult female rat. J Neurosci. 1999 Jul 15;19(14):5792-801. | PubMed |
Tanapat P, Hastings NB, Reeves AJ, Gould E. Estrogen stimulates a transient increase in the number of new neurons in the dentate gyrus of the adult female rat. J Neurosci. 1999 Jul 15;19(14):5792-801. | PubMed | Brinton RD, Proffitt P, Tran J, Luu R. Equilin, a principal component of the estrogen replacement therapy premarin, increases the growth of cortical neurons via an NMDA receptor-dependent mechanism. Exp Neurol. 1997 Oct;147(2):211-20. | CrossRef | PubMed |
Brinton RD, Proffitt P, Tran J, Luu R. Equilin, a principal component of the estrogen replacement therapy premarin, increases the growth of cortical neurons via an NMDA receptor-dependent mechanism. Exp Neurol. 1997 Oct;147(2):211-20. | CrossRef | PubMed | Rhodin J, Thomas T, Bryant M, Clark L, Sutton ET. Animal model of vascular inflammation. J Submicrosc Cytol Pathol. 1999 Jul;31(3):305-11. | PubMed |
Rhodin J, Thomas T, Bryant M, Clark L, Sutton ET. Animal model of vascular inflammation. J Submicrosc Cytol Pathol. 1999 Jul;31(3):305-11. | PubMed | Wise PM, Dubal DB. Estradiol protects against ischemic brain injury in middle-aged rats. Biol Reprod. 2000 Oct;63(4):982-5. | CrossRef | PubMed |
Wise PM, Dubal DB. Estradiol protects against ischemic brain injury in middle-aged rats. Biol Reprod. 2000 Oct;63(4):982-5. | CrossRef | PubMed | Wang J, Green PS, Simpkins JW. Estradiol protects against ATP depletion, mitochondrial membrane potential decline and the generation of reactive oxygen species induced by 3-nitroproprionic acid in SK-N-SH human neuroblastoma cells. J Neurochem. 2001 May;77(3):804-11. | CrossRef | PubMed |
Wang J, Green PS, Simpkins JW. Estradiol protects against ATP depletion, mitochondrial membrane potential decline and the generation of reactive oxygen species induced by 3-nitroproprionic acid in SK-N-SH human neuroblastoma cells. J Neurochem. 2001 May;77(3):804-11. | CrossRef | PubMed | Nilsen J, Diaz Brinton R. Mechanism of estrogen-mediated neuroprotection: regulation of mitochondrial calcium and Bcl-2 expression. Proc Natl Acad Sci U S A. 2003 Mar 4;100(5):2842-7. Epub 2003 Feb 25. | CrossRef | PubMed | PMC |
Nilsen J, Diaz Brinton R. Mechanism of estrogen-mediated neuroprotection: regulation of mitochondrial calcium and Bcl-2 expression. Proc Natl Acad Sci U S A. 2003 Mar 4;100(5):2842-7. Epub 2003 Feb 25. | CrossRef | PubMed | PMC | Dhandapani KM, Brann DW. Estrogen-astrocyte interactions: implications for neuroprotection. BMC Neurosci. 2002 Jun 7;3:6. | CrossRef | PubMed | PMC |
Dhandapani KM, Brann DW. Estrogen-astrocyte interactions: implications for neuroprotection. BMC Neurosci. 2002 Jun 7;3:6. | CrossRef | PubMed | PMC | Blurton-Jones M, Tuszynski MH. Reactive astrocytes express estrogen receptors in the injured primate brain. J Comp Neurol. 2001 Apr 23;433(1):115-23. | CrossRef | PubMed |
Blurton-Jones M, Tuszynski MH. Reactive astrocytes express estrogen receptors in the injured primate brain. J Comp Neurol. 2001 Apr 23;433(1):115-23. | CrossRef | PubMed | McEwen B, Akama K, Alves S, Brake WG, Bulloch K, Lee S, et al. Tracking the estrogen receptor in neurons: implications for estrogen-induced synapse formation. Proc Natl Acad Sci U S A. 2001 Jun 19;98(13):7093-100. | CrossRef | PubMed | PMC |
McEwen B, Akama K, Alves S, Brake WG, Bulloch K, Lee S, et al. Tracking the estrogen receptor in neurons: implications for estrogen-induced synapse formation. Proc Natl Acad Sci U S A. 2001 Jun 19;98(13):7093-100. | CrossRef | PubMed | PMC | Begliuomini S, Casarosa E, Pluchino N, Lenzi E, Centofanti M, Freschi L, et al. Influence of endogenous and exogenous sex hormones on plasma brain-derived neurotrophic factor. Hum Reprod. 2007 Apr;22(4):995-1002. Epub 2007 Jan 24. | CrossRef | PubMed |
Begliuomini S, Casarosa E, Pluchino N, Lenzi E, Centofanti M, Freschi L, et al. Influence of endogenous and exogenous sex hormones on plasma brain-derived neurotrophic factor. Hum Reprod. 2007 Apr;22(4):995-1002. Epub 2007 Jan 24. | CrossRef | PubMed | Sohrabji F, Lewis DK. Estrogen-BDNF interactions: implications for neurodegenerative diseases. Front Neuroendocrinol. 2006 Dec;27(4):404-14. Epub 2006 Oct 27. | CrossRef | PubMed | PMC |
Sohrabji F, Lewis DK. Estrogen-BDNF interactions: implications for neurodegenerative diseases. Front Neuroendocrinol. 2006 Dec;27(4):404-14. Epub 2006 Oct 27. | CrossRef | PubMed | PMC | Norbury R, Travis MJ, Erlandsson K, Waddington W, Ell PJ, Murphy DG. Estrogen therapy and brain muscarinic receptor density in healthy females: a SPET study. Horm Behav. 2007 Feb;51(2):249-57. Epub 2006 Dec 14. | CrossRef | PubMed |
Norbury R, Travis MJ, Erlandsson K, Waddington W, Ell PJ, Murphy DG. Estrogen therapy and brain muscarinic receptor density in healthy females: a SPET study. Horm Behav. 2007 Feb;51(2):249-57. Epub 2006 Dec 14. | CrossRef | PubMed | Tao X, Shu-Leong H, Ramsden D. Estrogen can down-regulate the human catechol-O-methyltransferase gene expression: its implication in Parkinson's disease. Mov Disord 1998; 13(suppl 2):114.
Tao X, Shu-Leong H, Ramsden D. Estrogen can down-regulate the human catechol-O-methyltransferase gene expression: its implication in Parkinson's disease. Mov Disord 1998; 13(suppl 2):114.  Schumacher M. Rapid membrane effects of steroid hormones: an emerging concept in neuroendocrinology. Trends Neurosci. 1990 Sep;13(9):359-62. | CrossRef | PubMed |
Schumacher M. Rapid membrane effects of steroid hormones: an emerging concept in neuroendocrinology. Trends Neurosci. 1990 Sep;13(9):359-62. | CrossRef | PubMed | Sulser F, Janowsky AJ, Okada F, Manier DH, Mobley PL. Regulation of recognition and action function of the norepinephrine (NE) receptor-coupled adenylate cyclase system in brain: implications for the therapy of depression. Neuropharmacology. 1983 Mar;22(3 Spec No):425-31. | PubMed |
Sulser F, Janowsky AJ, Okada F, Manier DH, Mobley PL. Regulation of recognition and action function of the norepinephrine (NE) receptor-coupled adenylate cyclase system in brain: implications for the therapy of depression. Neuropharmacology. 1983 Mar;22(3 Spec No):425-31. | PubMed | Seifer DB, Collins RL. Current concepts of beta-endorphin physiology in female reproductive dysfunction. Fertil Steril. 1990 Nov;54(5):757-71. | PubMed |
Seifer DB, Collins RL. Current concepts of beta-endorphin physiology in female reproductive dysfunction. Fertil Steril. 1990 Nov;54(5):757-71. | PubMed | Takeyoshi O, Yasuaki T, Kunihiro I, Hiroshi M, Teruo I, YoshihikoS, et al. Estrogen increases cerebral and cerebellar blood flows in postmenopausal women. Menopause 1995; 2:13-18. | Link |
Takeyoshi O, Yasuaki T, Kunihiro I, Hiroshi M, Teruo I, YoshihikoS, et al. Estrogen increases cerebral and cerebellar blood flows in postmenopausal women. Menopause 1995; 2:13-18. | Link | Bishop J, Simpkins JW. Estradiol enhances brain glucose uptake in ovariectomized rats. Brain Res Bull. 1995;36(3):315-20. | CrossRef | PubMed |
Bishop J, Simpkins JW. Estradiol enhances brain glucose uptake in ovariectomized rats. Brain Res Bull. 1995;36(3):315-20. | CrossRef | PubMed | Metz TJ, Colasante DA, Brown T, Kinnunen L, Cooper M. Effects of premarin and evista on cerebral metabolism of glucose in healthy postmenopausal women. Tenth Annual Meeting of NAMS 1999; 6 (4): 326–7. | Link |
Metz TJ, Colasante DA, Brown T, Kinnunen L, Cooper M. Effects of premarin and evista on cerebral metabolism of glucose in healthy postmenopausal women. Tenth Annual Meeting of NAMS 1999; 6 (4): 326–7. | Link | Cui W, Allen ND, Skynner M, Gusterson B, Clark AJ. Inducible ablation of astrocytes shows that these cells are required for neuronal survival in the adult brain. Glia. 2001 Jun;34(4):272-82. | CrossRef | PubMed |
Cui W, Allen ND, Skynner M, Gusterson B, Clark AJ. Inducible ablation of astrocytes shows that these cells are required for neuronal survival in the adult brain. Glia. 2001 Jun;34(4):272-82. | CrossRef | PubMed | Mor G, Nilsen J, Horvath T, Bechmann I, Brown S, Garcia-Segura LM, et al. Estrogen and microglia: A regulatory system that affects the brain. J Neurobiol. 1999 Sep 15;40(4):484-96. | CrossRef | PubMed |
Mor G, Nilsen J, Horvath T, Bechmann I, Brown S, Garcia-Segura LM, et al. Estrogen and microglia: A regulatory system that affects the brain. J Neurobiol. 1999 Sep 15;40(4):484-96. | CrossRef | PubMed | Nilsen J, Mor G, Naftolin F. Estrogen-regulated developmental neuronal apoptosis is determined by estrogen receptor subtype and the Fas/Fas ligand system. J Neurobiol. 2000 Apr;43(1):64-78. | CrossRef | PubMed |
Nilsen J, Mor G, Naftolin F. Estrogen-regulated developmental neuronal apoptosis is determined by estrogen receptor subtype and the Fas/Fas ligand system. J Neurobiol. 2000 Apr;43(1):64-78. | CrossRef | PubMed | Henderson VW. The Menopause at the Millenium. NY: Parthenon Publ, 2000.
Henderson VW. The Menopause at the Millenium. NY: Parthenon Publ, 2000.  Carlson MC, Zandi PP, Plassman BL, Tschanz JT, Welsh-Bohmer KA, Steffens DC, et al. Hormone replacement therapy and reduced cognitive decline in older women: the Cache County Study. Neurology. 2001 Dec 26;57(12):2210-6. | PubMed |
Carlson MC, Zandi PP, Plassman BL, Tschanz JT, Welsh-Bohmer KA, Steffens DC, et al. Hormone replacement therapy and reduced cognitive decline in older women: the Cache County Study. Neurology. 2001 Dec 26;57(12):2210-6. | PubMed | Asthana S, Baker LD, Craft S, Stanczyk FZ, Veith RC, Raskind MA, et al. High-dose estradiol improves cognition for women with AD: results of a randomized study. Neurology. 2001 Aug 28;57(4):605-12. | PubMed |
Asthana S, Baker LD, Craft S, Stanczyk FZ, Veith RC, Raskind MA, et al. High-dose estradiol improves cognition for women with AD: results of a randomized study. Neurology. 2001 Aug 28;57(4):605-12. | PubMed | Shumaker SA, Legault C, Rapp SR, Thal L, Wallace RB, Ockene JK, et al. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women's Health Initiative Memory Study: a randomized controlled trial. JAMA. 2003 May 28;289(20):2651-62. | CrossRef | PubMed |
Shumaker SA, Legault C, Rapp SR, Thal L, Wallace RB, Ockene JK, et al. Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women's Health Initiative Memory Study: a randomized controlled trial. JAMA. 2003 May 28;289(20):2651-62. | CrossRef | PubMed |