 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el V Congreso de la Asociación Chilena de Nutrición Clínica y Metabolismo realizado en Viña del Mar entre el 23 y 26 de Abril de 2008. El congreso fue organizado por la Asociación Chilena de Nutrición Clínica y Metabolismo, bajo la presidencia del Dr. Fernando Carrasco Naranjo. La edición científica de este artículo fue realizada por el Dr. Fernando Carrasco N.
La meta terapéutica en casos de dislipidemia depende de la categoría de riesgo, establecida por el NCEP ATP III (National Cholesterol Education Program, Adult Treatment Panel III) (1). Esta guía establece que se debe lograr valores de colesterol de LDL (LDL-c) inferiores a 70 mg/dl en pacientes con enfermedad coronaria o riesgo equivalente (> 20% en 10 años) de la categoría de muy alto riesgo, mientras que en los pacientes que presentan sólo un factor de riesgo para enfermedad cardiovascular se debe lograr valores inferiores a 160. Además se indica los valores sobre los cuales se debe considerar agregar una opción farmacológica y se recomienda hacerlo si los valores están bajo la meta, pero sobre la meta para el siguiente nivel de riesgo (Tabla I).
Los últimos estudios relacionados con la obesidad señalan que menos de 10% de las personas con índice de masa corporal (IMC) superior a 30 kg/m2 poseen sólo un factor de riesgo y entran en la categoría de bajo riesgo de enfermedad cardiovascular, grupo en el cual también se incluyen los pacientes sin factores de riesgo, que son una minoría. 90% de la población obesa tiene dos o más factores de riesgo cardiovascular, sin que se haya diagnosticado enfermedad cardiovascular o diabetes. El paciente obeso con síndrome metabólico tiene alterado el metabolismo de los triglicéridos y el HDL, por lo que es importante incorporar en el diagnóstico la medición del perfil lipídico. En la actualidad el tratamiento apunta a modificar los componentes del síndrome metabólico a través del cambio del estilo de vida, enfocado en dieta saludable, incremento de la actividad física y reducción del peso corporal y la grasa abdominal, lo que reduce los triglicéridos, aumenta el colesterol HDL y reduce la presión arterial, la glicemia y la respuesta inflamatoria.
La reducción del peso corporal permite mejorar la hipertensión (5%), la tolerancia a la glucosa (5%), la dislipidemia (10%) y la apnea obstructiva del sueño (5%); sin embargo, esta reducción debe ser superior a 5% para lograr mejoría del nivel de colesterol HDL y triglicéridos. Al respecto, es importante recordar que mientras el paciente está en período de baja de peso sus valores de perfil lipídico son inferiores a los reales, por lo que se recomienda esperar a que el peso del paciente se estabilice, lo que ocurre en alrededor de seis semanas, para obtener valores confiables.
El estudio Look AHEAD (Action For Health in Diabetes), un estudio multicéntrico aleatorio que contó con el respaldo del Instituto Nacional de Diabetes, tuvo como principal objetivo medir el efecto sobre la pérdida de peso de cambios en el estilo de vida dirigidos a disminuir la ingesta calórica y aumentar el ejercicio físico. El estudio se enfocó en el efecto de dichos cambios sobre la enfermedad más relacionada con el sobrepeso y la obesidad: la diabetes tipo 2, y sobre las enfermedades cardiovasculares, que son las que provocan mayor morbilidad y mortalidad. En un grupo se hizo un cambio intensivo en el estilo de vida y en otro grupo se entregó educación sobre la diabetes mellitus. Hubo una diferencia significativa en la pérdida de peso entre ambos grupos, con 8,6% versus 0,7% a favor del grupo en que se hizo cambio de estilo de vida. Los lípidos, los triglicéridos y la prevalencia de síndrome metabólico también se redujeron significativamente más en este grupo (2). El estudio demostró, además, que la pérdida de peso en un año tiene muchos beneficios en cuanto al control lipídico y a la reducción de los factores de riesgo cardiovascular (Tabla II).
En los pacientes con obesidad visceral se puede presentar hígado graso con esteatosis hepática; de hecho, el foie gras se obtiene de hígado de ganso hipertrofiado luego de tres meses de sobrealimentación e inactividad física. De la misma manera se producen las alteraciones hepáticas en los pacientes con hígado graso por enfermedad no alcohólica, síndrome metabólico, resistencia a la insulina y obesidad.
La definición de hígado graso por enfermedad no alcohólica relaciona la esteatosis hepática, la esteatohepatitis, la fibrosis y la cirrosis. “NASH” o “non alcoholic steatohepatitis” es el término que se usa para describir la esteatohepatitis no alcohólica, cuyo diagnóstico final se hace mediante el estudio histológico, que revela necroinflamación, fibrosis y cirrosis. La histología de la esteatohepatitis no alcohólica es casi idéntica a la de la hepatitis aguda por alcohol.
La patogenia del hígado graso por enfermedad no alcohólica tiene como base la resistencia a la insulina, aunque también puede partir por otros factores menos frecuentes, como mutaciones en la ApoB, deficiencia de colina, exceso de carbohidratos, ingesta de drogas como tamoxifeno y toxinas (3). La resistencia insulínica o estos factores (first hit) desencadenan una respuesta inflamatoria multiorgánica que favorece la acumulación de ácidos grasos en el hígado. La esteatohepatitis no alcohólica es el resultado de un segundo mecanismo de daño (second hit) dado por la liberación de ácidos grasos libres y mediadores de estrés oxidativo que conducen a daño celular y esteatohepatitis (Fig. 1).
Figura 1. Patogenia del hígado graso por enfermedad no alcohólica.
La prevalencia de esteatosis en Estados Unidos es de 20 a 30% en los adultos, de los cuales casi dos tercios son pacientes obesos con evidencia de esteatosis hepática. La esteatohepatitis no alcohólica es menos común: 2 a 3% de los adultos norteamericanos y 20 a 25% de los adultos obesos cumplen con los criterios diagnósticos. Los hepatólogos afirman que dentro de las siguientes décadas la esteatohepatitis no alcohólica será la causa más común de enfermedad hepática, desplazando a otras causas como hepatitis C, hepatitis B y alcohol. En los pacientes adultos obesos la esteatosis hepática puede progresar rápidamente hacia el estadio final de la enfermedad hepática, es decir, fibrosis hepática y diferentes grados de cirrosis, que se presenta en 3% de los adultos obesos (3, 4).
Se debe realizar estudio por sospecha de hígado graso por enfermedad no alcohólica en: pacientes obesos, diabéticos tipo 2, pacientes con HOMA (Homeostasis Model Assessment) superior a 1,64, con resistencia insulínica, historia familiar de esteatosis hepática o esteatohepatitis no alcohólica, síndrome metabólico y en pacientes mayores de 50 años, factor que es más significativo en hombres que en mujeres y en hispanoamericanos que en pacientes de raza blanca o negra.
La pesquisa incluye:
La biopsia hepática se debe considerar en pacientes que cumplan con tres o más de los siguientes criterios: obesidad (BMI > 30 kg/m2), diabetes mellitus tipo 2, historia familiar, edad mayor de cincuenta años, transaminasas persistentemente elevadas al doble de lo normal, disfunción hepática evidenciada por aumento de la bilirrubina directa e INR o reducción de la seroalbúmina y en aquellos pacientes que no responden a dieta y ejercicio con mejoría de las transaminasas (6).
La primera opción de tratamiento para el hígado graso por enfermedad no alcohólica es la pérdida de peso, sea con cambios en el estilo de vida, apoyo de fármacos como orlistat (7, 8) o cirugía bariátrica, que parece ser la forma más eficaz de reducir la esteatosis hepática (9). La segunda opción es el uso de herramientas farmacológicas; actualmente hay evidencia de que la vitamina E combinada con ácido ursodeoxicólico ayuda a reducir la esteatosis hepática (10); otros han demostrado que la metformina tiene efectos benéficos discretos (11, 12). Tal vez el estudio con resultados más alentadores es el de Belfort y colaboradores, en el que se describe que la mitad de los pacientes tratados con tiazolidinedionas normalizaron la función hepática y redujeron la esteatosis, aunque falta estudiar los efectos a largo plazo de estos fármacos (13).
El síndrome hipopnea-apnea del sueño no se define como la apnea del sueño tradicional, que corresponde al cese total de la respiración por diez segundos o más, sino como el cese de la respiración entre cinco y diez segundos medido con polisomnografía. Los síntomas clínicos de la apnea obstructiva del sueño incluyen: ronquidos, somnolencia grave, sueño intranquilo, sudoración nocturna, sequedad bucal matinal, úlceras faríngeas perceptibles en la mañana, nicturia, cefalea matinal, disfunción eréctil, confusión matinal y cambios de personalidad.
En la Fig. 2 se presenta el algoritmo para el paciente obeso con sospecha clínica de síndrome de hipopnea-apnea del sueño. Primero se debe aplicar la Escala de Sueño Epworth, que entrega un puntaje ajustado a la circunferencia del cuello y permite identificar a los pacientes con alta probabilidad de padecer de apnea obstructiva del sueño, en los que se debe solicitar polisomnografía, examen de mejor rendimiento pero de alto costo (14). De acuerdo a esto, sólo los pacientes con alto riesgo serán enviados para un estudio exhaustivo que permita realizar el diagnóstico.
Una vez hecho el diagnóstico se debe efectuar el tratamiento, donde lo más importante es la asistencia de la vía aérea. Algunos pacientes se alivian con cirugía de la articulación temporomandibular, con el objeto de mejorar el flujo aéreo durante la noche (14). En la fig. 3 se muestra el algoritmo para el tratamiento del paciente obeso con síndrome hipopnea-apnea del sueño.
Figura 3. Algoritmo para el tratamiento del paciente obeso con síndrome hipopnea-apnea del sueño.
En pacientes sin anormalidades anatómicas cuyo estudio del sueño entrega un índice de apnea-hipopnea entre 15 y 30 y que presentan síntomas clínicos de apnea obstructiva del sueño, se recomienda la mascarilla CPAP (Continuous Positive Airway Pressure), que mejora el estado clínico de la mayor parte de los usuarios durante años. Alrededor de 14% de los pacientes rechazan este tratamiento; en ellos es necesario modificar la mascarilla, con lo cual alrededor de 20% de los pacientes mejora, o buscar otros métodos de asistencia respiratoria durante el sueño. Esta terapia de asistencia ventilatoria más la baja de peso parecen tener grandes beneficios.
En un estudio realizado en pacientes con obesidad grave que no cumplían con los criterios para el tratamiento con CPAP se hizo reemplazo nutricional de las comidas durante tres meses para observar el efecto de la pérdida de peso mantenida sobre la dinámica del sueño (15). Hubo una pérdida de peso significativa en los primeros tres meses, que se mantuvo durante el resto del estudio.
En la siguiente imagen se observa el cambio en el Índice apnea/hipopnea (AHI) entre el estado basal y después de la pérdida de peso. La gravedad de la apnea obstructiva del sueño (OSA) fue una variable moderadora de la reducción en el AHI: los pacientes con OSA más graves tuvieron mayor mejoría en este índice que aquellos con OSA menos graves o sin OSA (Fig. 5).
El riesgo de hipertensión pulmonar se redujo levemente y la calidad de vida de estos pacientes mejoró en forma considerable. La saturación de oxígeno mínima mejoró de 82% a 89%, aunque en los casos de hipertensión pulmonar las cifras fueron menos alentadoras (Fig. 6).
Los pacientes obesos pueden presentar varios tipos de alteraciones cardíacas:
En el artículo titulado Obesidad y Enfermedad Cardiovascular: Fisiopatología, Evaluación y Efectos de la Pérdida de Peso publicado en 2006, una puesta al día de las normas sobre este tema de la Asociación Americana del Corazón, se describe con detalle el procedimiento clínico para tratar a los pacientes con enfermedad cardiovascular (16).
En pacientes portadores de obesidad se debe evaluar la presencia de las siguientes comorbilidades, que requieren tratamiento:

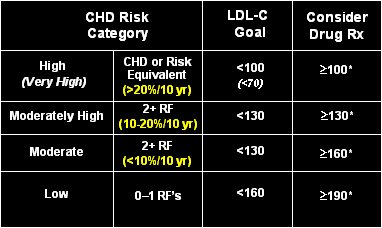 Tabla I. Metas terapéuticas para colesterol de LDL (LDL-c) según riesgo cardiovascular, NCEP ATP III.
Tabla I. Metas terapéuticas para colesterol de LDL (LDL-c) según riesgo cardiovascular, NCEP ATP III.

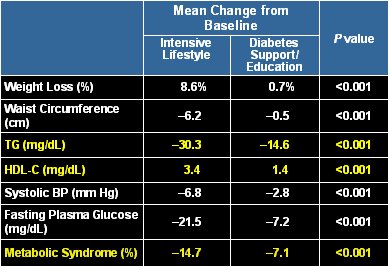 Tabla II. Estudio Look AHEAD: mejoría en los componentes del síndrome metabólico al año de intervención.
Tabla II. Estudio Look AHEAD: mejoría en los componentes del síndrome metabólico al año de intervención.

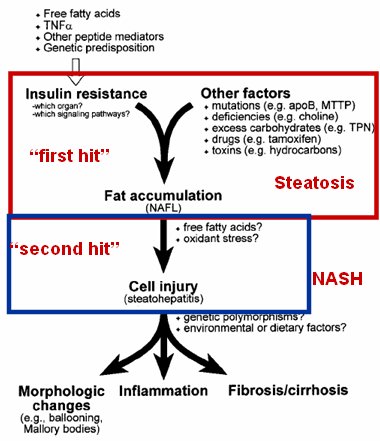 Figura 1. Patogenia del hígado graso por enfermedad no alcohólica.
Figura 1. Patogenia del hígado graso por enfermedad no alcohólica.

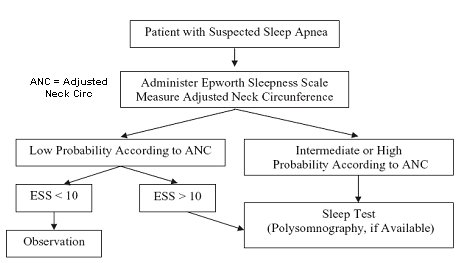 Figura 2. Algoritmo para el manejo del paciente obeso con sospecha de síndrome hipopnea-apnea del sueño.
Figura 2. Algoritmo para el manejo del paciente obeso con sospecha de síndrome hipopnea-apnea del sueño.

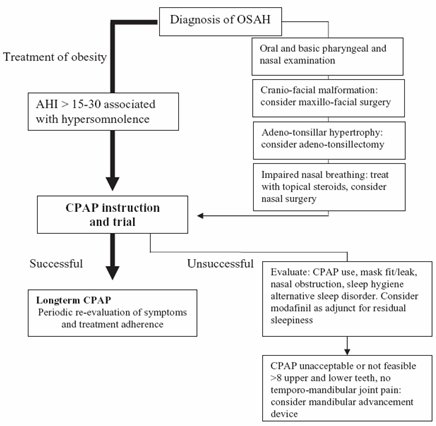 Figura 3. Algoritmo para el tratamiento del paciente obeso con síndrome hipopnea-apnea del sueño.
Figura 3. Algoritmo para el tratamiento del paciente obeso con síndrome hipopnea-apnea del sueño.

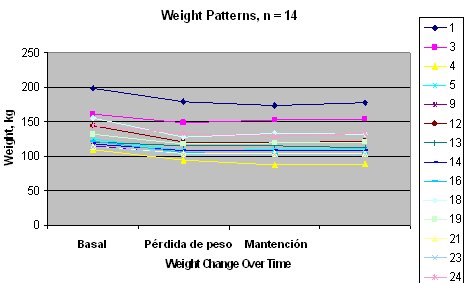 Figura 4. Cambios en el peso en pacientes obesos graves con reemplazo nutricional por tres meses (N = 14).
Figura 4. Cambios en el peso en pacientes obesos graves con reemplazo nutricional por tres meses (N = 14).

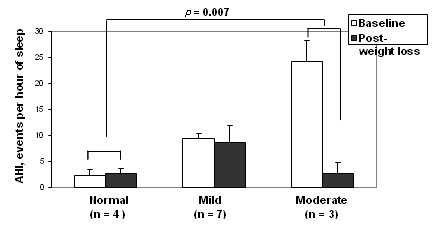 Figura 5. Cambio en el índice apnea/hipopnea (AHI) entre el estado basal y después de la pérdida de peso.
Figura 5. Cambio en el índice apnea/hipopnea (AHI) entre el estado basal y después de la pérdida de peso.

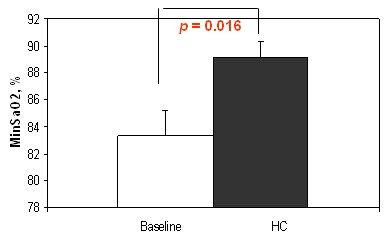 Figura 6. Saturación de oxígeno mínima en pacientes obesos graves sin apnea obstructiva del sueño. Efecto de la pérdida de peso.
Figura 6. Saturación de oxígeno mínima en pacientes obesos graves sin apnea obstructiva del sueño. Efecto de la pérdida de peso.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el V Congreso de la Asociación Chilena de Nutrición Clínica y Metabolismo realizado en Viña del Mar entre el 23 y 26 de Abril de 2008. El congreso fue organizado por la Asociación Chilena de Nutrición Clínica y Metabolismo, bajo la presidencia del Dr. Fernando Carrasco Naranjo. La edición científica de este artículo fue realizada por el Dr. Fernando Carrasco N.
 Autor:
Robert Eckel[1]
Autor:
Robert Eckel[1]

Citación: Eckel R. Management of comorbidities in obesity II: dyslipidemia, fatty liver, sleep apnea, heart disease. Medwave 2009 Abr;9(4):e3853 doi: 10.5867/medwave.2009.04.3853
Fecha de publicación: 1/4/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004 Jul 13;110(2):227-39. | CrossRef | PubMed |
Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004 Jul 13;110(2):227-39. | CrossRef | PubMed | Look AHEAD Research Group, Pi-Sunyer X, Blackburn G, Brancati FL, Bray GA, Bright R, et al. Reduction in weight and cardiovascular disease risk factors in individuals with type 2 diabetes: one-year results of the look AHEAD trial. Diabetes Care. 2007 Jun;30(6):1374-83. Epub 2007 Mar 15. | CrossRef | PubMed | PMC |
Look AHEAD Research Group, Pi-Sunyer X, Blackburn G, Brancati FL, Bray GA, Bright R, et al. Reduction in weight and cardiovascular disease risk factors in individuals with type 2 diabetes: one-year results of the look AHEAD trial. Diabetes Care. 2007 Jun;30(6):1374-83. Epub 2007 Mar 15. | CrossRef | PubMed | PMC | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003 May;37(5):1202-19. | CrossRef | PubMed |
Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003 May;37(5):1202-19. | CrossRef | PubMed | McCullough AJ. Update on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2002 Mar;34(3):255-62. | CrossRef | PubMed |
McCullough AJ. Update on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2002 Mar;34(3):255-62. | CrossRef | PubMed | Abrams GA, Kunde SS, Lazenby AJ, Clements RH. Portal fibrosis and hepatic steatosis in morbidly obese subjects: A spectrum of nonalcoholic fatty liver disease. Hepatology. 2004 Aug;40(2):475-83. | CrossRef | PubMed |
Abrams GA, Kunde SS, Lazenby AJ, Clements RH. Portal fibrosis and hepatic steatosis in morbidly obese subjects: A spectrum of nonalcoholic fatty liver disease. Hepatology. 2004 Aug;40(2):475-83. | CrossRef | PubMed | Grattagliano I, Portincasa P, Palmieri VO, Palasciano G. Managing nonalcoholic fatty liver disease: recommendations for family physicians. Can Fam Physician. 2007 May;53(5):857-63. | PubMed | PMC |
Grattagliano I, Portincasa P, Palmieri VO, Palasciano G. Managing nonalcoholic fatty liver disease: recommendations for family physicians. Can Fam Physician. 2007 May;53(5):857-63. | PubMed | PMC | Harrison SA, Fincke C, Helinski D, Torgerson S, Hayashi P. A pilot study of orlistat treatment in obese, non-alcoholic steatohepatitis patients. Aliment Pharmacol Ther. 2004 Sep 15;20(6):623-8. | CrossRef | PubMed |
Harrison SA, Fincke C, Helinski D, Torgerson S, Hayashi P. A pilot study of orlistat treatment in obese, non-alcoholic steatohepatitis patients. Aliment Pharmacol Ther. 2004 Sep 15;20(6):623-8. | CrossRef | PubMed | Hussein O, Grosovski M, Schlesinger S, Szvalb S, Assy N. Orlistat reverse fatty infiltration and improves hepatic fibrosis in obese patients with nonalcoholic steatohepatitis (NASH). Dig Dis Sci. 2007 Oct;52(10):2512-9. Epub 2007 Apr 3. | CrossRef | PubMed |
Hussein O, Grosovski M, Schlesinger S, Szvalb S, Assy N. Orlistat reverse fatty infiltration and improves hepatic fibrosis in obese patients with nonalcoholic steatohepatitis (NASH). Dig Dis Sci. 2007 Oct;52(10):2512-9. Epub 2007 Apr 3. | CrossRef | PubMed | Furuya CK Jr, de Oliveira CP, de Mello ES, Faintuch J, Raskovski A, Matsuda M, et al. Effects of bariatric surgery on nonalcoholic fatty liver disease: preliminary findings after 2 years. J Gastroenterol Hepatol. 2007 Apr;22(4):510-4. | CrossRef | PubMed |
Furuya CK Jr, de Oliveira CP, de Mello ES, Faintuch J, Raskovski A, Matsuda M, et al. Effects of bariatric surgery on nonalcoholic fatty liver disease: preliminary findings after 2 years. J Gastroenterol Hepatol. 2007 Apr;22(4):510-4. | CrossRef | PubMed | Dufour JF, Oneta CM, Gonvers JJ, Bihl F, Cerny A, Cereda JM, et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2006 Dec;4(12):1537-43. | CrossRef | PubMed |
Dufour JF, Oneta CM, Gonvers JJ, Bihl F, Cerny A, Cereda JM, et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2006 Dec;4(12):1537-43. | CrossRef | PubMed | Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005 May;100(5):1082-90. | CrossRef | PubMed |
Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005 May;100(5):1082-90. | CrossRef | PubMed | Uygun A, Kadayifci A, Isik AT, Ozgurtas T, Deveci S, Tuzun A, et al. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2004 Mar 1;19(5):537-44. | CrossRef | PubMed |
Uygun A, Kadayifci A, Isik AT, Ozgurtas T, Deveci S, Tuzun A, et al. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2004 Mar 1;19(5):537-44. | CrossRef | PubMed | Belfort R, Harrison SA, Brown K, Darland C, Finch J, Hardies J, et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis. N Engl J Med. 2006 Nov 30;355(22):2297-307. | CrossRef | PubMed |
Belfort R, Harrison SA, Brown K, Darland C, Finch J, Hardies J, et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis. N Engl J Med. 2006 Nov 30;355(22):2297-307. | CrossRef | PubMed | de Sousa AG, Cercato C, Mancini MC, Halpern A. Obesity and obstructive sleep apnea-hypopnea syndrome. Obes Rev. 2008 Jul;9(4):340-54. Epub 2008 Mar 18. | CrossRef | PubMed |
de Sousa AG, Cercato C, Mancini MC, Halpern A. Obesity and obstructive sleep apnea-hypopnea syndrome. Obes Rev. 2008 Jul;9(4):340-54. Epub 2008 Mar 18. | CrossRef | PubMed | Hernandez TL, Ballard RD, Weil KM, Shepard TY, Scherzinger AL, Stamm ER, et al. Effects of maintained weight loss on sleep dynamics and neck morphology in severely obese adults. Obesity (Silver Spring). 2009 Jan;17(1):84-91. Epub 2008 Oct 23. | CrossRef | PubMed |
Hernandez TL, Ballard RD, Weil KM, Shepard TY, Scherzinger AL, Stamm ER, et al. Effects of maintained weight loss on sleep dynamics and neck morphology in severely obese adults. Obesity (Silver Spring). 2009 Jan;17(1):84-91. Epub 2008 Oct 23. | CrossRef | PubMed | Poirier P, Giles TD, Bray GA, Hong Y, Stern JS, Pi-Sunyer FX, et al. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2006 Feb 14;113(6):898-918. Epub 2005 Dec 27. | CrossRef | PubMed |
Poirier P, Giles TD, Bray GA, Hong Y, Stern JS, Pi-Sunyer FX, et al. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2006 Feb 14;113(6):898-918. Epub 2005 Dec 27. | CrossRef | PubMed |