Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
Esta conferencia se referirá a una revisión de la literatura y al análisis de la experiencia acumulada en nuestros centros acerca del valor diagnóstico y pronóstico de la tomografía de emisión de fotón único (SPECT) de perfusión miocárdica con técnica gatillada (GSPECT) en enfermedad coronaria (EC).
La introducción del sestamibi marcado con Tc99m, en los años 80, despertó un gran interés por agregar la ventriculografía de primer pasaje a las imágenes de perfusión en estrés y reposo, para conseguir mayor información derivada del análisis funcional de pacientes con EC.
El aporte de los estudios desencadenantes de isquemia a través del estrés físico al diagnóstico y pronóstico de la EC está bien establecido, sobre todo por la caída de la fracción de eyección en ejercicio máximo y por las alteraciones de motilidad segmentaria; sin embargo, el agregar el primer pasaje implica dificultades logísticas inherentes a la inyección bajo gammacámara. Existen excelentes revisiones sobre la adición de la función a la perfusión miocárdica medida con isótopos (Borges Neto, J Nucl Cardiol 1997; Borges Neto, J Nucl Med 2004).
Los vasodilatadores (dipiridamol, adenosina), producen desbalance de flujo en las paredes ventriculares izquierdas y los parámetros de función durante este máximo estrés farmacológico son en cierto modo controvertidos, pues no se produce una elevación clara de la FEVI, como la esperada con ejercicio (del orden de 5% en pacientes normales), ni una disminución
tan significativa de ésta en pacientes con EC, pero sí pueden existir alteraciones de motilidad globales y segmentarias. Este hecho también está avalado por la literatura Ogilby et al, Circulation 1992; Massardo et al, Ann Nucl Med 1999; Fleming, Angiology 2002; Dziuk et al, Nucl Med Rev Cent East Eur 2003).
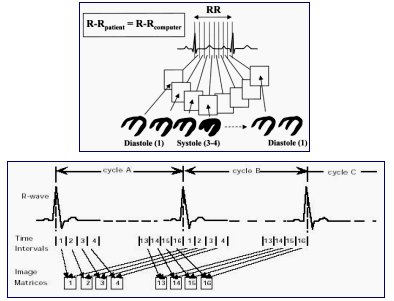
El SPECT gatillado de perfusión se puede realizar con 8 ó 16 cuadros o frames según el equipo disponible, aunque se acepta que basta con 8 para lograr mejor conteo y ocupar menos memoria. Las imágenes tienen buena resolución respecto las habituales no gatilladas por la ausencia de movimiento; se efectúa análisis de un solo latido, que corresponde a una suma de todos los latidos adquiridos (véase Figura 1). Si hubiera interés en analizar parámetros diastólicos debieran utilizarse mayor número de cuadros.
Figura 1. GSPECT: Gatillado de la señal ECG en el SPECT de perfusión.
La utilidad del GSPECT con fármacos marcados con Tc99m está ampliamente aceptada, en cambio, con Tl201 es menos clara. Los equipos de cabezales múltiples debieran preferirse; algunos grupos han logrado un buen trabajo con Tl201, pero utilizando además un mayor tiempo de adquisición (Itti et al, J Nucl Cardiol 2001: Itti et al, Nucl Med Commun 2001; Heiba SI et al, J Nucl Cardiol 2002).
El SPECT gatillado en fase de estrés entrega información sobre la función en pacientes inyectados en estrés máximo y adquiridos en un período posterior; se aconseja efectuarlo antes de los 45-60 min y comenzando entre 15 y 30 min post inyección. El GSPECT no representa la función del estrés máximo y entrega parámetros funcionales del período post estrés (Bavellar-Croon et al, Am Heart J 2001; Travin et al, J Nucl Cardiol 2004; Go et al, J Nucl Med 2004).
En perfusión, se pueden analizar alteraciones en sístole y en diástole. Los parámetros de función son: volumen de fin de diástole (VFD); volumen de fin de sístole (VFS); fracción de eyección (FEVI) global y regional; diferencia de FEVI (delta FE); volumen expulsivo; índice de dilatación isquémica transitoria o transient ischemic dilation (TID), que se utiliza generalmente en diástole; engrosamiento parietal; motilidad segmentaria Además, se puede cuantificar, porcentual o semicuantitativamente, la extensión e intensidad de las alteraciones de perfusión, motilidad y engrosamiento. En el fondo, se delimitan las cavidades y las paredes con una forma del corazón relativamente simulada, delimitada, con algoritmos de búsqueda de bordes (gaussianas y también basado en cuentas); esto tiene dificultad en casos de severos defectos de perfusión y aneurismas.
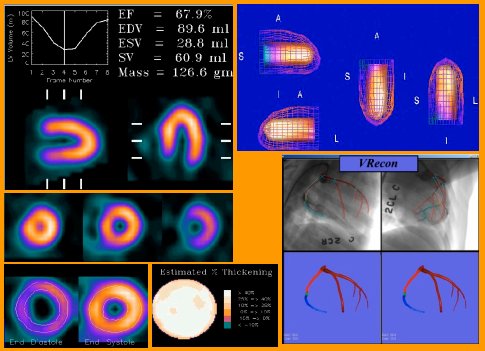
El programa Emory Toolbox ofrece parámetros de perfusión respecto a una base de pacientes; entrega índices de isquemia, VFD, VFS, FE y scores de motilidad, de perfusión y de reversibilidad e incluso una probabilidad de sobrevida a los dos años, basada en scores de isquemia. En la figura 2 se observa una imagen en que se aprecia la delimitación de bordes y mallas en diástole y en sístole, las paredes, la búsqueda de bordes en diástole y en sístole y la extensión estimada del engrosamiento porcentual. Se le puede agregar la ubicación de las arterias coronarias observado desde distintas posiciones.
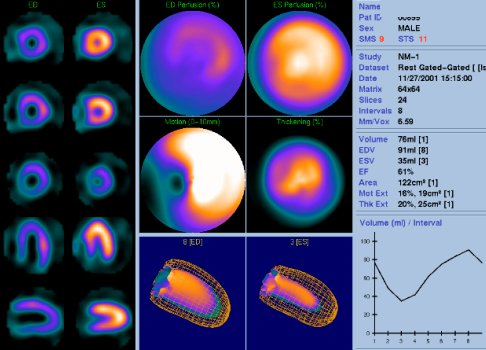
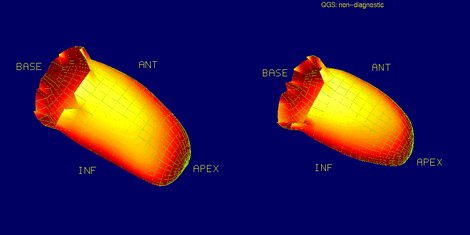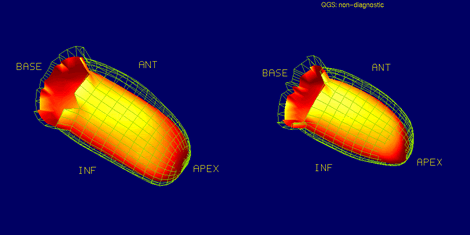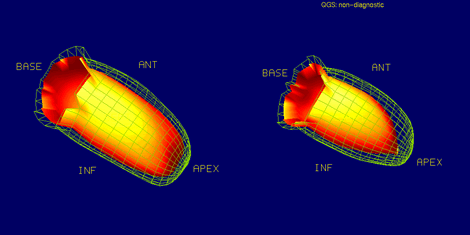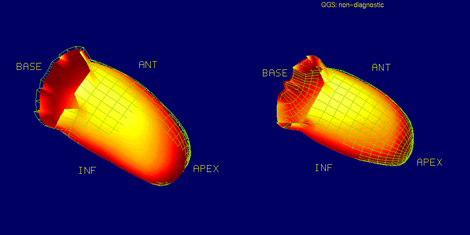
Otro programa, el QGS o Quantitative Gated SPECT, del Cedars Sinai, es más conocido, también entrega una cantidad considerable de información similar: scores de perfusión, motilidad y engrosamiento, y las redes de diástole y de sístole (véase Figura 3).
Figura 2. Programa Emory Toolbox.
Figura 3. Programa QGS Quantitative Gated SPECT (Cedars Sinai).
Hay distintas maneras de entregar la información: en cine, bullseyes de perfusión, motilidad, engrosamiento, imágenes en los distintos niveles de diástole y sístole y la curva de volumen, que sirve para medir la FEVI porcentual y volúmenes en ml. Es importante el control de calidad del equipo y el zoom que se elija, en los programas porque si éste no es el debido, puede haber discordancia entre lo que se adquiere y lo que tiene el computador seleccionado, que puede conducir a volúmenes incorrectos
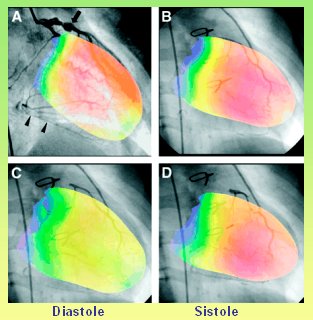
En la figura 4 se observa una fusión en diástole y en sístole, obtenida en un niño con enfermedad de Kawasaki. Se observan las arterias sobrepuestas en ambas fases.
Figura 4. Fusión Angiografía – GSPECT – QGS (Modificado de Nishimura Y et al, J Nucl Med sept. 2004. Superimposed display of coronary artery on gated myocardial perfusion scintigraphy).
En cuanto a la correlación de los parámetros del GSPECT con otras técnicas, en una revisión efectuada por Bavellar-Croon y publicada en Am Heart J 2001, con respecto a primer paso, ecografía, angiografía y resonancia magnética, en pacientes con infarto y sin él, se observó que las correlaciones de la FEVI eran adecuadas, sobre 0,90 en general, igual que las de los VFD y VFS, aunque en general, los valores de fin de sístole son más ajustados que los de fin de diástole.
En dos trabajos (Go et al, J Nucl Med 2004 y Nichols et al, J Nucl Cardiol 2002), se comparó el GSPECT con QGS, el ecocardiograma, la resonancia magnética, la angiografía y la ventriculografía de equilibrio, con un promedio de FEVI con QGS, para los mismos pacientes, de 63 ± 10%, con un límite inferior de 44%. Es algo distinto en comparación con otros métodos, pero el uso de los parámetros normales de un equipo con su software, debe hacerse con cautela, porque a pesar de que exista una correlación adecuada entre distintas técnicas, puede haber variaciones significativas en un mismo paciente, en especial, si las mediciones funcionales nos son simultáneas
Nichols comparó los valores de los dos programas mencionados anteriormente, en los mismos pacientes, en un grupo de mujeres y de hombres, por separado (Nichols et al, J Nucl Cardiol 2002), de manera similar a lo que se describe en un trabajo de González publicado en el Alasbimn Journal 2003, y encontró diferencias en los valores de ambos sexos; por ejemplo, la fracción de eyección con QGS es 69 en las mujeres y 57 en los hombres, y los VFD y VFS son más bajos en las mujeres. Ese trabajo se realizó adecuadamente, en 50 pacientes con probabilidad baja (menos de 5%) de EC por protocolos CADENZA, con perfusión normal.
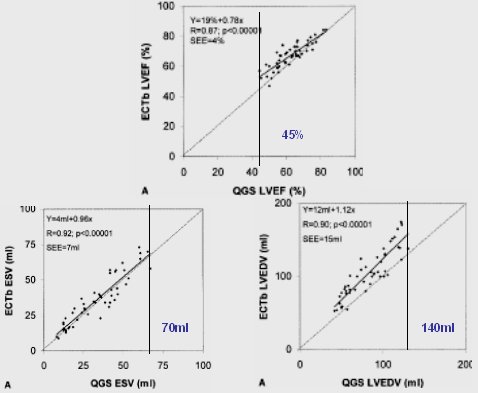
En la figura 5, que corresponde al mismo trabajo, aparece la dispersión de los valores de la FEVI, del VFS y VFD, está resaltado el valor aceptado como normal en la literatura, que corresponde a 70 ml para volumen de fin de sístole, como máximo; más de 70 ml se considera dilatado utilizando QGS, en un grupo normal de ambos sexos. El valor normal del volumen máximo de fin de diástole se considera generalmente de 140 ml, y la fracción de eyección mínima 45%. Esta es una correlación, en el eje X está QGS y en el eje Y está el programa Emory.
Figura 5. Curvas de regresión lineal de pacientes con probabilidad baja de EC (LLR) para n:50 (ambos sexos). VFS, VFD y FE comparando programa QGS y Emory Toolbox (Nichols et al. J Nucl Cardiol 2002).
El GSPECT, en relación con el SPECT, presenta menos informes indeterminados y menos falsos positivos por atenuación; por lo tanto, el gatillado aumenta la especificidad de la técnica; tiene, además, mejor detección de enfermedad multivaso. El aumento de la detección de la EC es debido a la dilatación transitoria del ventrículo izquierdo y la alteración de motilidad en estrés por isquemia, y especialmente porque disminuye los falsos negativos de perfusión que ocurren en la EC balanceada. Además, presenta mayor sensibilidad y especificidad para la angina inestable, al añadir la función y la perfusión, en comparación con el análisis de ambos por separado (Nishiyama O et al, Kaku Igaku 2004).
En la figura 6 se observa una imagen publicada por Mut en Alasbimn Journal 2000, correspondiente a un caso, en la fila superior, una paciente en la que se sospecha un infarto subendocárdico de pared anterior, la que engruesa bien, por lo que sólo corresponde a un artefacto por atenuación. En las imágenes inferiores, en cambio, en la pared inferior el segmento más basal está hipoperfundido y no presenta engrosamiento, lo que corresponde un infarto inferior, en un varón. Ésta es la utilidad más reconocida del GSPECT. El análisis de motilidad y engrosamiento permite, entonces, discriminar entre atenuación mamaria e infarto anterior en mujeres, y entre atenuación diafragmática e infarto inferior en hombres.
Figura 6. GSPECT (reposo) mejora la especificidad.
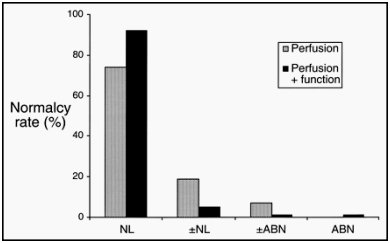
Otro dato interesante es que, al incorporar los datos funcionales, disminuye la cantidad de pacientes con informes limítrofes, o aumenta la probabilidad de informar adecuadamente. En la figura 7 aparece un gráfico publicado por Smanio en J Am Coll Cardiol 1997, en el cual la perfusión aislada corresponde al color claro y la perfusión más función, a un color más oscuro. (Normalcy rate es la capacidad de determinar la especificidad, usando pacientes con baja probabilidad de EC sin riesgo de sesgo de selección). En este trabajo se observa que mejora el normalcy rate, o la especificidad, en 9%, y los informes no concluyentes disminuyen de 32% a 10%, porque los casos limítrofes, con valores normales o anormales, disminuyen.
Figura 7. Smanio PE et al. Value of gating of technetium-99m sestamibi single-photon emission computed tomographic imaging. J Am Coll Cardiol. 1997;30:1687–1692. NL = normal; ±NL = borderline normal; ±ABN = borderline abnormal; ABN = abnormal.
En cuanto a las imágenes diastólicas, en 1993 se publicó un trabajo según el cual las lesiones sutiles o de menor tamaño se verían mejor con GSPECT, si se analizan sólo las imágenes diastólicas (Mannting, J Nucl Med 1993), pero en general estas imágenes no se utilizan en la práctica, sin embargo, se debiera observar cuidadosamente en diástole a las mujeres con el corazón de menor tamaño (Taillefer et al, J Nucl Cardiol 1999). Cabe destacar que gran porcentaje de las pacientes tienen corazón pequeño y, como la resolución de las cámaras tiene limitaciones, es más dificultoso pesquisar los defectos pequeños.
También hay un trabajo reciente con tetrofosmina, cuya conclusión es que el GSPECT reclasifica y disminuye, de 29% a 10%, los defectos no explicados en pacientes que con certeza no tenían infarto de miocardio (Fleischmann et al, J Nucl Med 2004). Los falsos positivos de los bloqueos completos de rama izquierda también se podrían disminuir con el análisis de las imágenes diastólicas (Demir et al, Cardiol 2003); por lo tanto, si un paciente tiene un defecto junto con un bloqueo de rama izquierda, se deben mirar las imágenes diastólicas aisladas, porque disminuirían los defectos.
En cuanto a los pacientes con enfermedad de vasos múltiples, sólo algunos, entre 15% y 50%, tienen defectos de perfusión en varios territorios; es decir, al interpretar la perfusión se cree que sólo está afectado un vaso. En estos casos, el GSPECT detecta mejor la extensión de la EC.
En dos trabajos se observó que la motilidad post ejercicio es un marcador de enfermedad coronaria grave y extensa (Sharir et al, Am J Cardiol 2000 y Shirai et al, J Nucl Med 2002). El estudio se realizó en el primero caso con sestamibi en 99 pacientes. La sensibilidad frente a cualquier coronaria muy estenosada fue mayor: 78% versus 49%; si se agrega este marcador de la motilidad a la perfusión, tiene importante y significativo valor. El otro hallazgo del trabajo de Shirai fue que el deterioro de la motilidad regional, más los defectos de perfusión en ejercicio, son más sensibles que la perfusión aislada. Este último trabajo es interesante, porque fue realizado con Tl201.
El GSPECT en reposo agrega información de tipo pronóstico, especialmente en miocardiopatías no sospechadas, las que también pueden ser de tipo isquémico, con fracción de eyección disminuida desconocida o con dilatación del ventrículo izquierdo basal.
Por otra parte, el GSPECT post estrés es capaz de pesquisar disminución de la FEVI y dilatación de la cavidad en sístole; el ejercicio debe disminuir el volumen de fin de sístole y el corazón no debe dilatarse. De hecho, normalmente, la FEVI aumenta por la disminución del fin de sístole; sin embargo, durante la isquemia, por atontamiento miocárdico, existe una menor motilidad y la FEVI puede aumentar. Este valor de reposo no es forzosamente similar a la FEVI post estrés, aunque se adquiera en forma tardía. Incluso, post estrés puede ser 5% más baja en comparación con el reposo. Si se quiere informar fracción basal, se debiera gatillar en reposo.
La duración del atontamiento, después de una isquemia grave secundaria a hipoxia miocárdica intensa, depende de la intensidad de la isquemia y puede extenderse hasta una hora. En un trabajo de Paul et al (J Nucl Cardiol 2002) en el cual se hizo un gatillado post estrés a la hora y se comparó con uno de reposo, se observó que los defectos isquémicos más intensos todavía presentaban atontamiento. De hecho, se ha demostrado en varios trabajos que, en los casos más graves, el atontamiento puede durar hasta dos o tres horas. En realidad, se debe realizar antes de una hora e idealmente, empezar a los 15 minutos, pero con dipiridamol esto puede ser inadecuado, porque hay gran actividad esplácnica, por lo que se debe intentar realizarlo entre los 30 y 60 minutos o posteriormente, si hay demasiada actividad hepática. Es útil tener doble cabezal angulado, para acortar tiempo de adquisición.
La disminución de la FEVI post ejercicio también predice la enfermedad de vasos múltiples (Yamagishi H et al. J Nucl Med 2002).
En cuanto a isquemia y atontamiento, en la figura 8 se observan las imágenes de un paciente al cual se le realizó un Mibi Tc99m dipiridamol y reposo, que tiene un defecto anteroseptal.
En la figura 9, se presenta el mismo paciente con FEVI de reposo de 55% y post estrés 44%. La relación de los VFD entre reposo y postestrés o TID correspondió a 1,46 (valor normal hasta de 1,2), lo que implica dilatación en estrés. El delta de fracción de eyección demostró también una caída de 11%. Esto es explicable por atontamiento; se observa, en este caso, que disminuye la motilidad regional con hipokinesia en toda la región anteroapical. El paciente tenía una EC multivaso.
Figura 8. Isquemia y atontamiento. Mibi Tc99m dipiridamol y reposo.
Figura 9. Isquemia y Atontamiento.
El GSPECT agrega valor pronóstico. En un trabajo de Sharir et al, publicado en J Nucl Med 2001;42:831-837 (n=2686 pacientes), bastante controvertido, describe que la FEVI post estrés fue el mejor predictor anual de muerte y la isquemia fue el mejor predictor de infarto no fatal. Se concluyó que el valor de estos parámetros se mantiene incluso en pacientes con perfusión normal, en reposo.
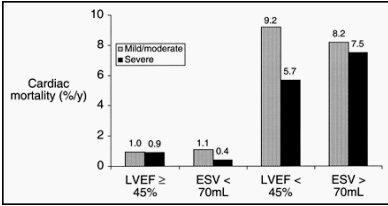
Según datos del mismo trabajo de Sharir, a mayor isquemia y menor FEVI, existe mayor mortalidad. En la figura 10 se observa la tasa anual de muerte, estratificada por volumen y fracción de eyección; se puede apreciar que hay diferencias entre la mortalidad con fracciones de eyección altas, sobre 45%, y con volúmenes de más de 70 ml.
Figura 10. Tasa anual de muerte cardíaca estratificada por volumen y FE de VI (Sharir T et al). Pacientes con FEVI de 45% o menos y VFS <70ml tuvieron menor mortalidad, independientemente de la gravedad de sus defectos de perfusión.
En cuanto al valor predictivo, es conocido que un paciente con un examen de perfusión normal tiene un riesgo de infarto, muerte o episodio cardíaco menor de 1% al año, pero los grupos de mayor riesgo tienen tasa anual más alta, entre 1,4 y 1,8% (Hachamovitch R et al, J Am Coll Cardiol 2003).
Las variables pronósticas más importantes de los estudios de perfusión, de acuerdo a Beller modificado (Circulation 2000) son: la dilatación transitoria o persistente del ventrículo izquierdo en estrés y la FEVI basal menor de 40%, en el SPECT gatillado en reposo. Otras variables pronósticas son:
En relación con el valor pronóstico de riesgo preoperatorio, el GSPECT ayuda a evaluar mejor los episodios cardíacos perioperatorios. El GSPECT también tiene valor para evaluar la evolución después de la revascularización (Hashimoto et al. J Nucl Med 2003, Kang et al. J Nucl Med 2003).
En pacientes con infarto de miocardio el GSPECT tiene escaso valor para predicción de mejoría de motilidad post revascularización si se analizan las imágenes diastólicas, sin embargo, la reserva contráctil parece tener un papel significativo. (González et al Eur J Nucl Med 1996, Spinelli et al. J Nucl Med 2003, Leoncini et al. Am J Cardiol 2001).

















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
 Expositora:
Teresa Massardo Vega[1]
Expositora:
Teresa Massardo Vega[1]

Citación: Massardo T. Diagnostic and prognostic value of gated perfusion SPECT in coronary artery disease. Medwave 2005 Mar;5(2):e1373 doi: 10.5867/medwave.2005.02.1373
Fecha de publicación: 1/3/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: fabian reyes
Fecha/date: 2011-02-23 15:21:33
Comentario/comment:
faltan las referencias completas para verificar lo que escribes (bibliografia completa) saludos a chile de mexico
Nombre/name: Vivienne Bachelet
Fecha/date: 2011-02-24 10:45:21
Comentario/comment:
Estimado Fabián:
Este trabajo fue editado y publicado en 2005. En esa época estábamos recién comenzando a incorporar referencias bibliográficas, y lo hacÃamos en el texto.
Ahora la bibliografÃa va al final de cada trabajo y es completa y normalizada.
Estamos en proceso de mejorar la calidad de la entrega editorial, sobre todo con más artÃculos originales, porque buscamos la indexación en PubMed.
Gracias y saludos a México desde Chile!
Dra. Vivienne Bachelet
Editora Ejecutiva
Medwave
Para comentar debe iniciar sesión