Dr. Canessa: El tema del cáncer de tiroides es bastante controvertido; se discute desde cómo enfrentarlo quirúrgicamente hasta cómo tratarlo y seguirlo. Es un tumor de baja frecuencia, generalmente diferenciado, de pronóstico relativamente bueno, con mortalidad muy baja aunque con tasa de recurrencia importante, problema que aparece después de tratar a pacientes durante años.
El hecho de que sea un tumor diferenciado permite tratar con yodo radioactivo, tanto el remanente como las recurrencias y las metástasis. Han aparecido algunas novedades, entre ellas, la TSH recombinante, el PET con glucosa marcada, disponible en nuestro medio, y algunas terapias de alternativa o en desarrollo. El esquema del diagnóstico, manejo, seguimiento y control del cáncer tiroideo es muy complejo, y esta discusión se centrará principalmente en terapia de radioyodo.
El cáncer de tiroides se clasifica en tumor localizado, invasor local, con compromiso ganglionar y con metástasis a distancia, lo que se traduce en un enfoque diferente. La recurrencia es frecuente, hasta en 30% de los casos, y puede presentarse varias décadas después del diagnóstico, aunque en la mayoría de los casos ocurre en la primera década.
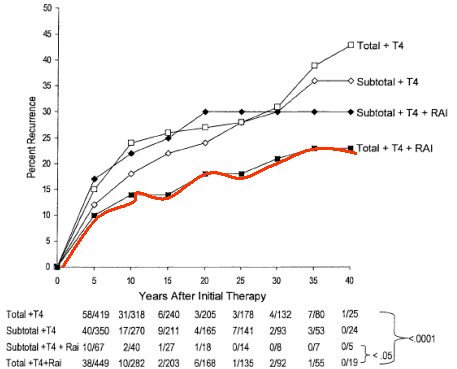
En el clásico trabajo de Mazzaferri (Current approaches to primary therapy for papillary and follicular thyroid cancer), que hizo un seguimiento a largo plazo, se demostró que el principal problema es que la tasa de recurrencia puede variar según el enfoque inicial, como puede verse en la Figura 1.
Figura 1. Recurrencia del cáncer de tiroides según tratamiento inicial (Mazaferri EL J Clin Endocrinol Metabol 2001;86: 1447-1463).
RAI: ablación con radioyodo; T4: reemplazo hormonal; Total: tiroidectomía total, Subtotal: tiroidectomía subtotal.
El manejo debe incluir tiroidectomía total, reemplazo hormonal y terapia con yodo; si no se realiza alguno de estos pasos, la tasa de recurrencia aumenta a lo largo de los años. Sin embargo, la sobrevida es larga, aun en presencia de diseminación ósea, a pesar de que las metástasis óseas son las más difíciles de manejar en el cáncer de tiroides.
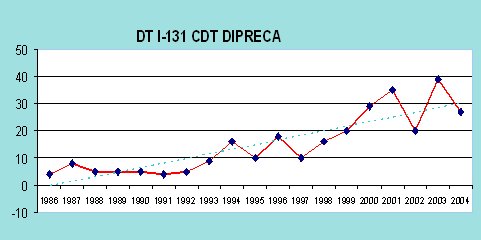
Al analizar la experiencia del Hospital DIPRECA, que partió en 1986, se comprobó lo mismo que en todos los centros que se dedican a tratamiento con radioyodo: ha ido aumentando en forma permanente a lo largo del tiempo la solicitud de terapia isotópica (véase Figura 2). También se ha observado que están aumentando los casos con terapia para recurrencias, lo que significa subir la dosis total de radioyodo entregada.
Figura 2. Terapia de Radioyodo en cáncer diferenciado de tiroides. Casos anuales, Hospital DIPRECA, período 1986- 2004. DT I31: Número de dosis anuales.
Los temas que vamos a tratar son: el uso de radioyodo postoperatorio, cómo calcular la dosis ablativa y algunas alternativas que manejan los endocrinólogos. La discusión se iniciará con el manejo del radioyodo.
Dr. Domínguez, ¿en qué pacientes indica radioyodo, cuál es la dosis y cómo los maneja?
Dr. Domínguez: Después de una adecuada cirugía de cáncer de tiroides, el yodo radioactivo permite eliminar todo el remanente de tejido tiroideo, tumoral y no tumoral, lo que hace posible seguir a estos pacientes con medición de tiroglobulina y con exámenes de exploración sistémica con yodo radioactivo, 131 ó 123, que sería el ideal, sin interferencias causadas por el remanente que queda cuando no se administra yodo radioactivo. Es una ventaja indudable, pero la gran controversia es en cuáles pacientes se debe utilizar y si debe administrarse a todos los pacientes.
No sé si llegaremos a algún acuerdo al respecto, pero en mi opinión, basada en la experiencia de tratamiento de nuestros pacientes y en la revisión de la literatura, es que el yodo radioactivo se debe administrar después de una cirugía bien aplicada de cáncer de tiroides, y que es un elemento terapéutico importante. Creemos que se debe usar en todos los pacientes, salvo aquellos cuya lesión tumoral sea pequeña, menor de 1 cm, especialmente si se trata de un cáncer papilar, en quienes no existan factores de riesgo, es decir, sin antecedentes familiares de cáncer de tiroides ni de irradiación del cuello en ninguna etapa de su vida, y que no presenten invasión de los tejidos vecinos, adenopatías cervicales ni metástasis a distancia. En esos pacientes, sobre todo si son menores de 40 años, pensamos que no se debe administrar el yodo radioactivo, porque como dice un artículo de Hay y colaboradores, de la Clínica Mayo, el pronóstico de ese grupo es bueno, y el yodo radioactivo no lo mejora más. Por eso, plantean no utilizar terapia radioactiva en esos pacientes seleccionados.
Dr. Canessa: Quisiera preguntar al Dr. Ilzauspe si está de acuerdo con no administrar radioyodo en los pacientes con un cáncer papilar de tamaño reducido, localizado, sin factores de riesgo.
Dr. Ilzauspe: Los argumentos del Dr. Domínguez son muy válidos y la evidencia que ha presentado la Clínica Mayo para resolver este conflicto es sólida, pero me parece que la respuesta no es definitiva, porque hay dos puntos que no se resuelven en estos pacientes. Uno es que, si bien son pacientes de bajo riesgo, con un tumor menor de 1 cm, y su evolución es muy buena, algunos pueden recidivar. Por otra parte, si no se elimina el remanente postquirúrgico de tiroides, este remanente va a dificultar la medición para realizar el seguimiento con tiroglobulina. Entonces, me parece que esa pregunta no está respondida, lo razonable sería poner en una balanza el riesgo que significa administrar una dosis ablativa de yodo radioactivo a un paciente versus hacer el seguimiento de ese paciente en el tiempo; aunque el administrar una dosis ablativa de yodo radioactivo tiene sus inconvenientes y sus problemas, éstos serían menores. Hay que tomar en cuenta que la mayoría de los pacientes con cáncer de bajo riesgo, con tumores menores de 1 cm, son jóvenes, por lo tanto, el seguimiento va a ser por un tiempo prolongado. El segundo punto, que se debe considerar siempre, es que el cáncer diferenciado de tiroides es una enfermedad multicéntrica, sobre todo el papilar, por lo tanto, es preciso considerar que estos pacientes pueden desarrollar, en otra célula, la misma enfermedad.
Dr. Canessa: Dr. Lillo, ¿cuál es el enfoque del grupo del Hospital Clínico de la Universidad de Chile respecto a este punto?
Dr. Lillo: Es similar al que se describe acá. No tenemos ninguna particularidad en el enfoque de este tipo de cáncer. Personalmente, comparto las apreciaciones que han hecho ambos colegas, porque la segunda es una especie de ampliación de la primera, que es lo que refleja la literatura. Aunque algunos grupos opinan que no sería conveniente tratar los tumores pequeños, localizados en un solo lóbulo, otros grupos plantean que sería bueno completar la eliminación total del tejido, porque eso da la posibilidad del seguimiento con marcadores tumorales y otras ventajas. En nuestro Hospital hay varios endocrinólogos, además recibimos solicitud de terapia para pacientes externos, y las opiniones están divididas, lo que también ocurre entre los cirujanos que operan a estos pacientes.
Dr. Domínguez: Nosotros llevamos a todos los pacientes a una reunión médico quirúrgica de tiroides y después son seguidos en estas reuniones, de manera que nuestra posición tiene que complementarse con la posición de los cirujanos ya que, según lo que ellos encuentren, podremos saber si ese paciente tiene una enfermedad multicéntrica o no, y si tiene ganglios linfáticos afectados microscópicamente, en la biopsia. Es un protocolo que consideramos debe ser muy estricto. Aun así, hay excepciones, como el caso de una paciente menor de 40 años que tenía un tumor papilar menor de 8 mm, pero con metástasis a distancia; fue pesquisada a tiempo, por lo que se trató con radioyodo y presentó incluso metástasis mamarias. Sin embargo, este caso es la excepción que confirma la regla; lo más frecuente que se ve es lo contrario, porque generalmente los tumores de tamaño reducido tienen muy buen pronóstico y no se justifica utilizar yodo radioactivo en las condiciones que mencioné.
Dr. Canessa: Dr. Ilzauspe, dos preguntas. Primero, ¿tiene experiencia con niños y radioyodo? Y segundo, ¿qué opina del cálculo de dosis, en lugar del esquema de dosificación que usamos habitualmente?
Dr. Ilzauspe: No tengo experiencia con el uso de radioyodo en niños. Respecto al cálculo de las dosis en estos pacientes, desde el punto de vista teórico, sería muy bueno determinar la necesidad propia de cada paciente y de su propio cáncer, lo que se ha intentado hacer de dos formas; una es medir cómo se distribuye el yodo en los sitios donde está el cáncer o la metástasis, pero no siempre se obtiene esa imagen, y la otra manera es hacer una evaluación del clearance del yodo para dosificar, intentando administrar la máxima dosis efectiva para ese paciente en particular. En la práctica, es un sistema complicado; en Chile, aparentemente, no se hace en ningún centro, porque es engorroso, y, en la mayoría de los casos, la modificación numérica de la dosis que se obtiene con la dosimetría no es tan diferente de la calculada de manera empírica.
Dr. Canessa: Las mismas preguntas para el Dr. Domínguez: niños y dosimetría.
Dr. Domínguez: Respecto a la dosimetría, utilizamos dosis fijas. Hay un consenso que data de 1998,en Chile, en que participaron endocrinólogos y médicos nucleares, en el cual se decidió establecer una dosis ablativa estándar, alrededor de 100 miliCuries (mCi); una dosis para metástasis de 100 a 150 mCi, cuando están en el cuello, y 200 a 250 mCi, cuando son a distancia. Pienso que las dosis mayores de 250 mCi, en una sola toma, no son útiles y la impresión que tenemos es que 250 mCi es el máximo útil por dosis. Creo que hacer una dosimetría es muy engorroso y no es seguro que tenga una aplicación práctica, porque es difícil determinar cuánto tiene el tumor y cuánto tiene el paciente en distintos sectores. Pienso que se debe dar entre 50.000 y 60.000 rads en una dosis, hasta 100.000 rads, porque con esas dosis estándar se logra un aporte adecuado.
En relación con los niños y adolescentes, en nuestra casuística, que incluye a 900 pacientes con cáncer, en seguimiento, alrededor de 30 corresponden a esa edad; incluso se ha tratado con yodo radiactivo a niños de cuatro años de edad, por cáncer de tiroides. Hemos tenido numerosas diferencias de apreciación; los médicos nucleares piensan que la dosis debe ser la dosis, pero yo hablé con el Dr. Sarlis, de la MD Anderson, que estuvo en Chile el 2003, y dijo que a los niños se les debe dar una dosis menor, porque había que relacionarla por kilogramo de peso. Pienso que en el caso de un niño que necesita tratamiento con radioyodo, porque tiene un cáncer invasor mayor de 1 cm, con metástasis regionales, como suele verse (pues, en general, los niños consultan cuando ya tienen metástasis) se debe partir con una dosis inicial equivalente a 50% de la dosis que se les da habitualmente a los adultos, pero las posteriores deben ser más altas, según el compromiso que tenga. El niño del cual hablé tenía metástasis pulmonares; la primera dosis que recibió fue de 50 mCi y la segunda, de 150, pero creo que no hicimos mal al darle 50 en la primera dosis; de hecho, el Dr. Sarlis estuvo de acuerdo y me dijo una frase muy cierta: “Don’t overtreat, don’t undertreat.”
Dr. Canessa: Las mismas preguntas para el Dr. Lillo.
Dr. Lillo: Hemos tratado a niños, pero en todos los casos hemos conversado con los endocrinólogos que envían al paciente. En nuestra experiencia, siempre hemos utilizado ese mismo criterio, el de administrar una dosis reducida. Es un tema controvertido porque, al revisar la dinámica del yodo, se ve que se absorbe por el estómago se distribuye difusamente por el sistema vascular y sólo se va a captar en aquellas zonas que tienen alguna funcionalidad o en zonas que, por sus características metabólicas, captan el yodo con su funcionamiento habitual. El problema, por el cual se dice que es mejor utilizar una dosis reducida, es que habría que tener la precaución de disminuir la irradiación al cuerpo entero del niño. Yo compartiría la apreciación de que es mejor utilizar dosis reducidas, en forma intuitiva, sustentada sólo en el hecho de que si se le administra un radiofármaco a un sujeto, sobre todo si es un niño, su distribución difusa causa una irradiación de cuerpo entero, la que se debe tratar de reducir lo más posible, especialmente en niños.
Dr. Canessa: Quisiera que discutiéramos algo de TSH recombinante, que todavía no está disponible de manera masiva en Chile, por su costo; sin embargo, creo que el Dr. Ilzauspe tiene alguna experiencia.
Dr. Ilzauspe: Se trata de una paciente en la que la TSH recombinante evitó la situación de hipotiroidismo prolongado, que tiene dos efectos deletéreos: uno, el hipotiroidismo en sí, que en algunos pacientes puede ser muy negativo, por ejemplo, en pacientes cardiópatas o depresivos, en los cuales se puede exacerbar la enfermedad de base; y el segundo efecto, que es más bien teórico, porque no hay evidencia que lo respalde, que consiste en que el estímulo de TSH propio, mantenido en el tiempo puede inducir en el paciente una activación excesiva de los receptores de las células tiroideas remanentes y gatillar una neoplasia. La TSH recombinante vendría a resolver esa situación de incomodidad y de riesgo para el paciente.
En series con un número importante de pacientes se ha demostrado que la TSH recombinante es muy útil para valorar tiroglobulina en el seguimiento, pero en cuanto al tratamiento con yodo radioactivo de la enfermedad residual, no presenta ventajas; al contrario, sería menos eficaz que la TSH endógena, por lo menos en 30%, en la gran mayoría de las series. Por tanto, la TSH recombinante serviría para realizar medición de tiroglobulina como seguimiento o, eventualmente, para hacer un rastreo de enfermedad residual.
Dr. Canessa: Es necesario mencionar que la TSH recombinante altera la cinética del radioyodo y por eso los resultados no son iguales a los que se obtienen con TSH endógena elevada. Dr. Domínguez, ¿tiene alguna acotación al respecto?
Dr. Domínguez: Sí. La TSH recombinante fue introducida en EEUU alrededor de 1998 y en Europa, en 2001. Tengo entendido que sólo ha sido aprobada para uso diagnóstico en el seguimiento del cáncer de tiroides, es decir, para efectuar exploraciones sistémicas sin suspender la hormona tiroidea o medir la tiroglobulina, sin suspender la tiroxina, pero no para tratamiento. Supongo que alguien la ha utilizado en el tratamiento, pero sin el apoyo de la FDA ni de los organismos europeos. Quizás estas entidades estén en lo correcto, porque como se mencionó aquí, creo que es distinto administrar un tratamiento de yodo radioactivo a un paciente con hipotiroidismo, con su TSH endógena elevada, que inyectarle TSH recombinante, porque la permanencia de yodo radioactivo en el organismo es diferente si el paciente es hipotiroideo o si está bajo el efecto de TSH recombinante exógena; la cinética es diferente, dado que el metabolismo del paciente es también diferente. Tenemos resultados a largo plazo de tratamiento con yodo radioactivo en pacientes hipotiroideos con elevación de su TSH endógena, pero eso es distinto.
En cuanto a los aspectos positivos, se ha demostrado que la sensibilidad de la TSH recombinante para hacer una exploración sistémica y medir tiroglobulina es tan buena como el hipotiroidismo que se logra suspendiendo la hormona tiroidea, y si se combina la exploración sistémica y tiroglobulina en el mismo procedimiento, lo que es lógico, ya que esta TSH tiene un costo elevado; con la TSH recombinante aumenta a alrededor de 98% la seguridad del diagnóstico, de manera que es un buen elemento con este objetivo. Se ha pretendido dar otros usos a la TSH recombinante, como hacer tratamiento con yodo radioactivo con TSH recombinante, hacer el diagnóstico de hipotiroidismo congénito y utilizarla como ayudante de la quimioterapia en cánceres poco diferenciados, pero tampoco están aprobados. Pienso que es necesario atenerse a lo que se ha comprobado y utilizarla de manera muy responsable.
Dr. Canessa: Dr. Lillo, ¿tiene alguna experiencia con TSH recombinante?
Dr. Lillo: Ninguna experiencia sistemática.
Dr. Canessa: Hablemos entonces de PET glucosa, que es un avance destacable en escala mundial y que está disponible en nuestro medio desde 2002. En el centro PET del Hospital Militar se han visto alrededor de 30 pacientes con cáncer diferenciado de tiroides; algunos de ellos pertenecen a los colegas que están sentados a la mesa, y quisiera preguntarle al Dr. Ilzauspe cuál ha sido su experiencia.
Dr. Ilzauspe: En un par de pacientes he recurrido al PET para resolver un problema clínico. El PET es una buena herramienta secundaria, en aquellos casos en que no se puede resolver con las herramientas habituales. Recuerdo a una de ellas que tenía tiroglobulinas negativas y anticuerpos dudosos, con un nódulo en el cuello que parecía ganglio, pero no se pudo determinar si era patológico, porque medía 6 mm y era difícil de puncionar para biopsia; en ese caso recurrimos al PET FDG, el cual marcó la zona y ayudó a resolver el seguimiento. Por lo tanto, el PET sería una buena alternativa cuando se sospecha enfermedad residual o recidiva de la enfermedad, en quienes esto no se puede determinar con el yodo 131 ó 123.
Dr. Canessa: Dr. Domínguez, ¿qué opina de esta nueva técnica, poco accesible todavía, pero ya disponible?
Dr. Domínguez: Creo que parece prometedora, aunque en algunos pacientes no hemos determinado la verdad, pero creo que con todos los exámenes pasa eso. Quizás no sea tan bueno como se pensaba inicialmente, pero es útil, y nosotros creemos que está indicado fundamentalmente en el paciente cuya tiroglobulina está elevada, en el cual, después del rastreo con tomografía computada (TC) y distintos métodos, no se ha podido encontrar el tumor. Hemos tenido varios casos con estas características; en uno de ellos se descubrió una metástasis pulmonar que, al operarla, resultó ser una metástasis de un cáncer papilar, que no captaba el yodo porque no era un tejido suficientemente maduro para hacerlo, pero sí producía tiroglobulina. Pienso que el PET es un buen elemento diagnóstico; tal vez se pueda perfeccionar más, pero es interesante y en muchos casos ayuda a saber dónde está la metástasis.
Dr. Canessa: El PET con FDG está indicado, en el cáncer diferenciado de tiroides, cuando hay elevación del marcador tiroglobulina y la exploración corporal con yodo es negativa o no demuestra un foco claro. Lo que se discute es un aspecto técnico del estudio, si se hace o no en situación de TSH elevada, lo que vuelve a plantear el problema de si vamos a elevarla suprimiendo el reemplazo hormonal para causar un hipotiroidismo, o si usamos TSH recombinante. Inicialmente, se describió que se podría obviar la elevación de TSH y que incluso sería un factor favorable al no tener que dejar al paciente hipotiroideo; sin embargo, las últimas series tienden a demostrar que el rendimiento del PET con elevación de TSH, es mayor.
En un estudio del Dr. Domínguez se proyecta observar la captación anormal de la glucosa en cadenas ganglionares cervicales. Cuando el cáncer diferenciado de tiroides deja de ser diferenciado, la que es una posibilidad, sobre todo en las metástasis, es decir, cuando la célula tumoral pierde la capacidad de captar yodo, se pierde también la opción terapéutica con radioyodo. Además, estas células dejan de expresar receptores de TSH y de producir tiroglobulina, por lo tanto, tampoco podemos pesquisarlas con marcadores plasmáticos ni podemos frenar su crecimiento con hormona tiroidea, o sea, el tumor queda fuera de nuestro alcance. Aquí es donde aparece una serie de elementos nuevos; la mayor parte de ellos está aún en fase I y algunos en fase II de aprobación farmacológica. Todos actúan en el ámbito molecular. Hay algunos genes que se sobreexpresan en el cáncer de tiroides, como los ret, los productores de angiogénesis; además los sistemas de apoptosis disminuyen, los estímulos de diferenciación celular se alteran. Estas nuevas técnicas, que aún no están disponibles, actúan a estos niveles y probablemente son el futuro del tratamiento del cáncer de tiroides, incluso cuando todavía se pueda pesquisar que el tumor está en forma diferenciada.
Quisiera discutir sobre la reinducción de diferenciación, que consiste en que, cuando el tumor se muestra indiferenciado, se utilizan algunos medicamentos; el más conocido es el ácido 13-Cis-retinoico, con el que se pretende que la célula vuelva a captar yodo y, de esta manera, vuelva a ser víctima potencial de una dosis ablativa. Dr. Ilzauspe, ¿hay alguna esperanza en este aspecto o es sólo una posibilidad teórica?
Dr. Ilzauspe: Hay cierta evidencia prometedora para esta vía de solución, porque es un tratamiento que, en el fondo, corrige las cadenas metabólicas de la célula. La célula folicular tiene una vida normal, pero se va desdiferenciando a medida que se va transformando en un cáncer cada vez más indiferenciado y pierde su capacidad normal de captar yodo, oxidarlo y organificarlo; por lo tanto, se altera la herramienta que nosotros utilizamos para destruir la célula que es el ingreso del yodo radiactivo. Entonces, se trata de lograr que las células que se han desdiferenciado recuperen las vías metabólicas de captación de yodo. El ácido retinoico ha mostrado elementos positivos al respecto. Hay dos tipos de receptores para este ácido: uno de ellos, al ser modificado, aumenta la captación de yodo, de modo que, en aquellos tejidos tumorales recidivantes que no captan yodo, con estos elementos se podría revertir esa situación. En la misma línea hay un medicamento muy útil, el litio, que favorece que el yodo que ingrese a la célula y se mantenga por más tiempo en su interior; por lo tanto, la eficacia del yodo radioactivo en una célula folicular que está tratada con litio se va a mantener por más tiempo.
Dr. Canessa: Dr. Domínguez, ¿qué opina al respecto?
Dr. Domínguez: Tenemos algunos pacientes que nos han planteado este problema, cuando el cáncer comienza a desdiferenciarse, no capta el yodo y sigue avanzando. Hay también evidencia de que el ácido valproico hacía mejor efecto que el ácido retinoico. Un grupo italiano, encabezado por Catalano, afirma que el ácido valproico aumenta el ARN mensajero del sodium iodide symporter (NIS) más que el ácido retinoico y que aumenta la captación de yodo más eficazmente que éste, según estudios experimentales realizados en líneas celulares de cultivos de tejido, pero plantea que también se puede usar clínicamente. Creo que son puertas que se abren para enfrentar casos complicados, que no tienen buen pronóstico, porque están fuera de la cirugía y del yodo radioactivo.
Dr. Lillo: Es alentador que aparezcan nuevos elementos que mejoran nuestra capacidad diagnóstica y terapéutica, porque el principal problema lo tenemos en los pacientes en quienes se plantea que el tumor entra en un proceso de desdiferenciación. Nos ha tocado participar en varios casos de este tipo y es impactante ver cómo se produce el retroceso de los pacientes por este proceso, de modo que se debe considerar el diagnóstico con FDG y cualquier herramienta que permita paliar la situación. Aún no tenemos experiencia con este tipo de terapias.
Dr. Canessa: Nosotros tampoco, pero creo que se debe empezar a tener en cuenta.
Dr. Domínguez: En aquellos pacientes cuya exploración sistémica es negativa, no aparece ningún foco demostrable y, sin embargo, tienen tiroglobulina alta ¿Se usa o no tratamiento con yodo radioactivo? Hemos tenido algunos casos de este tipo, en los que se recomienda administrar dosis terapéuticas de yodo altas, sobre 150 mCi, y seguirlos en forma muy estricta. Ahí se ve la diferencia entre hacer un rastreo diagnóstico con bajas dosis de yodo radioactivo y realizar un rastreo posterior a una dosis terapéutica. Pacini hizo un estudio en el que encontró lesiones en rastreos post dosis terapéutica en 30% a 40% de pacientes que no presentaban hallazgos en los rastreos previos, de manera que conviene tener cuidado con esos rastreos diagnósticos de dosis bajas. Tienen que ser bajas, para evitar el atontamiento que se presenta con dosis más altas de yodo radioactivo, I131 especialmente. Él preconiza el uso de tratamiento con yodo radioactivo en estos pacientes.
Dr. Canessa: Sin embargo, existe ahí un espacio intermedio, en el que se podría hacer un PET FDG. En este caso, recuerdo que el NIS, symporter sodio yodo, ya mencionado, está relacionado con el transporte de yodo y que se perdería en algunas células tumorales, pero que todavía conservan su capacidad de producir tiroglobulina. La glucosa se introduce en la célula por otro transportador, el glut, y este es el caso específico en que el PET podría localizar el tumor. El problema es que si no capta yodo de diagnóstico puede que lo capte en dosis terapéutica, pero en algunos casos no sucede, de modo que al final terminamos administrándole yodo, porque no hay otras opciones. No sé qué opina el Dr. Ilzauspe.
Dr. Ilzauspe: Creo que va a ser difícil resolver este problema, pero insisto en que se debe analizar al paciente en forma individual y poner en la balanza el riesgo de una dosis de más versus una dosis de menos.
Dr. Lillo: Se tiende a pensar que si no capta el yodo diagnóstico no va a captar el terapéutico, pero probablemente la discrepancia no está en ese comportamiento, sino que quizás tenga que ver con algo que nosotros observamos en un grupo de exploraciones sistémicas que hicimos después del tratamiento; al analizar las imágenes precoces y tardías, encontramos que un número no significativo de imágenes que aparecían precozmente, entre el cuarto y quinto día, desaparecían en el control posterior. El grupo italiano que se mencionó tiene un trabajo que respalda eso, y fue lo que nos motivó a hacer esta experiencia. Llama la atención la desaparición de esas imágenes o la atenuación de la captación; pienso que tal vez esas discrepancias están relacionadas con el momento en que se realizó la exploración, más que con un problema de si va a captar yodo diagnóstico o terapéutico, porque no creo que el comportamiento celular sea tan distinto en uno u otro caso.
Dr. Canessa: Como ustedes ven, las controversias continúan.
Pregunta Dra. C. Concha (Chile): En nuestro hospital hemos realizado varias terapias en niños menores de 15 años, aunque grandes. Dr. Domínguez, ¿cómo maneja el tema de la radioprotección en niños pequeños?
Dr. Domínguez: Les puedo contar el caso de un paciente que ahora tiene 11 años, que fue tratado hace 6 años, después de operarse, con yodo radioactivo. La familia se organizó, para hacerle aislamiento, que fue prácticamente toda la casa, y los hermanos se fueron a otro lugar. Los padres y tíos, que eran gente mayor, se quedaron, tratando de no estar en contacto con él, pero apoyándolo, porque con 50 y después 100 mCi tuvo que estar aislado en 2 oportunidades. De manera que la radioprotección se logró en forma muy adecuada.
Pregunta Físico Médico M. Cabrejas (Argentina): ¿No hubieran podido realizar una dosimetría para determinar la dosis máxima que le podían administrar?
Dr. Domínguez: Habría sido bueno, pero hacerla es muy complejo, sobre todo en un niño.
Dr. Lillo: Desde el punto de vista físico, el procedimiento no es tan complejo, pero la aprensión que tengo con la dosimetría es el problema de la distribución del radiotrazador. Hay un volumen en el cual está heterogéneamente distribuido y hay zonas de muy baja actividad y otras con captación variable, por lo que el problema es que no existe una masa de tejido claramente distinguible, como órgano blanco. Se puede hacer una dosimetría más bien del volumen del cuerpo. Lo otro que podría ayudar en estos casos es una atención preferente, en el sentido de medir al paciente permanentemente, para lograr una idea de la tasa de irradiación que tiene a diario y, de esa manera, ir regulando los tiempos con que el niño puede ser atendido. Nunca me ha tocado atender a un niño que no tenga control de esfínteres, que es un tema crítico en todo paciente, porque la mayor parte del yodo se elimina por la orina.
En dos estudios que hicimos con alumnos de tecnología médica, en pacientes con hipertiroidismo y cáncer tiroideo, pudimos deducir algunas reglas para los días de aislamiento y, en general, la experiencia fue muy positiva. Si se tiene la posibilidad de prestar atención y medir al paciente con un detector Geiger, se puede ir regulando el tiempo de exposición; de hecho, las normas norteamericanas, actualmente, llegaron a la conclusión de que la protección radiológica debe enfocarse a llegar hasta un cierto límite de irradiación de las personas que cuidan al paciente. Desde ese punto de vista, el uso de instrumentos que permitan medir y seguir la evolución de la tasa de irradiación podría ayudar a enfrentar el problema de la protección radiológica.
Medwave. Año 5, No. 3, Edición Abril 2005. Derechos Reservados.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 : Moderador: Dr. José Canessa, Hospital DIPRECA.
Participan: Dr. Miguel Domínguez, Hospital San Juan de Dios; Dr. Juan Ilzauspe, Hospital DIPRECA, Clínica Alemana; Dr. Ricardo Lillo, Hospital Clínico Universidad de Chile.
: Moderador: Dr. José Canessa, Hospital DIPRECA.
Participan: Dr. Miguel Domínguez, Hospital San Juan de Dios; Dr. Juan Ilzauspe, Hospital DIPRECA, Clínica Alemana; Dr. Ricardo Lillo, Hospital Clínico Universidad de Chile.

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión