Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
Muchos tumores neuroendocrinos sobreexpresan receptores de somatostatina, hormona cuya estructura corresponde a un péptido cíclico de 14 aminoácidos y con una vida media plasmática muy corta, de alrededor de dos minutos; por esto se ha sintetizado una serie de análogos. En la Figura 1 se observa, en la parte superior, la secuencia aminoacídica de la somatostatina en su versión de 14 aminoácidos (existe otra, de 28); ésta es la parte activa. Debajo de ella está el primer análogo conocido, el octreotide; ahí se observa su estructura. También aparecen otros de vida media más larga, como lanreotide, tyr-octreotide (TOC), RC-160 y tyr-octreotate. Los que se han utilizado para terapia son octreotride y TOC.
Figura 1. Algunos análogos de somatostatina.
Se ha clonado cinco subtipos de receptores de somatostatina, denominados, según el orden cronológico en que fueron descritos, sst 1 a 5. La variedad 2 tiene dos subtipos: A y B. La somatostatina natural tiene afinidad por todos estos receptores; los análogos tienen más afinidad por algunos subtipos que por otros.
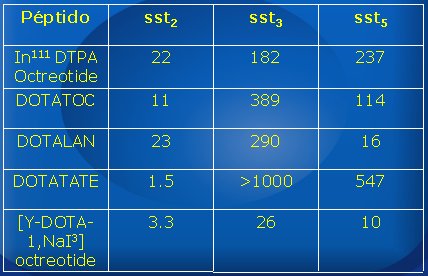
En la Tabla I se observa las afinidades de los distintos péptidos por los subtipos (sst2, sst3 y sst5); el número representa la concentración nanomolar necesaria para desplazar el 50% de los receptores, por lo que, cuanto menor sea el número, mayor es la afinidad del péptido por el receptor. El octreotide tiene muy buena afinidad por sst2, pero no tan buena por sst3 y sst5. El DOTA-d-Phe(1)-Tyr(3)-octreotide (DOTATOC), con el cual se tiene más experiencia, tiene mejor afinidad por sst2 y también por sst5, mejor que el octreotide.
Tabla I. Afinidades (IC50, nM) de péptidos por los subtipos de receptores de somatostatina.
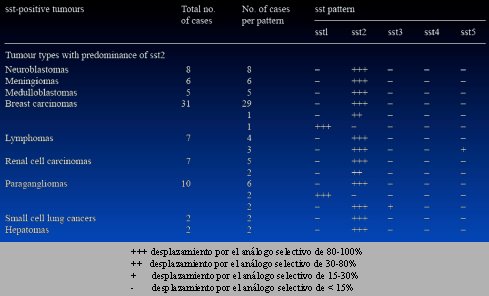
Otra variable de consideración es que los distintos tipos de tumores expresan diferentes subtipos de receptores. En un estudio se analizó los subtipos de receptores de somatostatina por tipo histológico. En la Tabla II están los que expresan fundamentalmente el sst2 y la explicación es el grado de desplazamiento del análogo selectivo; tres cruces significan entre 80 y 100%, es decir, buena afinidad.
Por ejemplo, los neuroblastomas, los meningiomas, los meduloblastomas y el cáncer de mama pueden expresar cantidades importantes del receptor SST2, aunque en el cáncer de mama existe una variabilidad, porque algunos expresan también SST1. Los linfomas también pueden expresar SST2; algunos carcinomas de células renales, los paragangliomas, el tumor de células pequeñas y los hepatomas también pueden expresar este tipo de receptores; luego, en teoría, este tipo de terapia no está limitada sólo a tumores neuroendocrinos.
Tabla II. Algunos tumores que expresan receptores sst2 (Mod. de Reubi JC et al. Somatostatin receptor sst1–sst5 expression in normal and neoplastic human tissues using receptor autoradiography with subtype-selective ligands; Eur J Nucl Med 2001; 28:836–846).
Entre los tumores que expresan principalmente sst1 y sst3 están el cáncer de próstata, que expresa sst1; los sarcomas, de los cuales algunos expresan sst1 y otros, sst3; y algunos adenomas hipofisiarios, aunque en éstos la variabilidad es mayor. Otros expresan sst2 y sst5, o sst1 o sst2. En los gastroenteropancreáticos, la expresión de los subtipos es variable, lo que explica por qué no todos los tumores neuroendocrinos son ávidos de octreotide. Los feocromocitomas pueden expresar uno u otro, y el cáncer gástrico, en algunos casos, también puede expresar sst1, igual que los ependimomas.
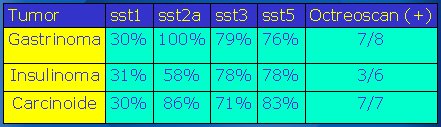
En un trabajo en el que se estudió tres tipos de tumores y su relación con el Indio-111 Octreotide (Octreoscan), se comprobó una relación bastante buena entre la expresión de sst2A versus la captación de Octreoscan. Por ejemplo, 100% de los gastrinomas expresaban sst2A; sin embargo, en 7 de los 8 pacientes a los que se les realizó Octreoscan fue positivo, a pesar de que todos tenían sst2A (el número de pacientes con gastrinoma era mayor, pero sólo a 8 se les realizó cintigrama con Octreoscan). Por otro lado, en el insulinoma sólo 60% expresaron sst2A y la mitad de los Octreoscan fueron positivos. Está descrito que 95% de los casos de carcinoide son positivos al Octreoscan; en este trabajo fueron 7 entre 7, pero sólo 86% expresaron sst2A y probablemente la contribución de sst5 puede explicar por qué el Octreoscan es positivo en un porcentaje tan alto de los carcinoides (véase Tabla III).
Tabla III. Expresión de receptores de somatostatina en algunos TN (Mod. de Kulaksiz et al. Identification of somatostatin receptor subtypes 1, 2A, 3, and 5 in neuroendocrine tumours with subtype specific antibodies. Gut 2002;50:52–60).
El DTPA-octreotide (Pentetreotide) u Octreoscan, que es el nombre comercial, fue el primer análogo que aprobó la FDA, en 1994, para la cintigrafía de los TN. Se une de manera específica a los sst2, pero también tiene afinidad por los sst5 y sst3. Su indicación principal, como herramienta diagnóstica, es para la localización de tumor primario y metástasis de los tumores gastroenteropancreáticos, entre los cuales están los carcinoides, tumores pancreáticos endocrinos, gastrinomas, insulinomas, glucagonomas, vipomas, etc.
También ha permitido visualizar otros tumores, como el cáncer medular de tiroides, el tumor de células pequeñas, feocromocitomas, tumores hipofisiarios y del sistema nervioso central. El cáncer de mama y algunos tumores renales también pueden expresar receptores de somatostatina, por lo que puede resultar positivo el estudio con Octreoscan.
Debido a que el indio 111 (In111) emite electrones de Auger con un rango menor de 1 diámetro celular, varios grupos de investigadores empezaron a tratar tumores con receptores para somatostatina y utilizaron múltiples dosis de In111 DTPA Octreotide, acumulada hasta 160 GBq, equivalentes a 4,32 Ci (Krening et al. Peptide receptor radionuclide therapy, Ann NY Acad Sci 2004;1014:234-245).
La experiencia acumulada en estos trabajos demuestra que hay una remisión parcial en 8% de los casos, entendiendo como remisión parcial que el tumor principal disminuya su tamaño en 50% o más. Además, se logra estabilización de la enfermedad progresiva en un alto porcentaje de los casos. La mejor respuesta se observa en tumores de alta captación por el octreotide. Sin embargo, no es eficaz en tumores grandes o en etapas avanzadas de la enfermedad.
En relación con la toxicidad, en tres pacientes se desarrolló un síndrome mielodisplásico o leucemia, cuando las dosis sobrepasaron los 100 GBq (2,7 Ci), por lo que se definió esa dosis como la dosis máxima tolerable acumulada. En la experiencia disponible, no hubo alteración de la función renal, ya que, debido a la escasa penetración de la radiación Auger del Indio 111, las células sin receptores para somatostatina no reciben radiación, lo que se denomina efecto de “fuego cruzado”; por tal motivo, para la terapia se buscó otros análogos e isótopos más eficaces que el In111 DTPA Octreotide.
Entre estos análogos está el DOTA (ácido dodecanatetraacético), que es un quelante universal capaz de crear uniones muy estables con varios metales como, por ejemplo, con Indio 111, Galio 67 ó 68, Ytrio 86 ó 90 y Cobre 64, lo mismo que con algunos lantánidos, como Lutecio 177, los cuales se pueden utilizar para imágenes o como terapia.
El Ytrio 90 (Y90) es un emisor beta puro, de vida media relativamente corta (64 horas), pero con una energía beta bastante grande, de 2,27 mega electrón volt (MeV). El rango, es decir, la penetración de estas partículas, depende del medio en que se encuentren; el máximo se da en agua, hasta 11 mm; en tejidos blandos oscila entre 2 y 5 mm.
El DOTA-Tyr3-Octreotide (DOTATOC) fue el primer análogo de somatostatina marcado con Ytrio 90. Comparado con el Indio 111 octreotide, es más hidrofílico y tiene mayor afinidad por los receptores sst2 y es dos veces más afín a este receptor que el octreotide. La farmacocinética de este radiofármaco es favorable; la eliminación plasmática es rápida, sólo 5% de la dosis inyectada queda a las 5 horas y menos de 1% a las 24 horas; se une escasamente a proteínas y la unión química del DOTA con el Ytrio y con el análogo es muy estable. La excreción renal es exclusiva: 50% de la dosis se elimina en tres horas y media y, a las 24 a 48 horas, se elimina menos de 5%.
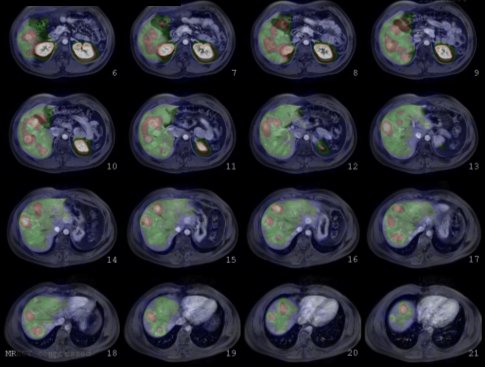
La Figura 2 muestra imágenes de nuestro primer paciente tratado; tenía un insulinoma metastásico. A la izquierda se observa el estudio realizado con Pentatreotide; la captación de las metástasis hepáticas es considerable, pero no tan alta. A la derecha está el estudio efectuado con la radiación de frenado de las partículas beta, con la que se puede obtener una imagen que, a pesar de algunos problemas técnicos, deja adivinar la captación de las metástasis; lo interesante es que la captación renal de este radiofármaco es significativa.
Figura 2. Imágenes obtenidas con In111-Pentatreotide y Y90 – DOTATOC.
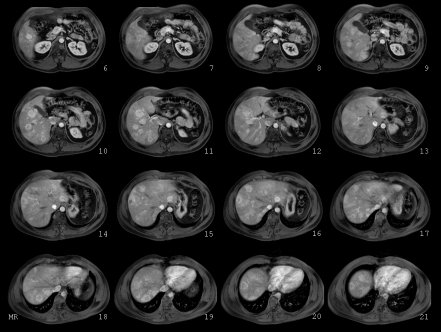
En la Figura 3 se observa el estudio con resonancia, que muestra múltiples lesiones de tamaño considerable. Este enfermo se trató porque desarrolló un síndrome de hipoglicemia tan grave que existía riesgo vital sin la infusión continua de suero glucosado endovenoso, sin embargo debido al número y tamaño de las lesiones se esperaba que la evolución pudiera no ser favorable.
Figura 3. Estudio con Resonancia Magnética del mismo paciente.
El estudio SPECT del octreotide, el Octreoscan, reveló en la imagen de fusión una correlación perfecta entre las lesiones de la RM y la captación del octreotide (véase Figura 4). Este paciente recibió hasta 150 mCi de Y-90 DOTATOC/m2; se observó una buena respuesta clínica inicial, pero después se volvió más resistente a la terapia.
Figura 4. Correlación entre lesiones de la RM y captación del Octreotide. Imágenes SPECT con cortes transaxiales a nivel hepático efectuando fusión con la RM.
En el último tratamiento, efectuado en julio del 2004, había mejorado nuestra capacidad técnica para obtener las imágenes con bremsstrahlung, (palabra alemana que significa “rayos frenadores”), de modo que se observaban con mayor claridad las metástasis hepáticas, aún captantes (véase Figura 5).
Figura 5. Estudio con radiación de frenado de las partículas beta, del mismo paciente, después del último tratamiento.
El Instituto Oncológico Europeo, con sede en Milán, realizó estudios fase I y fase II en un total de 256 pacientes, 80% de quienes, al inicio del estudio, tenían enfermedad progresiva. Muchos de estos enfermos habían recibido terapias previas. Se hicieron dos grupos, con protección renal y sin ella. El primer grupo recibió dosis bajas e iguales, partiendo con 1,1 GBq, o sea, 30 mCi, subiendo de 10 en 10 mCi por ciclo. Las dosis típicas de tratamiento administradas fueron 4,81 GBq, hasta alcanzar dosis acumulativas de 7 a 21 GBq.
En su experiencia no observaron efectos agudos con dosis hasta de 5,55 GBq por ciclo. Hubo toxicidad medular grado III, reversible, en leucocitos o plaquetas, cuando las dosis sobrepasaron los 140 mCi, por lo que se definió ese nivel como la dosis máxima tolerable por ciclo. En su casuística no hubo daño renal agudo ni crónico. La respuesta clínica global fue de 27%; pero menos de 5% de esos casos tuvieron respuesta completa, aunque en más de 25% se observó respuesta objetiva significativa con este tratamiento.
El grupo University Hospital Basel, de Suiza, realizó un estudio fase II en 400 pacientes a los que se administró 4 ó más dosis, con actividades crecientes e intervalos de seis semanas; se observó baja toxicidad renal y hematológica, siempre menor de grado 2, con dosis acumuladas iguales a 200 mCi/m2 o menores, es decir, alrededor de 350 mCi en un paciente adulto de 70 kilos. Se obtuvo respuesta parcial o total en 24% de los pacientes. El mismo grupo evaluó también el efecto de la dosis. Se comparó dos grupos que recibieron 50 mCi/m2, por cuatro dosis, cada seis semanas, con 100 mCi/m2, por dos dosis, cada 8 semanas; se observó mejor respuesta en el segundo grupo, por lo que se concluyó que hay un efecto de las dosis por ciclo y por intervalos, que en este estudio no fue posible separar, pero que tiene relevancia en la respuesta clínica.
Otro trabajo importante es el del grupo de Rotterdam, Bruselas y Tampa, que reunió a 47 pacientes y los siguió durante 19 meses, con el objeto de definir la dosis máxima tolerable, en dosis única y tras cuatro dosis de tratamiento. En 80% de los casos, sus pacientes tenían enfermedad progresiva. Las dosis por ciclo fueron variables, de 35 a 290 mCi iniciales, con miras a llegar de 25 a 150 mCi/m2 en cuatro ciclos, separados por seis a nueve semanas; la dosis acumulada de ese grupo osciló entre 46 y 730 mCi. En este estudio no se alcanzó la dosis máxima acumulada, la que no se logró definir.
Se observó cierta toxicidad, lo que limitó las dosis por ciclo; hubo 3 pacientes con toxicidad hepática, 4 con trombocitopenia grave, 1 con síndrome de mielodisplasia; 37% de ellos tuvieron aumento de la creatinina plasmática. Hubo remisión parcial en 10% de los enfermos y en 18% una respuesta menor. Se comprobó una clara relación de dosis respuesta, ya que, a mayor dosis de radiación, mayor fue la disminución del tamaño del tumor, hasta 600 Gy. También se observó que la quimioterapia previa predisponía a la toxicidad medular y que la infusión de aminoácidos, junto con el tratamiento, disminuía la toxicidad renal.
En resumen, el tratamiento con Y90 DOTATOC es claramente más eficaz que el tratamiento con Indio111 DTPA Octreotide, del orden de tres veces, en tumores neuroendocrinos.
El (Y DOTA) lanreotide (DOTALAN) fue el segundo análogo marcado con Y90. Es más lipofílico y su afinidad por los sst2 es similar, comparado con el DTPA-octreotide; tiene más afinidad por los sst5, por lo que podría ser más útil en tumores que expresan o sobreexpresan este tipo de receptor; por ejemplo, en teoría, podría ser más útil en insulinomas.
En el estudio clínico multicéntrico MAURITIUS (Multicenter Analysis of a Universal Receptor Imaging and Treatment Initiative, a European Study), realizado en 154 pacientes a los que se les administró una dosis acumulada hasta de 230 mCi, hubo una respuesta menor en sólo 14% de los casos. No hubo toxicidad hematológica grave, aguda o crónica, tampoco cambios en la función renal o hepática, pero en dos tercios de los casos, el Y90DOTATOC mostró mayor afinidad por los tumores que el Y90DOTALAN, probablemente debido a la menor afinidad de este último por los receptores sst2.
Es un análogo relativamente nuevo, en el que se introdujo un cambio en el carbono terminal del octreotide (treoninol por treonina), lo que cambia sus afinidades. Se demostró que tiene gran afinidad por los sst2. Algunos estudios clínicos y preclínicos señalan que este análogo tiene mayor afinidad que los anteriores por los tumores que expresan este tipo de subreceptores.
Es un lantánido que emite radiación gamma y beta; la radiación gamma es de 208 keV, por lo que permite realizar imágenes; la radiación beta es de baja a mediana energía, del orden de los 0,5 MeV, a diferencia de los 2,27 MeV del Ytrio, lo que corresponde a un rango de 20 diámetros celulares en el Lutecio versus 150 del Ytrio. La vida media es más larga, de 6,6 días. Es probable que cause menos daño renal por efecto de fuego cruzado. Por los modelos computacionales de este isótopo, se prevé que un porcentaje mayor de la dosis se absorberá en tumores pequeños o micrometástasis. Existen modelos animales en los cuales se ha usado Lu177 octreotate y se ha logrado efectos prometedores en cuanto a regresión tumoral y aumento de la sobrevida.
En una experiencia clínica con 76 pacientes con tumores neuroendocrinos gastroenteropancreáticos se utilizó una dosis/ciclo entre 100 y 200 mCi cada 6 a 9 semanas, con dosis acumulada entre 600, 700 y 800 mCi. Se observó una respuesta parcial o completa en 30% de los pacientes, lo que es alentador. La respuesta fue proporcional a la alta captación con Octreoscan; los pacientes con buen índice de Karnofsky y compromiso hepático no masivo evolucionaron de manera satisfactoria. Hubo pocos efectos adversos y generalmente fueron transitorios; el más común fue la depresión medular leve. No se produjo daño renal, salvo en un paciente que tenía daño renal previo, y se definió que la dosis a testículo se asociaba a disminución de los niveles de testosterona e inhibina B en los meses subsiguientes.











 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
 Expositor:
Juan Carlos Quintana[1]
Expositor:
Juan Carlos Quintana[1]

Citación: Quintana JC. Treatment of neuroendocrine tumors with somatostatin analogues. Medwave 2005 Abr;5(4):e1367 doi: 10.5867/medwave.2005.04.1367
Fecha de publicación: 1/5/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión