Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del V Congreso de Obstetricia, Ginecología Infantil y Adolescencia, realizado en Santiago entre los días 31 de agosto al 2 de septiembre de 2006. El evento fue organizado por la Sociedad Chilena de Obstetricia, Ginecología Infantil y Adolescencia. Presidente: Dra. Pamela Oyarzún.
En la práctica dermatológica es frecuente la consulta de pacientes de sexo femenino con estados hiperandrogénicos de distinto grado. Se dice que 10 a 20 % de las mujeres sanas presentan este problema, que tiene como signos cardinales seborrea, acné, hirsutismo y alopecia; algunas de ellas presentan, además, alteraciones menstruales y otras pueden tener obesidad, con o sin resistencia a la insulina.
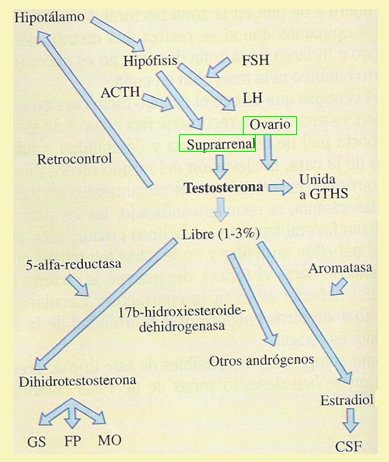
Las principales fuentes de testosterona en la mujer son las glándulas suprarrenales y los ovarios; esta testosterona actúa ya sea en forma directa, por medio de la 5 alfa reductasa, o a través de la conversión periférica (Fig.1).
Figura 1. Fuentes androgénicas en la mujer
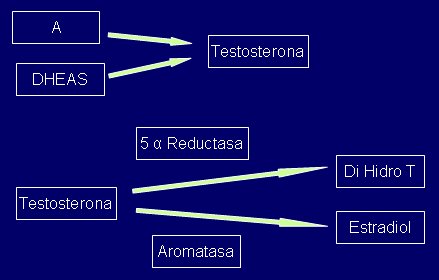
En este proceso la piel, el hígado y el músculo esquelético cumplen un papel importante, especialmente la piel, que es donde se produce principalmente la conversión periférica: la androstenodiona y la dehidroepiandrosterona sulfato (DHEA-S) se convierten en testosterona y ésta pasa a dihidrotestosterona por la acción de la 5 alfa reductasa y a estradiol, por efecto de la aromatasa (Fig.2).
Figura 2. Conversión periférica de testosterona
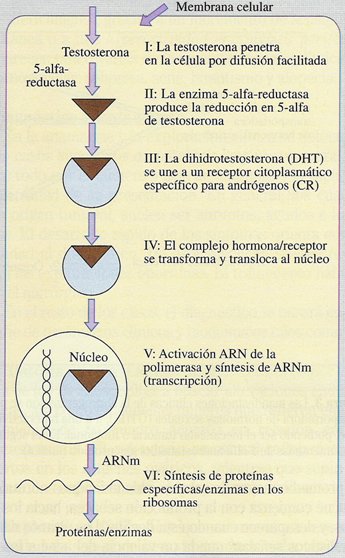
El mecanismo de acción de la testosterona a nivel local es importante en dermatología por las acciones que puede tener en el órgano blanco, en distintos sitios. La testosterona ingresa a la célula y, con posterioridad a la acción de la 5 alfa reductasa, la dihidrotestosterona se une al receptor citosólico para ingresar al núcleo, donde desencadena un ARN mensajero para producir una síntesis proteica que va a determinar los cambios que se producen (Fig.3).
Figura 3. Mecanismo de acción de la testosterona.
Dos tipos de 5 alfa reductasa nos interesan: la de tipo I, que se encuentra en la glándula sebácea de la piel del dorso alto torácico, en hígado y en riñón, aunque en la actualidad se plantea que también puede estar presente en algunos grados en el cuero cabelludo; y la de tipo II, que se encuentra principalmente en tórax, piel de la zona de la barba, hígado, sistema genitourinario masculino y cuero cabelludo.
A continuación se revisarán algunos aspectos de la fisiología de la piel y anexos y los principales signos y síntomas que orientan a la presencia de hiperandrogenismo.
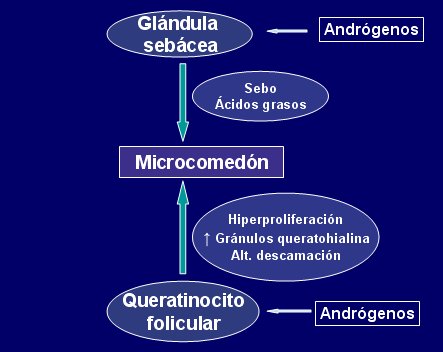
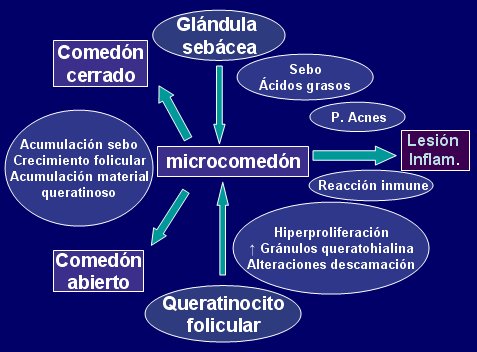
Figura 4. Formación de los microcomedones.
El microcomedón local va aumentando de tamaño, se acumula mayor cantidad de sebo, el crecimiento folicular continúa y se va acumulando cada vez más material queratinoso, hasta que se forma el comedón cerrado. Si éste se abre al medio externo, la grasa se oxida y lo coloniza el Propinobacterium acnes, principal bacteria asociada con el acné, desencadenando un mecanismo inmune que genera factores inflamatorios, los que llevan a la lesión inflamatoria propiamente tal (Fig.5).
Figura 5. Formación de la lesión inflamatoria.
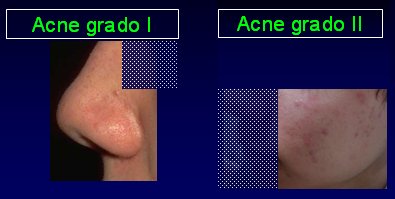
Existen cuatro tipos de acné, que se clasifica en grados de I a IV. En el grado I se observan las lesiones características: comedones cerrados, comedones abiertos y puntos negros típicos; histológicamente se evidencia la glándula con el gran tapón córneo. En el grado II ya hay lesiones inflamatorias importantes y mayor seborrea y en la histología se observa el folículo sebáceo con aumento del infiltrado perifolicular, aparentemente mononuclear (Fig.6).
Figura 6. Acné grado I y II
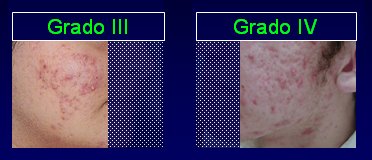
En el acné grado III comienzan a aparecer lesiones pustulosas; en la histología se observa disgregación de la zona del folículo y aumento de células inflamatorias. En el acné grado IV, o acné nódulo quístico, ya hay lesiones profundas y lesiones quísticas; la histología muestra disrupción del folículo piloso y al fondo se ven células gigantes multinucleadas de cuerpo extraño, que corresponden al propio material córneo que se va eliminando (Fig.7).
Figura 7. Acné grado III y IV
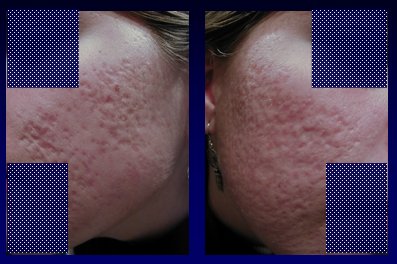
El tratamiento en estos pacientes tiene por objeto evitar que lleguen al estado de cicatrices secundarias al acné (Fig.8).
Figura 8. Cicatrices post acné.
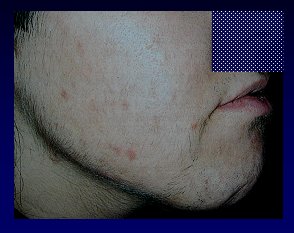
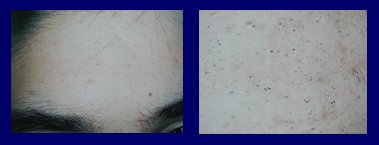
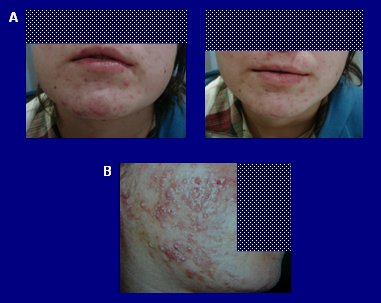
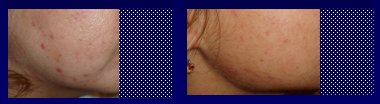
Se debe plantear la presencia de hiperandrogenismo en pacientes con acné y otros signos de androgenización cutáneos (Fig.9); en prepúberes con numerosos comedones, porque son una evidencia de que hay mucha reproducción folicular local y los factores comedogénicos están muy acelerados (Fig.10); en adolescentes cuyo acné no cede a tratamiento habitual bien llevado (Fig.11 A); en pacientes que al suspender los retinoides reinician rápidamente un brote de acné intenso, lo que significa que puede haber otra causa subyacente y no sólo un factor folicular importante (Fig.11 B); en una mujer adulta en la que se presenta acné en forma brusca, sin tener lesiones previas, lo que con frecuencia se asocia a grandes trastornos emocionales (Fig.12).
Figura 9. Signos de hiperandrogenismo en paciente con acné
Figura 10. Comedones abundantes en prepúber
Figura 11. A: Adolescente portador de acné, con mala respuesta a tratamiento. B: Intenso y rápido brote de acné al suspender retinoides
Figura 12. Debut de acné en mujer adulta
El impacto psicológico, social y emocional del acné es casi comparable con el de enfermedades crónicas como asma, epilepsia, diabetes y artritis. El impacto psicológico, en ambos sexos, está dado por el aspecto de la cara, independiente del grado de acné y de la edad, que llega a producir distintos grados de ansiedad y depresión. En el plano social, la tasa de desempleo en individuos con acné es mayor que en el resto de la población.
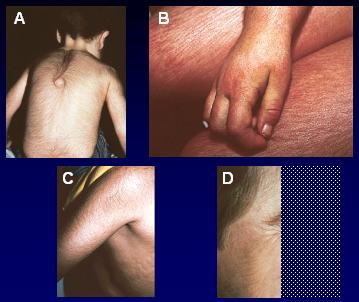
Figura 13. Casos de hipertricosis. A: Lanugosa congénita. B: Mucopolisacaridosis congénita. C: Dermatomiositis. D: Porfiria cutánea tarda
En cuanto a la acción de los andrógenos en el folículo piloso, al llegar la adolescencia la testosterona se une principalmente a receptores celulares, codificados por genes del cromosoma X, que se ubican en la papila dérmica y en la vaina pilosa. Debido a lo anterior, el pelo se multiplica en el folículo de la papila, se profundiza en la dermis y se inserta en la grasa de ésta, a la cual se adhiere con intensidad. Además de los andrógenos, también influye la actividad de la 5 alfa reductasa de cada individuo; las personas pueden tener receptores y 5 alfa reductasa más o menos activos debido a factores familiares y de acuerdo a ello tendrán mayor o menor cantidad de vello. La concentración de proteína transportadora de hormonas sexuales aumenta con los estrógenos y con las hormonas tiroideas y disminuye con los andrógenos, la insulina y el mayor índice de masa corporal, ya que hay menor síntesis hepática y mayor producción de andrógenos a nivel tecal; por todos estos factores, al disminuir la proteína transportadora de hormonas sexuales masculinas aumenta la pilosidad corporal. En los hombres, en general, la testosterona circula principalmente unida a proteínas; sólo 3% circula libre. Las mujeres normales tienen alrededor de 1% de testosterona libre, valor que se puede duplicar en las hirsutas, por lo que adquieren un patrón masculino de distribución del vello corporal.
En endocrinología, la hipertricosis se estudia mediante la escala de Ferriman-Gallway, que también se usa en dermatología y evalúa la presencia de vello en cara, zona del bigote, mentón, zona paraesternal, brazos, abdomen alto y bajo, caras anterior y posterior de los muslos, en especial en su parte interna, espalda y zona lumbar.
El síndrome de ovario poliquístico (SOP) se debe sospechar en caso de hirsutismo, en especial cuando se asocia con acné y alopecia; además puede haber síntomas anovulatorios y obesidad. Los patrones de laboratorio se alteran y en la ecografía se observan quistes ováricos; hay exceso de andrógenos ováricos, insulina y andrógenos adrenales; aumenta la LH, hay resistencia a la insulina y se observa obesidad androide, es decir, abdominal y aumento del riesgo cardiovascular. En un tercio de estas mujeres se encuentra alterada la prueba de tolerancia a la glucosa y en la mitad de ellas, al menos uno de los padres tiene diabetes mellitus tipo 2, es decir, no heredan receptores.
El hiperandrogenismo insulínico se caracteriza por una alteración del metabolismo de la glucosa, con resistencia al efecto de la insulina e hiperinsulinemia secundaria. Esto altera la esteroidogénesis y produce pseudo acromegalia, por desencadenamiento de factores de crecimiento, acantosis nigricans local y lipogénesis, por los mismos factores de crecimiento. Además, disminuye la globulina transportadora de hormonas sexuales, su gen productor y el colesterol LDH.
La acantosis nigricans es una consecuencia de la resistencia insulínica; consiste en una hiperplasia epidérmica, secundaria a IGF-1. No es que aumente la pigmentación local, sino que aumenta la proliferación del estrato córneo y de la epidermis en general, debido a lo cual, en forma secundaria, la piel se ve hiperpigmentada. Se puede melanizar discretamente en la base en algunas zonas, pero no se trata de un problema pigmentario inicial.
Dentro del estudio del hirsutismo en dermatología, se precisa evaluar si hay asociación entre hirsutismo y otros factores, como obesidad y acantosis nigricans. Se debe buscar hiperplasia suprarrenal congénita, ovario poliquístico y la presencia de otros hallazgos clínicos como hirsutismo periférico. De dichas asociaciones dependerá el enfoque del estudio.
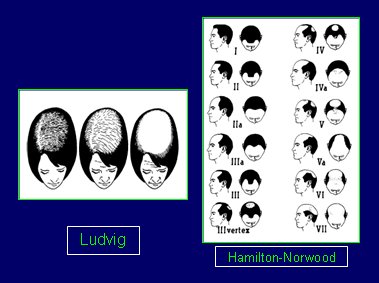
Figura 14. Patrones de alopecia en ambos sexos
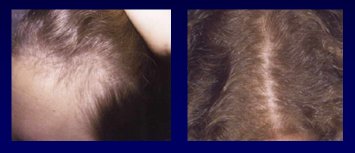
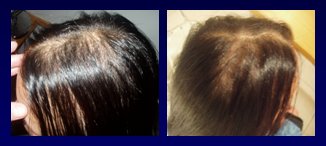
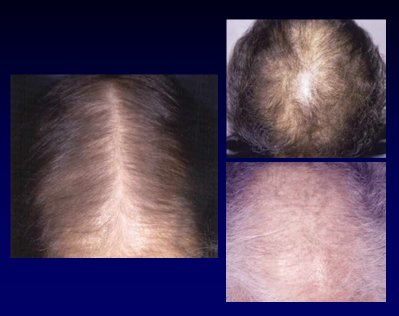
En la mujer, el patrón de pérdida del cabello depende de los niveles de andrógenos. En el caso de niñas con pubertad precoz y poco pelo, o en mujeres de cualquier edad con esta alteración, se debe buscar la causa. En la adolescencia, la pérdida de cabello en las zonas temporales se asocia, en general, al uso de peinados con gran tracción (Fig.15). En las adultas jóvenes, cuando no hay otras causas de pérdida del cabello, se debe sospechar un hiperandrogenismo (Fig.16). En la mujer adulta el patrón característico es la pérdida de cabello en la zona de la coronilla, respetando la zona frontal, patrón que se hace más notorio con la menopausia, después de la cual el pelo se miniaturiza progresivamente, la entrada a un nuevo período anágeno es cada vez más lenta y, por último, los folículos dejan de estar activos (Fig.17).
Figura 15. Patrones de pérdida de cabello en la adolescencia
Figura 16. Mujer de 25 años con pérdida de cabello asociada con hiperandrogenismo
Figura 17. Alopecia en mujer menopaúsica con hiperandrogenismo
El método diagnóstico irrefutable para alopecia androgénica es el tricograma, que consiste en cortar el pelo a un centímetro en dos áreas: frontal y occipital, las que se comparan a la semana y se evalúa el crecimiento del pelo. La relación normal es 80% en anágena y 20% en telógeno; en caso de alopecia androgénica, habrá menor cantidad de pelos en anágena que en telógeno. En la actualidad se dispone del tricograma digital.
El estudio hormonal de hiperandrogenismo comprende: medición de andrógenos libres totales, testosterona total, proteína transportadora de hormonas sexuales, DHEA-S, 17 hidroxiprogesterona, LH y FSH; además, siempre se debe solicitar TSH y T4 libre. Otros exámenes que se puede solicitar, en caso de que se observe algún signo clínico que oriente a una alteración, son los niveles plasmáticos de prolactina, la prueba de tolerancia a la glucosa y la prueba simplificada de resistencia insulínica, HOMA (HOmeostasis Model Assessment).
Entre las alternativas terapéuticas, uno de los fármacos que se utilizan es la espironolactona, previa evaluación por ginecólogo o endocrinólogo, según edad y sexo del paciente. Muchas de las mujeres, aun teniendo niveles de andrógenos normales, se benefician con el uso de anticonceptivos orales, debido a la disminución de las gonadotrofinas y al aumento de la proteína transportadora de hormonas sexuales. Otros fármacos son el acetato de ciproterona y el acetato de clormadinona. Además, para el tratamiento específico de obesidad e hiperinsulinismo se usa la flutamida, que funciona mejor en la mujer que el finasteride, al cual responden mejor los hombres.
Es muy importante explicar al paciente cuáles son las causas de su patología y los posibles agravantes. Además, es preciso aclararle sus expectativas reales y realizar una contención adecuada, para lo cual muchas veces se necesita el manejo interdisciplinario. No se debe olvidar que se trata de pacientes adultos, con frecuencia muy afectados social y psicológicamente.

















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del V Congreso de Obstetricia, Ginecología Infantil y Adolescencia, realizado en Santiago entre los días 31 de agosto al 2 de septiembre de 2006. El evento fue organizado por la Sociedad Chilena de Obstetricia, Ginecología Infantil y Adolescencia. Presidente: Dra. Pamela Oyarzún.
 Expositora:
Tatiana Riveros Reciné[1]
Expositora:
Tatiana Riveros Reciné[1]

Citación: Riveros T. Hyperandrogenism and skin. Medwave 2007 Jul;7(6):e1260 doi: 10.5867/medwave.2007.06.1260
Fecha de publicación: 1/7/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión