Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIII Congreso Internacional de Reumatologia, XXV Congreso Chileno, realizado en Las Termas de Chillán entre los días 17 al 20 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Reumatología.
Presidente del Congreso: Dr Carlos Fuentealba.
Secretario Ejecutivo: Dr Francisco Radrigán.
Presidente Comité Cientifico: Dr Miguel Gutiérrez.
Edición Científica: Dr. Francisco Radrigán.
Es importante conocer la fisiopatología del síndrome de fibromialgia (SFM) y entender cómo determina el correspondiente síndrome clínico, ya que en este cuadro no existen marcadores biológicos objetivos. Por otra parte, el síndrome clínico es distinto de los criterios de clasificación, los que se basan solamente en la presencia de dolor crónico.
Los pacientes con fibromialgia (FM) casi nunca tienen sólo dolor; este síntoma es necesario para el diagnóstico de fibromialgia, pero hay otros síntomas clínicos concomitantes cuya presencia se puede entender si se conoce la fisiopatología del síndrome.
Los síntomas clínicos son:
Es imprescindible tomar en cuenta el síndrome completo si se quiere construir una hipótesis de la fisiopatología de esta enfermedad.
Se ha escrito que la FM es una creación de la medicina moderna, pero síndromes con esta constelación de síntomas aparecen en la literatura médica desde hace más de dos siglos; de hecho, los puntos de gatillo fueron descritos por un médico francés en el s. XVIII. Del mismo modo, aunque la denominación de fibromialgia es relativamente reciente, algunos cuadros clínicamente casi idénticos han recibido distintos nombres, según las hipótesis fisiopatológicas elaboradas a lo largo de los siglos, especialmente la neurastenia.
Por último, y a pesar de que hay escasa evidencia de que su frecuencia haya aumentado o de que dependa del nivel económico de los países, las investigaciones fueron muy escasas hasta 1990, cuando el Colegio Americano de Reumatología desarrolló y respaldó los criterios de clasificación, con lo que pudo comenzar la investigación sobre la fisiopatología de esta enfermedad.
En una conocida diapositiva que forma parte de la colección del Colegio Americano de Reumatólogos aparece un cuadro en blanco, vacío, que representa la fisiopatología de la fibromialgia y señala que ésta no existe. La verdad es que no se trata de una caja vacía sino más bien de una caja negra, porque la fisiopatología existe, pero es poco comprendida. Esto es así porque los investigadores del síndrome son, en general, reumatólogos, especialistas que manejan cómodamente los mecanismos fisiopatológicos que afectan la inmunología, las estructuras musculoesqueléticas y biología de cartílagos y tejidos conectivos, pero no se sienten tan cómodos al observar el lugar donde se asienta la fisiopatología de la FM, que es el sistema nervioso central. Por eso es que, hasta hace poco, a los reumatólogos les resultaba difícil compenetrarse en la fisiopatología de esta enfermedad.
Los criterios de clasificación de FM del CAR son conocidos, pero es necesario recalcar que el dolor musculoesquelético crónico diseminado y la alteración de los umbrales del dolor a la presión, son esenciales para el diagnóstico. En FM, si uno se concentra únicamente en los mecanismos de dolor, no se va a poder comprender correctamente una parte importante de la fisiopatología. Este último criterio se define como la presencia de 11 entre 18 sitios subjetivamente dolorosos al aplicar una fuerza de menos de 4 kg/cm2.
En cuanto a la epidemiología de esta enfermedad, si se aplica la definición de la ACR, las observaciones de Wolfe, en Wichita, Kansas, refieren una prevalencia de 2% en la población general, con 3,4% en mujeres y 0,5% en hombres. En otros estudios poblacionales de otros países del mundo, se describe una prevalencia de 0,5 a 11%; muy pocos estudios han comprobado cifras sobre 5% o bajo 1% (Wolfe et al. 1995; Goldenberg et al. 1990; Wolfe et al., 1997).
Por lo tanto, 1% a 5% es una buena estimación de la prevalencia de fibromialgia en la población mundial, de acuerdo con la definición del CAR. En los Estados Unidos hay entre tres millones y seis millones de personas afectadas, lo que constituye un problema clínico serio, pues no hay suficientes reumatólogos para hacerse cargo de tal cantidad de pacientes. En Chile, seguramente, sucede lo mismo.
En los Estados Unidos, la prevalencia de fibromialgia aumenta a 6% en la población que consulta a médicos generales y familiares, y a 15% - 20% en la que consulta a reumatólogos. No se trata de un cuadro benigno: en los Estados Unidos, 26% de los pacientes con diagnóstico de fibromialgia reciben pensiones de discapacidad. A los investigadores y reumatólogos nos toca cerciorarnos de que nuestros colegas de atención primaria comprendan la fibromialgia, su diagnóstico diferencial y tratamiento.
La definición de FM es completamente arbitraria; la presencia de dolor difuso es mucho más prevalente en la población general y llega a 11% y el punto de corte de 11 ó 10 entre 18 puntos dolorosos no significa un cambio importante en ese paciente, en términos de la fisiopatología de la enfermedad. La definición no distingue entre las distintas poblaciones de pacientes y sin disponer de marcadores biológicos específicos se puede identificar a los pacientes más graves, pero no se puede extender la investigación hacia otras poblaciones, mientras no se cambie la definición o se desarrollen dichos marcadores.
En la Figura 1 se muestra un cuadro famoso de Frida Kahlo, que representa bien, no sólo la presencia de dolor, sino también el sufrimiento asociado con la fibromialgia. A mi juicio, no se puede comprender la fisiopatología de la fibromialgia sin tomar en cuenta tanto el dolor como el sufrimiento.
Figura 1. El dolor y el sufrimiento asociados en la obra de Frida Kahlo.
La fibromialgia no se presenta aislada, sino que se asocia con otros síndromes somáticos: algunos diseminados, como el síndrome de fatiga crónica; otros locales, como el síndrome de intestino o vejiga irritable, síndrome de dolor pélvico, desorden temporomandibular y síndrome de cefalea crónica. Investigadores de la Universidad de Carolina del Norte describieron que 40% a 50% de los pacientes con diagnóstico de desorden temporomandibular desarrollaban fibromialgia en los diez años siguientes; por lo tanto, es posible que estos cuadros locales o limitados sean una forma previa que posteriormente se va a generalizar como fibromialgia o síndrome de fatiga crónica.
En una serie personal de 92 pacientes identificados con fibromialgia o síndrome de fatiga crónica, se describe la prevalencia de patologías asociadas: síndrome de intestino irritable, 46%; dolor pélvico o desórdenes premenstruales, 42%; trastorno temporomandibular, 42%; y cistitis intersticial, 21%. (Korszun et al. Oral Surg Med Pathol Radiol Endod 1998; 86:416).
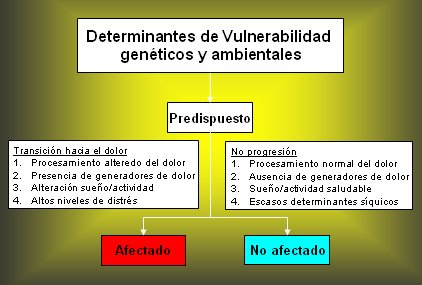
En la Figura 2 se resume la visión de nuestro grupo acerca de la patogenia de este síndrome. Con respecto a los determinantes de vulnerabilidad, la genética de la fibromialgia está en pañales, pero estudios familiares recientes demuestran que la agregación familiar de casos de FM es mucho mayor si el caso índice es un paciente con fibromialgia que si tiene, por ejemplo, artritis reumatoídea; además, la asociación de fibromialgia con fibromialgia familiar es más común que la de fibromialgia con depresión, lo que apoya la existencia de determinantes genéticos. Falta confirmar los estudios de investigación de las vías neuroquímicas y de neuropéptidos, pero ya se ha identificado un determinante genético específico.
Con respecto a los determinantes ambientales, cuando ha habido exposición temprana, durante la infancia, a entornos de victimización, por ejemplo, pueden participar en la vulnerabilidad a estos desórdenes Estos determinantes de vulnerabilidad han permitido identificar a la población predispuesta, pero aún no se ha podido explicar cómo se desarrolla la enfermedad en una persona vulnerable.
Nuestro grupo diseñó un estudio en gemelos para responder esta pregunta, partiendo de la base de que la transición hacia el síndrome doloroso surge de una alteración en el procesamiento del dolor y que la presencia de un generador de dolor es necesaria para que se desarrolle este proceso, además de comportamientos alterados durante el sueño y la vigilia y altos niveles de sufrimiento. En cambio, en los sujetos predispuestos que no desarrollan la enfermedad hay procesamiento normal del dolor, ausencia de generadores de dolor, comportamientos saludables de sueño y vigilia y menor número de determinantes psiquiátricos y psicológicos.
Figura 2. Fisiopatología del Síndrome de Fibromialgia.
En la actualidad estamos procurando identificar el procesamiento alterado del dolor y otros potenciales determinantes de vulnerabilidad, sobre la base del desarrollo hipotético de la fibromialgia, dividido en dos dominios diferentes, el del dolor y el del sufrimiento; la evidencia es mucho más abundante en el primero que en el segundo. A continuación se analizará la evidencia disponible para ambos.
Está claro que los pacientes con fibromialgia tienen dolor clínico; eso es evidente y está en la definición. También está claro que sufren dolores psicofísicos, lo que ha sido determinado mediante procedimientos experimentales. Estas personas tienen el umbral de dolor más bajo, alodinia e hiperalgesia, y el procesamiento alterado del dolor se manifiesta no sólo en el sistema musculoesquelético sino también en la piel y, en algunos casos, en las vísceras.
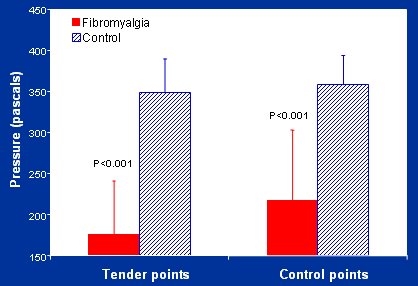
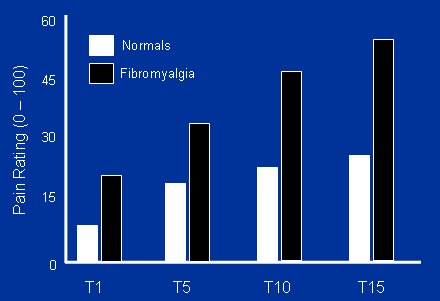
En la Figura 3 se ve un estudio realizado en conjunto con Geisser, de la Universidad de Michigan, en el que se analizó el dolor psicofísico, no sólo en los puntos sensibles, sino también en puntos control y se observó que el umbral de dolor mecánico era notablemente más bajo en los pacientes con fibromialgia, en ambas categorías de puntos de presión, de manera que se trata de una anomalía del procesamiento muy diseminada. Estos son estímulos mecánicos, pero la misma conclusión vale con otros tipos de estímulos dolorosos. (Geisser et al. Pain 2003).
Figura 3. Umbral del dolor mecánico en pacientes con fibromialgia y controles.
Cabe recordar que los estímulos dolorosos térmicos activan nociceptores cutáneos, no el músculo. Las pruebas psicofísicas de dolor térmico demuestran que en estos pacientes no sólo está disminuido el umbral, sino también la tolerancia, y que lo dicho vale para estímulos tanto nocivos como inocuos. Hay un claro cambio en la percepción somática entre inocuo y nocivo, de modo que sería razonable preguntarse si los trastornos del ánimo y la meditación de los pacientes con fibromialgia no quieren decir algo en el curso de la prueba, y si ésta quizás no refleje con precisión lo que ocurre efectivamente en el sistema nervioso central.
Claw y Graysley, de la Universidad de Michigan, hicieron varios estudios muy acabados para responder la pregunta: ¿es cierto lo que el paciente con fibromialgia refiere al examinador, en términos de lo que éste percibe como representación central del dolor? Utilizaron imágenes magnéticas funcionales y estímulos mecánicos, no en un punto sensible sino en la uña del pulgar, es decir, en una zona que no suele presentar dolor clínico, pero donde los pacientes con fibromialgia, igual que en el caso de los estímulos térmicos cutáneos, referirán un umbral del dolor bajo.
Los autores reunieron tres grupos experimentales: uno formado por pacientes con fibromialgia que comunicaron dolor de intensidad 12 en la escala de Graysley, frente a un estímulo de 2,5 kg/cm2; un grupo control, formado por individuos normales que con el mismo estímulo informaron un dolor de intensidad 3; y un grupo control de dolor subjetivo, en el cual los sujetos describieron la misma intensidad de dolor, pero con un estímulo distinto (4 kg/cm2).
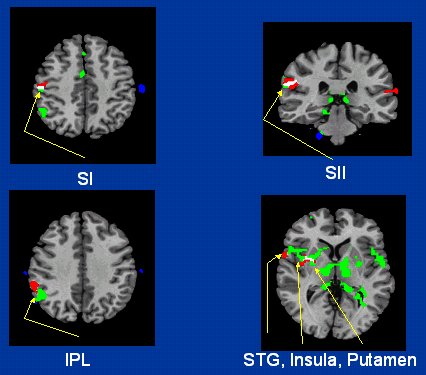
Luego estudiaron el cerebro, para determinar si los pacientes con fiibromialgia tenían anormalidades en las regiones que participan en el procesamiento del dolor. La investigación demostró, en primer lugar, menos activación de las áreas cerebrales estudiadas en el grupo control de presión, porque esos pacientes no refirieron dolor; luego sobreposición en la activación de las áreas cerebrales entre los pacientes con fibromialgia que refirieron dolor y el grupo control de dolor subjetivo que refirieron dolor, aunque con umbral de presión más alto. Estos resultados, aunque controvertidos, permiten afirmar que cuando los pacientes con fibromialgia refieren que sienten dolor, éste se representa en su cerebro. Se observa también sobreposición en la región insular, en el giro temporal y en el putamen, todas zonas que participan en la vía de procesamiento del dolor (Figura 4).
Figura 4. Activación de las áreas cerebrales frente a un estímulo doloroso en pacientes con fibromialgia y controles.
Otra evidencia que apoya la hipótesis de la alteración del procesamiento del dolor proviene de las investigaciones realizadas por Roland Staud y Don Price, en las que se utilizó una simulación térmica repetitiva sobre la piel de pacientes con fibromialgia. En un individuo normal, con frecuencia de estimulación de 2 hertz ocurre una situación llamada wind-up: si se aplica un estímulo doloroso repetitivo con intervalos de dos segundos, debido a que las vías neurales de procesamiento del dolor son normales, el estímulo se percibe como progresivamente más doloroso.
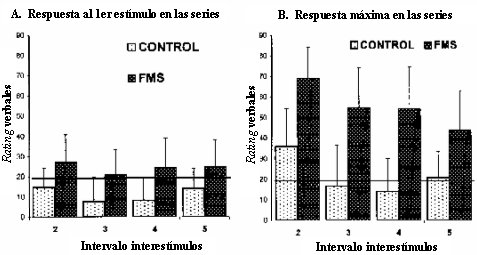
En la Figura 5, las barras representan el tiempo entre estímulos, en segundos; el primer estímulo produjo dolor de nivel 15 y la respuesta máxima de la serie llegó a 35, en individuos normales, con intervalo de dos segundos entre estímulos. La cifra 20 representa el umbral de dolor y los controles nunca cruzaron el umbral nocivo, aún con intervalos más largos entre estímulos; en comparación, los pacientes con fibromialgia, como era de prever, dados los datos anteriores, describieron niveles más altos de dolor con el primer estímulo de la serie y, también como era de prever, experimentaron wind-up con intervalos de dos segundos; el fenómeno de mantuvo incluso con intervalos de tres, cuatro y cinco segundos entre estímulos.
Figura 5. Suma temporal exagerada en fibromialgia.
Lo dicho vale no sólo con estímulos térmicos, sino también con estímulos musculares; frente a la estimulación repetitiva, los pacientes con fibromialgia presentaron una suma temporal de dolor muscular marcadamente exagerada (Figura 6).
Figura 6. Suma temporal del dolor muscular (0,3 Hz) (Staud et al. Pain 102: 87–95, 2003).
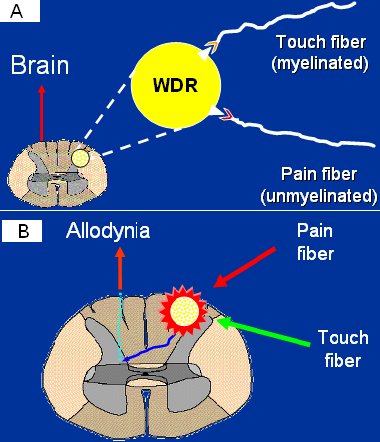
Lo anterior ocurre porque, en una situación normal, hay un conjunto de neuronas denominadas “neuronas de rango dinámico amplio”, que se ubican en la lámina cinco del asta dorsal, en la vía aferente principal estímulos tanto nocivos como inocuos. Las fibras mielínicas del tacto y las amielínicas del dolor convergen en la misma neurona de rango dinámico amplio, en el asta dorsal (Figura 7A). Cuando se produce una estimulación repetitiva proveniente de las fibras amielínicas de dolor, en estas neuronas ocurren cambios bioquímicos que las vuelven susceptibles a despolarización aumentada, incluso con el tacto, en las fibras mielínicas; al disminuir los intervalos entre estímulos, lo anterior no ocurre. El hecho de que este fenómeno ocurra en pacientes con fibromialgia plantea que ellos ya tienen cambios a nivel del asta dorsal, de modo que las neuronas de rango dinámico amplio del asta dorsal envían impulsos nocivos al sistema nervioso central, incluso con estímulos inocuos provenientes de las fibras del tacto e integrados en el asta dorsal (Figura 7 B).
Figura 7. A: Convergencia dentro de una neurona de rango dinámico amplio. B: Convergencia dentro de una neurona de rango dinámico amplio “sensibilizada”.
Los estudios disponibles hasta ahora permiten afirmar inequívocamente que la fibromialgia es un síndrome doloroso central. Sus características son las siguientes:
La presencia de anormalidades en el procesamiento del dolor no es lo que enferma a estos pacientes, sino la combinación de dichas anomalías en el procesamiento del dolor con los síntomas de sufrimiento, entre ellos los síntomas neuropsicológicos (fatiga y alteraciones cognitivas, del ánimo y del sueño) y una respuesta alterada ante la carga alostática o estrés).
La alteración de la respuesta al estrés en la fibromialgia queda comprobada por las siguientes características:
Por otra parte, la fibromialgia y ciertos trastornos siquiátricos, específicamente del ánimo, se presentan con frecuencia juntos, y aunque depresión y fibromialgia son claramente cosas distintas y la fibromialgia no es una depresión somatizada, sería un error no tomar en cuenta la presencia conjunta de estos dos cuadros.
Se sabe que la psiquiatría biológica se inició cuando se observó la falta de supresión del cortisol matinal con la administración de dexametasona; esta disciplina eliminó el concepto de que la depresión del paciente se debía a la madre y surgieron marcadores biológicos efectivos de este tipo de trastornos del ánimo. También se sabe que en la depresión melancólica la conducción de la actividad del eje HPA está aumentada, y que en el síndrome de estrés post traumático la regulación de este eje está alterada.
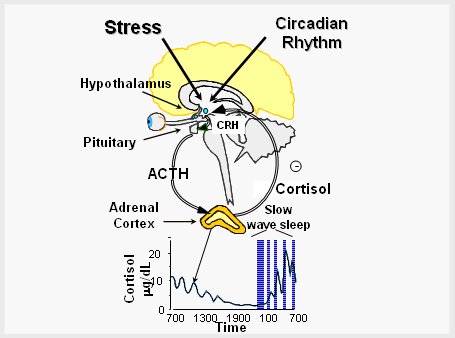
En la Figura 8 se ilustra cómo las neuronas de la región parvocelular del hipotálamo secretan hormona liberadora de corticotropina (CRH) y vasopresina; ambas actúan sobre la pituitaria anterior y estimula la secreción de ACTH hacia la circulación. La ACTH llega a la corteza adrenal, donde estimula la producción de cortisol, que, a su vez, efectúa una contraregulación hacia el cerebro y el hipocampo y estimula la secreción de señales inhibitorias al hipotálamo e hipófisis. Este es un sistema muy dinámico. El eje HPA tiene un ritmo circadiano normal; por eso, una medición única del cortisol no dice mucho sobre la actividad dinámica de este eje, que depende mucho de la fisiología del sueño, la comida y el ejercicio, de tal modo que el ritmo depende en gran medida del comportamiento.
Figura 8. Efecto del estrés sobre el eje hipotálamo-hipofisiario-adrenal.
Para comprender las anormalidades dinámicas del eje HPA, es necesario conocer su funcionamiento normal. En estudios poblacionales muy grandes se compararon personas que referían buena salud y personas que referían mala salud y se observó que en las personas sanas hay gran variación circadiana de cortisol, con niveles altos matinales y niveles bajos vespertinos; además, tienen una alta respuesta a estímulos fisiológicos y a estímulos estresantes no habituales, y son muy sensibles al feedback negativo de glucocorticoide; es decir, responden rápidamente, pero también pueden apagar inmediatamente la respuesta. En conclusión, en estudios poblacionales muy extensos, las personas sanas cuyo eje HPA tiene estos atributos refieren buena salud. Los pacientes cuyo eje HPA no cuenta con esos atributos refieren mala salud; son casos de síndrome metabólico X, por ejemplo, no sólo pacientes con síndrome de dolor crónico.
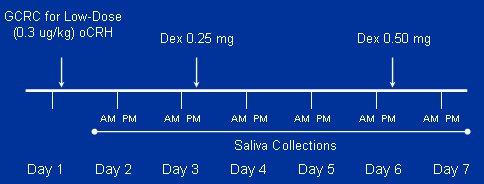
Para evaluar la sensibilidad y resiliencia del eje HPA en pacientes con fibromialgia, nuestro grupo utilizó un estímulo estresante repetitivo. Primero se inyectaron dosis fisiológicas (0,3 ug/kg) de oCRH y luego se midió cortisol (GCRC); durante los siete días siguientes, pero con dosis graduadas de dexametasona para simular una estimulación estresante repetitiva (0,25 y 0,5 mg) y se observó el efecto sobre ACTH y cortisol (Figura 9).
Figura 9. Protocolo de supresión con bajas dosis de oCRH/Dexametasona.
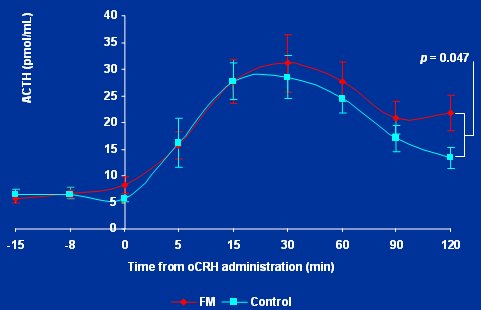
Por la tarde, hora en que se realizaba este experimento, los pacientes con fibromialgia mostraban niveles normales de ACTH y cortisol, y respondían muy bien a un estímulo fisiológico destinado a activar el eje HPA; por lo tanto, en esta enfermedad no habría una anormalidad en la capacidad del eje HPA para responder al estrés; incluso, en algunos estudios se ha encontrado una respuesta aumentada (Figura 10).
Figura 10. Respuesta de ACTH a estimulación con dosis bajas de oCRH (0,3 ug/kg) en pacientes con FM (n=14) y controles (n=12).
El problema es la resiliencia, pues estos pacientes fallan en apagar la respuesta del eje a los glucocorticoides. Es necesario recordar que los glucocorticoides endógenos actúan a nivel del hipocampo y la hipófisis para apagar el eje HPA, mientras que la dexametasona actúa sólo en la hipófisis, de manera que existen algunas diferencias en la acción de estos esteroides como contrarreguladores.
Al observar los niveles de cortisol libre durante la mañana y la tarde en el grupo control, a la mañana siguiente de la estimulación con oCRH los pacientes aún tienen un poco de supresión, comparado con los niveles de cortisol en las siguientes mediciones, debido a la contrarregulación negativa ejercida por los glucocorticoides endógenos, pero aún así conservan el ritmo circadiano (niveles mayores en las mañanas y menores en las tardes).
La administración de dexametasona, un glucocorticoide de acción larga que actúa en la hipófisis, hace que se produzca un nivel bajo en la mañana siguiente (producto de la contrarregulación negativa) y los niveles de la tarde disminuyen, pero el estímulo desaparece rápidamente y a la mañana siguiente se recupera el ritmo circadiana. Este proceso se repite varias veces y ocurre el mismo fenómeno; incluso con dosis bajas (1mg) es suficiente para producir una supresión en la tarde.
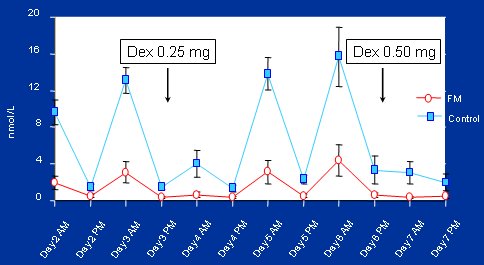
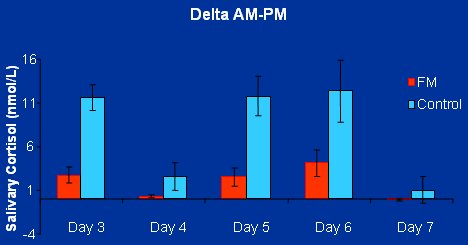
En los pacientes con FM, luego de la elevación endógena de cortisol se produce un escaso aumento matinal de éste, con la disminución esperada en la tarde, pero los niveles no se recuperan adecuadamente frente al estrés simulado (antes de comenzar el estudio, sus niveles de cortisol eran similares a la población control). Estos pacientes desarrollan una hipersupresión con dosis bajas de dexametasona y luego se comienzan a recuperar, pero sin alcanzar los niveles observados en una población normal, tal como se ve en la Figura 11. A su vez, la variabilidad del cortisol en el estrés (la diferencia entre los niveles de cortisol matinal y vespertino) se encuentra disminuida, es decir, tienen un ritmo circadiano aplanado (Figura 12).
Figura 11. Cortisol “estresado”.
Figura 12. Variabilidad del cortisol “estresado”.
En resumen, los pacientes con FM presentan una mayor supresión matinal con dosis bajas de dexametasona y una falta de variabilidad entre el cortisol matinal y el vespertino. El eje HPA posee una respuesta normal, pero carece de resiliencia; esto es muy sutil en condiciones basales, pero se exacerba con el estrés, especialmente cuando éste es repetido. La respuesta a dexametasona sugiere algo similar a lo que ocurre con el trastorno conocido como estrés postraumático, donde también se observa hipersupresión con bajas dosis de dexametasona y se han descrito niveles elevados de CRH en líquido cefalorraquídeo (Williams et al. Presentado en el Meeting ACR 2004, San Antonio, Tx).
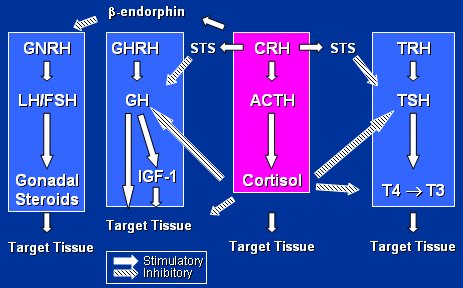
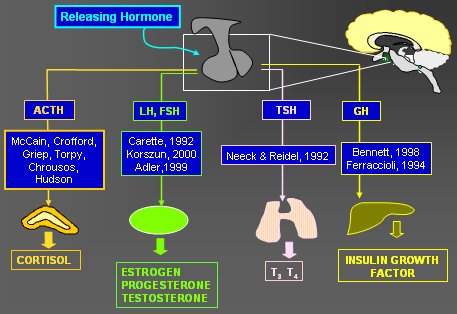
Las anomalías del CRH y del eje HPA no ocurren en forma aislada. De hecho, el CRH provee señales importantes a otros ejes neuroendocrinos, a través de, por ejemplo, la betaendorfina, que suprime el eje de la hormona del crecimiento, la somatostatina, que inhibe a la hormona del crecimiento y hormonas tiroideas, tal como se muestra en el esquema de la Figura 13.
Figura 13. Acción de CRH sobre otros ejes neuroendocrinos a través de betaendorfina y somatostatina (STS).
A su vez, el cortisol ejerce una contrarregulación negativa en múltiples ejes neuroendocrinos. De hecho, se ha descrito que los pacientes con FM tienen anormalidades en otros ejes neuroendocrinos, en especial una hipoactividad del eje de la hormona del crecimiento y de las hormonas tiroideas cuando hay un aumento del CRH, lo que sugiere un rol más difuso en la actividad de estas vías (Figura 14).
Figura 14. Evidencias de anormalidades en ejes neuroendocrinos en pacientes con FM.
En cuanto a las alteraciones del sistema nervioso autónomo en el SFM, estas anormalidades han sido muy bien descritas por autores que han demostrado la existencia de una respuesta alterada en el tilt-table testing, una disminución de la variabilidad de la frecuencia cardíaca (lo que indica una alteración del balance del tono simpático y parasimpático) y un aumento de los niveles plasmáticos y urinarios de norepinefrina, por lo que, aparentemente, esta anormalidad es más difusa. Teóricamente, se podrían identificar subgrupos según las anormalidades autónomas o neuroendocrinas, pero con el grado de evidencia disponible esto aún no es posible.
Resumiendo las alteraciones de la fisiología neuroendocrina:
La edición y publicación de esta conferencia han sido posibles gracias a un auspicio de Schering Plough y su producto Remicade.
Medwave, Año V No. 6 Julio 2005. Derechos Reservados.















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIII Congreso Internacional de Reumatologia, XXV Congreso Chileno, realizado en Las Termas de Chillán entre los días 17 al 20 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Reumatología.
Presidente del Congreso: Dr Carlos Fuentealba.
Secretario Ejecutivo: Dr Francisco Radrigán.
Presidente Comité Cientifico: Dr Miguel Gutiérrez.
Edición Científica: Dr. Francisco Radrigán.
 Expositor:
Leslie Crofford[1]
Expositor:
Leslie Crofford[1]

Citación: Crofford L. New knowledge of the pathophysiology of fibromyalgia syndrome. Medwave 2005 Jun;5(6):e1194 doi: 10.5867/medwave.2005.06.1194
Fecha de publicación: 1/7/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión