Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIII Congreso Internacional de Reumatologia, XXV Congreso Chileno, realizado en Las Termas de Chillán entre los días 17 al 20 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Reumatología.
Presidente del Congreso: Dr Carlos Fuentealba.
Secretario Ejecutivo: Dr Francisco Radrigán.
Presidente Comité Cientifico: Dr Miguel Gutiérrez.
Edición Científica: Dr. Francisco Radrigán.
El objetivo final del tratamiento de la AR es detener la enfermedad y alcanzar la remisión, es decir, limitar el daño estructural y funcional. Para esto, la ACR recomienda hacer un diagnóstico precoz e iniciar el tratamiento en forma precoz y agresiva, con agentes modificadores de la enfermedad. Es un término amplio que hay que recalcar y es preciso insistir en que se puede realizar con modificadores de enfermedad de segunda línea y no necesariamente con agentes biológicos.
La importancia de este concepto radica en que podría haber una ventana de oportunidad, que sería muy precoz, en la cual sería posible reprogramar farmacológicamente la tasa de progresión de la enfermedad, es decir, la tasa de destrucción y la pérdida de función. La evidencia plantea que es posible y que, por lo tanto, el retraso en el tratamiento tendrá un impacto negativo en la evolución de la enfermedad.
Se ha demostrado que 50% a 70% de los pacientes muestran daño radiológico a los dos años desde el inicio de los síntomas, y la evidencia plantea que se puede hacer una reprogramación farmacológica de la tasa de progresión de la enfermedad en los dos primeros años y que los retrasos de 8 meses a 1 año en comenzar la terapia con DMARD tendrán, años después, un impacto significativo en los parámetros de la enfermedad. Además, el retraso en el inicio del tratamiento con un único DMARD por 4 meses o más reduce notablemente la tasa de remisión y la respuesta al tratamiento.
COBRA fue el primer estudio, acerca del uso de agentes modificadores de enfermedad o de segunda línea, en el que se demostró que se podía modificar la enfermedad, no sólo en su evolución clínica sino también en sus daños estructurales. El estudio comparó monoterapia con terapia combinada (prednisona, hidroxicloroquina y sulfasalazina) y demostró que el uso de la terapia combinada durante cinco años determinaba menor índice de actividad (en este caso, el DAS), menor daño radiológico y menor progresión radiológica. Fue ese el primer estudio en demostrar que efectivamente hay una ventana de oportunidad de al menos 12 meses, y quizás hasta 24 meses, en que es posible reprogramar lo que ocurre en artritis reumatoídea, especialmente en cuanto a daño estructural y pérdida de función. En consecuencia, hoy está contraindicado el uso de monoterapia en artritis reumatoídea.
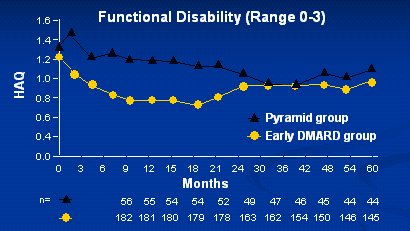
Otro hecho importante ocurre cuando se compara tratamientos agresivos desde el inicio de la enfermedad con tratamientos convencionales; la diferencia se observa en los primeros años del inicio del tratamiento. Por ejemplo, para la función, la mejoría es mucho mayor si se usa tratamiento combinado que si se administra el tratamiento convencional o piramidal; sin embargo, cinco años más tarde, la respuesta al tratamiento convencional es muy similar al combinado y lo mimo ocurre desde el punto de vista estructural (Figura 1).
Figura 1. Ventana de oportunidad terapéutica en AR.
En conclusión, el concepto de AR precoz se encuentra en evolución; su definición y fisiopatología se deben aclarar mejor. Es necesario disponer de mejores instrumentos para hacer un diagnóstico temprano y certero; es importante iniciar una terapia temprano para impactar en esta ventana de oportunidad.
De acuerdo con el Subcomité para las guías de AR, del ACR 2002, los objetivos principales del manejo precoz y agresivo de la AR son los siguientes:
Es importante conocer los instrumentos que evalúan la respuesta a los fármacos. El patrón de oro para evaluar cualquier fármaco en reumatología son los criterios del Colegio Americano de Reumatología: ACR20, ACR 50, ACR 70, pero vale la pena recordar los otros criterios, sobre todo Paulus, ACR-N y el DAS.
El criterio Paulus utiliza seis parámetros, que son: número de articulaciones dolorosas, número de articulaciones edematosas, rigidez matinal, evaluación de la enfermedad por el propio paciente, evaluación de la enfermedad por el médico y VHS. Se define como Paulus 20 a un respondedor que ha mostrado mejoría de 20% en cuatro de los seis parámetros.
Los ACR 20, 50 y 70 corresponden a mejoría en 20%, 50% y 70% en el número de articulaciones dolorosas e inflamadas, más tres de los siguientes criterios: evaluación de la actividad de la enfermedad por el paciente, por el médico, VHS, escala de dolor y cuestionario funcional, por lo que en la práctica corresponden a modificaciones de Paulus, quien integró en persona el comité que desarrolló estos criterios. El que mejor refleja respuesta a tratamiento es el ACR 20; a primera vista podría parecer ridículo obtener una respuesta de 20%, porque significa que mejoran dos entre diez articulaciones y sería preferible que mejoraran cinco o siete entre diez; pero a nivel poblacional de enfermos con AR, una mejoría de 20% tiene bastante fuerza, desde el punto de vista estadístico.
El ACR-N se ha utilizado en algunos de los artículos más recientes; permite estudiar la respuesta de manera continua y diferenciar la respuesta individual de los pacientes desde el comienzo de la enfermedad, el estado basal. Se define como el más pequeño porcentaje de mejoría sobre el estado basal de los componentes ACR (número de articulaciones dolorosas, edematosas y la media de los otros cinco criterios). Compara la forma en que se presenta el paciente en un comienzo y la manera en que evoluciona con el tiempo (11).
El DAS 28 es un índice compuesto que incorpora VHS, número de articulaciones dolorosas (1-28), edematosas (1-28) y evaluación de la salud general del paciente (VAS 1-100). Exige el uso de una fórmula, una calculadora o un computador; los europeos lo utilizan mucho, pero mi experiencia personal es casi nula; nosotros usamos el ACR 20.
La terapia piramidal clásica tiene solamente un valor histórico, aunque no está completamente abandonada. Hoy se enfrenta a los pacientes en forma precoz y más agresiva. Si el paciente tiene una enfermedad leve, se maneja con antinflamatorios no esteroidales, pero si en forma precoz presenta un cuadro más grave, se utiliza fármacos de segunda línea solos o en combinación.
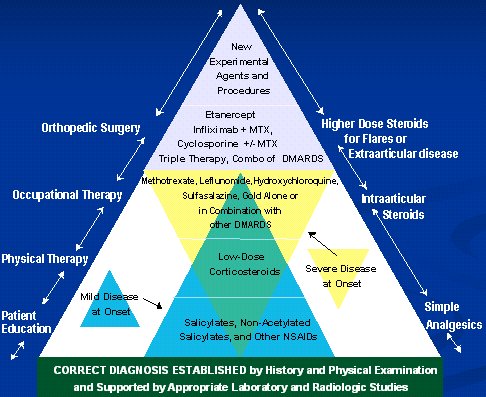
En la Figura 2 se ve la pirámide de tratamiento que se utiliza en nuestro centro, donde la intervención precoz se hace desde un comienzo con tratamiento combinado cuádruple: con hidroxicloroquina, metotrexato, sulfasalazina y prednisona. En enfermedades más graves realizamos diferentes combinaciones y añadimos los agentes biológicos. Por supuesto, en los pacientes que no responden (los agentes biológicos son excelentes y los pacientes responden de maravilla, pero no son la panacea) se intenta con fármacos nuevos. A su vez, se utiliza analgésicos, corticoides intraarticulares, cirugía y, por supuesto, educación, terapia ocupacional y terapia física.
Figura 2. Pirámide de tratamiento de AR: Cambio de enfoque. Cortesía de Arthur L. Weaver, MD. Arthritis Center of Nebraska, Lincoln.
Hace 15 años estuve en México y tuve la osadía de declarar que en los pacientes con AR usábamos prednisona de manera precoz; los reumatólogos antiguos opinaron que estaba cometiendo un grave error con mis pacientes, que la prednisona era muy dañina y que nunca se debía administrar en pacientes con AR. Hace quince años, el uso de prednisona era algo difícil, pero los trabajos recientes han demostrado que la administración de prednisona en AR precoz disminuye significativamente la progresión del daño radiológico.
Gene Novell, de Omaha, Nebraska, fue el precursor del tratamiento combinado en AR. A fines de la década de 1980 comenzó a utilizar tratamiento triple con hidrocloroquina, sulfasalazina y metrotrexato, con o sin prednisona; método que fue recibido con bastante escepticismo y miedo a una posible mayor toxicidad; pero Novell tenía razón y se ha demostrado que el tratamiento combinado es bastante eficaz, pues permite hasta 70% de mejoría.
En AR precoz el tratamiento combinado se realiza tradicionalmente con fármacos de segunda línea. Al comparar monoterapia con metotrexato, hidrocloroquina o sulfasalazina; doble terapia con metotrexato más sulfasalazina o metotrexato más hidroxicloroquina; y triple terapia, con metotrexato, hidroxicloroquina y sulfasalazina, con o sin prednisona, en pacientes con enfermedad de 24 meses y menos de ocho meses de duración, los resultados demográficos son bastante buenos; con la terapia triple se observa 97% de mejoría en el número de articulaciones dolorosas y edematosas, con buen perfil de toxicidad. En pacientes con AR precoz de 8 meses o 24 meses, el tratamiento con fármacos de segunda línea muestra resultados muy buenos.
La educación es muy importante, en los Estados Unidos se hace por muchas razones, entre ellas, por motivos médico-legales (negligencia médica).
Lamentablemente, no es posible usar agentes biológicos de manera precoz, aun en los Estados Unidos, país que, a pesar de su poderío económico, no está en condiciones de subvencionar el uso de agentes biológicos para todos los afectados. En los 12 a 18 últimos meses, la industria ha estado promoviendo el uso de estos agentes, no sólo para AR sino también para AR precoz; los datos disponibles relativos a los agentes biológicos etanercept, infliximab, adalimumab muestran excelentes resultados.
En el caso del adalimumab, los datos son impresionantes en cuanto a respuesta, pero no está tan claro que los agentes biológicos deban utilizarse en AR precoz desde el inicio. No hay estudios que demuestren que la respuesta sea mejor que el uso combinado de agentes de segunda línea. Son agentes muy buenos, pero no son la panacea. Además, se usan en forma indefinida y la enfermedad regresa cuando se suspenden (a las 2 semanas con etanercept y a las 6 semanas con adalimumab o infliximab).
Por otra parte, a medida que se utilizan los agentes de segunda línea, la eficacia y el tiempo de infusión se acortan. Al comienzo se administran cada ocho semanas, pero después de uno o dos años se pueden espaciar cada seis o cinco semanas, y en lugar de 3 mg/kg se debe aumentar la dosis. Esto último es importante desde el punto de vista del costo; cuesta US$35.000 lograr la remisión de un paciente; en cambio, con el uso de metotrexato cuesta US$6000. Faltan datos todavía sobre mejoría de la calidad de vida y reducción del daño estructural (con disminución de la cantidad de operaciones y reemplazo articular), por lo que se desconoce el costo total a largo plazo.
En general, los agentes biológicos son benignos; puede haber infecciones o tuberculosis, que en este momento se controlan bien, pero permanece la interrogante sobre los efectos a largo plazo. Tres años después de la introducción de infliximab, la FDA ha exigido el uso de la etiqueta negra de advertencia, lo que significa que no se permite recetar el medicamento salvo que no haya alternativa, por el riesgo de compromiso grave de médula ósea y el riesgo aumentado de linfoma, es decir, aún permanecen incógnitas sobre su efecto a largo plazo.
La introducción de agentes biológicos ha significado un avance extraordinario para los pacientes y su calidad de vida, y para el conocimiento de la patogenia de la enfermedad, pero es probable que no sea la respuesta definitiva; afortunadamente, la investigación continúa.
Lo importante es diagnosticar y tratar al paciente en forma precoz, con el fin de asegurar una mejor calidad de vida, disminuir los costos de la intervención para el Estado y tener más confianza en los resultados de la terapia.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del XIII Congreso Internacional de Reumatologia, XXV Congreso Chileno, realizado en Las Termas de Chillán entre los días 17 al 20 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Reumatología.
Presidente del Congreso: Dr Carlos Fuentealba.
Secretario Ejecutivo: Dr Francisco Radrigán.
Presidente Comité Cientifico: Dr Miguel Gutiérrez.
Edición Científica: Dr. Francisco Radrigán.
 Expositor:
Luis R. Espinoza[1]
Expositor:
Luis R. Espinoza[1]

Citación: Espinoza LR. Part I: treatment of early rheumatoid arthritis. Medwave 2005 Ago;5(7):e1192 doi: 10.5867/medwave.2005.07.1192
Fecha de publicación: 1/8/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión