Este texto completo es la transcripción editada y revisada de la conferencia dictada en el I Congreso Latinoamericano de Páncreas, efectuada en el marco del XXX Congreso Chileno de Gastroenterología, que se realizó en Viña del Mar el día 29 de noviembre de 2003.
Presidente del Congreso: Dr. Zoltán Berger.
Editor Científico: Dr. Zoltán Berger.
Los análisis de laboratorio tienen por objetivo comprender la respuesta generada por la célula pancreática frente a la agresión de una pancreatitis aguda; la idea conceptual es determinar lo que hace la célula acinar frente a esta agresión y tratar de interpretar esas respuestas, de modo de ir acumulando elementos para llegar a diseñar, algún día, una estrategia terapéutica contra la pancreatitis aguda que sea más racional que la actual, que es fundamentalmente empírica.
La agresión a cualquier tipo celular, incluida la célula pancreática, es conocida con el nombre de estrés celular. La respuesta a este estrés se define como un estado fisiológico celular nuevo, que puede ser inducido por distintos tipos de agresión y que constituye una respuesta universal, es decir, todos los tipos celulares son capaces de responder, de una manera o de otra, a esta agresión.
La característica más importante de esta respuesta es que se produce una modificación muy rápida en la expresión de genes, con represión de los genes funcionales constitutivos y una inducción de nuevos genes, llamados genes de estrés: El objetivo final de todo esto es que la célula logre adaptarse para sobrevivir y sobrepasar esta agresión, que por lo general es transitoria.
Cuando una célula cualquiera del organismo es sometida a un estrés o agresión, existen dos alternativas: si la agresión es muy fuerte, la célula puede activar el mecanismo de muerte programada conocido como apoptosis; en cambio, si el sistema de respuesta resulta suficientemente eficaz o la agresión es leve, la célula responde y sobrevive.
Sin embargo, en el páncreas las cosas son más complicadas; la célula pancreática que se lesiona devuelve su contenido hacia el intersticio, las enzimas lisan nuevas células y esas células liberan nuevas enzimas, y se pone en juego un mecanismo de cascada. Según esto, en teoría, cada vez que se hace una endoscopía debería desencadenarse este sistema y destruirse el páncreas por completo; sin embargo, esto no pasa, porque como la célula pancreática es tan peligrosa, desarrolla sistemas muy potentes para contrarrestar las agresiones que sufre a diario.
Cuando es agredida, la célula pancreática modifica el contenido intracelular de una serie de segundos mensajeros, como el calcio y el AMPc; ellos van a modificar la actividad de factores de transcripción nucleares que activan o reprimen la expresión de ciertos genes. Esto conduce a cambios en el fenotipo de la célula y, en general, estos cambios van a ir asociados con un aumento de la resistencia celular.
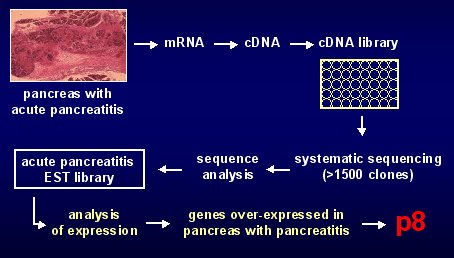
Nuestro tema de trabajo y estudio son los nuevos genes que se activan en respuesta a la lesión pancreática. Para dar un ejemplo de cómo abordamos este problema, les contaré que, en nuestro laboratorio, hace unos años se indujo pancreatitis en un modelo animal; de ese páncreas agredido se extrajeron ADN mensajeros que fueron transformados en ADN complementario, gracias al cual se construyó una biblioteca de ADN complementario de páncreas con pancreatitis, que contiene casi 2.000 genes al azar, cuya secuencia fue analizada para construir lo que denominamos una biblioteca de EST.
La expresión de todos los genes fue analizada de manera sistemática mediante esta estrategia de clonación, detectándose un número importante de genes activados después de la pancreatitis, particularmente el gen p8, una pequeña proteína de sólo 80 aminoácidos, codificada por un ARN pequeño de 600 nucleótidos. En la figura 1 se puede ver un resumen de lo expuesto.
Figura 1. Estrategia de clonación para análisis de la expresión genética (aproximación sistemática).
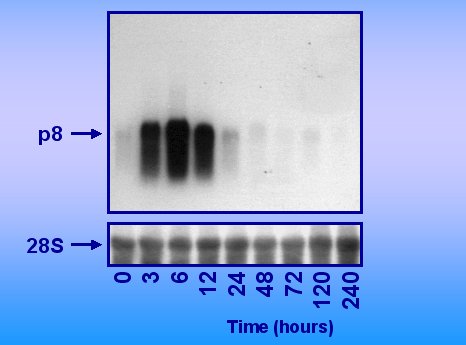
La cinética de expresión de este gen en el curso de una pancreatitis aguda es un proceso muy interesante; el gen, que casi no es expresado en el páncreas sano, se activa muy rápidamente durante la fase aguda de la pancreatitis, pero su expresión decae, hasta desaparecer totalmente, durante la fase de recuperación pancreática. O sea, es un típico gen de estrés, porque se activa en forma muy rápida e intensa en respuesta a la agresión, pero luego cae con la misma rapidez y desaparece (Figura 2).
Figura 2. Expresión de p8 mRNA en la pancreatitis aguda.
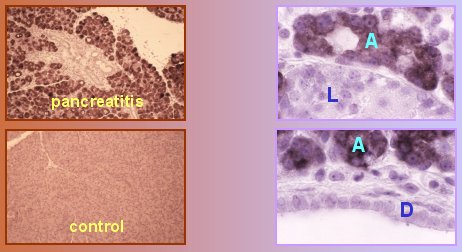
Para determinar cuál célula del páncreas es la que responde, la que, según la hipótesis expuesta más arriba, debería ser la célula peligrosa, es decir, la célula acinar, de modo que la expresión debería detectarse por lo menos en ella, se utilizó la técnica de hibridación in situ, que permite detectar qué tipo celular expresa un determinado gen; con este método se demostró que la respuesta a la agresión fue interpretada sólo por la célula acinar pancreática, como se puede ver en la figura 3.
Figura 3. Hibridación in situ de mRNA de p8 (páncreas).
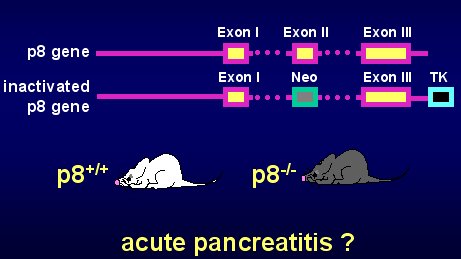
Es muy difícil interpretar la función de este gen con técnicas in vitro o de biología molecular; por eso, se procedió a inactivar este gen en un ratón, construyendo un knock out para el gen p8. Para esto, se identificó el fragmento de DNA que codifica para este gen y se secuenció por completo; se determinó que está constituido por 13 exones, de los cuales, el exón 2 codifica para 60% de esta proteína. Mediante técnicas de biología molecular, el exón 2 fue reemplazado por otro elemento, con el objetivo de inactivarlo, y luego este gen fue introducido en un ratón, que pasó a ser deficiente en el gen p8, es decir, tiene todos los genes, menos el gen p8.
Esta herramienta permite determinar la función de p8, al comparar las respuestas de este animal con otro que tiene los mismos genes, más p8; o sea, la única diferencia es la inactivación de este gen en los así llamados ratones p8 -/-, porque los dos alelos están inactivados. Este modelo permite estudiar la función de p8 en la pancreatitis aguda, para así determinar si cumple un papel importante o si es un epifenómeno irrelevante en esta enfermedad (véase figura 4).
Figura 4. Inactivación del gen p8 in vivo.
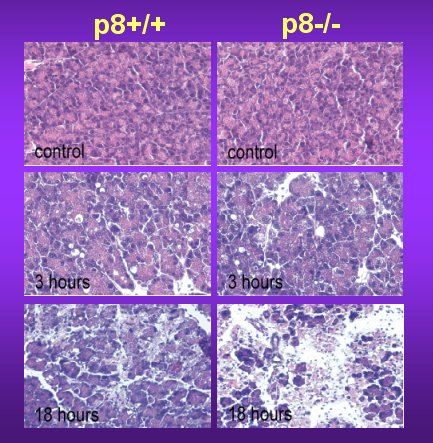
Cuando se indujo pancreatitis aguda en los ratones, se observaron los cambios que se muestran en la figura 5; inicialmente, los páncreas en los que no se indujo pancreatitis eran muy parecidos, es decir, la falta del gen p8 no indujo modificaciones, o éstas eran muy leves. A las tres horas se observó formación de vacuolas y un ligero edema; sin embargo, a las 18 horas, período en que la pancreatitis se torna muy grave, apareció necrosis muy marcada en los ratones con el gen p8 inactivado. En los ratones en los que el gen p8 subsistía hubo cierta protección contra la pancreatitis, lo que indicaría que el gen p8 se activa frente a esta enfermedad, como defensa.
Figura 5. Histología de la pancreatitis aguda.
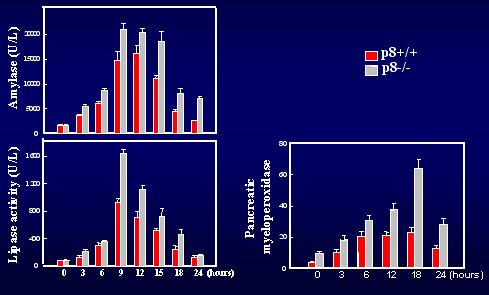
Para determinar si estas alteraciones morfológicas tenían alguna repercusión a nivel biológico, se midieron niveles de amilasa o de lipasa sérica, encontrándose que los ratones -/- deficientes para este gen, tenían niveles mucho más altos de amilasa. Es cierto que, en clínica, estas enzimas no son un buen indicador de niveles de gravedad, pero en este tipo de modelo, que permite controlar todos los parámetros, los niveles son, en general, representativos de la intensidad de la enfermedad. Por último, se midió el infiltrado inflamatorio del páncreas durante la pancreatitis mediante la determinación de mieloperoxidasa pancreática, y se observó que la infiltración era mucho más importante, lo mismo que en los animales deficientes en p8 (véase figura 6).
Esto indicaría que el gen p8 defendía y que era un gen de respuesta positiva; sólo faltaba entender cuál era el mecanismo, con la idea de desarrollar una terapéutica original y buscar nuevos medicamentos, a partir de estos hallazgos.
Figura 6. Marcadores biológicos.
Cuando se intentó determinar la función del gen aparecieron complicaciones, ya que no se había encontrado ningún criterio para definir la función, por lo que se procedió a analizar la estructura de estas proteínas y a clonar e identificar las secuencias de otras especies. Se había identificado el gen p8 de la rata y, luego, el del ser humano y el del ratón, para determinar si este sistema era nuevo o antiguo; se estudió una rana y una mosca, y en ellas se identificó el mismo gen, prácticamente conservado, especialmente la región c-terminal de la proteína, lo que significa que es un gen de relativa importancia, porque durante la evolución quedó conservado en todas las especies.
Este análisis dio una pista importante: en la región terminal de la proteína había una marca que indicaba que esta proteína debía dirigirse, cada vez que era sintetizada, hacia el núcleo; una vez que se fabricaron anticuerpos contra esta proteína, mediante inmunofluorescencia se les pudo ver en el núcleo. Así se determinó que esta proteína defiende el páncreas contra la pancreatitis aguda y que se localiza en el núcleo.
Después se utilizó una serie de programas computacionales muy complejos, con los que se encontró que había cierta similitud entre la proteína p8 y la proteína conocida como HMG-I/Y, pero con baja homología, y se planteó que de todos modos las propiedades podrían ser parecidas, por lo que se diseñó una serie de estudios bioquímicos para comparar las características de HMG-I/Y y de p8.
Estos estudios demostraron que ambas proteínas tienen un punto isoeléctrico similar, extremadamente básico, cosa que es rara, y un peso molecular muy parecido; además, tienen una separación de cargas y propiedades hidrofílicas casi idénticas, y ambas son muy resistentes a la desnaturalización. Las dos proteínas son nucleares, pero además tienen la capacidad de ligarse al ADN y ambas pueden fosforilarse y acetilarse, lo que es muy importante para los factores de transcripción, que son los factores que van a modificar la expresión de genes. Por último, se demostró que las dos proteínas actúan como cofactores de transcripción, o sea, son proteínas nucleares con las características bioquímicas de un factor de transcripción.
El siguiente paso fue identificar el gen que era modificado por la proteína p8. Mediante una búsqueda sistemática en el laboratorio, se identificó una proteína que habíamos trabajado varios años antes, que era inducida por el páncreas durante la pancreatitis aguda, pero en forma más tardía, llamada pancreatitis-associated protein o PAP, cuya función no estaba clara, porque no había animales deficientes en PAP, pero al saber que la proteína p8 protegía el páncreas y que la PAP es un gen blanco de p8 se concentró el interés en esta proteína.
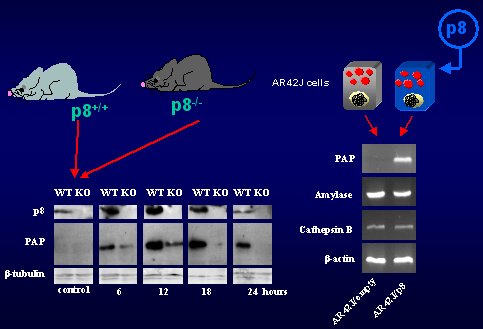
Como se habían fabricado ratones deficientes para el gen, o ratones KO (knock out) , se determinó que la PAP en el páncreas de los ratones sanos o de los ratones deficientes en p8 no está expresada y que los ratones wild type que tienen el gen p8 activan esta proteína durante el curso de la pancreatitis; esta expresión es mucho más baja en los animales deficientes en el gen p8, lo que quiere decir que en los ratones deficientes en p8 la PAP no es capaz de activarse en forma correcta.
Para verificar que la PAP era blanco de p8, se construyeron células obligadas a expresar de manera constitutiva el gen p8, y luego se analizó la expresión de estas células con la técnica de PCR. Se observó que la PAP no estaba expresada en las células normales, pero sí estaba activada en las células obligadas a producir p8. La amilasa, la catepsina o la actina no sufren modificaciones, lo que quiere decir que este gen p8 tiene sólo algunos genes target, no todos los genes pancreáticos. Los resultados se resumen en la figura 7.
Figura 7. La expresión de PAP es dependiente de p8.
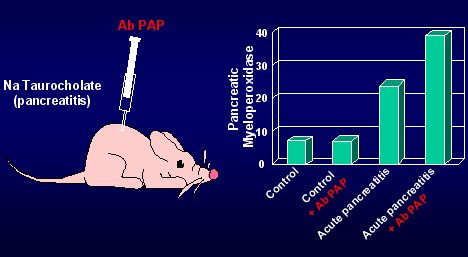
La función de la proteína PAP se determinó mediante una experiencia muy sencilla, en la que se indujo una pancreatitis aguda experimental mediante inyección de sales biliares en el canal pancreático, y al mismo tiempo se bloqueó la función de la PAP con inyección de anticuerpos, para ver qué pasaba. Recordemos que en los animales deficientes el infiltrado pancreático es mucho más importante y que, cuando se induce una pancreatitis, la mieloperoxidasa, que es el marcador de infiltración, está aumentada; sin embargo, cuando se bloquea la función de la PAP este infiltrado es mucho mayor, lo que quiere decir que, de alguna forma, la PAP tendría una función antiinflamatoria. La experiencia está ilustrada en la figura 8.
Figura 8. Investigación de la función de PAP en la inflamación pancreática.
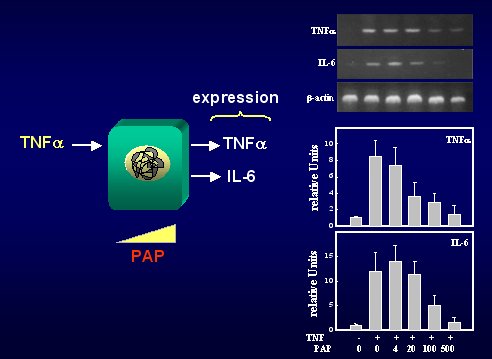
Si esta hipótesis era cierta, y como para entender los mecanismos siempre es bueno trabajar in vitro, se tomaron macrófagos, se les activó con una citoquina proinflamatoria, el TNFalfa, y se midió la expresión de TNFalfa y de la citoquina IL-6, proinflamatoria, y se trató con distintas dosis de PAP. Se comprobó que los macrófagos expresan muy bajos niveles de TNFalfa y de IL-6, cuando son tratados con TNF, y que cuando se les aumenta los niveles de PAP, la producción de citoquinas proinflamatorias disminuye de manera proporcional a la concentración de PAP puesta en el medio de cultivo. O sea, in vitro se obtenían los mismos resultados que in vivo, como se puede ver en la figura 9.
Figura 9. Efecto antiinflamatorio de PAP.
Con respecto al mecanismo, cabe recordar que en los fenómenos proinflamatorios hay un factor capital, que es el NFkappaB, que tiene la propiedad de ser citoplásmico. Cuando la célula no está activada para inflamarse y es activada, por ejemplo, por el TNFalfa, la proteína del citoplasma pasa rápidamente al núcleo para activar, igual que la proteína P8, una serie de genes blanco. Como al parecer la PAP funcionaba como un fenómeno antiinflamatorio, parecía importante determinar la actividad de la PAP sobre la activación de este factor NFkappaB.
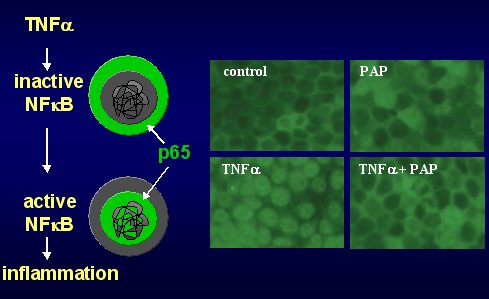
Para esto se estudiaron células pancreáticas in vitro, en las que se vio que la localización de NFkappaB es citoplasmática cuando las células están activadas. Al tratar esas células con TNFalfa, lo que era citoplasmático pasaba al núcleo y la célula quedaba activada por la inflamación para aumentar, a su vez, el proceso inflamatorio. Cuando este tipo de activación se incuba con PAP, esta traslocación nuclear no tiene lugar, lo que quiere decir que la PAP actúa como fenómeno antiinflamatorio, bloquea la traslocación o la activación del NFkappaB y frena, de esa manera, el proceso inflamatorio (Figura 10).
Figura 10. PAP inhibe la activación de NFkappaB.
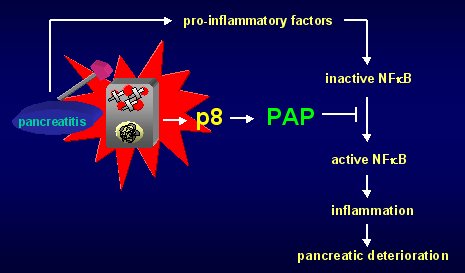
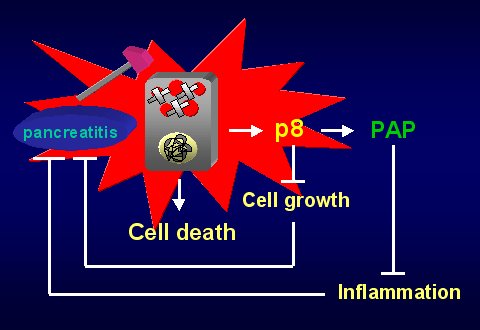
En la figura 11 se puede ver un resumen de todo lo expuesto. Durante la pancreatitis hay una liberación de factores proinflamatorios que van a activar la forma inactivada del NFkappaB, para favorecer el proceso inflamatorio y aumentar el deterioro pancreático; pero, al mismo tiempo la célula acinar activará a p8, que va a activar a PAP para bloquear este fenómeno.
Figura 11. Rol de p6, PAP y NFkappaB en la pancreatitis.
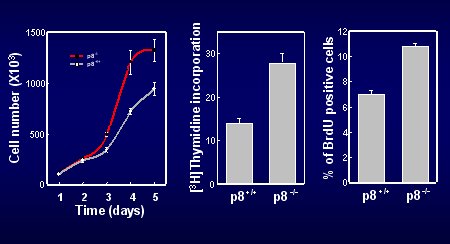
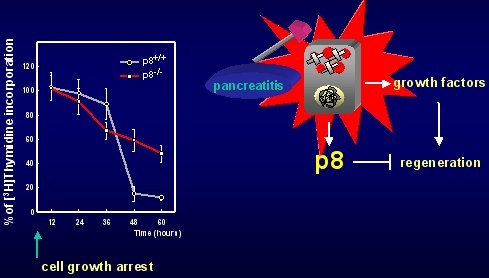
Como se disponía de animales deficientes en este gen p8, se estudió el comportamiento de las células y, al analizar la curva de crecimiento celular en función del tiempo se observó un hecho interesante, y es que los ratones que tienen el gen p8 crecen hasta cierto nivel; cuando se les saca este gen p8, la célula crece mucho más rápidamente, lo que quiere decir que la presencia de este gen frena el crecimiento celular, como se ilustra en la figura 12.
Figura 12. p8 y crecimiento celular.
Si a las células que tienen el gen p8 se les mide la incorporación de timidina o de bromouridina, que son indicadores de la síntesis de ADN, se puede ver que las células deficientes en el gen incorporan mucho más rápidamente estos marcadores, que permiten una estimación exacta de la proliferación. Cuando se induce de manera artificial la detención del crecimiento, las células normales paran de crecer de manera muy drástica. En las células en las que p8 no está, la incorporación de timidina cae con mucha lentitud; no hay una caída brusca, lo que se interpreta aceptando que esta caída es consecuencia de p8 (Figura 13).
Figura 13. p8 facilita la detención del crecimiento celular.
Lo anterior tiene algunas repercusiones en la interpretación de la pancreatitis, porque ésta siempre significa lesión celular, lesión que desencadena la producción de factores de crecimiento para que la célula se regenere, pero este es un fenómeno muy rápido, es inmediato: la célula se muere, y la célula vecina trata de activar factores de crecimiento para que la célula se multiplique y el páncreas no desaparezca.
Lo dicho es correcto, pero tiene que suceder en el momento propicio. Los factores de crecimiento actúan sobre una célula, la multiplicación celular es de mala calidad y aparecen mutaciones que pueden generar cáncer. El páncreas responde con la estimulación de factores de crecimiento, al mismo tiempo que estimula la expresión de P8. Ya se vio que la formación de P8 es muy rápida e intensa, pero transitoria, lo que quiere decir que, durante ese breve lapso de fase aguda, no está tan bien reproducirse y multiplicarse, porque la célula no puede frenar la producción de factores tróficos, por lo que le envía factores para frenar la regeneración.
Esto podría tener alguna repercusión en el tratamiento; podríamos imaginar que durante la fase aguda de la pancreatitis aguda, se podría, farmacológicamente, inhibir la proliferación celular durante un tiempo corto, para procurar que ese proceso no suceda.
Como se resume en la figura 14, la pancreatitis aguda va a inducir la producción de P8, la que va a inducir la producción de PAP, para frenar la inflamación; pero, al mismo tiempo, la producción de P8 va a frenar el crecimiento celular. Estos dos mecanismos van a tratar de frenar la evolución de la pancreatitis.
Figura 14. Resumen de los fenómenos inflamatorios en la pancreatitis.
Pregunta: Usted habló de la evaluación de los macrófagos. ¿Cómo se hizo este estudio? ¿Se incorporó una evaluación de tipo biológico, se separaron estos macrófagos con algún método específico inmunológico?
Dr. Iovanna: Los macrófagos son los que inician la mayor parte de los procesos inflamatorios. Uno puede estudiar los neutrófilos, que son actores, pero lo más interesante es estudiar los iniciadores porque si uno entiende cómo funcionan los iniciadores, puede ir a frenar ese fenómeno; en cambio, una vez que los neutrófilos están en el lugar, es muy poco lo que se puede hacer. Por esto fue que nos interesamos en los macrófagos; el páncreas no es una excepción, su proceso inflamatorio es como cualquier otro.
Con respecto a cómo se hizo el estudio, recuperamos macrófagos alveolares mediante un lavado bronquial, en el que es muy fácil identificarlos, porque son las únicas células del lavado que se adhieren a la placa de cultivo celular; estas células están inactivadas en cultivo, porque las ponemos en condiciones frías. Al tratarlas con TNFalfa, se provoca la translocación del factor NFkappaB al núcleo y todo el proceso inflamatorio se activa.
Me he referido a dos de los factores que medimos, porque el TNFalfa activa los macrófagos para que produzcan citoquinas, entre ellas al propio TNFalfa, y se forma un círculo vicioso muy difícil de frenar; pero medimos una serie de marcadores de la inflamación, sobre todo en la membrana de los macrófagos, y todos los factores que dependían del NFkappaB estaban activados.
La expresión de los genes se evaluó con una técnica llamada RT-PCR, que mide los niveles de expresión génica, los niveles de ARN mensajero. Cuando se miden moléculas de superficie, se miden por citometría de flujo: se pone un anticuerpo contra la proteína de interés sobre la membrana, marcado con un agente de fluorescencia, y se mide la fluorescencia por citometría de flujo.
Pregunta: En relación a la descripción que usted está haciendo, ¿qué tipo de kit utilizaron para distinguirlos en la citometría de flujo? ¿Qué tipo de marcadores utilizaron, cd14, cd12, cd16, cd64?
Dr. Iovanna: Usamos cd11a y cd11b, y el único que se modifica es el cd18, que era su segundo partner.
Pregunta: ¿Usaron HLA-b?
Dr. Iovanna: No, porque la idea era tratar de ver si nuestra proteína tenía un efecto o no. En vivo, cuando uno bloquea la función de la PAP, el proceso inflamatorio más grave, como se dijo, será directo o indirecto. Es decir, el objetivo era ver si la célula sola más la proteína sola, sin otros agentes, tenía efecto o no. Uno puede ir mucho más lejos y tratar de entender todos los fenómenos, pero ése no era nuestro objetivo.
Pregunta: Usted dijo que la timidina y la bromooxiuridina son indicadores de inflamación que se induce en procesos neoplásicos, ¿Qué le parecen los estudios de propidio yodado para estudios de ADN?
Dr. Iovanna: Es una técnica clásica para estudiar cantidad de ADN. El yoduro de propidio se adhiere al ADN y florece, de modo que se puede medir la intensidad de yoduro de providio como cantidad de ADN, pero tiene un inconveniente. Se usó timidina o bromouridina, porque son moléculas que se incorporan directamente al ADN, así que la fluorescencia o radioactividad que se miden son un indicador directo y específico de la cantidad de ADN. Si se estudia la integración de yoduro de providio, este compuesto no se integra sino que se intercala entre las dos cadenas de ADN, por lo que puede verse modificado por la permeabilidad y, como no todas las células se permeabilizan de la misma manera, cuando se estudia células enfermas y sanas se podría dificultar la interpretación de los estudios.
La edición y publicación de esta conferencia han sido posibles gracias a un auspicio sin restricciones de Grünenthal.
Medwave. Año 4, No. 8, Edición Septiembre 2004. Derechos Reservados.














 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el I Congreso Latinoamericano de Páncreas, efectuada en el marco del XXX Congreso Chileno de Gastroenterología, que se realizó en Viña del Mar el día 29 de noviembre de 2003.
Presidente del Congreso: Dr. Zoltán Berger.
Editor Científico: Dr. Zoltán Berger.
 Expositor:
Juan Iovanna[1]
Expositor:
Juan Iovanna[1]

Citación: Iovanna J. Pancreatic cell: how it responds to injury. Medwave 2004 Sep;4(8):e1067 doi: 10.5867/medwave.2004.08.1067
Fecha de publicación: 1/9/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión