Este texto completo es la transcripción editada y revisada de la conferencia dictada en el I Congreso Latinoamericano de Páncreas, efectuada en el marco del XXX Congreso Chileno de Gastroenterología, que se realizó en Viña del Mar el día 29 de noviembre de 2003.
Presidente del Congreso: Dr. Zoltán Berger.
Editor Científico: Dr. Zoltán Berger.
La prevención y tratamiento de la infección es uno de los temas más controvertidos en pancreatología. La infección pancreática y la sepsis consecuente, son los principales determinantes de la sobrevida en la pancreatitis aguda grave, como lo han demostrado varios autores (Bradley, Arch Surg 1993; Büchler, Ann Surg 2000; Gloor, Br J Surg 2001).
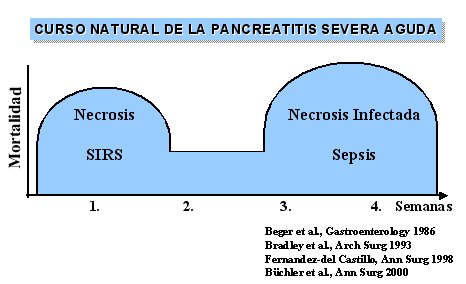
En la necrosis del páncreas suele producirse una infección grave, en cuyo caso es necesario operar, porque se sabe que la mortalidad en la fase temprana es secundaria al síndrome de respuesta inflamatoria sistémica (SRIS), pero que en fases más avanzadas se debe a la sepsis derivada de la necrosis infectada. Éste constituye el mayor problema, a pesar de que existen buenos tratamientos.
Los objetivos del tratamiento en la fase temprana de la pancreatitis son tratar la inflamación local y prevenir la aparición de necrosis y de SRIS, lo que se logra satisfactoriamente con el manejo del paciente en la UCI, aunque no existe actualmente un tratamiento específico. En la fase más tardía, el objetivo es tratar o prevenir la infección, posiblemente mediante el uso profiláctico de antibióticos, y cuando la infección está establecida, se debe operar.
A continuación se mostrará el curso natural de la necrosis pancreática infectada, que se resume en la figura 1, y se analizará la forma en que se puede actuar sobre ella según lo que se desprende del análisis de los estudios aleatorios y controlados disponibles, incluso algunos metaanálisis. También se discutirá el desplazamiento de los microorgismos inducido por los tratamientos con antibióticos y, por último, se presentará el tratamiento de la necrosis infectada.
Figura 1.
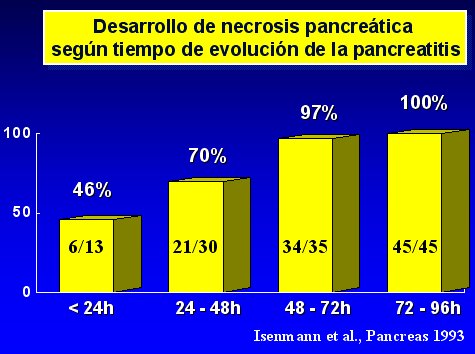
La necrosis se desarrolla rápidamente, durante los cuatro o cinco primeros días desde el comienzo de la enfermedad, lo que ha sido confirmado por varios estudios, como el de Isenmann, publicado en Pancreas en 1993, cuyos principales resultados se resumen en el gráfico de la figura 2.
Figura 2.
Es muy importante recordar que en la fase precoz de la pancreatitis grave puede aparecer un SRIS en ausencia de necrosis pancreática significativa, y que con cierta frecuencia este síndrome se presenta sin evidencia de infección pancreática (Tenner et al., Gastroenterology 1997; Lankisch et al., Pancreas 2000).
El diagnóstico de necrosis se hace por los niveles de Proteína C Reactiva (PCR) mayores de 150 mg/l y se confirma mediante tomografía computada (TC) con contraste (Büchler et al., Int J Pancreatol 1986; Block et al., Gut 1986; Balthazar, Rad Clin North Am 1989; Bradley et al., Ann Surg 1989).
Se sabe que la necrosis estéril no es un problema, porque muchos estudios realizados desde principios de los 90 hasta la fecha han demostrado que en estos casos prácticamente no hay mortalidad, y no es necesario operar. Por lo tanto, la necrosis estéril se puede manejar de modo conservador (Bradley et al., Am J Surg 1991; Rau et al., J Am Coll Surg 1995; Büchler et al., Ann Surg 2000; Ashley et al., Ann Surg 2001).
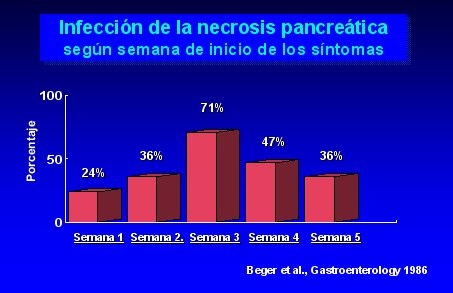
En la mayoría de los casos, las infecciones de las necrosis pancreáticas ocurren después de la segunda semana de iniciados los síntomas de pancreatitis; después de la tercera semana, 71% de los pacientes están infectados, como se ilustra en la figura 3.
El grado y cantidad de la infección se relacionan con la extensión de la necrosis; en una serie de nuestros pacientes, de los que tenían 30% a 50% de necrosis, sólo 16% tenían infección; en cambio, cuando la necrosis superaba 50% hubo 72% de infección. Luego, cuanto más extensa es la necrosis, mayor es el riesgo de que se infecte; los datos se resumen en la tabla I.
Figura 3.
Tabla I.
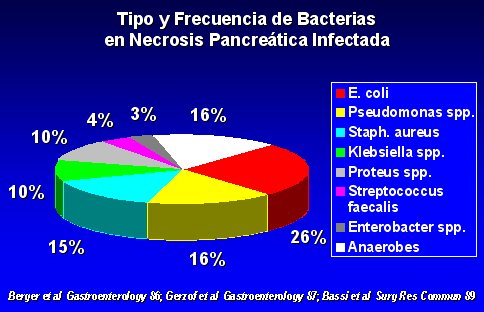
Un dato muy importante, que se debe tener presente siempre, es que en el curso natural de la pancreatitis aguda con necrosis, la tasa de infección oscila entre 40% y 70% (Beger et al., Gastroenterology 91, 433-438, 1986; Gerzof et al., Gastroenterology 93, 1315-1320, 1987; Bassi et al., Surg Res Comm 5, 1-4, 1989).
Diagnóstico de la necrosis infectada
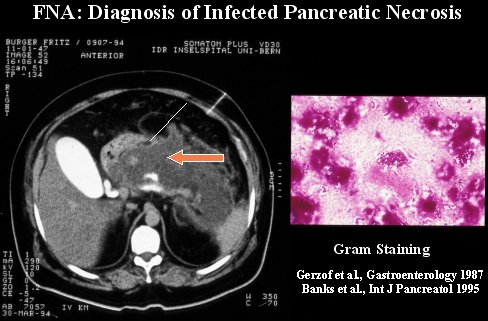
Para diagnosticar la infección, es necesario haber diagnosticado la necrosis con una TC y luego sospechar clínicamente la presencia de infección, porque el paciente hace un cuadro séptico o desarrolla una deficiencia orgánica. Hay dos métodos para diagnosticarla: puede ser visualizando inclusiones de aire en la TC o realizando una aspiración con aguja fina (FNA) guiada por TC, y hacer luego una tinción de Gram. Este método es seguro, confiable y rápido para diferenciar la necrosis estéril de la necrosis infectada; se puede realizar incluso con ultrasonido.
En la figura 4 se puede ver cómo se realiza el procedimiento; se aspira algunas partes de la necrosis, guiando la aguja con visión mediante TC, el material obtenido se tiñe con Gram y así se obtiene el diagnóstico.
Los gérmenes que se encuentran en la pancreatitis necrótica infectada son los mismos que se encuentran en el intestino, como se puede ver en la figura 5.
Figura 4.
Figura 5.
Profilaxis con antibióticos
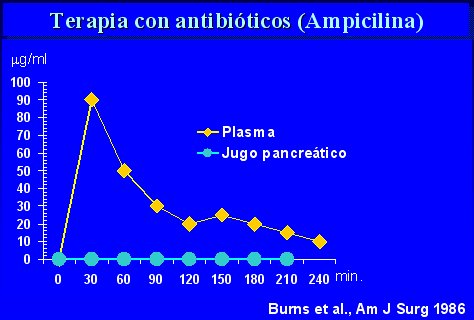
Los estudios que se hicieron en los años 70 no fueron útiles, porque no hubo mortalidad de los pacientes estudiados ni en los controles, de modo que no fue posible evaluar el efecto del uso de antibióticos (Finch, Ann Surg 1976; Howes, Surg Res 1975; Craig, Ann Intern Med 1975). Además, se usó ampicilina, que no es el fármaco adecuado, como lo demostró Burns, a mediados de los años 80, cuando descubrió que se forma una barrera entre el flujo sanguíneo y el páncreas, de manera que, aunque se logren niveles séricos adecuados, el fármaco no penetra en el órgano y no produce efecto alguno (véase figura 6, de Burns, Ann Surg 183, 667-671, 1986).
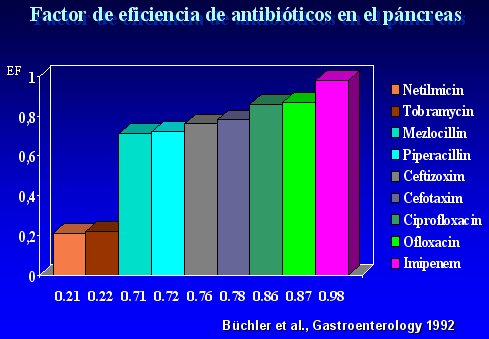
A comienzos de los años 90, Büchler evaluó los niveles de distintos antibióticos en el páncreas y demostró que Imipenem y las quinolonas tienen altos factores de eficiencia, sobre 80%, lo que los convierte en los fármacos de elección si se desea prevenir o tratar la infección en la necrosis pancreática. Sus resultados se resumen en la figura 7.
Figura 6. La Ampicilina no penetra la barrera hematopancreática.
Figura 7.
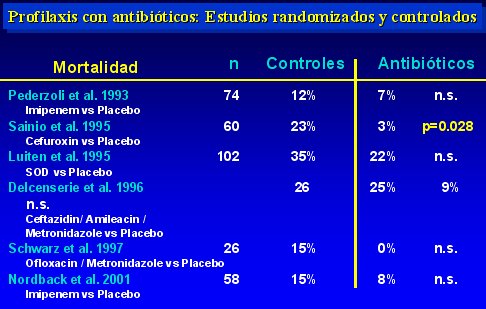
Uno de los estudios, realizado por Luiten, es un estudio holandés que no evaluó antibióticos endovenosos, sino que investigó la descontaminación selectiva del intestino; en otro estudio, hecho por Bassi, no se usó grupo control sino que se comparó Imipenem/cilastatin con Pefloxacino, para determinar cuál es la mejor droga, y no se usó un grupo control con placebo.
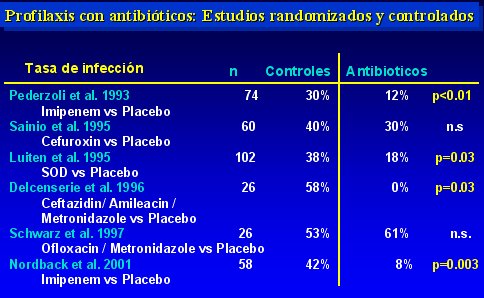
En la tabla II se observa las tasas de infección encontradas. En cuatro de los seis estudios analizados hubo un descenso significativo, de modo que la tasa de infección que se obtiene, sumando todos los grupos en que se utilizó antibióticos profilácticos, es de 17% (34 entre 207 pacientes), lo que contrasta con la tasa de 40% a 70% que se observa en el curso natural de la enfermedad.
La mortalidad se redujo significativamente sólo en uno de los seis estudios, el de Sainio, pero en los demás hubo una tendencia a mejorar la sobrevida, la que seguramente no fue significativa debido al reducido número de pacientes investigados. Los datos se muestran en la tabla III.
Tabla II.
Tabla III.
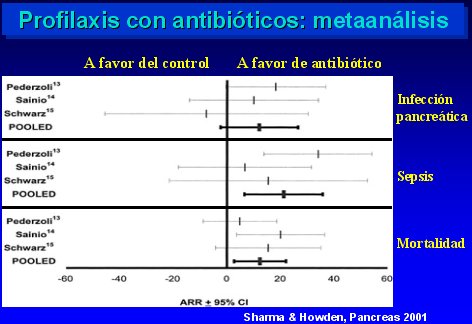
Con respecto a los metaanálisis, hay dos, publicados en 1998 y 2001, respectivamente (Golub., J Gastrointestinal Surg 2:496, 1998 (n=4); Sharma, Howden, Pancreas 22:28, 2001 (n=3). En ellos se observó que la mortalidad disminuye al utilizar antibióticos profilácticos, pero en tres de los estudios sólo hubo una tendencia, sin significación estadística; sólo en el estudio de Sainio el descenso fue significativo. En el otro metaanálisis, cuyo detalle se muestra en la figura 8, también se comprobó una mejoría de la infección pancreática, sepsis y mortalidad.
Figura 8.
Hay dos estudios nuevos, publicados después de los metaánalisis (Nordback et al., J Gastrointest Surg 2001; Isenmann, Abstract, Pancreas 2002; Isenmann, Abstract, Gastroenterology 2003). El grupo finlandés realizó un estudio aleatorio y controlado por placebo en un solo centro, en el que se utilizó Imipenem, y se demostró que en el grupo que recibió antibióticos profilácticos disminuía la incidencia de necrosis infectada, complicaciones y necesidad de cirugía.
Posteriormente, Isenmann hizo un estudio multicéntrico, doble ciego, en el que se concluyó que no hay beneficio al usar antibióticos profilácticos, pero esta conclusión podría ser errónea, porque se investigó casos no muy graves (35 entre 56 pacientes tenían necrosis en la TC), la necrosis infectada estuvo presente sólo en 12% de ellos y 8% de los pacientes del grupo control murieron, así que probablemente no fue el grupo más apropiado para estudiar el uso de antibióticos profilácticos (Isenmann, Abstract, Pancreas 2002, Gastroenterology 2003).
Además, hubo sólo un hallazgo significativo: 50% de los pacientes en el grupo placebo requerían antibióticos ya dirigidos por la aparición de complicaciones sépticas con traslado a UCI, de modo que se puede concluir de estos resultados, que el traslado a UCI y las complicaciones sépticas disminuyen al usar antibióticos profilácticos.
Con respecto al desplazamiento microbiano, en el curso natural de la enfermedad se encuentran principalmente Gram-negativos; en los estudios mencionados se investigaron los microorganismos después del tratamiento antibiótico, y se encontró un aumento de Gram-positivos, en comparación con lo que se ve en el curso natural, que no eran bacterias multirresistentes. También aumentaron los hongos y hubo una desaparición de los anaerobios.
Por lo tanto, la recomendación de la mayoría de las sociedades internacionales y de la última guía, publicada en 2002 por la Asociación Internacional de Pancreatología, establece una indicación absoluta para el uso de antibióticos profilácticos en pancreatitis aguda grave, con evidencia tipo 1a, que es la más alta posible; es necesario administrar un antibiótico que penetre en el páncreas y que posea una cobertura adecuada de las bacterias que probablemente estén presentes.
Esta medida debe prolongarse al menos hasta la tercera semana y está comprobado que evita la necesidad de cirugía, que reduce en un 30% la tasa de infección y que no produce un desplazamiento importante de microorganismos (Uhl et al., IAP Guideline 2002).
Todavía están abiertas algunas interrogantes. En primer lugar, falta por establecer cuál es la mejor droga, pero, en mi opinión, de estos estudios se puede concluir que es Imipenem, cuyo uso se está evaluando actualmente en un gran estudio multicéntrico. También falta determinar cuánto tiempo es preciso usar el antibiótico, pero todo parece indicar que sería por 10 a 14 días. Por ahora no parece imprescindible combinar los antibióticos con antimicóticos, pero quizás las infecciones fúngicas sean un problema en el futuro. La aparición de bacterias multirresistentes tampoco constituye un problema por ahora.
Tratamiento de la infección en la pancreatitis aguda
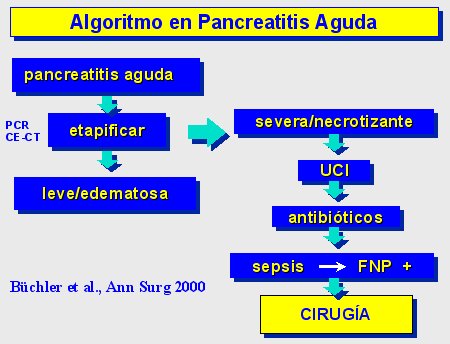
En la figura 9 se muestra el algoritmo utilizado en nuestro hospital, que también ha sido publicado por la Asociación Internacional de Pancreatología. Una vez que se ha establecido el diagnóstico y la etapa, el paciente con pancreatitis grave necrótica debe ser monitorizado en la UCI y tratado con antibióticos; si se sospecha sepsis, se debe hacer una punción y aspiración con aguja fina (FNP), y si ésta es positiva, recurrir a la cirugía.
Figura 9.
Los objetivos de la cirugía son controlar el foco de sepsis, que en este caso es la necrosis infectada, y detener la infección y la liberación de mediadores de la inflamación. Hoy ya no se hace cirugía precozmente, porque se asocia con mayor mortalidad. El tratamiento quirúrgico temprano solía ser de elección hace 10 ó 15 años, pero las tasas de mortalidad eran hasta de 65%.
Lo habitual hoy en día es la cirugía tardía, después de tres semanas de evolución, que tiene la ventaja de que ya se ha producido una demarcación adecuada de la necrosis, lo que permite limitar la extensión de la cirugía y tener condiciones óptimas para ésta, disminuir el riesgo de sangrado y reducir al mínimo la pérdida de tejido vital, con lo que se preserva la función exocrina y endocrina.
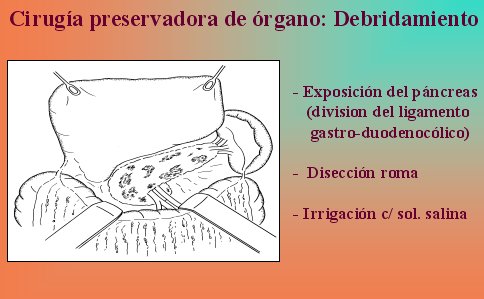
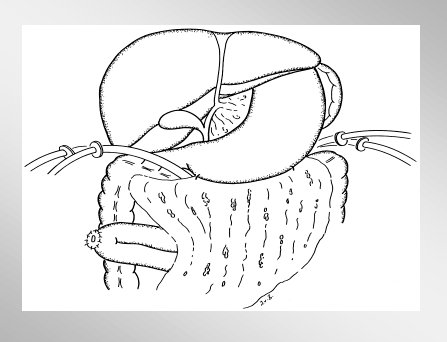
No hay que sacar el páncreas por completo, porque a primera vista se observa una necrosis completa de la glándula en la superficie, pero dentro de ella hay mucho tejido vital, por lo que la técnica de elección es la necrosectomía y debridamiento de la glándula. La disección roma permite remover todo el tejido necrótico pancreático y peripancreático, y se reduce o se elimina el riesgo de sangrado. El páncreas es expuesto mediante la división del ligamento gastrocólico y duodenocólico, como se esquematiza en la figura 10.
Figura 10.
Hay cinco técnicas disponibles hoy en día, cada una con sus correspondientes ventajas e inconvenientes. Ellas son:
En general, es necesario diferenciar dos enfoques. El primero consiste en relaparotomías y reintervenciones, que son las dos primeras de la lista; en el segundo se incluyen las técnicas tercera y cuarta de la lista, en las que se inserta un dispositivo que remueve continuamente la necrosis después de la operación, sin necesidad de abrir el abdomen nuevamente.
A continuación se muestran algunos datos de la experiencia de Branum con necrosectomía, open packing y cierre final sobre drenajes (Branum et al., Ann Surg 1998 1990-1996, n=50). Se operó en necrosis infectada en la mayoría de los casos, postergándose la cirugía, pero tuvieron que reoperar entre 2 y 13 veces, con una mortalidad de 54%.
La otra técnica, que se utiliza principalmente en la Clínica Mayo, en los Estados Unidos, es la necrosectomía operatoria repetida usando una técnica de zipper (Tsiotos G.G., Luque-de Leon E., Söreide J.A., Zietlow S.P., Baerga-Varela Y., Sarr M.G. Am J Surg 175, 91-98, 1998), que busca evitar la reoperación y se puede realizar incluso en la UCI. En la mayoría de los casos se opera la necrosis infectada y se posterga la cirugía todo lo posible, pero aun así es necesario reoperar 2,2 veces en promedio.
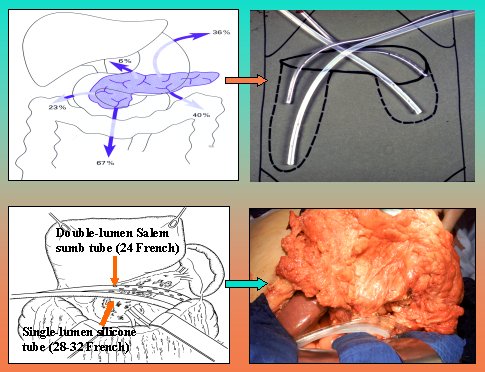
Ambas técnicas tienen el inconveniente de que se exigen múltiples relaparotomías. La de Open Packing /Planned Relaparotomies presenta mayor número de complicaciones, debido a que la manipulación del intestino provoca fístulas y hernias. Beger inventó la necrosectomía con lavado local postoperatorio en la pancreatitis necrotizante, que es el método de elección en nuestra institución y que consiste en que, después de la necrosectomía, se insertan tubos de doble lumen, que pueden lavar y drenar al mismo tiempo, como se ve en la figura 11.
A continuación se cierran nuevamente los ligamentos gastrocólicos y se forma un espacio cerrado para lavar (Figura 12). Si la necrosis se encuentra detrás del colon, conviene evitar las fístulas hacia el colon, para poder comenzar la nutrición enteral en forma temprana. Con tal fin se efectúa una ileostomía derivativa (Beger HG, Büchler M, Bittner R, Block S, Nevalainen T, Roscher R. Br J Surg 75, 207-212, 1988).
Figura 11. Lavado local postoperatorio.
Figura 12. Reaproximación del ligamento gastrocólico y duodenocólico para crear un espacio cerrado para el lavado local postoperatorio.
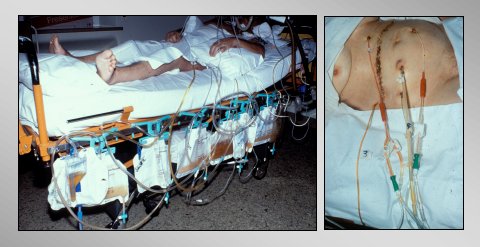
En la figura 13 se ve al paciente en la UCI después de la operación. Se lava al paciente con 40 a 50 litros en los primeros días, y se puede observar que se limpia rápidamente.
Figura 13. Paciente en UCI después de lavado local postoperatorio.
La serie descrita por Beger a mediados de los 80 comprende a pacientes operados con necrosis infectadas y algunas estériles; no se esperó tanto tiempo y los resultados fueron bastante buenos, probablemente porque se operó a pacientes que no lo necesitaban. La mortalidad fue solamente de 8,4% y la tasa de relaparotomías disminuyó a un cuarto (Necrosectomy and local closed lavage(1982-1987, n= 95). Beger et al., Br J Surg 1988).
Büchler, en Bonn, intervino a sus pacientes con una estrategia acorde con el estado de la infección. En su serie se incluyen sólo casos graves; 93% estaban infectados; la cirugía se postergó siempre, al menos por 10 días, y hubo que realizar relaparotomías sólo en 17% de los casos; la mortalidad fue de 21%, cifra que en necrosis infectada es bastante aceptable (Büchler MW, Gloor B, Müller CA, Friess H, Seiler CA, Uhl W. Ann Surg 232, 5586-590, 2000). El detalle de sus datos se entrega en la siguiente lista.
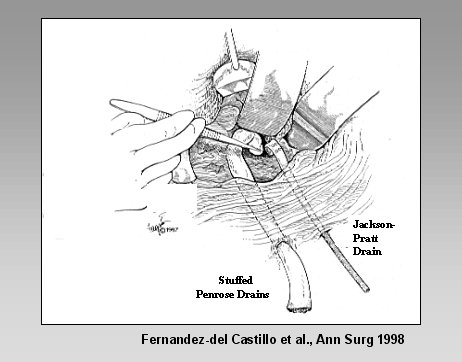
Por último, se presenta el concepto del closed packing, desarrollado por Warshaw (Debridement and Closed Packing for the Treatment of Necrotizing Pancreatitis. Fernandez-del Castillo C, Rattner DW, Makary MA, Mostafavi A, McGrath D, Warshaw AL. Ann Surg 228, 676-684, 1998).
En esta técnica, luego de la necrosectomía, se llena la cavidad residual con drenajes penrose rellenos de gasa, drenajes de succión cerrada, y se realiza el drenaje continuo de la cavidad durante alrededor de siete días; después de ese lapso se comienza a sacar sucesivamente los drenajes y la cavidad se cierra.
Figura 14. Closed Packing.
Los resultados son similares a los descritos en Bonn, aunque no se operó los casos graves, se postergó la cirugía hasta 300 días. Con n= 64:
Cuando hay que operar en forma temprana a un paciente con pancreatitis aguda, por complicaciones, sangrado o perforación intestinal, antes de que la necrosis esté totalmente delimitada, conviene utilizar el método de Open packing/Laparotomía planificada, porque será preciso operar al paciente de nuevo, pues la primera operación fue muy precoz y la necrosis no estaba delimitada claramente en ese momento.
Si es posible postergar la cirugía hasta la tercera semana y retardar la aparición de infección mediante el uso de antibióticos profilácticos, se debe usar uno de los dos métodos y habrá menos relaparotomías y menos complicaciones.
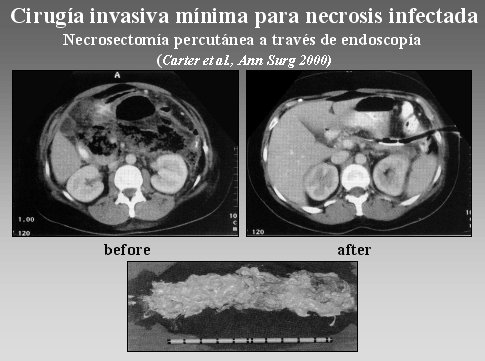
La cirugía mínimamente invasiva (MIC) se utiliza en pocos centros; uno de ellos es el Centro de Glasgow, en Gran Bretaña. Este método consiste en insertar un endoscopio por el costado del retroperitoneo y realizar una necrosectomía a través de este instrumento, como se ve en la figura 15. El inconveniente está en que probablemente se alcance sólo las zonas necróticas del lado izquierdo, y los resultados no son tan buenos hasta ahora.
Figura 15.
La mayor serie comunicada con uso de esta técnica es la de Connor, en Liverpool. En este estudio se intentó la MIC en 53% (24/45) de los pacientes que el autor tuvo en su departamento entre 1996 y 2000, y se practicó sólo en 21 de ellos (46%), por complicaciones técnicas de los otros tres. Sólo en 16 de los 45 pacientes se realizó tratamiento endoscópico con éxito.
Fue necesario efectuar necrosectomía abierta en 8 de los 24 pacientes en los que se quiso efectuar la MIC (33%), de modo que hubo una alta tasa de fracaso y complicaciones en el grupo preseleccionado, con 36 complicaciones en 24 pacientes, aunque la mortalidad fue bastante buena para casos de pancreatitis grave (Connor, Dig Surg 2003).
En la pancreatitis aguda grave no sólo es necesario administrar antibióticos profilácticos; además, en los pacientes con síndrome séptico se debe hacer aspiración con aguja fina para diferenciar entre necrosis estéril e infectada. Ésta, al igual que las siguientes, es una recomendación basada en la evidencia de tipo 2 a, recomendación B.
Hay consenso en que la pancreatitis estéril se puede manejar en forma conservadora y que sólo algunas excepciones necesitan cirugía. La necrosis infectada del páncreas en pacientes con signos clínicos de sepsis es una indicación de cirugía, aunque puede haber casos con aspiración con aguja fina positiva y sin sepsis, en los cuales es posible no operar; hay unos 30 casos descritos en la literatura.
Pregunta: ¿Hay alguna recomendación sobre la elección del antibiótico en el tratamiento profiláctico? ¿Cuál es su opinión acerca de los métodos de alternativa, drenajes radiológicos, tratamientos percutáneos en necrosis infectada?
Dr. Werner: Como profilaxis antibiótica, usamos Imipenem en todos los casos en que tengamos una TC con necrosis o bien, una PCR de 150, en cuyo caso realizamos una TC para confirmar la necrosis. En nuestro departamento, todos los pacientes reciben antibióticos desde el primer día en que sospechamos necrosis, según lo que recomiendan las guías.
Con respecto al drenaje radiológico, pienso que en algunos casos es posible hacerlo. Cuando hay una infección tardía, luego de la primera semana, y está bien localizada, se puede utilizar esta opción, aunque yo no la llamaría “necrosis infectada”; más bien es un absceso, y es bien sabido que se puede drenar un absceso. También mencioné que en algunos casos con infección sin síndrome séptico no es necesario operar, y basta con el tratamiento antibiótico, pero no lo recomendaría como rutina, porque no hay datos significativos, sólo 20 ó 30 casos descritos en la literatura.
Pregunta: ¿Qué opina de la aspiración con aguja fina con ecoendoscopía? ¿Es útil en este estado de la pancreatitis aguda?
Dr. Werner: Normalmente es fácil hacerlo con ultrasonido, ecotomografía abdominal, pero, si se puede llegar a esa área con el ecoendoscopio, es también una alternativa posible. Pienso que se debe tratar de obtener la mejor dirección hacia el área necrótica. Normalmente, los pacientes con una pequeña cantidad de necrosis no se infectan, así que cuando hay indicación de punción diagnóstica, la necrosis es extensa y no habría dificultad de acceso a esa área. Por consiguiente, se puede usar el ultrasonido, para el cual se ha descrito una sensibilidad y especificidad sobre 80% en los casos graves.
La edición y publicación de esta conferencia han sido posibles gracias a un auspicio sin restricciones de Grünenthal.
Medwave. Año 4, No. 10, Edición noviembre 2004. Derechos Reservados.



















 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el I Congreso Latinoamericano de Páncreas, efectuada en el marco del XXX Congreso Chileno de Gastroenterología, que se realizó en Viña del Mar el día 29 de noviembre de 2003.
Presidente del Congreso: Dr. Zoltán Berger.
Editor Científico: Dr. Zoltán Berger.
 Expositor:
Jens Werner[1]
Expositor:
Jens Werner[1]

Citación: Werner J. Acute pancreatitis: prevention and treatment of infection. Medwave 2004 Nov;4(10):e1053 doi: 10.5867/medwave.2004.10.1053
Fecha de publicación: 1/11/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión