Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por la Sociedad Chilena de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores
A continuación se analizará el papel que cumplen las terapias extracorpóreas en el complejo síndrome de la sepsis. Se examinará el paso desde las observaciones clínicas a los mecanismos; las fases humorales y celulares de la sepsis; la red de citoquinas; las funciones celulares; la hipótesis de los picos de concentración; el concepto de ambiente séptico y la homeostasis inmune. Todo esto, porque en la actualidad las terapias extracorpóreas se están aplicando a situaciones diferentes a la original, que es la terapia de reemplazo renal; un ejemplo es el caso de un paciente con rabdomiolisis séptica aguda y síndrome de distrés respiratorio del adulto tratado con HF-CPFA (Coupled Plasma Filtration-Adsorption) isovolémica.
La secuencia de hechos en la sepsis es como sigue: invasión bacteriana del huésped; presencia de exotoxinas y endotoxinas en la sangre; reconocimiento de lipopolisacáridos (LPS) por receptores específicos; activación de la respuesta humoral; activación de señales y vías celulares específicas; y producción de mediadores químicos proinflamatorios. Así, el proceso se mueve desde la inflamación hacia el síndrome de respuesta sistémica (SIRS) y desde ahí, a la sepsis y el shock séptico.
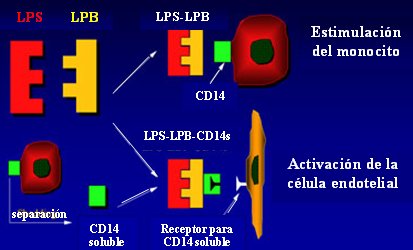
La activación de las vías humorales por los LPS lleva a la activación de anafilotoxinas (C3a y C5a), las que a su vez causan agregación plaquetaria (con la participación del factor XII de Hageman); disminución de la resistencia vascular y aumento de la permeabilidad; y activación de los neutrófilos en el endotelio. Al ser activados, los neutrófilos liberan mediadores, como el factor activador de plaquetas (PAF), que tiene diversos efectos biológicos: induce la agregación plaquetaria; promueve la quimiotaxis de los neutrófilos; aumenta la permeabilidad vascular; altera el tono vascular; activa los monocitos; y promueve la degranulación de las plaquetas y los neutrófilos. Por lo tanto, desde el punto de vista biológico, estos mediadores disponen de un amplio espectro de acciones. Cuando el LPS entra en la circulación, también se origina una activación de vías celulares. La proteína ligadora del LPS (LBP) captura el LPS y forma un complejo que se une a los receptores CD14 de la superficie del monocito y lo activa (Fig. 1). Al mismo tiempo, el CD14 soluble, unido a los complejos LPS-LBP, puede encontrar los receptores para CD14 soluble en la superficie del endotelio, lo que causa la activación de la célula endotelial. Aquí, el monocito cumple tres papeles fundamentales: reconocimiento temprano de LPS y complejos LPS-LBP, producción de citoquinas y depuración sanguínea de LPS y complejos.
Figura 1. Formación de complejos LPS/proteína en el plasma
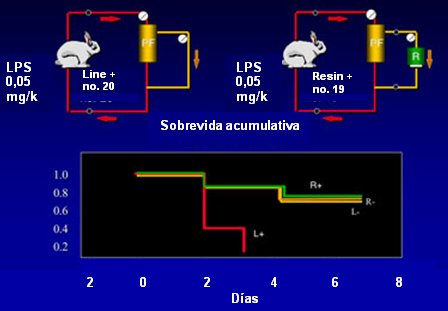
Figura 2. Filtración de plasma acoplada con sorbentes (HF-CPFA, Coupled Plasma Filtration-Adsorption) en un modelo de shock tóxico en conejos.
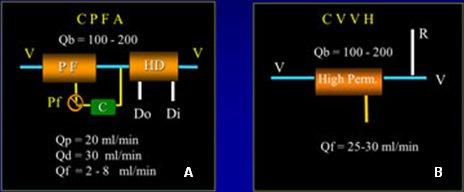
Posteriormente nuestro grupo hizo un estudio prospectivo, aleatorio y controlado, en el que se comparó el efecto de 10 horas de CPFA versus 10 horas de CVVH (Continuous Veno-Venous Hemofiltration), con un período de washout nocturno (Fig. 3). De nuevo, se observó que mejoraba la resistencia vascular sistémica y el índice cardíaco, con leve mejoría en la presión arterial media y disminución de los requerimientos de norepinefrina para mantener al paciente estable. No hubo cambios en los niveles de TNF, pero hubo un cambio importante en la capacidad de las células para responder, luego de la incubación con LPS. Avaló este efecto el hecho de que, después del sorbente, el plasma de estos pacientes no inhibía las células, a diferencia del plasma antes del cartucho, de modo que el sorbente estaba removiendo algo. Por último, se demostró que lo que se estaba removiendo era IL-10, un mediador antiinflamatorio.
Figura 3. CPFA (A) versus CVVH (B) Diseño del estudio.
En resumen, en este estudio sobre la CPFA se comprobó mejoría de la mortalidad, aunque no era la variable principal de evaluación en este estudio; mejoría de la hemodinamia; reducción de los requerimientos de vasopresores; mejoría de la respuesta de los monocitos al LPS; mejoría de la fagocitosis y efectos inmunomodulatorios mediante una reprogramación de TNF/IL-10. Es decir, el monocito humano, en el paciente séptico, tiene disminuida la capacidad de producir citoquinas frente a una estimulación in vitro. Frente a lo anterior surgieron varias interrogantes: ¿Se trata de células exhaustas? ¿Las células están inhibidas? ¿La remoción se orienta hacia la reducción de mediadores peligrosos o hacia la modulación de la actividad del monocito, permitiéndole recuperar su función de secreción con efectos autocrinos y paracrinos?
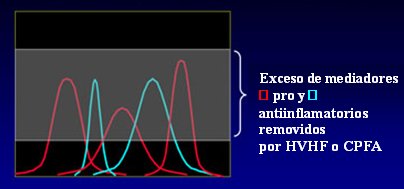
Si se inyecta un animal con LPS se forman picos, tanto de mediadores inflamatorios como de mediadores antiinflamatorios. Los tratamientos pueden cortar estos picos, cuya vida media es muy corta (Fig. 4); por eso conviene mantener una terapia continua, ya que no se puede predecir el momento en que van a aparecer estos picos.
Figura 4. Hipótesis del pico de concentración.
A la luz de lo expuesto, los criterios para medir la eficiencia de una nueva terapia no se deben limitar a la respuesta hemodinámica, con mejoría de presión arterial media, resistencia vascular e índice cardíaco, además de reducción del uso de fármacos vasopresores, sino que se debe esperar una reducción de los niveles circulantes de citoquinas proinflamatorias o endotoxinas y mejoría de los scores de gravedad, además de restablecer la respuesta celular. En este sentido se ha desarrollado la hemofiltración de pulso. En el paciente séptico hay células que ya no responden, de modo que, por un lado, está muy inflamado y, por el otro, está inmunodeprimido; frente a este cuadro, nuestro grupo planteó que la hemofiltración de pulso de alto volumen podría ser útil, lo que se avaló con un estudio en el cual se demostró que, después del tratamiento, las células producían TNF en respuesta a la incubación con LPS y la capacidad de fagocitosis de los monocitos aumentaba en 75%.
Figura 5. Ambiente hostil en la sepsis.
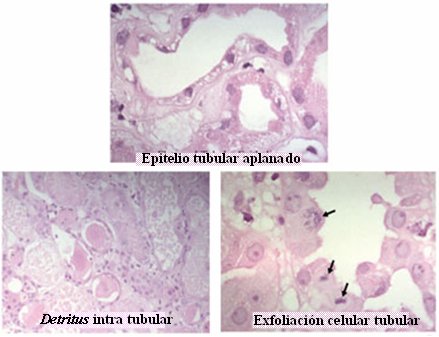
En el modelo típico de reperfusión post isquemia, en el epitelio normal se pierde la polaridad, desaparecen las moléculas de adherencia y se presenta intensa necrosis y algo de apoptosis; las células se descaman, algunas aún viables, hacia el lumen tubular. Luego hay migración, desdiferenciación y proliferación celular, lo que permite volver a la normalidad. En la Fig. 6 se observa la imagen típica de pérdida de moléculas de adherencia, con descamación de las células tubulares y epitelio tubular de aspecto aplanado.
Figura 6. Histología en la reperfusión renal post isquemia
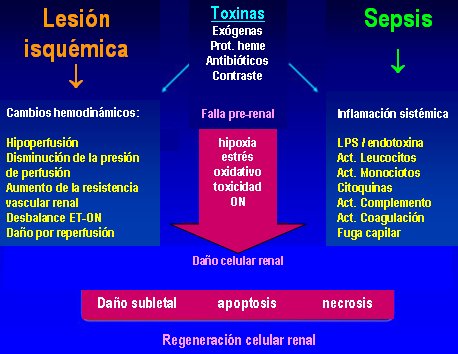
Es frecuente que en la sepsis no disminuya el flujo sanguíneo renal; de hecho, en la mayoría de los casos se observa una circulación hiperdinámica. La hipoperfusión renal sostenida, con isquemia renal, global o regional, seguida de reperfusión, sería el principal evento desencadenante de la insuficiencia renal aguda; pero si lo anterior vale en los modelos de isquemia-reperfusión y, probablemente, en los estados sépticos hipodinámicos, ¿se podrá aplicar a los estados sépticos hiperdinámicos? Se ha demostrado que en estos últimos hay redistribución del flujo y vasodilatación renal, de modo que el flujo sanguíneo se mantiene; por tanto, la lesión se debe a los efectos tóxicos que se han mencionado.
Además de la necrosis tubular aguda, en la sepsis se puede presentar un estado llamado apoptosis tubular aguda; en otras palabras, el proceso fisiológico de la apoptosis se vuelve patológico debido a las condiciones propias de ambiente hostil, que llevan a un estado apoptótico prevalente. Si en las biopsias de los pacientes con IRA por sepsis no se suele encontrar gran cantidad de apoptosis es porque los monocitos remueven los cuerpos apoptóticos rápidamente. No importa si existe un daño primario renal, porque al final la disfunción renal forma parte del círculo vicioso del síndrome. Se sabe que las células tubulares renales pueden morir de necrosis, pero también de apoptosis; que ésta requiere depleción de GTP; y que, si se inhibe a las enzimas caspasas, la apoptosis disminuye.
Hay dos mecanismos por los cuales una célula puede entrar en apoptosis: uno es la vía de los receptores de muerte celular, que son receptores para TNF o para Fas y Fas-ligando; el otro es la vía del daño celular, en la cual se encuentran las proteínas Bax, que son parte de la familia de BCL-2 y que al ser activadas causan la salida del citocromo C desde la mitocondria, con la consecuente activación de procaspasa-3, caspasa-3 y caspasa-9, que finalmente desencadenan la apoptosis. Es interesante el hecho de que, frente a estas proteínas Bax apoptóticas, hay una molécula especular que es anti-apoptótica. Bax es un miembro pro-apoptótico de la familia de BCL-2 que inhibe la acción anti-apoptótica de BCL-2; se sabe que el knock-out del gen Bax causa tumorogénesis en ratones, no por proliferación celular, sino por falta de muerte celular programada. Por otro lado, BCL-2 es anti-apoptótica; si se sobreexpresa de manera inapropiada también se originan tumores sólidos y, además, contribuye a causar resistencia a la quimioterapia, debido a que impide la apoptosis normal de las células.
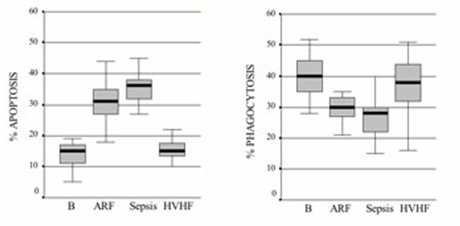
En cuanto a la relación entre el ambiente hostil y la apoptosis (Fig. 7), al observar los niveles basales de apoptosis en sujetos normales y sujetos con insuficiencia renal aguda y sepsis, se puede ver que en los últimos hay una situación de apoptosis patológica, la cual se revierte parcialmente con la hemofiltración de alto volumen. Lo más sorprendente es que la apoptosis se relaciona en forma inversa con la función fagocítica y, de nuevo, la hemofiltración de alto volumen restablece la capacidad de fagocitosis. Por lo tanto, ya no se habla de remover urea o de remover TNF-alfa, sino de remover el ambiente plasmático en el cual las células tienen que operar por fuerza.
Figura 7. Apoptosis y fagocitosis. B = estado normal; ARF = insuficiencia renal aguda; HVHF = hemofiltración de alto flujo
En otros estudios se ha visto que si se utiliza 4 litros por hora en vez de 2 litros por hora el porcentaje de apoptosis cae significativamente a la hora de tratamiento y si después se vuelve a 2 litros por hora, el efecto se mantiene. Esta es la justificación para hacer hemofiltración de pulso. Es interesante que si se utiliza 2 litros por hora se obtiene algo; si se emplea 2 litros por hora primero y luego se sigue con 4 litros por hora, con el mismo filtro, no se obtiene el mismo resultado después de una hora de alto volumen, sino después de cinco horas. Es probable que lo dicho se deba a que, después de 12 ó 24 horas de uso, el filtro se tapone y el aclaramiento disminuya, incluso con alto volumen, de modo que probablemente sea mejor cambiar el filtro, hacer alto volumen y luego seguir con bajo volumen. Más o menos el mismo tipo de comportamiento se observa en las mediciones de caspasa-3, aunque las variaciones son más amplias y se obtienen valores menos significativos.
Nuestro grupo también estudió la posibilidad de usar sorbentes para remover el potencial pro-apoptótico del plasma y comprobó un efecto de arteria a vena muy pequeño, pero que aumentaría con el tiempo, de modo que los sorbentes pueden ser útiles en este aspecto.







 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por la Sociedad Chilena de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores
 Expositor:
Claudio Ronco[1]
Expositor:
Claudio Ronco[1]

Citación: Ronco C. Immunomodulation in hemofiltration: Lessons from sepsis. Medwave 2007 Jul;7(6):e1042 doi: 10.5867/medwave.2007.06.1042
Fecha de publicación: 1/7/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión