Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, Simposio Fresenius, realizado en Valdivia entre los días 4 y 7 de octubre de 2006. El evento fue organizado por la Sociedad Chilena de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores.
Para responder a la pregunta sobre si la hemodiafiltración (HDF) en línea es la solución para mejorar la remoción de las toxinas urémicas y optimizar el tratamiento de la insuficiencia renal, se abordarán cuatro puntos principales:
Cuando se trabaja en una empresa, lo primero es hacer el análisis de mercado. En los últimos tiempos se han producido cambios en los tipos de diálisis utilizados: el número de dializadores de flujo bajo disminuyó en 6% y los filtros de celulosa disminuyeron en 12%, mientras que los de flujo alto aumentaron en 14% y los filtros sintéticos, en 16%. A continuación se analizará la causa de estos cambios.
Figura 1. Clearances del riñón humano y artificial: ¿Cómo reducir la brecha? (2)
Lo primero que se puede hacer para mejorar el rendimiento de la diálisis es modificar la tecnología. En la Fig. 2 se observa que con sólo aumentar el área de superficie del dializador de 1,4 a 2,2 m2, manteniendo constante el flujo sanguíneo y el flujo de filtración, el clearance de urea aumenta en 6%; si, de acuerdo a la fórmula del clearance, se aumenta el flujo sanguíneo de 300 a 500 ml/min, se consigue un aumento del clearance de 40%; si se utiliza un método como la HDF, es decir, un flujo convectivo o, en otras palabras, filtración con un fluido de sustitución, manteniendo la superficie y el flujo sanguíneo constantes, se obtiene un aumento adicional de 18% del clearance de urea. Es decir, con sólo introducir modificaciones tecnológicas se logra aumentar el clearance de urea de 100 a 160%, lo que es válido para moléculas de bajo peso molecular, como la urea.
Figura 2. Dializadores y clearance de urea in vivo (3).
Si se utiliza como modelo de molécula de peso molecular alto la beta-2-microglobulina, que pesa 11.800 y se hacen las mismas modificaciones que en el caso de la urea, el aumento de la superficie lleva a un aumento de 22% del clearance, el aumento del flujo sanguíneo lo incrementa en otro 16% y la aplicación de flujo convectivo, es decir, el aumento de la filtración, produce un aumento de 75% en el clearance, es decir, éste aumenta de 100 a 210% (Fig. 3). Sin embargo: ¿Estamos realmente aprovechando este conocimiento? ¿Realmente estamos utilizando mayor superficie? ¿Usamos mayor flujo sanguíneo? ¿Usamos flujos convectivos? Cada persona debe responder para sí misma a estas preguntas.
Figura 3. Dializadores y clearance de beta-2-microglobulina in vivo (3).
El análisis que demuestra los beneficios que se obtienen con estas modificaciones tecnológicas se publicó en 1985, hace más de 20 años. En la Fig. 4 se observa claramente los excelentes resultados que se pueden obtener en la remoción, tanto de moléculas pequeñas como de peso molecular alto, mediante la HDF con flujo convectivo, cuyo rendimiento es claramente superior. Esto se observa no sólo con la beta-2 microglobulina, como marcador sustituto para moléculas de alto peso molecular, sino que con citoquinas o cualquier otra molécula en el rango de peso; e incluso se observa con moléculas de mayor peso molecular, poco menor que el de la albúmina, como la amilasa. En resumen, el método es muy bueno para la remoción de moléculas de bajo peso molecular y aun mejor para las de peso molecular mayor.
Figura 4. Beneficios de la HDF (4).
Desde el punto de vista de la física, convección es un término que se relaciona solamente con diferencias de temperatura. Si se observa el globo terráqueo, es obvio que hay diferencias de temperatura entre el Sahara y el Polo Sur, o entre el Mar de Barents, en América del Norte, y el Golfo de México, en el Caribe. Hoy se sabe que las diferencias de temperatura inducen corrientes en la atmósfera y que la magnitud de estas corrientes depende de las gradientes de temperatura, con un poder de cuatro, es decir, mientras mayor es la diferencia de temperatura, mayor es la intensidad de la corriente atmosférica; esto explica los huracanes, tan frecuentes en casi todo el continente americano. Por definición, entonces, convección se refiere a gradientes de temperatura. Al aplicar esto a la diálisis se extendió la idea desde temperatura hacia flujos, de modo que se considera a la convección como el transporte de energía, cargas o moléculas, efectuado por una corriente de líquidos o gases a través de una membrana, es decir, flujo de filtración. Es, entonces, el flujo que hace pasar moléculas a través de una membrana; por eso, no es adecuado hablar de convección; es mejor llamar a este proceso arrastre por solvente: es como un río que arrastra a un bote, a un nadador, o a lo que sea que flote en él. El concepto de HDF se refiere al flujo de un solvente que arrastra consigo partículas o moléculas.
Para comprender cómo se puede influir en el flujo convectivo se debe recurrir a la fórmula matemática que indica que este flujo es el coeficiente de tamizaje (sieving coefficient) de la membrana, en otras palabras, el tamaño de los poros, multiplicado por el flujo. Para aumentar la convección se puede aumentar el tamaño de los poros, es decir, el coeficiente de tamizaje, o aumentar el flujo de filtración, es decir, la ultrafiltración, la que, a su vez, depende de la diferencia de presión. Desde el ingreso al dializador se va perdiendo presión hasta el final; mientras mayor sea la caída en la presión, mayor será la ultrafiltración; en otras palabras, filtra más si hay mayor caída en la presión. La caída de presión es mayor si el diámetro interior de la membrana capilar es más pequeño, lo que se explica por la famosa ley de Hagen-Poiseuille, como se ilustra en la Fig. 5.
Figura 5. El gradiente de presión en los dializadores aumenta la convección.
La caída de presión que induce el flujo a través de una membrana, en términos de arrastre por solvente, se puede modificar de diversas maneras: se puede aumentar la longitud del dializador, con lo cual aumenta la caída de la presión y aumenta la filtración; se puede aumentar la viscosidad de la sangre usando eritropoyetina, que aumenta el número de eritrocitos y con un hematocrito de 40 ó 45 la sangre es más viscosa que con uno de 20, de modo que los pacientes que reciben cantidades grandes de eritropoyetina tienen mayor caída de presión en el dializador y mayor flujo convectivo; también se puede aumentar el flujo sanguíneo, de 300 a 400 ml por ejemplo, con lo que se logra lo mismo, mayor caída en la presión y mayor ultrafiltración. Dicho de otra manera, si se pretende hacer terapia convectiva no tiene sentido usar un flujo sanguíneo de 250 o 200 ml, se debe usar 350, 400 y hasta 500 ml; por último se debe considerar el radio de la membrana capilar, que tiene un poder de cuatro, de modo que una mínima reducción en el diámetro interior de la membrana capilar tiene un impacto enorme en la caída de la presión. En la Fig. 6 se observa el efecto de este fenómeno en moléculas grandes, como urea, creatinina, fósforo, vitamina B12 e inulina: una pequeña disminución en el diámetro de la membrana capilar produce un aumento de 100% en el clearance de vitamina B12 e inulina.
Todos estos efectos se pueden lograr por medio de modificaciones técnicas. Con esta base, la empresa Fresenius decidió reducir el diámetro de las fibras en todos sus dializadores nuevos y fomentar el uso de flujos convectivos, para mejorar la remoción de las toxinas urémicas.
Por otra parte, el aumento del flujo sanguíneo tiene un claro efecto sobre la remoción de inulina, de peso molecular 5.200, tal como se observa en la Fig. 7: si aumenta el volumen de filtración de 6 a 12 litros, la remoción de inulina aumenta al doble; por tanto, lo que se debe hacer es, simplemente, aumentar la ultrafiltración a través de la membrana. Cuando se habla sobre la diálisis aguda se repite continuamente que es necesario remover grandes volúmenes, sin que se aclare por qué: ¿es sólo para sacar agua, o es porque el agua arrastra consigo otras cosas? En realidad, la hemofiltración, o la HDF, aguda es una forma de arrastre por solvente, es decir, retira grandes volúmenes para retirar moléculas de toxinas; por tanto, si se dispone de membranas capilares, dispositivos y filtros, se debe hacer HDF.
Figura 7. Flujo de filtrado y clearance. Membranas de alto flujo Psu (F60) (6).
Los primeros equipos de HDF, a fines de los 60, tenían gran cantidad de botellas con fluido de sustitución, todas las cuales debían contener agua ultra pura, lo cual no es barato. Desde entonces se ha trabajado en mejorar los equipos de HDF; el resultado de estos avances es la HDF en línea, cuyos principios se resumen en la Fig. 8: el fluido de hemodiálisis pasa por osmosis reversa, se agregan concentrados, hay un primer filtro de endotoxinas, porque el agua debe ser purificada, y se divide en dos; una parte va al dializador y la otra va a un contenedor y de ahí directamente al paciente, como fluido de sustitución. Es obvio que éste debe estar extremadamente purificado, para no infundir ni siquiera trazas de endotoxina, por lo que el agua debe ser ultra pura. Para ello se hace pasar por lo que aparece en el esquema como filtro de endotoxina II.
Figura 8. Principios de la HDF en línea.
Figura 9. Clearance de beta-2-microglobulina durante la HDF on-line según el flujo. Qf = flujo (8).
Lo anterior se ha confirmado con observaciones de la tasa de reducción (Kt/V) de la beta-2-microglobulina, que es mayor con la HDF en línea (9). También se ha comparado la remoción de los productos AGE unidos a proteínas, que son productos finales de la glicosilación, ciertamente en los rangos de peso molecular más alto, y se ha comprobado claramente que la HDF en línea es superior a la diálisis normal (10). Asimismo, se ha demostrado que los síntomas intradialíticos son menores con la HDF en línea; en el estudio de Altieri, todos los síntomas observados: hipotensión, hipertensión, arritmias, disnea, calambres, cefalea, prurito, náuseas y vómitos, fueron significativamente menos frecuentes con la HDF que con la diálisis de flujo alto convencional (11). Por tanto, existe un impacto clínico real con el uso de la HDF.
El control de la anemia también es mejor con la HDF; está comprobado que los pacientes que utilizan esta técnica necesitan menos eritropoyetina (12). Bonomini, en Italia, planteó que esto se debe a que el eritrocito tiene una gran cantidad de fosfatidilserina en la cara citoplasmática de su membrana, mientras que por la cara externa tiene fosfatidilcolina. Si la membrana se altera la fofatidilserina se trasloca hacia el exterior, lo que indicaría que algo anda mal. Bonomini incubó eritrocitos con ultrafiltados provenientes de diferentes técnicas de diálisis: hemodiálisis, HDF y HDF en línea, y observó que el ultrafiltrado de la HDF en línea es el que tiene mayor efecto tóxico, porque es el que produce mayor traslocación de la fosfatidilserina hacia la superficie externa de la membrana del eritrocito; por lo tanto, la HDF en línea evita la traslocación de la fosfatidilserina causada por las toxinas, previniendo el daño a los glóbulos rojos, puesto que, como las toxinas se encuentran en el ultrafiltrado, significa que fueron removidas desde la sangre. Esto demuestra, también, que existe una toxicidad que afecta directamente al eritrocito produciendo su degradación y que si esta toxicidad se remueve en forma efectiva, habrá menos anemia y se necesitará menos eritropoyetina (13). Una vez más se comprueba que, si se hacen las cosas correctamente, es fácil reducir los problemas; por ejemplo, se puede disminuir la necesidad de eritropoyetina (Fig. 10).
Finalmente, se ha demosrado que el producto calcio/fosfato es más elevado con la hemodiálisis de flujo bajo que con la HDF en línea (14).
Figura 11. Remoción de endotoxinas por membranas polisulfonadas.
También se ha estudiado la capacidad de absorción del lípido A, parte principal de la molécula de endotoxina y se ha visto que en situación de flujo bajo, las polisulfonas adsorben más lípido A y más lipopolisacáridos de P. aeruginosa que otras membranas. Algo similar sucede con los dializadores de flujo alto: muestran alta capacidad adsortiva (18). La razón de ello es que la mayoría de las membranas actuales tienen una estructura de dominios; no son polímeros puros, con una superficie homogénea, sino que tienen dominios correspondientes a anillos benceno, que son los que fijan la endotoxina, como se ve en la fotografía (Fig. 12).
Figura 12. Estructura de dominio de las modernas membranas de diálisis.
El otro punto importante, en lo que se refiere a seguridad, es la pérdida de albúmina, que se va a producir si las membranas se abren mucho. Observando la pérdida de albúmina en relación a la remoción de beta-2-microglobulina u otra molécula, se puede ver que las membranas se comportan de manera diferente, dependiendo del tamaño y la geometría de los poros. En la Fig. 13 se ve claramente que algunas membranas eliminan adecuadamente la beta-2-microglobulina, pero también pierden gran cantidad de albúmina. Por eso, es fundamental limitar las membranas por debajo de 65.000 de peso molecular, para que la albúmina no pueda pasar.
Figura 13. Pérdida de beta-2-microglobulina y albúmina en membranas de alto flujo (19).
Figura 14. Funciones proteicas de las membranas biológicas (22).
La edición y publicación de esta conferencia han sido posibles gracias al auspicio de Fresenius Medical Care
Medwave Año VII No. 3 Abril 2007. Derechos Reservados.

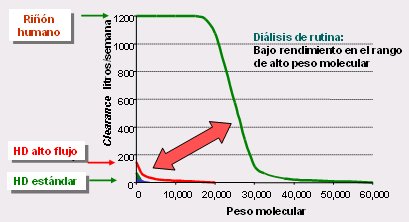 Figura 1. Clearances del riñón humano y artificial: ¿Cómo reducir la brecha? (2)
Figura 1. Clearances del riñón humano y artificial: ¿Cómo reducir la brecha? (2)

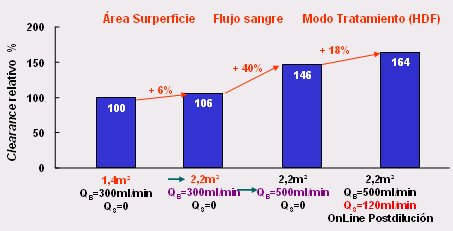 Figura 2. Dializadores y clearance de urea in vivo (3).
Figura 2. Dializadores y clearance de urea in vivo (3).

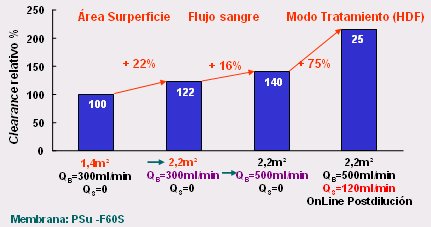 Figura 3. Dializadores y clearance de beta-2-microglobulina in vivo (3).
Figura 3. Dializadores y clearance de beta-2-microglobulina in vivo (3).

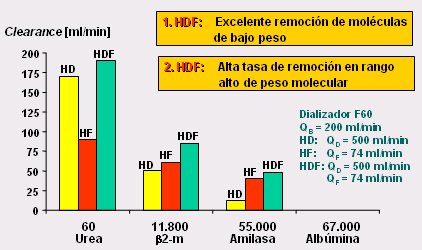 Figura 4. Beneficios de la HDF (4).
Figura 4. Beneficios de la HDF (4).

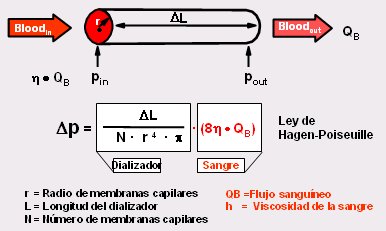 Figura 5. El gradiente de presión en los dializadores aumenta la convección.
Figura 5. El gradiente de presión en los dializadores aumenta la convección.

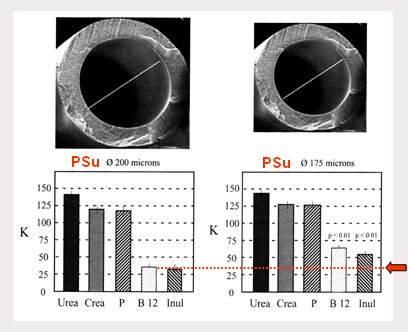 Figura 6. Diámetro interno de los capilares de la membrana y clearance de moléculas grandes. Dializador Psu, A: 0,5 m2 (5).
Figura 6. Diámetro interno de los capilares de la membrana y clearance de moléculas grandes. Dializador Psu, A: 0,5 m2 (5).

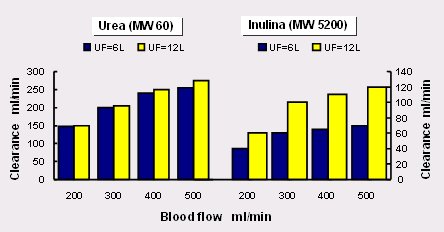 Figura 7. Flujo de filtrado y clearance. Membranas de alto flujo Psu (F60) (6).
Figura 7. Flujo de filtrado y clearance. Membranas de alto flujo Psu (F60) (6).

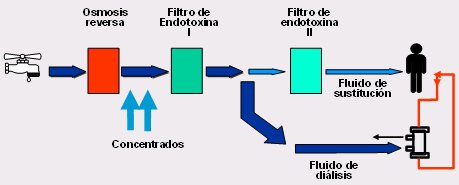 Figura 8. Principios de la HDF en línea.
Figura 8. Principios de la HDF en línea.

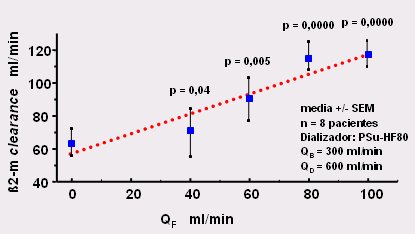 Figura 9. Clearance de beta-2-microglobulina durante la HDF on-line según el flujo. Qf = flujo (8).
Figura 9. Clearance de beta-2-microglobulina durante la HDF on-line según el flujo. Qf = flujo (8).

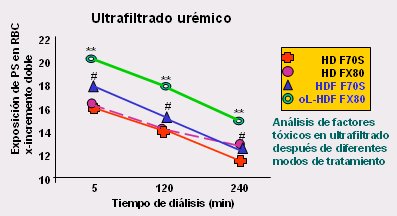 Figura 10. Eritrocitos y fosfatidil-serina (PS). Los factores urémicos del plasma inducen la exposición de la PS en la superficie del glóbulo rojo (RBC). n = 8. (13).
Figura 10. Eritrocitos y fosfatidil-serina (PS). Los factores urémicos del plasma inducen la exposición de la PS en la superficie del glóbulo rojo (RBC). n = 8. (13).

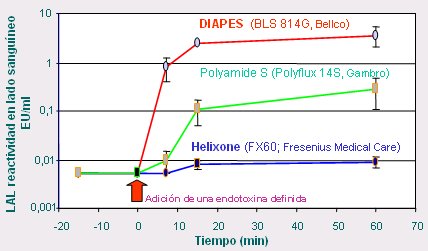 Figura 11. Remoción de endotoxinas por membranas polisulfonadas.
Figura 11. Remoción de endotoxinas por membranas polisulfonadas.

 Figura 12. Estructura de dominio de las modernas membranas de diálisis.
Figura 12. Estructura de dominio de las modernas membranas de diálisis.

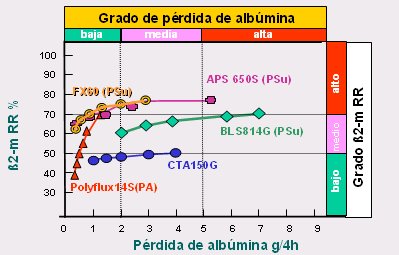 Figura 13. Pérdida de beta-2-microglobulina y albúmina en membranas de alto flujo (19).
Figura 13. Pérdida de beta-2-microglobulina y albúmina en membranas de alto flujo (19).

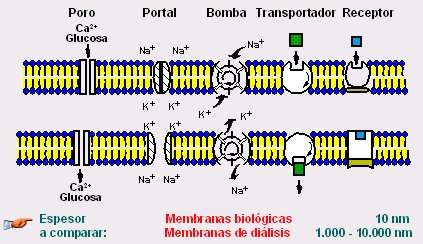 Figura 14. Funciones proteicas de las membranas biológicas (22).
Figura 14. Funciones proteicas de las membranas biológicas (22).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, Simposio Fresenius, realizado en Valdivia entre los días 4 y 7 de octubre de 2006. El evento fue organizado por la Sociedad Chilena de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores.
 Expositor:
Jörg Vienken[1]
Expositor:
Jörg Vienken[1]

Citación: Vienken J. Line hemodiafiltration to enhance the removal of uremic toxins and optimize the treatment of end stage renal failure and acute renal failure. Medwave 2007 Abr;7(3):e1034 doi: 10.5867/medwave.2007.03.1034
Fecha de publicación: 1/4/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión