 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por las Sociedades Chilenas de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores.
El principal objetivo de esta exposición es establecer que este método de diálisis es una buena alternativa para el manejo de la insuficiencia renal aguda (IRA), en especial en los países en desarrollo, como Brasil. La IRA es una patología muy común en pacientes internados en unidades de cuidados intensivos (UCI) y es un marcador de mortalidad, principalmente cuando requiere diálisis. El estudio de Clermont (1) demostró que los pacientes con IRA, sin diálisis, presentan mayor mortalidad que los pacientes sin insuficiencia renal y que los insuficientes renales crónicos (IRC) en diálisis. La IRA con necesidad de diálisis se asocia con mayor mortalidad (Fig. 1).
Figura 1. IRA e IRC en Unidad de Cuidados Intensivos (1).
En las últimas décadas ha habido gran progreso en el conocimiento de los mecanismos de la IRA, pero poco se ha traducido en medidas clínicas que permitan prevenir la insuficiencia o acelerar la recuperación de la función renal, de manera que el manejo actual de la IRA sigue siendo el soporte clínico y la diálisis.
La definición adecuada de la diálisis es compleja y no está claro cuándo es el momento adecuado para indicarla, tampoco las dosis ni el método que se deben utilizar, a tal punto que algunos autores plantean que el principal método de diálisis en la IRA es aquel en que el equipo médico tiene más experiencia. En los estudios sobre este tema se ha visto que las terapias continuas son las preferidas en todo el mundo y que en América Latina y Europa se realiza diálisis peritoneal (DP) en alrededor de 20% de los pacientes con IRA (2). En cambio, en los Estados Unidos se realiza muy poca DP: el trabajo de Metha demostró que 35% de los centros de diálisis estadounidenses nunca realizaron este tipo de diálisis (Tabla I).
Tabla I. Métodos de diálisis que se utilizan en los Estados Unidos (3).
En el Brasil también se utiliza la DP. Datos del Hospital Sao Paulo demuestran que en 2000 se realizó este tipo de diálisis en cerca de 20% de los pacientes agudos; y en el hospital de Botucatu, en ese mismo año, se hizo DP a alrededor de 40% de los pacientes de este tipo (Fig. 2).
Figura 2. Métodos de diálisis que se utilizan en el Brasil (4).
En 2006 se publicó una revisión, en Renal Failure, en la que se evaluó la DP en la IRA y se revisaron aspectos históricos de la DP en la IRA (5). En la década de 1970 la diálisis se realizaba con catéter rígido, en forma intermitente y manual; algunos trabajos de ese tiempo demostraron que esta diálisis era efectiva y comparable a la hemodiálisis intermitente (5). En la década de 1980, con la introducción del catéter flexible, la diálisis se empezó a hacer en forma continua y automática, y algunos estudios demostraron que era superior a la hemodiálisis intermitente (6, 7). En la década de 1990, la diálisis peritoneal (DP) fue sustituida por la hemodiálisis intermitente y diaria y, principalmente, por las terapias continuas. Entre las causas de la caída en la utilización de la DP están los avances técnicos en la hemodiálisis (HD); el hecho de que en algunos trabajos se comprobó que no se lograba el control de la uremia (8); las grandes pérdidas proteicas (9) y las complicaciones infecciosas, principalmente las peritonitis (10). Por tal motivo, hay pocos trabajos recientes en la literatura sobre la DP en la IRA y han surgido algunos conceptos sobre el tema sin base científica: por ejemplo, que la DP está indicada sólo en niños y posterior a cirugía cardiaca, o que la DP no es adecuada en los pacientes graves y con gran catabolismo.
Para confirmar o reafirmar esos conceptos, en 2002 se publicó, en New England Journal of Medicine, un trabajo de Phu y colaboradores en el que se evaluó la hemofiltración y la DP en IRA asociada con infección, en 36 pacientes con DP y 34 pacientes con hemofiltración; el estudio se interrumpió por los malos resultados obtenidos en el grupo de pacientes con DP, cuyos parámetros fueron muy inferiores a los de los pacientes con hemofiltración, algunas horas después de iniciado el procedimiento. Además, el riesgo relativo de muerte fue de 3,2 en el grupo con DP. Los autores concluyeron que la DP no está indicada en la IRA (11). Sin embargo, otros autores analizaron estos resultados y observaron que la DP se efectuó con técnica de la década de 1970, es decir, con catéter rígido, sistema abierto y cambios excesivos (2 litros cada media hora) y que, en cambio, la hemofiltración se realizó con técnicas más modernas, con acceso venoso femoral, flujos adecuados y una cantidad de hemofiltrado de 25 litros al día. Además, en el estudio de Phu no se hacía referencia a las dosis de diálisis utilizadas en los grupos (11). Por tanto, la duda sobre la utilidad de la DP en IRA no se ha resuelto.
En ese mismo año, se publicó en Kidney International un trabajo de Chitalia y colaboradores, en el que se evaluó la DP en pacientes en países en desarrollo, concretamente, en India. También fue un estudio prospectivo; se estudió a 87 pacientes portadores de IRA de diferentes etiologías y catabolismo leve o moderado; se dividieron en 2 grupos: uno con DP continua (DPC) y otro DP tidal (DPT); se utilizó catéter flexible y se efectuó diálisis automática por ciclador; el objetivo del trabajo no fue evaluar la evolución de los pacientes, sino los métodos de diálisis. Los autores planificaron una DPC con volumen inicial de infusión de dos litros, sin volumen de reserva, 4 horas de duración del ciclo, 48 horas de tiempo total por sesión, 12 cambios por sesión y un volumen total de dializado de 26 litros por sesión. Para la DP tidal también el volumen inicial de infusión fue de dos litros, pero con volumen de reserva de 1.325 ml, con ciclos de 20 minutos de duración, 12 horas de tiempo por sesión, 36 cambios por sesión y también un volumen total de dializado de 26 litros por sesión. Los pacientes sometidos a DP tidal presentaron valores más bajos de BUN postdiálisis, valores mayores de KT/V por sesión y semanal, y mayor índice de remoción de solutos (IRS) y ultrafiltración en litros, por sesión; pero también mostraron mayor pérdida proteica total y de albúmina (Tabla II). Los autores concluyeron que tanto la DPC como la DPT fueron opciones razonables para pacientes con IRA y catabolismo leve o moderado, y que los resultados fueron superiores con la DPT.
Con base en estos resultados y en la experiencia local en DP, el grupo de Botucatu realizó un trabajo dirigido a evaluar la DP en la IRA, utilizando grandes volúmenes de dializado. El objetivo fue evaluar los resultados de la DPC como tratamiento de la IRA, en cuanto a: controles metabólicos y de volumen, dosis de diálisis prescrita y recibida, complicaciones clínicas y evolución de los pacientes. El protocolo contempló evaluación nefrológica y exclusión de los portadores de insuficiencia renal crónica; luego se indicaba la DPC y el catéter flexible era implantado por nefrólogos. Se prescribió la DPC automática con una estimación de peso (balanza digital o fórmula de 2 variables) y de volumen (promedio entre fórmula fisiológica y fórmula de Watson), con KT/V de 0,65 por sesión y sesiones de 24 horas de duración. Tras cada sesión de DPC se realizó evaluación clínica y con exámenes de laboratorio, tanto en sangre, con creatinina, urea, potasio, gasometría diaria y proteínas totales, y albúmina cada 3 días, como en el dializado, con creatinina y urea diarias y proteínas totales y albúmina cada 3 días. También se calculó la depuración de creatinina y de urea, además del KT/V y el IRS. El protocolo terminaba con la suspensión de la DPC cuando se cumplían los criterios de recuperación de la función renal: diuresis mayor de un litro en 24 horas, creatinina menor de 4 mg/dl y urea menor de 100 mg/dl; o bien, cuando se requería cambio de método de diálisis, cuando la diálisis se mantenía por más de 30 días o en caso de muerte del paciente. En la Tabla III se resume la prescripción de las sesiones.
Tabla III. Prescripción de las sesiones (16).
Se evaluó a 30 pacientes; 67% eran hombres; el promedio de edad fue de 59 años; 76% de los pacientes estaban en la Unidad de Cuidados Intensivos; el APACHE II fue de 32,2 ± 8,6; la enfermedad principal fue la sepsis (53%); la IRA fue mixta en 50% de los pacientes e isquémica en 30%; 70% de los pacientes presentaron oliguria. Las principales indicaciones de diálisis fueron la uremia y la hipervolemia. La duración del tratamiento fue de 6 días en promedio. Se consiguió el control de los niveles de urea y creatinina a partir de la tercera sesión de DP, con niveles de urea de alrededor de 6 mg/dl y de creatinina de alrededor de 4 mg/dl (Fig.3).
Figura 3. Evolución de los niveles de urea y creatinina.
En cuanto al equilibrio ácido-básico, se consiguió el control del bicarbonato y el pH a partir de la segunda sesión de diálisis, los que se mantuvieron estables a partir de entonces; en cuanto al potasio, se dividió a los pacientes en dos grupos: con potasio elevado y con potasio normal al inicio de la DP, y en los dos grupos se logró control de los niveles de potasio a partir de la tercera sesión de diálisis, los que permanecieron así hasta el final del seguimiento. En relación a la ultrafiltración, se objetivó un ultrafiltrado medio de 2 a 2,5 litros en cada sesión; y en cuanto a la adecuación, se consiguió una depuración de creatinina de 15,8 ml por minuto y por sesión, depuración de urea de 17 ml/minuto y por sesión, y KT/V prescrito de 0,65 por sesión y 4,5 semanal. El KT/V recibido fue de 0,55 por sesión, 3,8 semanal, con IRS de 41%, valores más elevados que todos los que se han descrito en la literatura hasta el momento. En cuanto a la pérdida de proteínas en el dializado, los pacientes sin ascitis ni peritonitis perdieron 20 gramos de proteínas totales y 3 gramos de albúmina; en los pacientes con ascitis o peritonitis las pérdidas fueron mayores, pero no hubo alteración de los niveles de albúmina de los pacientes, que se mantuvieron en 2,5 a 3 g/dl. Respecto a las complicaciones, no las hubo en dos tercios de los pacientes; 17% de ellos presentaron peritonitis y 7% tuvieron complicaciones mecánicas. La mortalidad fue de 57% y hubo recuperación de la función renal en 23% de los casos (Fig. 4).
Figura 4. Complicaciones y evolución de los pacientes.
En este estudio se concluyó que: la DPC en la IRA fue efectiva para lograr el control metabólico y de volumen de los pacientes; la utilización de gran volumen de dializado permitió la utilización de elevadas dosis de diálisis, con KT/V semanal de 3,8 e IRS sobre 40%; la incidencia de complicaciones fue pequeña y la mortalidad fue semejante a la descrita en la literatura. Por lo tanto, la DPC sería una alternativa de tratamiento de la IRA, comparable con otros métodos dialíticos (5).
Es muy difícil comparar el resultado de los métodos dialíticos en la IRA, de modo que se encuentran pocos trabajos que comparen la hemodiálisis intermitente con las terapias continuas, pero en los que se han hecho no se han encontrado diferencias entre ambas modalidades o bien, los resultados no han sido concluyentes. Por otra parte, hasta el año 2006 no se había hecho ningún estudio comparativo de la hemodiálisis con la DPC. Por este motivo, el grupo de Botucatu realizó un estudio para comparar la DPC y la hemodiálisis diaria (HDD) en la evolución de pacientes con IRA, en cuanto a control metabólico, complicaciones clínicas, mortalidad y recuperación de la función renal. Fue un estudio clínico prospectivo, aleatorio, en el que participaron 120 pacientes divididos en dos grupos: grupo 1, compuesto por 60 pacientes tratados con HDD, y grupo 2, compuesto por 60 pacientes tratados con DPC, entre enero de 2004 y diciembre de 2006, todos mayores de 18 años.
Los pacientes recibieron una sesión de HDD de 3 horas o una sesión de 24 horas de DPC. La metodología fue similar a la del trabajo anterior: evaluación nefrológica, descarte de los pacientes con IRC, selección de los pacientes con indicación de diálisis, inclusión aleatoria en el grupo HDD o DPC, implantación del catéter por el propio nefrólogo y empleo de catéter de doble luz en la HDD, y flexible en la DPC. La prescripción de la diálisis se realizó con KT/V de 1,2 en el grupo de HDD y de 0,65 por sesión, en el grupo que recibió DPC. Tras cada sesión de diálisis se realizó evaluación clínica, exámenes de laboratorio semejantes al protocolo anterior y cálculo del KT/V recibido, con los mismos criterios para la suspensión de la diálisis. Para la DPC se instaló un catéter flexible en la fosa ilíaca izquierda y se utilizó ciclador; para la HDD se utilizaron catéteres doble luz en vena yugular interna o vena subclavia. En el momento de esta exposición había 54 pacientes en el grupo 1 (HDD) y 59 pacientes en el grupo 2 (DDP). Las características de estos pacientes (Tabla IV) fueron semejantes: predominio de hombres; edad de 56 a 60 años; volúmenes de 34 a 35 litros; la mayor parte eran oligúricos; casi todos estaban internados en UCI, con APACHE II 24 a 26; se realizaron, en promedio, 6 sesiones por paciente y por grupo, y los valores de urea prediálisis fueron semejantes.
A continuación se resume la distribución de los pacientes según distintos parámetros:
Según la enfermedad de base, en los dos grupos hubo predominio de sepsis y de causas isquémicas, principalmente insuficiencia cardiaca congestiva. De acuerdo a la etiología de la IRA, hubo predominio de la IRA mixta y la IRA por isquemia, en ambos grupos. En cuanto a las indicaciones de diálisis, las principales fueron la uremia, la hipervolemia o ambas, tanto en el grupo de HDD como en el de DPC. Respecto a los niveles de creatinina sérica, en los dos grupos hubo una caída progresiva de los valores de creatinina, con estabilización en los 4 a 4,5 mg/dl, a partir de la cuarta sesión de diálisis, en ambos grupos (Fig. 5). La urea disminuyó en forma progresiva desde el inicio de la diálisis, con estabilización en alrededor de 6 mg/dl, a partir de la tercera sesión, en los dos grupos. El potasio se controló a partir de la primera o segunda sesión de diálisis, tanto peritoneal como hemodiálisis. En relación con el equilibrio ácido-básico, se controlaron los niveles de bicarbonato y pH, a partir de la primera o segunda sesión de diálisis, en los dos grupos. En cuanto a las dosis de diálisis por sesión y semanal, en el grupo 1 se prescribió un KT/V por sesión de 1,2 y el KT/V recibido fue 0,73; el KT/V semanal prescrito fue de 6,6 y el KT/V recibido, 4,38. En el grupo 2 los valores fueron más bajos, con KT/V por sesión prescrito de 0,65 y recibido de 0,54; y semanal prescrito de 4,5, con recibido de 3,76 (Tabla V).
Figura 5. Creatinina sérica de acuerdo con las sesiones.
Tabla V. Dosis de diálisis por sesión y semanal.
En dos tercios de los casos no hubo complicaciones, en ambos grupos. Las complicaciones infecciosas ocurrieron en 7,5% de los pacientes del grupo en que se usó hemodiálisis y en 19% de los pacientes del grupo DPC. Hubo complicaciones mecánicas en solamente 7,35%, en el grupo HDD, y 2,2% del grupo DPC. Más importante fue la evolución de los pacientes conforme al método dialítico: la mortalidad en los dos grupos fue de 60%, sin diferencias estadísticas entre ellos, y se logró la recuperación de la función renal en 20% a 25% de los pacientes, también en los dos grupos (Fig. 6).
Figura 6. Evolución de los pacientes conforme el tratamiento dialítico.
Las conclusiones que se han obtenido hasta ahora con este estudio prospectivo de pacientes con IRA son las siguientes: primero, la HDD y la DPC son eficaces para lograr el control metabólico, con elevada dosis de diálisis recibida y complicaciones poco frecuentes; segundo, la mortalidad y la recuperación renal observadas son semejantes a los datos de la literatura, sin diferencia estadística entre los grupos. Por lo tanto, la DPC es un método de diálisis comparable a la HDD en el tratamiento de pacientes con IRA (5).
La diálisis peritoneal todavía se utiliza en la IRA, pero hay pocos estudios sobre sus resultados. La diálisis peritoneal está indicada como opción terapéutica en grupos seleccionados de pacientes. Se debe efectuar de modo continuo y automático, con grandes volúmenes de dializado. Hay espacio para aumentar el uso de la diálisis peritoneal en la IRA.

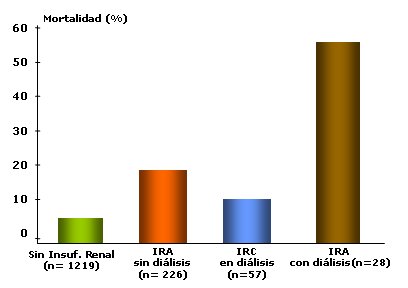 Figura 1. IRA e IRC en Unidad de Cuidados Intensivos (1).
Figura 1. IRA e IRC en Unidad de Cuidados Intensivos (1).

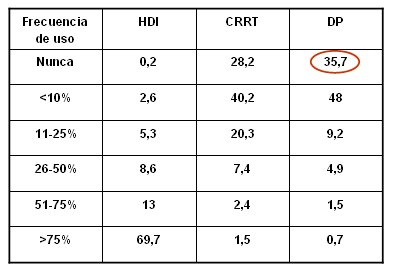 Tabla I. Métodos de diálisis que se utilizan en los Estados Unidos (3).
Tabla I. Métodos de diálisis que se utilizan en los Estados Unidos (3).

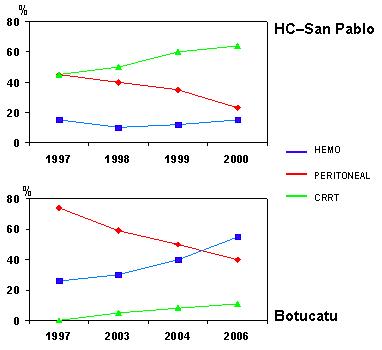 Figura 2. Métodos de diálisis que se utilizan en el Brasil (4).
Figura 2. Métodos de diálisis que se utilizan en el Brasil (4).

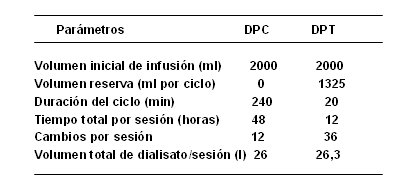 Tabla II. Diálisis peritoneal continua y tidal en pacientes con IRA. Resultados en 87 pacientes (15).
Tabla II. Diálisis peritoneal continua y tidal en pacientes con IRA. Resultados en 87 pacientes (15).

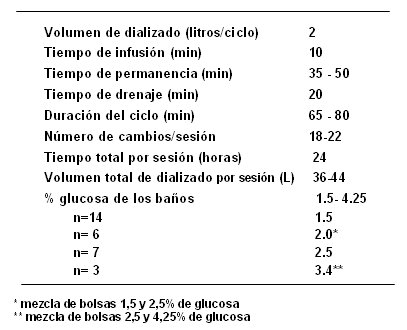 Tabla III. Prescripción de las sesiones (16).
Tabla III. Prescripción de las sesiones (16).

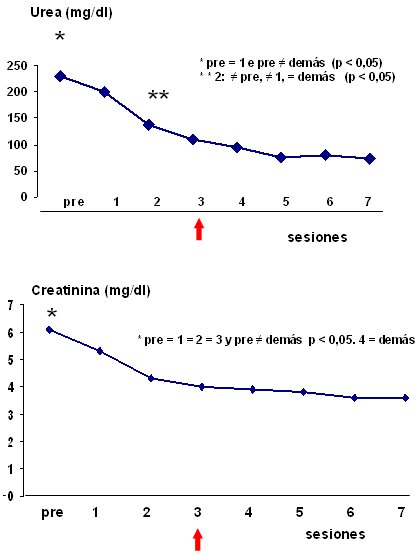 Figura 3. Evolución de los niveles de urea y creatinina.
Figura 3. Evolución de los niveles de urea y creatinina.

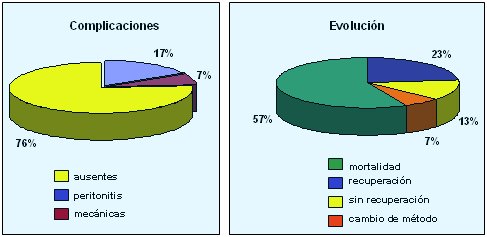 Figura 4. Complicaciones y evolución de los pacientes.
Figura 4. Complicaciones y evolución de los pacientes.

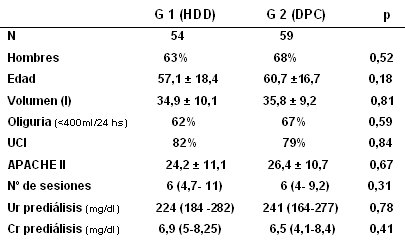 Tabla IV. Comparación entre diálisis peritoneal continua y hemodiálisis diaria en la evolución de pacientes con IRA: características de los grupos (16).
Tabla IV. Comparación entre diálisis peritoneal continua y hemodiálisis diaria en la evolución de pacientes con IRA: características de los grupos (16).

 Figura 5. Creatinina sérica de acuerdo con las sesiones.
Figura 5. Creatinina sérica de acuerdo con las sesiones.

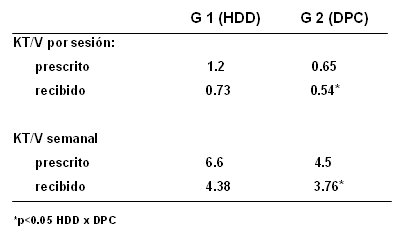 Tabla V. Dosis de diálisis por sesión y semanal.
Tabla V. Dosis de diálisis por sesión y semanal.

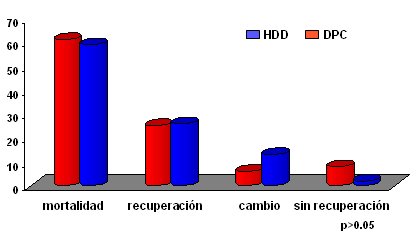 Figura 6. Evolución de los pacientes conforme el tratamiento dialítico.
Figura 6. Evolución de los pacientes conforme el tratamiento dialítico.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del Congreso Conjunto de Nefrología, Hipertensión y Trasplante 2006, realizado en Valdivia entre los días 4 al 7 de octubre de 2006. El evento fue organizado por las Sociedades Chilenas de Nefrología, Hipertensión y Trasplante. Secretaria Ejecutiva: Dra. Patricia Herrera. Secretario Ejecutivo Local: Dr. Claudio Flores.
 Expositor:
André Balbi[1]
Expositor:
André Balbi[1]

Citación: Balbi A. Role of peritoneal dialysis in the treatment of acute renal failure. Medwave 2007 May;7(4):e1031 doi: 10.5867/medwave.2007.04.1031
Fecha de publicación: 1/5/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Clermont G, Acker CG, Angus DC, Sirio CA, Pinsky MR, Johnson JP. Renal failure in the ICU: comparison of the impact of acute renal failure and end-stage renal disease on ICU outcomes. Kidney Int. 2002 Sep;62(3):986-96. | CrossRef | PubMed |
Clermont G, Acker CG, Angus DC, Sirio CA, Pinsky MR, Johnson JP. Renal failure in the ICU: comparison of the impact of acute renal failure and end-stage renal disease on ICU outcomes. Kidney Int. 2002 Sep;62(3):986-96. | CrossRef | PubMed | Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005 Aug 17;294(7):813-8. | CrossRef | PubMed |
Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA. 2005 Aug 17;294(7):813-8. | CrossRef | PubMed | Mehta RL, Letteri JM. Current status of renal replacement therapy for acute renal failure. A survey of US nephrologists. The National Kidney Foundation Council on Dialysis. Am J Nephrol. 1999;19(3):377-82. | CrossRef | PubMed |
Mehta RL, Letteri JM. Current status of renal replacement therapy for acute renal failure. A survey of US nephrologists. The National Kidney Foundation Council on Dialysis. Am J Nephrol. 1999;19(3):377-82. | CrossRef | PubMed | Balbi A. Rol de la diálisis peritonial en el tratamiento de la insuficiencia renal aguda (IRA). SAVALnet. [on line] | Link |
Balbi A. Rol de la diálisis peritonial en el tratamiento de la insuficiencia renal aguda (IRA). SAVALnet. [on line] | Link | Posen GA, Luisello J. Continuous equilibration peritoneal dialysis in the treatment of acute renal failure. Perit Dial Bull. 1980;1:6.
Posen GA, Luisello J. Continuous equilibration peritoneal dialysis in the treatment of acute renal failure. Perit Dial Bull. 1980;1:6.  Steiner RW. Continuous equilibration peritoneal dialysis in acute renal failure. Perit Dial Int. 1989;9(1):5-7. | PubMed |
Steiner RW. Continuous equilibration peritoneal dialysis in acute renal failure. Perit Dial Int. 1989;9(1):5-7. | PubMed | Lewandowski L. Developing collaborative partnerships between inpatient nephrology and outpatient dialysis units. Adv Ren Replace Ther. 1995 Oct;2(4):371-2. | PubMed |
Lewandowski L. Developing collaborative partnerships between inpatient nephrology and outpatient dialysis units. Adv Ren Replace Ther. 1995 Oct;2(4):371-2. | PubMed | Mehta RL, Letteri JM. Current status of renal replacement therapy for acute renal failure. A survey of US nephrologists. The National Kidney Foundation Council on Dialysis. Am J Nephrol. 1999;19(3):377-82. | CrossRef | PubMed |
Mehta RL, Letteri JM. Current status of renal replacement therapy for acute renal failure. A survey of US nephrologists. The National Kidney Foundation Council on Dialysis. Am J Nephrol. 1999;19(3):377-82. | CrossRef | PubMed | Blumenkrantz MJ, Kopple JD, Moran JK, Grodstein GP, Coburn JW. Nitrogen and urea metabolism during continuous ambulatory peritoneal dialysis. Kidney Int. 1981 Jul;20(1):78-82. | CrossRef | PubMed |
Blumenkrantz MJ, Kopple JD, Moran JK, Grodstein GP, Coburn JW. Nitrogen and urea metabolism during continuous ambulatory peritoneal dialysis. Kidney Int. 1981 Jul;20(1):78-82. | CrossRef | PubMed |