Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
A continuación se tratarán las nuevas tecnologías que están en desarrollo y todavía no se pueden adquirir en el comercio especializado.
La misión de todo endoscopista es observar para encontrar una patología o bien tranquilizar al paciente, informándole que no se ven lesiones potencialmente malignas; pero en los últimos años la tecnología ha cambiado dramáticamente. Antes, la atención se centraba en úlceras o cánceres; hoy, en cambio, se intenta identificar lesiones menores. La endoscopía se ha unido al mundo de los instrumentos y tratamientos mínimamente invasivos.
La endoscopía convencional de luz blanca tiene varias limitaciones: aunque la tendencia dominante actual es descubrir lesiones pequeñas e identificar la displasia, por ejemplo, en la enfermedad de Barrett, que está muy de moda, y también en el estómago, especialmente en un país como Chile, donde el cáncer gástrico es muy frecuente. Con el método convencional a menudo es difícil identificar la displasia. Por otra parte, si se encuentran múltiples protuberancias pequeñas en el colon, es difícil definir si corresponden a hiperplasia o adenoma y, por lo tanto, es difícil determinar lo que hay que remover y lo que hay que dejar indemne. Tampoco permite detectar recurrencias iniciales en las cicatrices de resecciones anteriores y, en enfermedades que comprometen áreas extensas de la mucosa, como el esófago de Barrett y la colitis ulcerosa, la única manera de encontrar una displasia es mediante un protocolo de biopsias al azar, lo que significa tomar numerosas muestras. En cáncer esofágico, la nueva tecnología no se dirige a encontrar lesiones grandes, que se pueden pesquisar al ojo desnudo; la mayor atención se concentra en encontrar lesiones pequeñas, sutiles, cuyo gran problema es el de ser asintomáticas. Por otra parte, cuando se encuentra una lesión, las técnicas disponibles actualmente producen visiones aberrantes de las criptas.
El desarrollo tecnológico debe permitir encontrar lo invisible, sin riesgo de equivocarse; obtener un mapa del área que se va a explorar, lo que ha llevado a acuñar el concepto linterna. Este concepto se refiere a que se puedan identificar fácilmente las áreas al observar el interior del esófago, estómago y colon; efectuar un biopsia óptica focalizada, es decir, que una vez que se identifique el área se pueda estudiar una muestra, pero sin necesidad de extraerla; determinar la etapa y profundidad de la lesión; y, finalmente, decidir si se va a efectuar una ablación endoscópica o alguna intervención biológica.
La mayor atención ahora se aplica a mejorar la detección de lesiones displásticas planas y pequeñas, pero el avance de las nuevas tecnologías ha dejado en evidencia que el problema fundamental está más en el ojo que en la técnica. Aunque se desarrollen nuevos videos o nuevos aumentos, lo más importante es acrecentar nuestra capacidad de observación, puesto que, en la mayoría de los casos, las lesiones por las cuales se va a utilizar un equipo que cuesta decenas de miles de dólares ya están al alcance de la percepción del ser humano, si éste utiliza apropiadamente su vista y su cerebro.
La endoscopía de luz blanca con biopsia se puede efectuar, en la actualidad, mediante dos técnicas generales: la de gran amplitud y la focal. La endoscopía amplia se puede facilitar mediante la cromoendoscopía (regular o con magnificación); la autofluorescencia (de imágenes o monoclonal); o la proyección de imagen de banda angosta (Narrow Band Imaging o NBI). Luego, una vez que se encuentra la lesión, se puede utilizar la técnica focal para obtener una biopsia óptica, que puede ser confocal, endocitoscopía o tomografía de conferencia óptica, la que entrega una imagen microscópica que se ve en la pantalla. Probablemente, se deberá obtener primero una imagen y luego la otra. Sin embargo, cabe preguntarse si las nuevas técnicas de escaneo de gran amplitud, es decir, la autofluorescencia y la de banda angosta, van a reemplazar una técnica barata y disponible sin dificultad en todas partes, como es la técnica de tinción con aerosol.
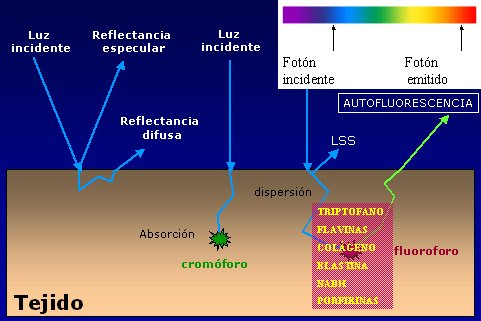
La autofluorescencia se usa desde hace mucho tiempo: es la luz que se utiliza en los endoscopios corrientes, emitida por una fuente de luz de cierta longitud de onda, luz azul, la que reacciona con un producto químico llamado fluoróforo, gracias al cual la luz sale con una longitud de onda mayor; la diferencia entre las dos longitudes de onda entrega información relativa a la patología.
Figura 1. Bases de la autofluorescencia: interacción de la luz con los tejidos
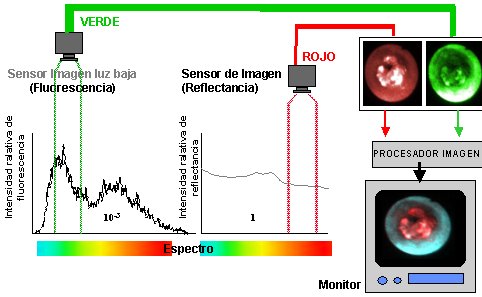
La primera imagenología fluorescente que funciona con fibra óptica la fabricó una firma canadiense y se puede adquirir en Canadá y en Europa, pero el futuro está en el video chip, que Olympus y Pentax han lanzado al mercado. En esencia, ambos sistemas utilizan una cámara o un chip; se ilumina la superficie con luz, habitualmente azul, y se recogen las imágenes con la cámara o el chip en el rango verde; se obtiene una imagen de color verde o bien se detecta lo que se denomina la reflectancia roja, en el rojo; luego, un procesador entrega un pseudocolor en tiempo real. Algunos colores significan lesión benigna o normal y otros, generalmente los rojos, indican la presencia de lesión maligna.
Figura 2. Esquema del modo fluorescencia de Xillix Onco-LIFE (R)
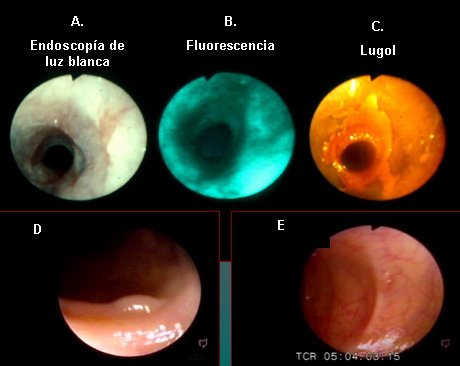
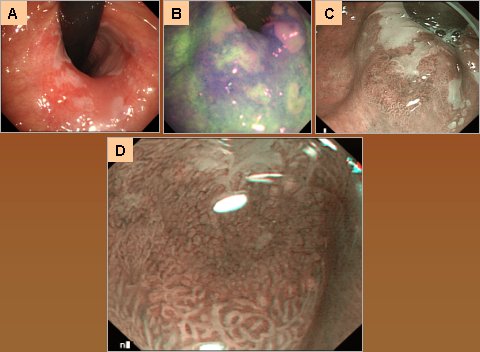
En la Figura 3, en la parte superior, se muestra un esófago escamoso visto con endoscopía tradicional (A); a la derecha, la tinción con lugol, que muestra un área de displasia que se tiñe negativamente (C); y al centro, lo mismo con fluorescencia, sin la necesidad de hacer tinción con aerosol (B). En la misma figura se muestra, abajo, un pólipo pequeño que puede ser un adenoma o un pólipo hiperplástico; la fluorescencia es normal, lo que significa que es un pólipo hiperplástico y no es necesario removerlo (D); y a la derecha se observan pequeñas protuberancias que bajo la fluorescencia se ven de color rojo; por lo tanto, se trata de adenomas múltiples que se pueden detectar y determinar si se trata de neoplasias, en cuyo caso hay que extraerlos, o de hiperplasias, de las cuales se puede hacer caso omiso (E).
Figura 3. Observación de lesiones esofágicas con distintas técnicas (explicación en el texto)
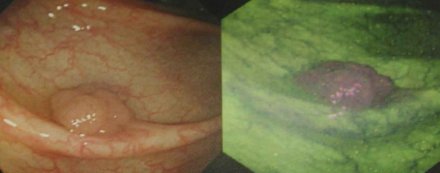
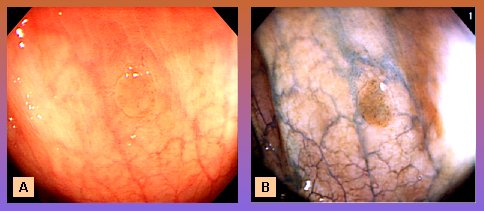
La técnica desarrollada por Olympus (Fig.4) tiene una fórmula distinta y colores distintos, pero el resultado es el mismo. A la izquierda se observa un pequeño adenoma con luz blanca (A); a la derecha se muestra la misma lesión con el sistema Olympus, que confirma la presencia del adenoma y da un fondo sombreado de verde (B). Así, la imagenología autoflorescente tiene varias ventajas: permite ver con rapidez y precisión amplias áreas de mucosa; identifica las áreas displásticas planas con seguridad, en especial en el colon; no requiere el uso de tinciones; y mejora la detección de lesiones pequeñas y la precisión diagnóstica de hiperplasia versus adenoma, en 39% de los casos, en comparación con la luz blanca. La desventaja es que puede dar falsos positivos en los pacientes con inflamación crónica, es decir, justamente en el grupo de pacientes en quienes no debiera haber falsos positivos, que son los que sufren de Barrett y colitis ulcerosa de larga data.
Figura 4. Endoscopía y video con autofluorescencia, sistema Olympus (explicación en el texto)
Una nueva tecnología aparecerá muy pronto; es probable que dentro de un año se puedan adquirir electro-endoscopios para efectuar imagenología de banda angosta, en la cual se separan los diferentes componentes de la luz blanca. La luz azul tiene muy poca penetración y otorga una buena identificación de la microvasculatura de la mucosa; la parte roja del espectro, cuya longitud de onda es mayor, tiene mayor penetración, pero deja ver menos detalles de la mucosa superficial (Fig. 5).
Figura 5. Profundidad de la penetración de las distintas longitudes de onda
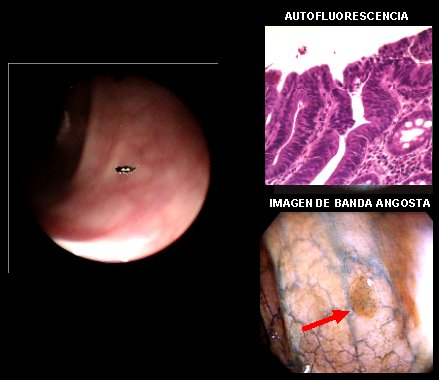
La combinación de la endoscopía de luz blanca (WLE, White Light Endoscopy), la endoscopía de autofluorescencia (AFI, Autofluorescence endoscopy) y la de banda angosta (NBI, Narrow-Band Imaging) (Fig. 6) es útil para pesquisar displasia de alto grado (HGD) en la vigilancia de un paciente con esófago de Barrett. En A se ven islas escamosas y una zona que parece anormal; con la fluorescencia (B) se ve claramente una zona anormal (lo verde es normal, con el sistema Olympus); con banda angosta (C) se observa una anomalía estructural y se puede ver la densidad de la microvasculatura de la lesión; por último, con la máquina Olympus de banda angosta y con aumento (D) se observa con notable detalle la presencia de células pequeñas e irregulares que corresponden a una displasia. Lo anterior permite biopsiar, mapear, remover y curar.
La combinación de la endoscopía de luz blanca (WLE, White Light Endoscopy), la endoscopía de autofluorescencia (AFI, Autofluorescence endoscopy) y la de banda angosta (NBI, Narrow-Band Imaging) (Fig. 6) es útil para pesquisar displasia de alto grado (HGD) en la vigilancia de un paciente con esófago de Barrett. En A se ven islas escamosas y una zona que parece anormal; con la fluorescencia (B) se ve claramente una zona anormal (lo verde es normal, con el sistema Olympus); con banda angosta (C) se observa una anomalía estructural y se puede ver la densidad de la microvasculatura de la lesión; por último, con la máquina Olympus de banda angosta y con aumento (D) se observa con notable detalle la presencia de células pequeñas e irregulares que corresponden a una displasia. Lo anterior permite biopsiar, mapear, remover y curar.
Figura 6. Combinación de endoscopía de luz blanca, autofluorescencia y banda angosta en la pesquisa de displasia de alto grado durante la vigilancia de un paciente con esófago de Barrett (explicación en el texto)
Otro ejemplo (Fig. 7) es el de una colonoscopía, en la que se observan los vasos sanguíneos y se puede ver que con imagenología de banda angosta: la microvasculatura es mucho más nítida y se puede ver un adenoma pequeño.
Figura 7. Colonoscopía convencional (A) comparada con NBI con aumento (B)
Para la exploración amplia, lo que se denomina linterna, tanto la fluorescencia como la NBI funcionan bien en el colon y el esófago escamoso; ninguna de las dos requiere tinciones, de modo que se podrían realizar rápidamente; pero hasta ahora no hay estudios comparativos y también aumenta el riesgo de falsos positivos en presencia de enfermedades inflamatorias crónicas de esófago (Barrett) y colon. Se espera que estén disponibles en el comercio dentro de los dos a tres próximos años.
Un campo nuevo, del que muchos se preguntan si llegará algún día a tener utilidad práctica en el ejercicio de la endoscopía, es la que se denomina biopsia óptica con exploración focal, en la cual primero se debe encontrar la lesión y luego efectuar una imagen de la microestructura del tejido a nivel de histopatología, o próximo a ese nivel, sin necesidad de extraer un trozo de tejido para que lo examine el patólogo. También se ha dado a este procedimiento el nombre de histología virtual in-vivo. Hay tres tecnologías para aplicar este sistema, pero ninguna de ellas está disponible en el comercio y no está claro si lo estarán algún día; ellas son: la fluorescencia confocal, la endocitoscopía y la tomografía de coherencia óptica (OCT, Optical Coherence Tomography). Todas estas tecnologías examinan una superficie de menos de 1 mm².
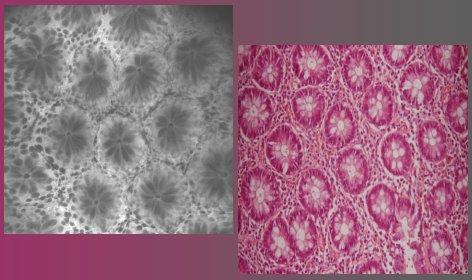
La endoscopía de fluorescencia confocal es la técnica más avanzada en el momento actual; la fabrica Pentax y consiste en un endoscopio convencional que lleva incorporado un sistema de imagenología confocal fijo. Se necesita un medio de contraste endovenoso, que por lo general es fluoresceína, el mismo compuesto que usan los oftalmólogos. Entrega secciones tomográficas múltiples hasta de un cuarto de milímetro, es decir, de un tamaño pequeñísimo. En la Figura 8 se compara una biopsia de recto normal con hematoxilina eosina, en fucsia, y con el sistema confocal, en gris; y en la Figura 9, con fluoresceína, se observan las células y las criptas separadas, con gran detalle. Hasta ahora esto se realiza sólo en algunos centros; nosotros no lo tenemos. Es probable que en el futuro esta técnica desempeñe un papel importante en el estudio de las enfermedades intestinales.
Figura 8. Biopsia de recto normal con hematoxilina eosina (en fucsia) y con el método confocal (en gris)
Figura 9. Endoscopía de fluorescencia confocal
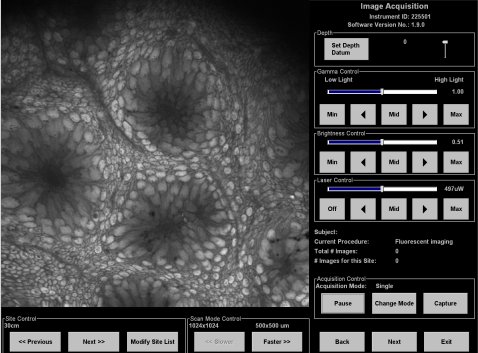
La Figura 10 ilustra lo que se ve con el endocitoscopio de Olympus. Se observan células escamosas separadas, se ve su núcleo, con aumento de 1100x y se ven las células de Barrett y criptas. El tiempo dirá si esta técnica va a servir para realizar un diagnóstico histológico específico, pero es el tipo de tecnología que se está promoviendo con ese objetivo.
Figura 10. Endocitoscopía
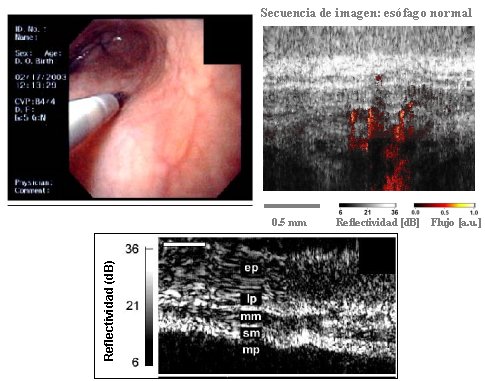
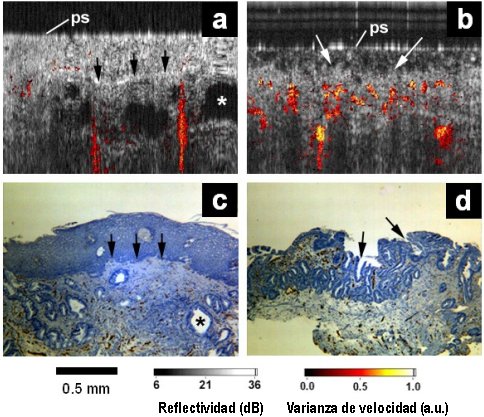
En nuestro Centro se ha desarrollado un sistema propio de tomografía de coherencia óptica denominado Doppler OCT, con el que se obtienen imágenes de sección transversal sub-superficiales de alta resolución; el concepto es similar al del ultrasonido, excepto que se utilizan modelos de interferencia de luz. La técnica permite ver la histología con una resolución de 10 a 20 micrones y una profundidad de 1,5 mm; se puede ver la muscularis mucosa, de modo que en un paciente con Barrett, en quien se sospeche una displasia, permitiría hacer el diagnóstico y, lo que es más importante, determinar la profundidad de la lesión. Ninguna otra tecnología entrega una imagen de la muscularis mucosa como la que se obtiene con esta técnica, ni en esófago normal (Fig. 11) ni en el de Barrett (Fig. 12). Por ahora, el procedimiento todavía no tiene la calidad suficiente para asegurar que hay una displasia y que el paciente necesita una endoscopía o una intervención quirúrgica, pero es probable que, si se logra perfeccionarlo, en el futuro será la forma ideal de diagnosticar y etapificar la enfermedad de la mucosa.
Figura 11. Doppler OCT en esófago normal
Figura 12. Doppler OCT en esófago de Barrett
La biopsia óptica con histología in vivo es una excelente tecnología, pero tiene los siguientes inconvenientes: requiere una histología virtual primero (conofocal); enfoca sólo una superficie diminuta, por lo tanto no se puede escanear el esófago o el colon con este dispositivo, porque el examen tardaría un año; exige que se haya descubierto la lesión previamente; tiene una curva de aprendizaje; el movimiento interfiere con los resultados; y todavía no se ha determinado cuál es la mejor profundidad (50, 250 o 2000 micrones). Se necesita, entonces, un tipo de tecnología que permita identificar las zonas sospechosas para luego examinarlas en profundidad, lo que probablemente se va a conseguir en los próximos cinco años.
Analicemos las siguientes interrogantes: ¿mejorarán estas técnicas, en especial la biopsia óptica, la detección de displasias ocultas en áreas afectadas por el Barrett o la colitis ulcerosa? ¿Nos guiarán en forma eficaz para hacer la biopsia? ¿Nos permitirán eliminar la necesidad de hacer biopsia? Se puede responder que todavía no hay ningún dispositivo comercial que se pueda utilizar en forma habitual en endoscopía, o sea, estas técnicas no están listas para debutar.
En conclusión, la primera prioridad es mejorar la detección de displasia mediante la exploración amplia, lo que probablemente se va a lograr, en cuanto al colon, con la técnica de banda angosta o la autofluorescencia; sobre el esófago no se puede decir nada aún y sobre el estómago no hay datos disponibles, dada la escasez de estudios multicéntricos. El procedimiento ideal (Fig. 13) sería utilizar la técnica de fluorescencia o de banda angosta, y luego obtener la histología. Los endoscopistas de las nuevas generaciones deberán determinar hacia dónde se debe avanzar.
Figura 13. Procedimiento ideal para la detección de displasias














 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
 Expositor:
Norman Marcon[1]
Expositor:
Norman Marcon[1]

Citación: Marcon N. Photodiagnostic techniques: ready for debut?. Medwave 2006 Ago;6(7):e1025 doi: 10.5867/medwave.2006.07.1025
Fecha de publicación: 1/8/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión