Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005.
Presidente del Congreso: Dr. Claudio Navarrete.
A continuación se tratará la importancia de los factores genéticos en la enfermedad inflamatoria intestinal (EII), los genes que participan y las evidencias que se encuentran en la literatura sobre el papel del NOD2/CARD15, entre otros genes.
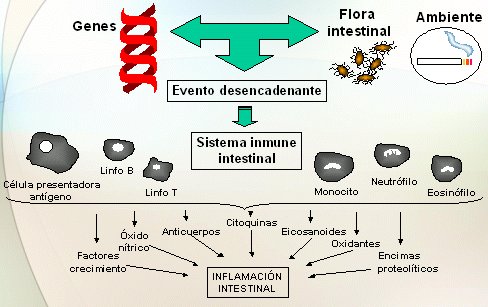
La genética no tendría sentido si no tuviera utilidad práctica; por ejemplo, saber que los pacientes con enfermedad de Crohn presentan más mutaciones en el NOD2 y las investigaciones genéticas en Crohn y colitis ulcerosa no tendrían sentido, si no se pudiera obtener desde esa información un índice predictivo para el paciente que permitiera saber si va a presentar alguna complicación o si va a responder a determinado fármaco. La causa del Crohn y de la colitis ulcerosa no se conoce, pero se sabe que su fisiopatología se sustenta en tres puntos fundamentales: un antecedente o predisposición genética; una serie de factores ambientales, como la flora intestinal y el tabaco, que favorecen el desarrollo del Crohn y protegen de colitis ulcerosa; y un episodio desencadenante. Es decir, es preciso que sobre un sujeto genéticamente predispuesto actúe una serie de factores para que las células del sistema inmune se desrregulen y se altere la síntesis de mediadores de la inflamación, lo que va a generar lesión tisular (Fig. 1).
Figura 1. Fisiopatología de la Enfermedad Inflamatoria Intestinal
Numerosas evidencias en la literatura plantean que los factores genéticos predisponen a algunos sujetos a presentar Crohn o colitis ulcerosa; algunas de ellas proceden de estudios de agregación familiar; otras, de estudios con gemelos; otra evidencia es que el Crohn y la colitis ulcerosa son más frecuentes en ciertas etnias, como los judíos Askhenazi; también está el hecho de que estas enfermedades se asocian con otras que tienen un claro componente genético y una relación conocida con el complejo mayor de histocompatibilidad, como la espondiloartritis anquilosante, la psoriasis y la esclerosis múltiple. El estudio sistemático del genoma ha demostrado que algunos puntos de éste tienen una clara asociación con Crohn o colitis ulcerosa y en modelos animales de colitis ulcerosa se ha demostrado que los genes son importantes.
En cuanto a la agregación familiar, se sabe que en torno a un paciente índice hay alrededor de 20% de probabilidades de encontrar un pariente de segundo o tercer grado con el problema, lo que prueba con fuerza la importancia de los genes, porque dicho porcentaje es mucho mayor que la prevalencia que se observa en la población general. Varios estudios han demostrado que hay concordancia, es decir, si el paciente índice tiene Crohn, es probable que el pariente afectado tenga enfermedad de Crohn y lo mismo ocurre con la colitis ulcerosa. También hay concordancia en cuanto a la localización, extensión, fenotipo y comportamiento de la enfermedad.
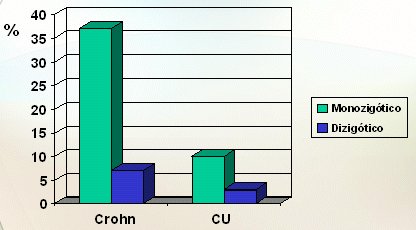
La anticipación genética es muy clara, es decir, la enfermedad de los hijos de un caso índice tiende a manifestarse antes, lo que sería una nueva prueba que apoya la importancia de los genes, aunque aún es controvertida. El riesgo relativo de los hermanos de pacientes con enfermedad de Crohn es mayor de 20 y sobre 10, en el caso de la colitis ulcerosa, superior a otras enfermedades en las que se sabe que el componente genético es importante, como la diabetes mellitus y la esquizofrenia. En estudios realizados en gemelos se puede ver que, sobre todo en el caso de la enfermedad de Crohn, si los gemelos son monocigóticos la probabilidad de que el segundo esté afectado es mayor de 35%; en cambio, en los gemelos dicigóticos, si bien el riesgo también aumenta, lo hace en menor grado y lo mismo ocurre, aunque en forma menos significativa, en la colitis ulcerosa (Fig. 2).
Figura 2. Estudios de concordancia en gemelos (Tysk C, Gut 1988; Orholm M, Gut 1996; Thompson NO, BMJ 1996)
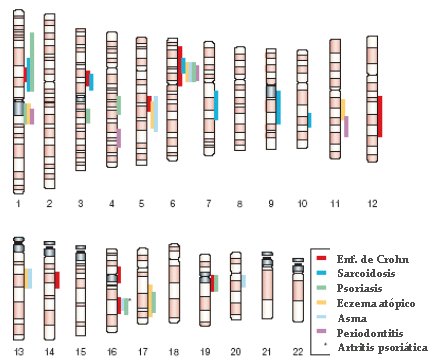
En cuanto al estudio sistemático del genoma humano, en un gráfico complejo (Fig. 3) se han marcado las regiones en las que se han detectado genes o material genético asociados con diversas enfermedades.
Figura 3. Estudio sistemático del genoma humano para localizar genes responsables de enfermedades (Schreiber S, Nature Reviews Genetics)
Los modelos que se utilizan en experimentación animal confirman que los genes son importantes en el desarrollo de inflamación intestinal; por ejemplo, en animales knockout para la interleuquina (IL) 2, el fenotipo de la lesión intestinal se asemeja a colitis ulcerosa; el animal knockout para la IL-10 tiene un fenotipo de ileocolitis parecido al de la enfermedad de Crohn; y los animales en los que se bloquea el receptor TCR alfa/beta tienen un fenotipo parecido al de la colitis microscópica.
El gen NOD2/CARD15 tiene siete mutaciones, de las cuales tres son las que más se han estudiado y se asocian en forma importante con la enfermedad de Crohn. Buen número de estudios demuestran que si el sujeto es heterocigoto, es decir, si presenta uno de los dos alelos mutados para NOD2, el riesgo de desarrollar enfermedad de Crohn aumenta entre 1,5 y 3 veces; si el sujeto es homocigoto y tiene los dos alelos para esa mutación, o si es un heterocigoto compuesto, o sea, tiene dos mutaciones, la probabilidad de desarrollar esta enfermedad es mucho más alta, alrededor de 20 a 40 veces.
Las mutaciones en el NOD2 se encuentran en 10% a 20% de la población general, pero, en los estudios realizados en su mayoría en países europeos, la probabilidad o la frecuencia con que se encuentran mutaciones en los enfermos de Crohn es cercana a 40%, aspecto que se debe considerar cuando se realizan estudios de genética en la EII: el antecedente genético varía mucho según la zona geográfica. Por ejemplo, en Asia prácticamente no hay mutaciones del NOD2 y son menos frecuentes en los países escandinavos del norte de Europa. Todos los estudios demuestran que es un factor importante y que, cuando está presente, aumenta claramente el riesgo de desarrollar enfermedad de Crohn.
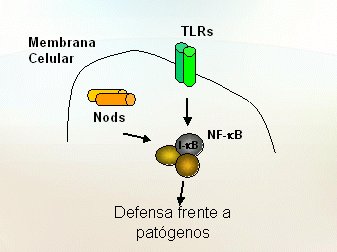
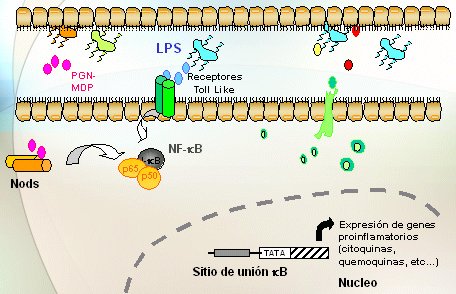
En cuanto a cómo estas mutaciones terminan en enfermedad, no está claro aún. Las células utilizan dos sistemas para responder a los microorganismos (Fig. 4): los receptores intracelulares denominados NODs y unos receptores denominados Toll-Like Receptors (TLR) que están en la superficie celular y que sirven para reconocer productos bacterianos. Unos y otros transmiten señales que activan el factor de transcripción NF kappa B, lo que echa a andar diversos mecanismos que protegen el organismo de los patógenos que se han detectado. En el lumen intestinal normal (Fig. 5) hay una multitud de bacterias; MDP es el muramildipéptido, una fracción de la bacteria; el lipopolisacárido (LPS) es otra fracción; los receptores NOD están dentro de la célula y los Toll-Like en su superficie. Lo normal es que los NOD reconozcan el MDP y los receptores Toll Like reconozcan los LPD, y que ambos induzcan la activación del factor de transcripción NF kappa B. Lo anterior significa que la fracción inhibidora se va a separar y se va a degradar; en cambio, la fracción activa va a migrar hacia el núcleo, donde causará un aumento de la expresión de genes para sintetizar las citoquinas y quemoquinas que causarán la inflamación.
Figura 4. Mecanismos de respuesta a microorganismos
Figura 5. Respuesta inmune intestinal normal
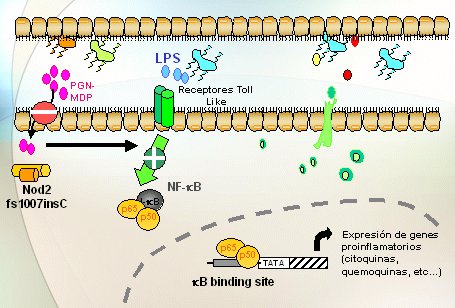
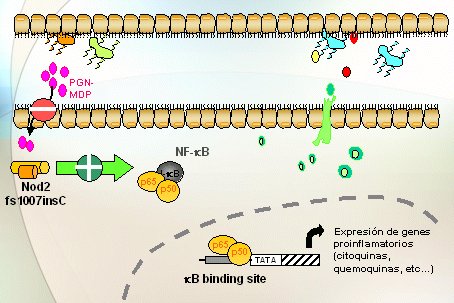
Cuando en vez de los alelos wildtype o normales hay variantes o mutaciones en el gen NOD2, hay menos reconocimiento o el reconocimiento es más difícil por parte del NOD, del MDP y a partir de ahí hay varias hipótesis: es posible que esto determine menos efecto, pero que haya un feedback, una especie de acción refleja debido a la cual la otra vía, la de los Toll Like, señaliza mucho más y, por lo tanto, todo conduzca a mayor activación del NF kappa B y mayor síntesis de quemoquinas (Fig. 6). Otros autores piensan lo contrario; que cuando el NOD2 está mutado, lleva a la activación del NF kappa B y de la síntesis de citoquinas proinflamatorias por otras vías (Fig.7).
Figura 6. Las variantes de NOD2 ¿significan pérdida de respuesta? (Watanabe et al, Nature Immunology 2004)
Figura 7. Las variantes de NOD2 ¿significan aumento de la respuesta? (Maeda S et al, Science 2005)
Muchos trabajos han demostrado que la mutación en el gen NOD2 se asocia con mayor riesgo de Crohn y que además las mutaciones influyen en el comportamiento de la enfermedad, aspecto importante en la clínica. Se ha publicado que algunas mutaciones de NOD2 se asocian con la localización de la enfermedad en el íleon, con el fenotipo estenosante y, probablemente, también con el fenotipo fistulizante, aunque hay menos datos.
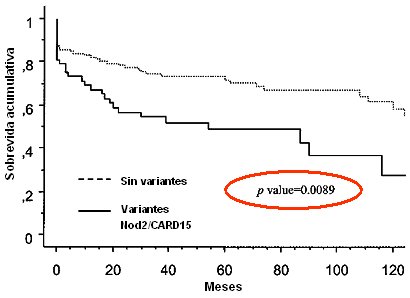
En un trabajo publicado recientemente por Alvarez-Lobos se analizó la relación entre las mutaciones del NOD2 y el riesgo de que estos pacientes requieran cirugía. La probabilidad de cirugía a cinco años (Fig. 8) es mucho mayor que la de los pacientes que no presentan mutaciones en el NOD2. En cuanto a la causa de cirugía, los pacientes con mutaciones en el gen NOD2 tienen 23% de probabilidad de necesitar cirugía por estenosis, lo que constituye el triple de los pacientes con Crohn que no presentan estas mutaciones. No hay diferencia cuando la cirugía se debe a fístulas, abscesos o fracaso del tratamiento médico. La sobrevida sin cirugía por estenosis es el parámetro que presenta mayor diferencia: si no hay mutaciones en el gen NOD2, la probabilidad de presentar estenosis que lleven a cirugía es muy baja, pero cuando existen dichas mutaciones, el riesgo sube al triple. Este concepto no sólo se aplica a la primera cirugía, también es válido para el riesgo de que se requiera una segunda intervención (Alvarez-Lobos MD et al, Ann Surg 2005; 242: 693-670).
Figura 8. Probabilidad actuarial de permanecer sin cirugía de acuerdo con el estado de los genes Nod2/CARD15
Muchos otros genes intervienen, ya que la familia de los NOD tiene numerosos elementos. Recientemente se publicó un estudio en el que se encontró una relación entre NOD1 (CARD4) (7p14) y mayor riesgo de desarrollar enfermedad de Crohn y otras enfermedades de base inmunológica, como el asma bronquial o el eczema atópico (McGovern D et al Hum Mol Genet 2005; 14:1245-50). Por otra parte, los receptores Toll Like son importantes para detectar lo que ocurre en el interior del intestino y la presencia de componentes bacterianos. Se conoce un gran número de cada uno de estos receptores, cada uno de los cuales reconoce diferentes componentes bacterianos o virales; se conocen los genes que codifican estos TLR; y una serie de datos demuestran que determinadas mutaciones en los TLR se asocian con mayor riesgo, ya sea de Crohn o de colitis ulcerosa.
La asociación entre mutaciones en el sistema HLA y el riesgo de Crohn o colitis ulcerosa se conoce hace más de 15 a 20 años. Se han descrito varios alelos HLA que se asocian con mayor riesgo de colitis ulcerosa y de Crohn, y no sólo eso: hay información interesante respecto al comportamiento de la enfermedad. El alelo DRB1/0103 es mucho más frecuente en colitis ulcerosas graves, en las que requieren cirugía y en las que se asocian con manifestaciones extraintestinales.
Recientemente se estudió el factor genético DLG5 (Discs Large Homolog 5)-R30Q, gen que tiene que ver con la integridad epitelial, y se observó que los sujetos que muestran esta mutación tendrían mayor riesgo de desarrollar enfermedad de Crohn (Stoll M et al Nat Genet. 2004; 36: 476-80), resultados que se reprodujeron en dos estudios realizados en Canadá e Italia (Daly M et al Eur J Hum Genet 2005). Con todo, comunicaciones más recientes señalan que no se logró reproducir estos resultados, por lo que sería un factor importante en ciertas áreas, pero no en otras, lo que confirma la heterogeneidad genética según área geográfica (Noble CL Gut 2005; Torok HP Gut 2005; Vermeire S Gastro 2005 en prensa; Waller S DDW 2005). El factor OCTN (Novel Organic Cation Transporter) tiene que ver con el transporte de cationes.
En estudios sistemáticos del genoma se observó que en esta región existía un gen importante y hace poco se describió que OCTN 1 y 2 podrían originar mayor riesgo de enfermedad de Crohn (Rioux JD Nat Genet 2001; 29:223-28; Peltekova Nat Genet 2004; 36: 471-5). Por último, el factor genético 4G/4G PAI-1 se asocia con el fenotipo fistulizante del Crohn, según lo plantean los resultados de un estudio realizado en el hospital clínico de Barcelona, en el que se observó que los sujetos que poseen este fenotipo tienen alta probabilidad de desarrollar fístulas o abscesos posteriormente.
Los estudios de genotipo pueden ser muy útiles, porque si un paciente tiene este factor genético y, por lo tanto, está en riesgo superior a 50% ó 70% de desarrollar fístulas, se puede plantear un tratamiento diferente; o sea, este conocimiento puede predecir el curso clínico, desarrollo de complicaciones y respuesta a fármacos, lo que conduce al concepto del IBDchip. La necesidad de hacer un panel genético que permita leer muchos genes al mismo tiempo se suscita, primero, porque Crohn y colitis son dos enfermedades heterogéneas, no sólo en lo que ocurre a nivel intestinal y en la actividad luminal, sino en cuanto a la presencia o ausencia de manifestaciones extraintestinales, pero, por desgracia, en la actualidad no se dispone de elementos pronósticos. Hoy, ante un debut de Crohn o de colitis ulcerosa, si el paciente pregunta si va a presentar o no un brote, una artritis, una uveítis o un eritema nodoso, no se le puede dar una respuesta. Por otra parte, muchos fármacos, con cierta frecuencia, causan efectos secundarios, y una proporción de pacientes no responde a tratamiento, pero no se puede saber quién va a responder y quién va a presentar efectos adversos.
Desde el punto de vista teórico, es interesante utilizar el DNA como herramienta que permita predecir estos hechos. Se debe tener en cuenta que estas enfermedades son poligénicas, pero, en los numerosos estudios que se han realizado hasta el momento, sólo se ha evaluado el valor predictivo de mutaciones individuales. Se trata de contar con un examen que permita leer y estudiar a un tiempo todos los factores genéticos que ejerzan una posible influencia en la EII, lo que sería de gran utilidad en la clínica.
El objetivo del chip de DNA (IBDchip) es desarrollar una herramienta para predecir el curso clínico, el riesgo de desarrollo de complicaciones y la probabilidad de respuesta a fármacos en pacientes con enfermedad de Crohn y colitis ulcerosa. Hay una base tecnológica para este proyecto, que se está realizando con la colaboración de una empresa biotecnológica al norte de España, en Bilbao, integrado a un parque tecnológico y de investigación, en Zamudio. El examen se compone de un chip de DNA con un soporte de cristal, en cuya superficie se coloca el material genético y se lee mediante tecnología láser, lo que permite hacer el análisis simultáneo hasta de 800 mutaciones en una sola medición. Esta empresa progénica tiene experiencia en el desarrollo de chips de DNA; anteriormente desarrolló el lipochip, que se utiliza en España en el estudio rutinario de la hipercolesterolemia familiar, y el bloodgen, para estudio de antígenos eritrocitarios de superficie, que está en desarrollo en los países europeos.
El IBDchip, en su primera versión, abarca 61 mutaciones localizadas en 40 genes diferentes. Estas mutaciones, que fueron obtenidas a partir de lo que se había publicado hasta el momento y se pusieron encima de un trozo de cristal, son las del NOD2, DLG5, MDR-1, OCTN, TUCAN, algunas de los Toll Like, etc.; en definitiva, 61 mutaciones procedentes de 40 genes. El chip no es más que un trozo de cristal sobre el cual se colocan, mediante un robot, pequeños fragmentos de DNA que van a detectar si existe o no la mutación. Este trozo de cristal tiene capacidad para albergar hasta 800 mutaciones. La muestra de un paciente determinado que se envía a analizar se amplifica, se marca, se hibrida y en la fluorescencia se ve la presencia o ausencia de la mutación; si es homocigoto, con los dos alelos mutados; si es heterocigoto o se trata de un homocigoto wildtype, es decir, sin ninguna de las dos mutaciones. Esto determina una serie de puntos luminosos que luego se analizan mediante un equipo especial. El concepto es que de una muestra de sangre o DNA por láser, este aparato determina si están o no presentes las 61 mutaciones; es una herramienta dinámica, ya que a medida que se vayan publicando, se puede ir añadiendo otras mutaciones.
En cuanto a los primeros resultados del IBDchip, se está preparando un estudio piloto para determinar hasta qué punto esta herramienta predice el curso clínico, desarrollo de complicaciones y respuesta a fármacos en pacientes con EII. El estudio se hará en unos 600 pacientes, la mayoría del Hospital Clínico Barcelona, pero también del Hospital Clínico Zaragoza, Hospital Central Asturias y Hospital Clínico Universitario Santiago; los pacientes deberán tener al menos cinco años de seguimiento, porque para predecir si desarrollarán estenosis, fístulas o si necesitarán cirugía, no sirven los pacientes con diagnóstico reciente, quienes podrían ser portadores de genes malignos que no han tenido tiempo para manifestarse.
Se dispone de datos preliminares de 342 pacientes del Hospital Clínico de Barcelona: 184 pacientes con enfermedad de Crohn y 158 con colitis ulcerosa. En la enfermedad de Crohn, el objetivo fue determinar la utilidad de esta herramienta para predecir extensión, fenotipo fistulizante, enfermedad perianal, fenotipo estenosante, necesidad de cirugía y manifestaciones extraintestinales, además de la respuesta a esteroides y a infliximab. En la colitis ulcerosa, se evaluó la posibilidad de predecir la extensión de la enfermedad, la necesidad de cirugía y las manifestaciones extraintestinales, además de la probabilidad de respuesta a esteroides y ciclosporina.
En el caso de fístulas en Crohn, entre 184 pacientes, 70 presentaron enfermedad de Crohn fistulizante. La idea es que esta herramienta debe ser muy específica: no importa que no los detecte a todos, quizás detecte sólo a la mitad, pero se debe evitar los falsos positivos, o sea, el examen debe ser positivo cuando sea muy probable que el episodio clínico suceda en ese paciente; con esta premisa y con una exigencia de especificidad superior a 90%, se detectó a 41% de los pacientes que desarrollaron fístula. En el caso de colectomía, la especificidad fue de 93% y el examen logró detectar más de 80%, o sea, 4 de cada 5 pacientes que acabaron necesitando colectomía. La conclusión es muy preliminar, pero el IBDchip permitiría identificar, con gran especificidad, una proporción importante de los pacientes con enfermedad de Crohn que presentarán fístulas, o de los pacientes con colitis ulcerosa que necesitarán colectomía. Falta terminar el estudio piloto y realizar otros, pero si fuera así, esta herramienta permitiría seleccionar pacientes de mayor riesgo, a quienes habría que tratar de manera más agresiva.
El desarrollo de esta herramienta no termina aquí. Además del estudio piloto con 600 pacientes españoles, hace poco se presentó un proyecto a la Comisión Europea, que se coordinará desde nuestro hospital y abarcará dos empresas Progenika, que son las que fabrican los chips, y la empresa francesa Innopsys, y cuyo objetivo es lograr que dentro de los tres próximos años el aparato láser sea cinco veces más pequeño, el doble de rápido y cueste la décima parte. En el consorcio toman parte personas de prestigio en enfermedad inflamatoria y genética, como Derek Jewell, de Inglaterra; Severine Vermeire, de Bélgica; Salvador Peña, de Holanda; Stephan Schreiber, de Alemania; Milan Lukas, de la República Checa; y Silvio Danese, de Italia. Se ha solicitado 2,5 millones de euros. Es un proyecto ambicioso, que contempla un total de 11 estudios pensados para 4.000 a 5.000 pacientes, con un seguimiento mínimo de 10 años. Con estos números se debería responder a la pregunta de si los genes serán útiles, en la práctica clínica, para identificar a los pacientes que van a requerir un tratamiento específico.








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005.
Presidente del Congreso: Dr. Claudio Navarrete.
 Expositor:
Miquel Sans[1]
Expositor:
Miquel Sans[1]

Citación: Sans M. Genetics and inflammatory bowel disease. Medwave 2006 Jul;6(6):e1021 doi: 10.5867/medwave.2006.06.1021
Fecha de publicación: 1/7/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión