Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
Por definición, la terapia biológica intenta utilizar estrategias de tratamiento determinadas que actúen sobre una molécula o un punto clave en la fisiopatología, sobre la base de que una terapia más específica tendría que ser más eficaz, o sea, más potente o con menor número de efectos perjudiciales, en comparación con los esteroides.
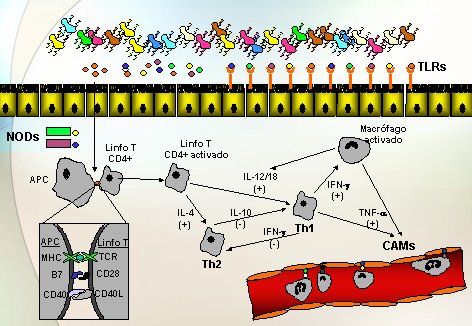
En la Figura 1 se resume la fisiopatología de la EII. En el lumen intestinal hay un gran número de bacterias (estimado en 10 en potencia de 9 a 12), con más de 40 especies y por tanto, un gran número de productos bacterianos, como el muramildipéptido (MDP) y los lipopolisacáridos (LPS), además de productos que provienen de la dieta. Para interactuar con estos productos y con las bacterias, y reconocer las comensales y las patógenas, hay dos formas de reconocimiento: los toll-like receptors, que están en la superficie, y la familia de los NOD, que son receptores intracelulares. Otro componente importante de la fisiopatología es un aumento de la permeabilidad; por una u otra vía habrá reconocimiento de antígenos por parte de las células presentadoras de antígenos (APC). Muchas moléculas actúan a este nivel, como CD-40 con CD-40L y B7 con CD-28, por tanto existe una serie de moléculas sobre las cuales se podría intervenir, que se están investigando en animales.
La interleuquina (IL) 4 es clave en la vía hacia TH2 y las IL 2 y 18, producidas por macrófagos, son clave para que el linfocito recién estimulado se dirija hacia TH1. A ese nivel se formará un círculo vicioso, en el que el linfocito produce interferón que activa los macrófagos y éstos, a su vez, producen IL-2 y 18 y se potencia la vía proinflamatoria o TH1; en cambio, la IL-10 tiene una potente actividad natural antiinflamatoria que bloquearía o inhibiría esa tendencia hacia el TH1. Las vías TH1 y TH2 se inhiben mutuamente. Otro episodio importante es la producción de mediadores como el TNF alfa, tanto por macrófagos como por linfocitos T, que producirán un aumento en la expresión de las CAM (moléculas de adherencia celular), tanto en el lado endotelial como en la superficie leucocitaria, por lo que los leucocitos circulantes podrán adherirse, emigrar y, una vez en el intersticio, cumplir un papel fundamental en la liberación de una serie de sustancias que contribuirán al daño.
Figura 1. Fisiopatología de la enfermedad inflamatoria intestinal
Las posibles estrategias de tratamiento tienen como objetivo modificar o actuar sobre tres tipos de moléculas diana: las citoquinas, los antígenos linfocitarios o las moléculas de adherencia.
Los datos sobre la eficacia de Infliximab, sobre todo en casos de enfermedad de Crohn, se conocen desde hace 10 años, pero fue el estudio de Targan el que demostró hasta qué punto el bloqueo del TNF alfa puede favorecer la recuperación de pacientes en quienes los esteroides han fracasado, situación que antes constituía indicación de cirugía de resección intestinal. Dicho estudio fue clave en la historia de Infliximab, ya que demostró que la tasa de respuesta y la inducción de la remisión, es decir, que el paciente quede sin síntomas y se normalice el índice CDAI, eran muy superiores en los pacientes tratados que en el grupo placebo, en pacientes refractarios a la terapia convencional. Desde ese momento, los pacientes con enfermedad de Crohn corticorresistente comenzaron a recibir tratamiento con Infliximab. Posteriormente se comprobó que la administración de tres dosis (en los días 0, 2 y 6) era mucho mejor que la dosis única de Infliximab, que había sido la estrategia inicial, para lograr la inducción de la remisión (Targan et al. N Engl J Med 1997).
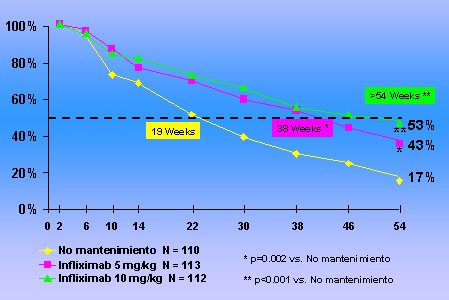
En cuanto al mantenimiento de la remisión (Fig. 2), los resultados del estudio multicéntrico Accent I, al final del año de tratamiento: en amarillo, los pacientes a quienes se administró una dosis inicial, sin ninguna dosis extra; en rosado, los que recibieron tratamiento inicial y luego una mantención con 5 g/kg de peso cada ocho semanas; y, en verde, los tratados con una dosis de 10 mg/kg de peso cada ocho semanas. Las dos estrategias de mantener periódicamente al paciente con Infliximab fueron muy superiores, en términos de mantener la remisión, que la estrategia de inducir la respuesta sin hacer el esfuerzo de mantenerla, en el plazo de un año. Si se analiza el tiempo que transcurre hasta que la mitad de los pacientes pierdan la respuesta, lo dicho sucede en forma muy rápida, a las 19 semanas, en los pacientes en quienes no se realiza mantenimiento, contra 38 a 54 semanas si se aplica esta estrategia.
Figura 2. Tratamiento de mantenimiento con Infliximab en enfermedad de Crohn de fenotipo inflamatorio: Estudio Accent I
En el estudio Accent I se plantearon una serie de objetivos secundarios, uno de los cuales fue determinar cuántos pacientes se mantienen bien sin utilizar esteroides; tanto en la semana 30 como en la 54; el porcentaje de pacientes que necesitaron esteroides fue menor entre los pacientes con mantenimiento sistemático con 5 mg/kg que entre los que no recibieron mantenimiento, y la diferencia fue mayor cuando se utilizó la dosis de 10 mg/kg de Infiblimax. Del mismo modo, la tasa de cicatrización y resolución de las lesiones en la endoscopía, otro hecho que se va a convertir en un objetivo clínico en los próximos años, también fue mayor en los pacientes mantenidos en forma sistemática.
Los pacientes con enfermedad de Crohn luminal con resistencia a esteroides son los primeros en beneficiarse con el uso de Infliximab, porque se evitan una cirugía que antes de este fármaco era obligatoria. En cuanto a lo que ocurre con el fenotipo fistulizante, es importante conocer el estudio ACCENT II, efectuado en pacientes con EII con fístulas, cuyo objetivo fue comparar la tasa de reducción del drenaje o de cierre de la fístula entre los pacientes tratados con 5 mg/kg o 10 mg/kg de Infliximab, o placebo. Los resultados fueron mucho mejores con el fármaco, de modo que Infliximab no sólo actúa sobre la actividad luminal y sobre los síntomas que se pueden medir con el CDAI sino que también es eficaz para lograr el cierre de las fístulas (Present et al. N Engl J Med 1999). El ACCENT II fue un estudio multicéntrico, dirigido a demostrar eficacia del mantenimiento en pacientes que presentan enfermedad de Crohn con fístulas. Se realizó inducción con dosis a las cero, dos y seis semanas y a los pacientes que presentaron respuesta se les mantuvo con Infliximab, con infusiones cada dos meses o placebo, con lo que se comprobó que los pacientes que siguieron con Infliximab cada ocho semanas mantuvieron los resultados que habían conseguido en la fase de inducción, a diferencia de los que recibieron “mantención” con placebo, que no mantuvieron estos resultados.
Hay cerca de un millón de pacientes con enfermedad de Crohn tratados y muchos estudios poblacionales demuestran la seguridad de Infliximab, aunque hay también riesgo de infecciones y riesgo teórico de neoplasia a largo plazo. En la enfermedad de Crohn se utiliza en forma rutinaria, tanto para el Crohn luminal resistente a esteroides como para el Crohn fistulizante, en los cuales ha fracasado la inmunosupresión con azatioprina (AZA) o 6 mercaptopurina (6MP).
Si hace diez años la revolución fue el uso de Infliximab en Crohn, el gran cambio en la actualidad es su uso en la colitis ulcerosa. En los estudios ACT 1 y 2, doble ciego, controlados con placebo, cada uno con 364 pacientes que se considerarán en forma conjunta porque eran muy parecidos, es decir, más de 700 pacientes en total. En cuanto a los criterios de inclusión, eran pacientes difíciles de tratar, pacientes en tratamiento actual con inmunosupresores (AZA o 6MP), fracaso reciente del tratamiento inmunosupresor, resistencia o intolerancia a esteroides o corticodependencia. En el estudio ACT 2 se consideró la resistencia a mesalazina (5-ASA), aunque el porcentaje de pacientes que entraron por esta vía fue pequeño. Los pacientes con colitis ulcerosa activa moderada o grave se asignaron al azar a placebo, Infliximab 5 mg/kg o Infliximab 10 mg/kg; se realizó inducción a las cero, dos y seis semanas y mantenimiento cada ocho semanas.
Al analizar la respuesta, es decir, mejoría significativa de los síntomas, en los pacientes tratados con 5 mg/kg o con 10 mg/kg las tasas de respuesta, tanto a las 8 como a las 30 semanas, fueron muy superiores a las de quienes no habían recibido este tratamiento extra en forma de Infliximab. Si se aumenta la exigencia y se desea que el paciente no sólo mejore un poco sino que esté bien, que no tenga síntomas y que su CDAI sea normal por debajo de 150, por tanto un criterio más exigente, los pacientes tratados con 5 mg/kg o 10 mg/kg de Infliximab cumplen el objetivo de estar bien a las 8 semanas, lo que se mantiene a las 30 semanas, en una tasa muy superior a la del grupo que no recibió Infliximab como tratamiento extra. Luego existe claro beneficio, tanto en la respuesta como en la inducción de la remisión.
Los estudios ACT 1 y ACT 2 son fundamentales, se publicaron hace poco y a partir de ellos estamos utilizando Infliximab en los pacientes con colitis ulcerosa grave corticorresistente. Aquí, la duda va a ser si se indica ciclosporina o Infliximab. Existen pros y contras, pero el perfil de seguridad de ciclosporina es peor y se utiliza hace más tiempo. Los estudios con Infliximab, desde el punto de vista científico, son mucho más sólidos, doble ciego, controlados, 700 pacientes y la clínica confirma que es un fármaco eficaz; en cambio, los datos sobre ciclosporina se basan en un estudio con 20 pacientes.
La utilidad de Infliximab en colitis ulcerosa quedó reforzada en un artículo publicado en Gastroenterology por el grupo escandinavo de Jarnerot, en el que se describe un estudio efectuado en pacientes con colitis ulcerosa grave resistente a esteroides, como paso previo a la colectomía. El objetivo primario fue evitar la colectomía: en 71% de los pacientes tratados con Infliximab no se realizó colectomía y en 29% de los casos sí se realizó, que es la historia natural de los pacientes con colitis ulcerosa grave corticorresistente. En el grupo que recibió tratamiento convencional, con esteroides y sin Infliximab, ocurrió lo contrario: dos tercios fueron a pabellón y sólo un tercio se libraron de la cirugía. En cuanto a lo que pasó en el tiempo, el grupo que no recibió Infliximab necesitó colectomía en forma rápida, dentro de los quince primeros días, y la tasa de colectomía llegó a 65%; en el grupo en el cual se ofreció el rescate con Infliximab también hubo cirugías en los quince primeros días, pero sólo en un tercio de los pacientes.
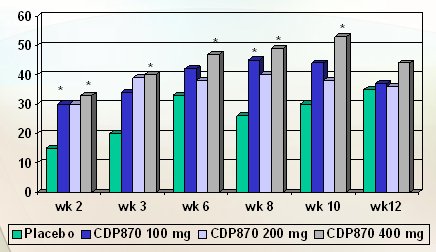
Otros anticuerpos anti-TNF son Adalimumab (Humira) y Certolizumab (Cimzia). Adalimumab es un anticuerpo anti-TNF que tiene dos diferencias: primero, es humanizado, por tanto causa menos inmunogenicidad; y su aplicación es subcutánea, lo que es una ventaja desde el punto de vista práctico. En un estudio realizado en pacientes con enfermedad de Crohn, en quienes se utilizó Infliximab, mejoraron y se logró remisión, pero en el mantenimiento se observó pérdida de respuesta. Esto se debe a que Infliximab tiene 25% de proteína de componente murino de ratón, que es una proteína que va directo a la circulación y genera anticuerpos; y a medida que estos anticuerpos aumentan en título y cantidad, bloquean el Infliximab que se administra en cada una de las dosis. Estos pacientes son excelentes candidatos al uso de otros anti-TNF y en este estudio, que se realizó con sólo 13 pacientes, lo dicho se comprobó. Los pacientes que un día se beneficiaron con el uso de Infliximab pueden beneficiarse con Adalimumab, que es una proteína diferente y no la afecta la presencia de anticuerpos anti Infliximab (Fig. 3). De modo muy parecido, Certolizumab es un anticuerpo humanizado, subcutáneo. El estudio fundamental que prueba su eficacia se realizó en casi 300 pacientes, con diferentes dosis, y su objetivo primario fue lograr respuesta. En cada momento del tiempo, la tasa de respuesta que se consiguió con este nuevo anti-TNF fue superior a la que se obtuvo con placebo (Fig. 4).
Figura 3. Adalimumab (Humira) en pérdida de respuesta a Infliximab. n=13. Pérdida de respuesta a Infliximab 10 mg/kg/8 semanas; Adalimumab: 80 mg + 40 mg /20semanas subcutáneo (Papadakis KA et al. Am J Gastroenterol 2005)
Figura 4. Uso de Certolizumab en enfermedad de Crohn activa. 298 pacientes con EC activa (CDAI 220-450); CDP870 100, 200, 400 mg o placebo (Sem 0, 4, 8), subcutáneo. Objetivo primario: respuesta: CDAI 100 o mayor (Schreiber S et al. DDW 2003)
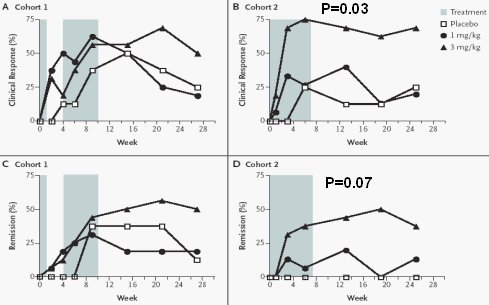
Están en una fase más inicial de desarrollo, pero prometen como estrategia de tratamiento. En el área de las citoquinas TH 1 o proinflamatorias hay datos del bloqueo mediante anticuerpos de IL-12 e interferón gamma. Se bloquea la IL-12 que producen los macrófagos o se bloquea el interferón, que contribuye a cerrar el ciclo y potencia la vía TH 1 de las citoquinas. Un estudio (Fig. 5) publicado en el New England en el cual participaron 71 pacientes con enfermedad de Crohn activa y se evaluaron dos estrategias de tratamiento: en la cohorte 1 (izquierda) los pacientes recibieron tratamiento inicial, después no recibieron tratamiento durante cuatro semanas y luego volvieron a recibir tratamiento. En la cohorte 2, (derecha), los pacientes recibieron tratamiento más seguido durante siete dosis diferentes semanales; no se interrumpió el tratamiento y hubo diferencias claras entre los pacientes que recibieron el anticuerpo anti IL-12 y los que no.
Figura 5. Uso de anticuerpos anti-IL-12 en enfermedad de Crohn. n= 79. Pacientes con EC activa (CDAI 220-450) 2 cohortes; 3 opciones de tratamiento (1, 3 mg/kg anti-IL-12 o placebo). Mannon et al, NEJM 2004
Luego se evaluó hasta qué punto el bloqueo de la IL-12 cambiaba el patrón de síntesis de citoquinas proinflamatorias por parte del linfocito y se pudo observar que el efecto fue dramático, ya que todas las citoquinas disminuyeron cuando se bloqueó la IL- 12.
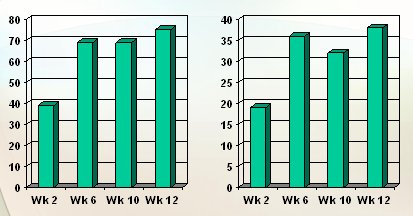
Por último, el uso de Fontolizumab o anticuerpos contra el interferón gamma, se evaluó en un estudio en el que la tasa de respuesta fue de 70% y la tasa de remisión fue de alrededor de 35%, cifras comparables a las que se obtienen con el uso de Infliximab en la enfermedad de Crohn (Fig. 6). Estos son datos preliminares, pero pronto se llegará a las fases 2 y 3.
Figura 6. Ac anti-IFN-g (Fontolizumab) en ECDe (Villiers, DDW 2005)
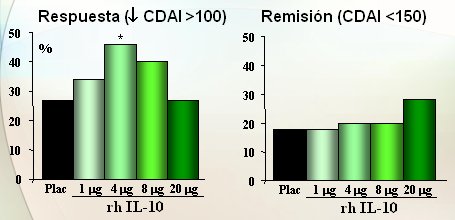
Actualmente se está intentando que la IL-10 inhiba la vía de las citoquinas TH 1, donde están TNF, interferón, IL-12 e IL-18. Los resultados previos son prometedores: en un estudio que de 329 pacientes con enfermedad de Crohn, difíciles de tratar, que habían fracasado con esteroides, se evaluó la eficacia de diferentes dosis de IL-10 recombinante humana, en comparación con placebo (Fig. 7). La respuesta y mejoría de los síntomas sin que el paciente esté totalmente en remisión (izquierda), aunque son cifras lejanas del 70% que se vio antes, demuestran cierto efecto de respuesta. En el gráfico de la derecha se muestran En cuanto a los resultados de remisión (derecha), cuántos pacientes están realmente bien, sin síntomas, con CDAI normal; se observó muy poco efecto, lo que fue decepcionante. A menos que mejore la vía de administración o la dosis, es probable que la vía de la IL-10 no vaya a ir más lejos.
Figura 7. IL-10 recombinante humana en EC. Estudio aleatorio, doble ciego, 329 pacientes con EC refractaria al tratamiento con rh IL-10 (1, 4, 8, 20 mg/día sc) versus placebo x 4 setmanas (Schreiber S. Gastroenterology 2000)
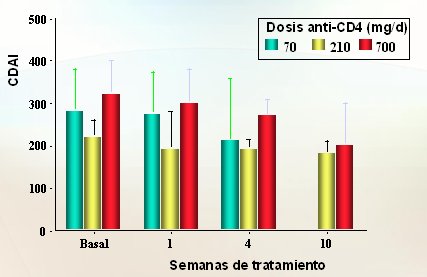
Los linfocitos, elementos clave en la fisiopatología de la enfermedad inflamatoria intestinal, presentan en su superficie una serie de anticuerpos. Todos los linfocitos T tienen el CD3 y los linfocitos T helper tienen el CD4, por lo que desde hace tiempo se consideró que utilizar estos marcadores como diana para dirigir un anticuerpo podría ser una estrategia prometedora para actuar contra los linfocitos. En un estudio (Fig. 8) en que se intentó bloquear con un anticuerpo los linfocitos T CD4, los resultados no fueron concluyentes, porque hubo cierto efecto, pero no el previsto Con la dosis más alta se logró cierto descenso en el CDAI, que es el índice de actividad de la enfermedad de Crohn, pero no fue un resultado prometedor.
Figura 8. Anticuerpo Anti-CD4 en la Enfermedad de Crohn (Stronkhorst et al. Gut 1997)
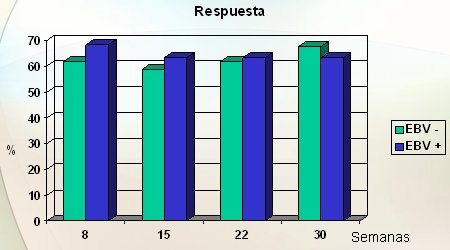
Por otra parte, con el bloqueo con anticuerpos anti-CD3 Visilizumab se observó alrededor de 60% a 70% de respuesta, similar a lo observado con anti interferón, anti IL12 e Infliximab; por lo tanto, bloquear a todos los linfocitos T con un anticuerpo anti CD3 podría ser una estrategia de tratamiento (Fig. 9).
Figura 9. Anticuerpos Anti-CD3 (Visilizumab) en la Enfermedad de Crohn: 53 pacientes: 34 EBV-, 19 EBV + (Targan et al. DDW 2005)
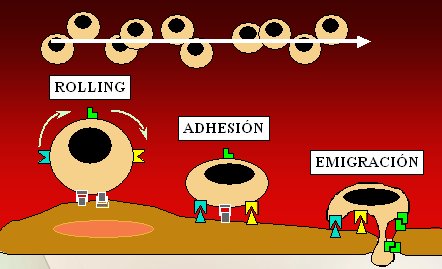
Este procedimiento tiene como objetivo tratar de que los linfocitos no puedan salir de los vasos sanguíneos ni acudir hacia el foco inflamatorio, y que los glóbulos blancos no puedan adherirse ni engancharse. Cuando el leucocito emigra desde el vaso sanguíneo hacia el foco inflamatorio, como su paso es muy rápido, si no existieran las moléculas de adherencia nunca podría ir a causar inflamación; en cambio, gracias a la acción de las moléculas de adherencia de la superficie tanto endotelial como leucocitaria, el leucocito primero rueda sobre la superficie endotelial y luego logra engancharse, adherirse y, finalmente, emigrar y producir inflamación (Fig. 10). Este proceso se puede observar muy bien mediante microscopía experimental: cada punto blanco es un leucocito que interactúa con el endotelio. En el caso de colitis ulcerosa y Crohn, muchos leucocitos van rodando poco a poco encima del endotelio, donde engancharse y emigrar. Cuando se administra un tratamiento antimoléculas de adherencia en ratas, todos los leucocitos pasan de largo y no pueden engancharse.
Figura 10. Interacciones leucocito-endotelio. CAM
La casa ISIS, de California, diseñó un oligonucleótido antisentido dirigido contra una molécula del endotelio (ICAM 1), pero el resultado no dio desesperanzas, porque no al administrar este antisentido contra ICAM 1 en humanos, no se logró efecto. Es probable que ICAM 1 no sea la molécula ideal, porque está presente en condiciones normales; tal vez la molécula más adecuada sea VCAM 1, que no aparece en condiciones normales y aparece cuando hay inflamación. En todo caso, el estudio fue un fracaso y no se utilizará ICAM 1 en la enfermedad de Crohn.
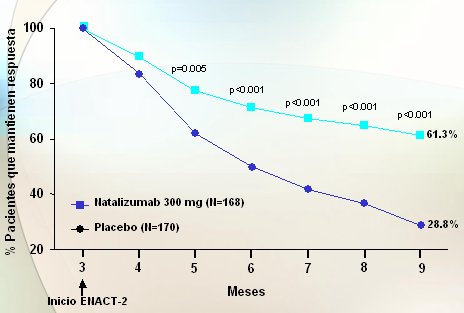
El bloqueo de la vía del VCAM 1, no administrando un anticuerpo contra VCAM sino quizás contra la molécula que está en el leucocito y que permite que se enganche a VCAM, ha dado resultados alentadores. Natalizumab es el anticuerpo contra anti-integrina alfa y su contrarreceptor es el VCAM en el endotelio. En un estudio de diferentes dosis contra placebo, a lo largo del tiempo, se observó que en los grupos que recibieron el fármaco activo hubo un efecto claramente superior a placebo, aunque las diferencias no fueron tan espectaculares como con Infliximab en inducir la remisión. En cambio, en el mantenimiento de la remisión, el estudio ENACT II (Evaluation of Natalizumab As Continuous Therapy-2) demostró que, a lo largo de casi un año, los pacientes que recibieron tratamiento mensual mostraron tasas de respuesta dos o tres veces mejores que los pacientes que, habiendo respondido de entrada, no recibieron dosis periódicas mensuales (Fig. 11).
Figura 11. Natalizumab en la Enfermedad de Crohn, mantenimiento de la remisión: ENACT II
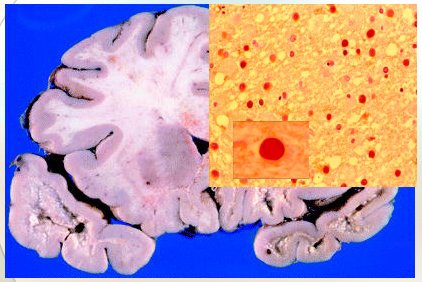
Por desgracia, se han descrito tres casos de leucoencefalopatía multifocal progresiva, que no es sino la reactivación de un virus que la mayoría de los seres humanos tienen en forma latente: el virus JC que produce lesiones características en la sustancia blanca (Fig. 12).
Figura 12. Leucoencefalopatía multifocal progresiva
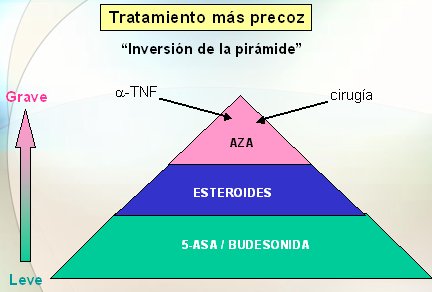
La tendencia va hacia un tratamiento más precoz, con una inversión de la pirámide: en este momento se empieza por 5 ASA: si no responde se usan esteroides; si no responde, azatioprina; si no responde, Infliximab; y si no hay respuesta, el paciente va a cirugía. A futuro, la idea es que se va a utilizar lo antes posible fármacos más eficaces, como azatioprina o Infliximab, y si no hay respuesta se van a adicionar esteroides o se terminará por operar al paciente (Fig. 13).
Figura 13. Tendencia actual en el manejo de la EII
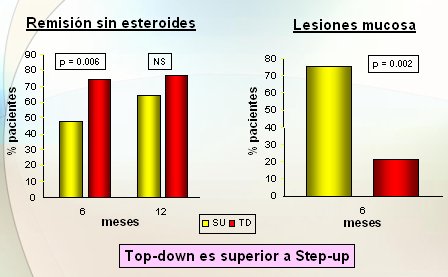
El grupo de Hommes trabaja con la hipótesis de que la aplicación de un tratamiento más intensivo, denominado top down (de arriba hacia abajo), y más precoz, resulta más eficaz que el tratamiento convencional o en secuencia, en el cual, si el paciente no responde bien se sube de escalón o step up. Además, el grupo está convencido de que los esteroides tal vez no sean necesarios, ya otros fármacos permiten inducir la remisión. En un estudio efectuado en 130 pacientes, en que se comparó una y otra vía de acción, en el grupo top down se utilizó Infliximab de entrada y azatioprina de mantención; si el paciente no respondía, se administraba Infliximab y, si no iba bien, recién entonces se utilizaban esteroides. En el grupo step up se procedió como es habitual: se administraron esteroides; si no respondía bien, se inmunosuprimía y, si no respondía, se administraba Infliximab. A los seis meses, el grupo que recibió tratamiento más intenso mostró una remisión libre de esteroides mucho mayor que el grupo convencional; con el transcurso del tiempo este efecto se perdía, porque en el grupo con esteroides se utilizaba cada vez más azatioprina e Infliximab, pero a seis meses con la estrategia pura, los datos demostraron que la agresividad es más eficaz, aunque el costo es más alto. En cuanto a la cicatrización de la mucosa, el grupo con tratamiento más agresivo dio mejores resultados. El perfil de seguridad de los dos grupos fue parecido (Fig. 14).
Figura 14. El tratamiento precoz con AZA y IFX (top down) es más eficaz que el tratamiento convencional o secuencial (step-up) (Hommes D. et al. Gastroenterology 2005; 125:A111-112)
En España se iniciará pronto el protocolo AZTEC (Azatioprina en el tratamiento de la enfermedad de Crohn), estudio multicéntrico que lidera nuestra unidad, en el cual a los pacientes a quienes se diagnostique esta enfermedad se les administrará azatioprina o placebo al azar, para evaluar la utilidad del tratamiento precoz con azatioprina en la enfermedad de Crohn, en cuanto a su impacto en el mantenimiento de la remisión y en la prevención del desarrollo de fenotipo fistulizante.
Otra visión importante tiende a que el tratamiento sea individualizado, ya que se trata de fármacos de alto costo y no exentos de efectos adversos. Se deberán utilizar todas las herramientas disponibles (IBDchip u otras) para evaluar riesgo o probabilidad de respuesta a un fármaco, y así optimizar los resultados.
Las novedades más inmediatas son el uso generalizado de Infliximab en la colitis ulcerosa, igual que en la enfermedad de Crohn. Es probable que en poco tiempo Certolizumab compita con Infliximab y lo desplace, de modo que habrá como mínimo dos opciones, pues tiene la ventaja de ser un anti-TNF humanizado y subcutáneo; también se utilizará la combinación de agentes biológicos (anti-TNF + anti-molécula de adherencia).
Medwave. Año VI No. 7 Septiembre 2006. Derechos Reservados.














 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el XXXII Congreso Chileno de Gastroenterología, realizado en la ciudad de Pucón entre los días 23 al 25 de noviembre de 2005. El evento fue organizado por la Sociedad Chilena de Gastroenterología.
Presidente del Congreso: Dr. Claudio Navarrete.
 Expositor:
Miquel Sans[1]
Expositor:
Miquel Sans[1]

Citación: Sans M. Biological therapies in inflammatory bowel disease. Medwave 2006 Sep;6(8):e1015 doi: 10.5867/medwave.2006.08.1015
Fecha de publicación: 1/9/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión