 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en marco del Programa de Educación Médica Continua de Clínica Santa María y Clínica Dávila en 2009.
Chile es el país con menos mortalidad materna en América Latina, alcanzando una tasa promedio de 17,4 cada 100.000 nacidos vivos en los últimos cinco años. La disminución de alrededor de 60% desde los años 90, se ha debido principalmente a las políticas de reducción de las tasas de natalidad. Chile se comprometió ante la Organización de las Naciones Unidas (ONU), a tener para el año 2010 y 2015, una tasa de mortalidad materna 50% y 75% menor respectivamente, en relación a la obtenida en la década de los 90, quedando para esa fecha con un valor de 9,9. Cabe recordar que en Estados Unidos la tasa de mortalidad del último año fue de 9,3 – 9,5.
En la Fig. 1 se observan las tasas de natalidad de Chile en los últimos 15 a 20 años, denotando una disminución principalmente en el grupo de pacientes que tiene menor riesgo de embarazo; es decir, en rango de edad entre 20 y 30 años. Sin embargo, en los grupos de mayor riesgo obstétrico, entre los 35 y 45 años, la tasa de natalidad ha aumentado, de hecho supera a las tasas de natalidad de países como Finlandia y países nórdicos.
La importancia de estas estadísticas apunta a que las causas de mortalidad materna en Chile también han variado, teniendo desde el año 2000 en adelante, como primera causa el síndrome hipertensivo del embarazo (preeclampsia). Este, asociado a una población de mayor riesgo, implica que las herramientas que se están utilizando para seguir disminuyendo la tasa de mortalidad materna no sean tan eficaces y éstas se estabilicen. Para mejorar esta situación probablemente sea necesario cambiar el enfoque hacia las principales causas de mortalidad materna, que es el síndrome hipertensivo del embarazo, lo que tiene importancia no sólo en un embarazo actual, sino que también en los sucesivos.
En la Fig. 2 se visualiza un gráfico de Funai del año 2005, que muestra años postparto y porcentaje de sobrevida. La línea punteada refleja las pacientes que tuvieron preeclampsia, pero cuyo estado posterior se desconoce. La línea más clara indica las mujeres que no presentaron preeclampsia y la más oscura las que tuvieron preeclampsia y postparto con cifras normotensas. A los 10 años posteriores del embarazo, la tasa de mortalidad en las pacientes que tuvieron preeclampsia aumenta; es decir, no sólo hay un aumento en la tasa de mortalidad materna en el embarazo actual, sino que también a los cinco años de sobrevida, lo que aparentemente se debería a cambios endoteliales y vasculares que tienen las pacientes durante los períodos de preeclampsia, lo que es un dato muy interesante que hace replantear la forma de enfrentar los controles prenatales.
Figura 2. Gráfico que muestra porcentaje de sobrevida en relación a los años postparto.
En la Fig. 3 se explica muy bien lo que sucede en las pacientes con preeclampsia. La manifestación clínica (presión arterial, proteinuria) aparece en el tercio final del embarazo. Durante los dos tercios previos del embarazo la paciente cursó con enfermedad subclínica, con algunos marcadores biológicos, y por último evoluciona hacia la enfermedad clínica.
La intervención se realiza recién cuando se hace evidente que la paciente tiene un cuadro de preeclampsia. Sin embargo, esta conducta nunca logrará disminuir la prevalencia de la enfermedad y si no hay reducción de la prevalencia, el efecto sobre las tasas de mortalidad será mínimo o ninguno. Aún cuando se manejen muy bien las pacientes, y evitemos desenlaces fatales, pero si la paciente llega con un HELLP o una complicación severa será mucho más difícil, o a costos más altos, lograr disminuir la tasa de mortalidad materna.
Sin embargo, el principal objetivo es lograr la capacidad de predecir el cuadro, para así poder enfrentar en forma precoz la prevención.
Figura 3. Efecto homeostásico de la preeclampsia.
La fisiopatología de la preeclampsia se inicia con una placentación deteriorada, que lleva a un estrés oxidativo local, lo que tiene efectos a nivel fetal y puede producir retardo del crecimiento. Asimismo, hay un cambio en la liberación de factores de daño endotelial como el sFIt-1, que produce cambios en la respuesta inflamatoria sistémica materna, en la función endotelial y en los signos clínicos (Fig. 4).
Es preciso poder predecir la placentación pobre y el estrés oxidativo, de tal manera de poder actuar sobre el estrés oxidativo y sobre la placentación inadecuada. En otras palabras, se debe predecir para poder prevenir la enfermedad.
La intervención en la preeclampsia está enfocada principalmente a la prevención, para lo cual se han estudiado múltiples estrategias, incluso el uso de ajo.
Dentro de los estudios relevantes, se encuentra una revisión de Cochrane del año 2008 (1) sobre el uso de antioxidantes. El trabajo más importante de ésta es el de Lucilla Poston, que se hizo el año 2006 y que reclutó más de 1.000 pacientes. Habían aparecido muchos estudios menores que indicaban que el uso de antioxidantes era beneficioso en la disminución de las tasas de incidencia, por su efecto sobre el estrés oxidativo que está en la génesis de la preeclampsia. Sin embargo, la evidencia fue absolutamente contraria al uso de antioxidantes para la prevención de este síndrome y en la actualidad no se dispone de estudios bien diseñados y de suficiente magnitud que corroboren la hipótesis del uso de vitaminas antioxidantes.
Este resultado se puede deber a dos factores. El primero se refiere a que el tiempo en que se administran los antioxidantes podría ya ser muy tardío (a las 20 semanas de gestación); y el segundo, que el tipo de población sea disímil, planteándose el concepto de que no todas las preeclampsias son iguales. Puede presentarse la paciente con preeclampsia severa, que se manifiesta a las 25-26 semanas, con retardo de crecimiento intrauterino y que obliga a la interrupción por la severidad del cuadro. Así también, pueden presentarse pacientes que también son catalogadas como casos severos, como por ejemplo, una diabética que cursa con preeclampsia, con 40 semanas de gestación, con cifras tensionales elevadas desde las 36 semanas sin una crisis hipertensiva y con un feto cuyo peso es de 4,5 kilos. Si bien se denominan de la misma manera, sin embargo, son cuadros completamente diferentes. Se colige que probablemente no exista la herramienta para diagnosticar todos los tipos de preeclampsia, por lo que se debe tener la capacidad, por medio de los exámenes predictivos, poder diferenciarlas.
Los agentes antiplaquetarios, principalmente la Aspirina, también han sido usados (2). La revisión de Cochrane del año 2008, en que se analizaron 59 estudios y 37.560 mujeres, muestra que existe 17% de reducción del riesgo de preeclampsia. Lo importante es el NNT “number needed to treat”, esto significa que se necesita tratar a 72 pacientes para obtener al menos una a quien le disminuya el riesgo; es decir, a pesar de que hay un cierto grado de reducción, esto es bastante moderado, ya que se requiere un gran NNT para producir una disminución en la prevalencia de la preeclampsia. También existe 8% de reducción en el parto prematuro, 14% de muerte fetal y neonatal. Cabe destacar, eso sí, que para evitar una muerte fetal se necesita tratar 243 pacientes; por lo tanto, a pesar de que los antiplaquetarios ejercen ciertos efectos beneficiosos, se requiere más información para evaluar qué tipo de mujeres tienen mayores probabilidades de resultar beneficiadas y cuál es la dosis y el mejor momento para iniciar el tratamiento. Es así como se apunta una vez más a lo mismo: las preeclampsias no son todas iguales y tratarlas a todas por igual no sería la política correcta. Los esfuerzos deben ir en la dirección de identificar un subgrupo de pacientes que son las que reúnen la mayor morbilidad y esas serían las que deberían ser tratadas.
Se realizó un estudio aleatorizado consistente en administrar Aspirina a pacientes con Doppler de arteria uterina anormal a las 23 semanas de gestación (3). La conclusión fue que el tratamiento no arrojó evidencia de efectividad. Se infiere que la falta de efectividad no se debe a que no sea favorable, sino porque el grupo de población donde se actúa ya tiene un daño establecido. Este elemento es importante, porque si se realiza un screening para preeclampsia a las 22 semanas de embarazo, probablemente ya sea tarde para administrar aspirina. A pesar de que el screening con Doppler es bastante utilizado, no sirve para prevenir la preeclampsia debido a que la fisiopatología ya está desencadenada. Cualquier intervención a las 23 o 24 semanas será ya tardío para evitar la preeclampsia.
Respecto al calcio existen dos estudios, uno publicado el año 1997 en el New England Journal of Medicine, que mostró que la suplementación con dos gramos de calcio no redujo la incidencia de preeclampsia, a pesar de que habían estudios previos en poblaciones que tenían baja ingesta de calcio que señalaban que podía prevenirla, pero cuando se usaron en pacientes con ingesta normal, no fue efectiva (4). Para reanalizar este aspecto, se realizó el 2006 un nuevo estudio en pacientes con baja ingesta de calcio, que evidenció que para preeclampsia en términos generales no existe protección, pero sí para eclampsia e hipertensión arterial severa con crisis hipertensiva. Se concluye, entonces, que en población con baja ingesta de calcio, el uso de calcio podría ser de utilidad únicamente en caso que se administre antes de las 20 semanas de gestación (5).
Una de las herramientas de medición importantes en preeclampsia es el Doppler. Existe un estudio de Parra y cols sobre la sensibilidad y especificidad del Doppler a las 11-14 semanas y 22-25 semanas. La sensibilidad en pacientes preeclámpticas a las 11-14 semanas de gestación fue sólo 25%, y a las 22-25 semanas la sensibilidad alcanzó un 48%, mientras que en los casos de preeclampsias severas sube a 66%. En consecuencia, a pesar de que los marcadores biofísicos son un buen elemento, necesitan de otros estudios para poder predecir adecuadamente la preeclampsia (6).
Los estudios de Levine de 2006 (7) muestran algunos marcadores bioquímicos como sFIt-1 que aumenta entre las 17 y 20 semanas en las pacientes que desarrollan preeclampsia, al igual que el receptor soluble del VEGF y el PIGF. El problema es que estos marcadores bioquímicos aparecen recién en el segundo trimestre, por lo que son de poca utilidad.
Por su parte, existe un trabajo de Poon con respecto a marcadores endoteliales de primer trimestre, como la PAPP, que demuestra menor nivel en las pacientes que desarrollan preeclampsia (8).
Otro estudio de Romero y cols se realizó en relación a la PP13, que es otra molécula de daño endotelial, que en las pacientes con preeclampsia está bastante más baja que en pacientes normales. A pesar que la sensibilidad y especificidad no son muy buenas cuando se ocupa para todos los tipos de preeclampsia, mejora bastante cuando se usa PP13 solamente para diagnóstico de preeclampsia severa, sin embargo, no son ideales (9).
Una cosa es el remodelamiento endotelial que existe en las pacientes con preeclampsia y otra el estrés oxidativo que se produce por una hipoperfusión placentaria la que genera isquemia. Hasta ahora no se había medido qué pasaba desde el punto de vista de la isquemia y de la remodelación placentaria secundaria a ésta. Para realizar este estudio se recurrió al DNA libre fetal. Un estudio del año 2007 demostró que el DNA libre fetal es de origen placentario, avalado por múltiples trabajos; es decir, se sabe que los niveles de DNA libre fetal presentes en la circulación materna son de origen placentario (10).
Otro estudio del año 2009 publicado en el American Journal of Obstetrics and Gynecology muestra cómo los niveles de DNA libre fetal están aumentados en pacientes que cursan con preeclampsia y retardo del crecimiento intrauterino. Las pacientes con preeclampsia severa tienen niveles mucho más altos que las moderadas. Esto se debe a que las pacientes con preeclampsia moderada o pacientes obesas con hipertensión no presentan daño placentario ya que la placentación en ellas es normal. En estos casos, la patología es el resultado de la reacción inflamatoria que se produce por la obesidad, lo que desencadena el cuadro hipertensivo. Al no ser una preeclampsia placentaria, los niveles de DNA libre fetal están absolutamente normales en estas pacientes. Por el contrario, las pacientes con preeclampsia severa presentan una placentación anómala, por lo que se produce hipoxia placentaria, la que se manifiesta con niveles de DNA libre fetal más altos. A pesar de estos cambios, su utilidad no es significativa, ya que estos diagnósticos son realizados entre la semana 30 y 40 de gestación, cuando la paciente manifiesta clínicamente su enfermedad (11).
Una publicación del año 2009 de nuestro grupo, analiza acerca de los niveles de DNA libre fetal a las 11 y 14 semanas, demostrando que en las pacientes que desarrollaron preeclampsia y retardo del crecimiento fetal severo, los niveles ya están elevados; es decir, son pacientes que van a desarrollar preeclampsia y tendrán que ser interrumpidas antes de las 35 semanas, que ya tienen isquemia y apoptosis a nivel placentario a las 11-14 semanas, lo que se plantea como otra herramienta más para la prevención de preeclampsia. En el estudio se realizó una regresión logística que puso en evidencia que en la medida que aumentan los niveles de DNA libre fetal, también aumenta el riesgo de preeclampsia con interrupción antes de las 35 semanas (12).
Otra publicación de Poon (2009) plantea por primera vez la predicción certera de preeclampsia. Los autores combinaron todas las herramientas y factores: Doppler de arteria uterina; medición de la presión arterial media entre las 11 y 14 semanas; medición de PAPP y PIGF. Tras ello, desarrollaron un algoritmo que mostró capacidad de predicción de preeclampsia precoz con interrupción del embarazo antes de las 32 semanas, con prácticamente un 100% de capacidad de predicción a las 11-14 semanas (13).
Como esto fue realizado en una población inglesa, nuestro grupo se ha adjudicado un proyecto FONIS (Fondo de Investigación y Desarrollo en Salud) cuyo objetivo es predecir la preeclampsia en forma precoz a las 11-14 semanas, con el mismo diseño que hizo Poon para pacientes inglesas, pero en pacientes chilenas. Aproximadamente más de 1.000 pacientes entre las 11 y 14 semanas de gestación serán contraladas mediante Doppler, presión arterial, peso, características de raza, muestras de sangre y otras mediciones, lo que permitirá hacer un algoritmo para predicción de preeclampsia.
Esta es la primera experiencia en Chile y podría ser aplicado a nivel nacional un examen específico entre las 11 y 14 semanas de gestación, anticipando qué perfil de pacientes tienen riesgo de hacer preeclampsia, cambiando así el control prenatal, focalizándose en aquellas pacientes de riesgo y disminuyendo el control prenatal en pacientes de bajo riesgo, con lo cual se podría lograr el objetivo de disminuir las tasas de mortalidad materna.

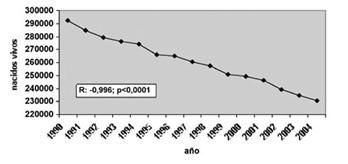

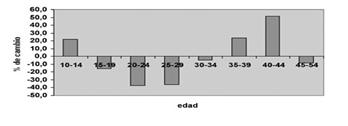 Figura 1. Tendencia de la natalidad y porcentaje de cambio del número de recién nacidos vivos, según edad materna en Chile, 1990-2004.
Figura 1. Tendencia de la natalidad y porcentaje de cambio del número de recién nacidos vivos, según edad materna en Chile, 1990-2004.

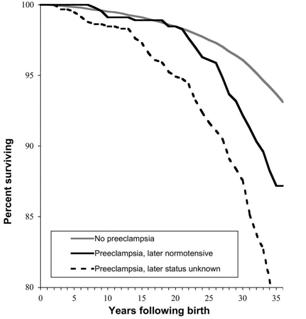 Figura 2. Gráfico que muestra porcentaje de sobrevida en relación a los años postparto.
Figura 2. Gráfico que muestra porcentaje de sobrevida en relación a los años postparto.

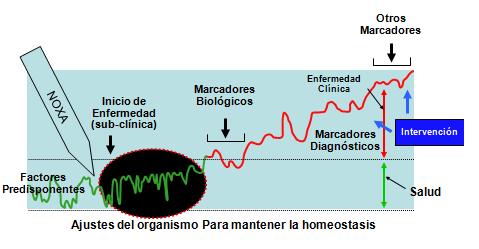 Figura 3. Efecto homeostásico de la preeclampsia.
Figura 3. Efecto homeostásico de la preeclampsia.

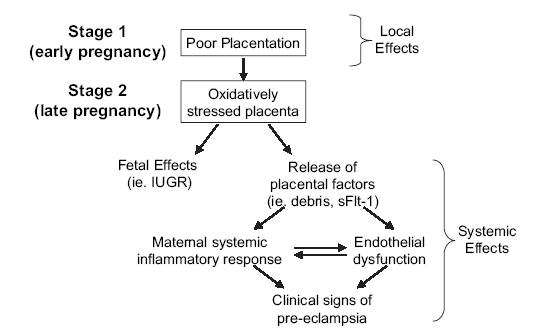 Figura 4.
Figura 4.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en marco del Programa de Educación Médica Continua de Clínica Santa María y Clínica Dávila en 2009.
 Expositor:
Sebastián Illanes[1]
Expositor:
Sebastián Illanes[1]

Citación: Illanes S. Practical aspects for the prevention of preeclampsia. Medwave 2010 Nov;10(10):e4786 doi: 10.5867/medwave.2010.10.4786
Fecha de publicación: 1/11/2010

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Rumbold A, Duley L, Crowther CA, Haslam RR. Antioxidants for preventing pre-eclampsia. Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD004227. | CrossRef | PubMed |
Rumbold A, Duley L, Crowther CA, Haslam RR. Antioxidants for preventing pre-eclampsia. Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD004227. | CrossRef | PubMed | Duley L, Henderson-Smart DJ, Meher S, King JF. Antiplatelet agents for preventing pre-eclampsia and its complications. Cochrane Database of Systematic Reviews 2007, Issue 2. Art. No.: CD004659. | CrossRef | PubMed |
Duley L, Henderson-Smart DJ, Meher S, King JF. Antiplatelet agents for preventing pre-eclampsia and its complications. Cochrane Database of Systematic Reviews 2007, Issue 2. Art. No.: CD004659. | CrossRef | PubMed | Yu CK, Papageorghiou AT, Parra M, Palma Dias R, Nicolaides KH; Fetal Medicine Foundation Second Trimester Screening Group. Randomized controlled trial using low-dose aspirin in the prevention of pre-eclampsia in women with abnormal uterine artery Doppler at 23 weeks' gestation. Ultrasound Obstet Gynecol. 2003 Sep;22(3):233-9. | CrossRef | PubMed |
Yu CK, Papageorghiou AT, Parra M, Palma Dias R, Nicolaides KH; Fetal Medicine Foundation Second Trimester Screening Group. Randomized controlled trial using low-dose aspirin in the prevention of pre-eclampsia in women with abnormal uterine artery Doppler at 23 weeks' gestation. Ultrasound Obstet Gynecol. 2003 Sep;22(3):233-9. | CrossRef | PubMed | Levine RJ, Hauth JC, Curet LB, Sibai BM, Catalano PM, Morris CD, DerSimonian R, Esterlitz JR, Raymond EG, Bild DE, Clemens JD, Cutler JA. Trial of calcium to prevent preeclampsia. N Engl J Med. 1997 Jul 10;337(2):69-76. | CrossRef | PubMed |
Levine RJ, Hauth JC, Curet LB, Sibai BM, Catalano PM, Morris CD, DerSimonian R, Esterlitz JR, Raymond EG, Bild DE, Clemens JD, Cutler JA. Trial of calcium to prevent preeclampsia. N Engl J Med. 1997 Jul 10;337(2):69-76. | CrossRef | PubMed | Villar J, Abdel-Aleem H, Merialdi M, Mathai M, Ali MM, Zavaleta N, Purwar M, Hofmeyr J, Nguyen TN, Campódonico L, Landoulsi S, Carroli G, Lindheimer M; World Health Organization Calcium Supplementation for the Prevention of Preeclampsia Trial Group. World Health Organization randomized trial of calcium supplementation among low calcium intake pregnant women. Am J Obstet Gynecol. 2006 Mar;194(3):639-49. | CrossRef | PubMed |
Villar J, Abdel-Aleem H, Merialdi M, Mathai M, Ali MM, Zavaleta N, Purwar M, Hofmeyr J, Nguyen TN, Campódonico L, Landoulsi S, Carroli G, Lindheimer M; World Health Organization Calcium Supplementation for the Prevention of Preeclampsia Trial Group. World Health Organization randomized trial of calcium supplementation among low calcium intake pregnant women. Am J Obstet Gynecol. 2006 Mar;194(3):639-49. | CrossRef | PubMed | Parra M, Rodrigo R, Barja P, Bosco C, Fernández V, Muñoz H, Soto-Chacón E. Screening test for preeclampsia through assessment of uteroplacental blood flow and biochemical markers of oxidative stress and endothelial dysfunction. Am J Obstet Gynecol. 2005 Oct;193(4):1486-91. | CrossRef | PubMed |
Parra M, Rodrigo R, Barja P, Bosco C, Fernández V, Muñoz H, Soto-Chacón E. Screening test for preeclampsia through assessment of uteroplacental blood flow and biochemical markers of oxidative stress and endothelial dysfunction. Am J Obstet Gynecol. 2005 Oct;193(4):1486-91. | CrossRef | PubMed | Levine RJ, Qian C, Maynard SE, Yu KF, Epstein FH, Karumanchi SA. Serum sFlt1 concentration during preeclampsia and mid trimester blood pressure in healthy nulliparous women. Am J Obstet Gynecol. 2006 Apr;194(4):1034-41. | CrossRef | PubMed |
Levine RJ, Qian C, Maynard SE, Yu KF, Epstein FH, Karumanchi SA. Serum sFlt1 concentration during preeclampsia and mid trimester blood pressure in healthy nulliparous women. Am J Obstet Gynecol. 2006 Apr;194(4):1034-41. | CrossRef | PubMed | Poon LC, Maiz N, Valencia C, Plasencia W, Nicolaides KH. First-trimester maternal serum pregnancy-associated plasma protein-A and pre-eclampsia. Ultrasound Obstet Gynecol. 2009 Jan;33(1):23-33. | CrossRef | PubMed |
Poon LC, Maiz N, Valencia C, Plasencia W, Nicolaides KH. First-trimester maternal serum pregnancy-associated plasma protein-A and pre-eclampsia. Ultrasound Obstet Gynecol. 2009 Jan;33(1):23-33. | CrossRef | PubMed | Romero R, Kusanovic JP, Than NG, Erez O, Gotsch F, Espinoza J, Edwin S, Chefetz I, Gomez R, Nien JK, Sammar M, Pineles B, Hassan SS, Meiri H, Tal Y, Kuhnreich I, Papp Z, Cuckle HS. First-trimester maternal serum PP13 in the risk assessment for preeclampsia. Am J Obstet Gynecol. 2008 Aug;199(2):122.e1-122.e11. Epub 2008 Jun 9. | PubMed | PMC |
Romero R, Kusanovic JP, Than NG, Erez O, Gotsch F, Espinoza J, Edwin S, Chefetz I, Gomez R, Nien JK, Sammar M, Pineles B, Hassan SS, Meiri H, Tal Y, Kuhnreich I, Papp Z, Cuckle HS. First-trimester maternal serum PP13 in the risk assessment for preeclampsia. Am J Obstet Gynecol. 2008 Aug;199(2):122.e1-122.e11. Epub 2008 Jun 9. | PubMed | PMC | Alberry M, Maddocks D, Jones M, Abdel Hadi M, Abdel-Fattah S, Avent N, Soothill PW. Free fetal DNA in maternal plasma in anembryonic pregnancies: confirmation that the origin is the trophoblast. Prenat Diagn. 2007 May;27(5):415-8. | CrossRef | PubMed |
Alberry M, Maddocks D, Jones M, Abdel Hadi M, Abdel-Fattah S, Avent N, Soothill PW. Free fetal DNA in maternal plasma in anembryonic pregnancies: confirmation that the origin is the trophoblast. Prenat Diagn. 2007 May;27(5):415-8. | CrossRef | PubMed | Alberry MS, Maddocks DG, Hadi MA, Metawi H, Hunt LP, Abdel-Fattah SA, Avent ND, Soothill PW. Quantification of cell free fetal DNA in maternal plasma in normal pregnancies and in pregnancies with placental dysfunction. Am J Obstet Gynecol. 2009 Jan;200(1):98.e1-6. | PubMed |
Alberry MS, Maddocks DG, Hadi MA, Metawi H, Hunt LP, Abdel-Fattah SA, Avent ND, Soothill PW. Quantification of cell free fetal DNA in maternal plasma in normal pregnancies and in pregnancies with placental dysfunction. Am J Obstet Gynecol. 2009 Jan;200(1):98.e1-6. | PubMed | Illanes S, Parra M, Serra R, Pino K, Figueroa-Diesel H, Romero C, Arraztoa JA, Michea L, Soothill PW. Increased free fetal DNA levels in early pregnancy plasma of women who subsequently develop preeclampsia and intrauterine growth restriction. Prenat Diagn. 2009 Dec;29(12):1118-22. | CrossRef | PubMed |
Illanes S, Parra M, Serra R, Pino K, Figueroa-Diesel H, Romero C, Arraztoa JA, Michea L, Soothill PW. Increased free fetal DNA levels in early pregnancy plasma of women who subsequently develop preeclampsia and intrauterine growth restriction. Prenat Diagn. 2009 Dec;29(12):1118-22. | CrossRef | PubMed |