Este texto completo es una transcripción editada de una conferencia dictada en el XVII Curso de Extensión de Pediatría, organizado por el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, el Departamento de Pediatría Centro de la Facultad de Medicina de la Universidad de Chile, el Servicio de Salud Metropolitano Central y la Dirección de Atención Primaria. Se realizó entre el 01 de abril y el 25 de noviembre de 2008 y sus directores fueron el Dr. Francisco Barrera y la Dra. Cristina Casado.
En la primera parte de esta presentación se habló sobre electrofisiología, clasificación general de las arritmias y arritmias benignas. En esta segunda parte se analizarán las arritmias patológicas, que se clasifican en taquiarritmias y bradiarritmias. De las taquiarritmias patológicas, 95% son taquiarritmias supraventriculares (TSV) y 5%, taquiarritmias ventriculares.
Los mecanismos involucrados en el origen de las taquiarritmias supraventriculares son tres:
Dentro de las taquiarritmias ventriculares destacan las taquicardias ventriculares o salva de taquicardia ventricular, cuando se producen más de tres extrasístoles ventriculares; la fibrilación ventricular y la torsade des pointes (torsión de punta), una taquicardia ventricular polimorfa que se presenta en pacientes portadores de síndrome QT prolongado congénito o adquirido.
La presentación clínica de las taquiarritmias varía según la edad. En lactantes y preescolares la consulta es tardía debido a que los niños no verbalizan sus síntomas; se manifiestan por rechazo alimentario, taquipnea, diaforesis e irritabilidad, con desarrollo de insuficiencia cardíaca en 40% de los casos. En escolares y adolescentes destacan síntomas como palpitaciones, mareos, precordalgia y sensación de lipotimia o “presíncope”; es raro que presenten insuficiencia cardíaca. Estos pacientes consultan en los servicios de urgencia por síntomas de insuficiencia cardíaca, palpitaciones o síncope. El compromiso hemodinámico es desencadenado por frecuencia cardíaca muy elevada, taquicardia de evolución prolongada, taquicardia ventricular, disfunción miocárdica y/o miocardiopatía previa.
80% de las taquicardias supraventriculares (TSV) se origina en la presencia de vías accesorias evidentes, como en el síndrome de Wolf Parkinson White, o vías ocultas. En 60% de los casos el primer episodio ocurre durante el primer año de vida, con mayor frecuencia en niños menores de 3 meses; en general los episodios no recurren, aunque en 30% de los pacientes pueden volver a aparecer en edades mayores, en cuyo caso se estudian y tratan mediante ablación por radiofrecuencia. 70% de las TSV paroxísticas (TPSV) en niños menores de 3 meses se deben al síndrome de Wolf Parkinson White.
Existen dos formas de TSV por reentrada auriculoventricular: aquellas por reentrada ortodrómica, en que el impulso desciende por su vía normal hacia el ventrículo y vuelve a la aurícula a través de una vía accesoria que lo conduce en sentido retrógrado depolarizando a la aurícula en forma casi inmediata después del ventrículo, lo que se refleja en el ECG como una onda P negativa, retrógrada, separada de su complejo QRS en por lo menos 90 milisegundos e intervalo RP menor que PR; y aquellas reciprocantes permanentes de la unión, en que la vía accesoria se localiza en la parte posteroseptal del corazón y en el ECG se caracterizan por PR normal, RP largo y ondas P negativas en las derivaciones inferiores, DII, DIII y aVF.
Los pacientes que tienen mayor riesgo de insuficiencia cardíaca o compromiso vital secundario al colapso hemodinámico por déficit del gasto cardíaco provocado por la taquicardia son los recién nacidos y los niños portadores de cardiopatía congénita. Las cardiopatías que presentan esta complicación son las miocardiopatías hipertróficas, las miocarditis, los shunts importantes de izquierda a derecha, la hipertensión pulmonar y la obstrucción del tracto de salida del ventrículo izquierdo, como ocurre en la estenosis aórtica y la coartación aórtica.
La TPSV reciprocante ortodrómica es de alta frecuencia, 300 lpm, con QRS angosto y presencia de onda P, lo cual es patológico a cualquier edad (Fig. 1).
Figura 1. TSV paroxística reciprocante ortodrómica.
En la Fig. 2 se observa también una taquicardia de alta frecuencia, pero sin ondas P ni T visibles.
Figura 2. TSV paroxística sin ondas P ni T visibles.
Síndrome de Wolf Parkinson White (WPW): se caracteriza por la existencia de una vía accesoria que se denomina haz de Kent, el cual transmite el impulso eléctrico en vez de la vía normal y excita a los ventrículos mucho antes que ésta, produciendo un sistema de circuito cerrado que devuelve el impulso por la vía normal y provoca una taquicardia de frecuencia elevada con presencia de extrasístoles (Fig. 3).
Figura 3. Esquema fisiopatológico del síndrome de Wolf Parkinson White.
El síndrome de WPW se caracteriza en el ECG por PR menor de 0,08 segundos, onda delta que representa la preexcitación ventricular y complejo QRS ancho. Estos elementos permiten realizar el diagnóstico, pero sólo en ritmo sinusal ya que en las crisis de taquicardia no es posible observarlos debido a la elevada frecuencia (Fig 4).
Figura 4. Diagnóstico de síndrome de WPW en ECG con ritmo sinusal.
La Fig. 5 muestra la conversión a ritmo sinusal de una taquicardia paroxística tipo WPW tras la administración de adenosina; se puede apreciar la existencia de una onda delta.
Figura 5. Conversión de síndrome de WPW tras administración de adenosina.
TPSV reciprocante de la unión: En la Fig. 6 se observar una taquicardia paroxística de diferente morfología, también con frecuencia elevada, pero con complejo QRS angosto.
Figura 6. Taquicardia reciprocante de la unión o PJRT.
Taquicardia auricular multifocal: es un ritmo auricular multifocal caótico con distintas morfologías, frecuencias variables y complejos QRS angostos (Fig. 7).
Figura 7. Taquicardia auricular multifocal.
Flutter auricular: su principal característica es la presencia de una onda de morfología en serrucho, con una onda parecida a una onda P ancha, grande y alta, y frecuencia elevada debido a las ondas de contracción auricular que se introducen entre los complejos QRS, los que continúan con su frecuencia habitual porque, a pesar de la frecuencia alta (alrededor de 300 lpm) el corazón tiene cierto grado de bloqueo que lo protege y ocasiona frecuencias ventriculares menores. En la Fig. 8 se oberva un flutter auricular con bloqueo 2:1: frecuencia auricular 300 lpm y ventricular, 150.
Figura 8. Flutter auricular con bloqueo 2:1. Frecuencia auricular 300 lpm y ventricular, 150.
En la Fig. 9 se muestra un flutter auricular tras la administración de adenosina; se evidencia onda auricular en serrucho seguida por complejo QRS.
Fibrilación auricular: Arritmia más frecuente en adultos que en niños; a diferencia del flutter, la fibrilación tiene una onda pequeña (Fig. 10).
Figura 10. Fibrilación auricular.
Las taquicardias ventriculares causan entre 4 y 19% de los paros cardiorrespiratorios en niños; la incidencia de este trastorno aumenta con la edad y su diagnóstico diferencial con TSV con conducción antidrómica o bloqueo de rama periférico, las cuales también pueden mostrar complejos anchos, es difícil. 85% de estas arritmias poseen un sustrato orgánico, por lo tanto tienen riesgo de muerte súbita y fibrilación ventricular. A diferencia de las TSV, las ventriculares presentan complejo QRS anchos y frecuencias entre 150 y 200 lpm (Fig. 11).
Figura 11. Taquicardia ventricular con QRS ancho y patológico.
La diferencia entre taquicardia y fibrilación ventricular es que esta última se caracteriza por complejos QRS irregulares y polimorfos (Fig. 12).
Figura 12. Taquicardia ventricular versus fibrilación ventricular.
Síndrome QT prolongado: es un síndrome que se transmite en forma genética, cuya prevalencia alcanza 1 de cada 3.000 individuos. Se habla de QT prolongado frente a un QT corregido (QTc) mayor de 0,45 segundos (Fig. 13).
Figura 13. Síndrome QT prolongado. QTc 578 milisegundos ó 0,57 segundos.
El QT prolongado puede ser grave en recién nacidos tras provocar bloqueo auriculoventricular 2:1, puesto que puede provocar arritmias, muerte súbita in útero y arritmias ventriculares o torsión de punta durante los primeros meses de vida (Fig. 14).
Figura 14. Síndrome QT prolongado con bloqueo 2 x 1.
Torsión de puntas (torsade de pointes): taquiarritmia ventricular con complejos QRS anchos y polimorfos (Fig. 15).
En el manejo de las arritmias, tanto supraventriculares como ventriculares, lo primero es evaluar el compromiso vital y determinar la presencia de síncope o inestabilidad hemodinámica. Con este objetivo se debe aplicar el ABC de soporte vital, que incluye manejar la vía aérea, establecer vías venosas y asegurar la estabilidad hemodinámica, si es necesario con cardioversión eléctrica. Se debe evaluar si la condición permite el manejo médico o si existe necesidad urgente de conversión a ritmo sinusal.
Para efectuar el manejo agudo dentro del servicio de urgencia se debe obtener un ECG en ritmo sinusal o un registro en papel (DII largo) para diagnosticar y certificar la arritmia y facilitar el manejo posterior. En el primer episodio de taquiarritmia se debe hospitalizar al paciente para efectuar un ecocardiograma, con el objetivo de evaluar la función ventricular y la existencia de anomalías estructurales. El especialista puede continuar el estudio mediante Holter o monitoreo electrocardiográfico de 24 horas, o en forma más especifica con un loop recorder, monitoreo más prolongado que es fundamental para definir la terapia crónica o el uso de métodos más agresivos, como la ablación por radiofrecuencia que hoy en día se encuentra disponible en los hospitales públicos de Chile. Para aplicar este procedimiento se debe efectuar estudio electrofisiológico y se indica sólo en niños mayores de siete años de edad porque implica cateterismo cardíaco y riesgo de bloqueo, puesto que la ablación es una quemadura directa de las vías anómalas y existe cierto riesgo de dañar vías normales, sobre todo en niños pequeños.
La cardioversión eléctrica se realiza con paletas de cardioversión de diferente tamaño según la edad: las paletas pediátricas, que tienen 4,5 cm de diámetro, se utilizan en niños de menos de 10 kilos de peso y las paletas de 8 a 12 cm de diámetro se utilizan en niños de más de 10 kilos, con potencias entre 0,5 a 4 Joule por kilo.
Para efectos de manejo las taquicardias se clasifican en taquicardias con pulso y sin pulso; dentro de las con pulso están las que presentan complejos QRS angostos y las de QRS ancho; entre las de QRS angosto están las TSV y las taquicardias sinusales y, por otro lado, están las taquicardias ventriculares. Entre las taquicardias sin pulso se encuentran la fibrilación ventricular, la taquicardia ventricular y las taquicardias sin actividad eléctrica o asistolía.
El flujo de manejo agudo de la TPSV es el siguiente:
Si no está claro que el paciente sea portador de un síndrome de WPW no se debe utilizar digital, ya que puede inducir la aparición de taquicardias ventriculares y fibrilación ventricular; es más seguro elegir adenosina o amiodarona si el paciente está estable. Si no se cuenta con estos recursos corresponde derivar al paciente a un centro más especializado. El verapamilo se utiliza en adultos, pero es un potente depresor miocárdico en los niños y por este motivo no se recomienda en la edad pediátrica. El propanolol endovenoso es recurso de intensivista, porque el paciente tiene que estar en monitorización continua por el riesgo de hipotensión.
En la Fig. 16 se observa la conversión farmacológica de una TPSV con adenosina.
En el manejo del flutter auricular, además de realizar maniobras a nivel de urgencia es necesario determinar la coexistencia de trombos, a través de una ecografía en dos dimensiones, para utilizar anticoagulantes y planificar la cardioversión eléctrica, que debe ser realizada por especialistas. Si no hay trombos se pueden administrar bloqueadores beta o digital o también se puede ejecutar cardioversión eléctrica (Fig. 17).
Figura 17. Manejo del flutter auricular.
En la taquicardia ventricular es fundamental evaluar la inestabilidad hemodinámica y realizar cardioversión eléctrica en forma inmediata, ya que la sobrevida de estos pacientes, especialmente en caso de arritmias sin pulso, está determinada por el tiempo que se tarda en cardiovertir: si el procedimiento se logra en los primeros tres minutos la sobrevida es mayor de 50%, mientras que si demora más de 12 minutos la sobrevida se reduce a 5%. La reanimación previa a un shock eléctrico puede mejorar estas cifras.
En caso de taquicardia ventricular con pulso, después de evaluar la estabilidad hemodinámica y aplicar el ABC de apoyo vital, si no hay compromiso hemodinámico se debe administrar amiodarona en la dosis descrita o lidocaína endovenosa en dosis de 1 mg/kg. Si hay inestabilidad se debe intubar al paciente y aplicar cardioversión con 0,5 a 1 J/k. Para el manejo crónico de una taquicardia ventricular con pulso se pueden usar beta-bloqueadores, amiodarona oral o un desfibrilador implantable, que en la actualidad está disponible dentro del sistema AUGE y consiste en un marcapaso desfibrilador que se instala en el paciente y que frente a un episodio de taquicardia ventricular induce una descarga intracardíaca de intensidad menor. Los pacientes con síndrome QT prolongado sintomáticos tienen indicación perentoria de desfibrilador implantable.
En caso de taquicardia ventricular sin pulso, sea fibrilación o taquicardia ventricular, se recomienda desfibrilar y no cardiovertir. La desfibrilación se lleva a cabo con cargas de 2 a 4 J/k cada 2 minutos por tres veces, en cargas progresivas de 2, 2 a 4 y 4 J, asociado a maniobras de resucitación entre cada descarga e intubación. Si no hay resultado se administra adrenalina en bolo en dosis de 0,1 mg/k diluido 1:10.000 y se procede a una cuarta desfibrilación con 4 J/k, más amiodarona 5 mg/k endovenoso, lidocaína 1 mg/k endovenoso o sulfato de magnesio 25 a 50 mg/k endovenoso; este último se usa en pacientes con torsión de puntas, seguido de una quinta desfibrilación asociada a maniobras de resucitación.
En actividad eléctrica sin pulso y asistolía se emplea adrenalina y simultánamente se descartan patologías que puedan inducir esta arritmia, como taponamiento cardíaco, hemotórax, pericarditis o trastorno hidroelectrolítico asociado. El manejo crónico, al igual que en las taquicardias ventriculares, se realiza con beta-bloqueadores y amiodarona y está indicado el desfibrilador, especialmente en pacientes con QT prolongado.
Entre las bradiarritmias patológicas están la enfermedad del nódulo sinusal, los bloqueos AV de primer, segundo y tercer grado y los bloqueos de rama, como el bloqueo completo de rama derecha (BCRD) y el hemibloqueo anterior izquierdo (HBIA).
Enfermedad del nódulo sinusal: arritmia muy rara de encontrar en forma primaria en los niños; se presenta como secuela en pacientes sometidos a operación cardíaca tipo Fontan de ventrículos únicos, debido a manipulación auricular. En esta alteración el marcapaso endógeno es disfuncional, por lo que genera frecuencias menores y a veces frecuencias mayores, lo que se considera como manifestación grave.
Bloqueos auriculoventriculares: son trastornos a nivel del nódulo auriculoventricular que se clasifican en primer, segundo y tercer grado. Los bloqueos parciales o completos de rama se observan en pacientes operados, debido a manipulación intraventricular; el hemibloqueo izquierdo anterior se presenta en pacientes con cardiopatías tipo comunicación interauricular. El bloqueo AV de primer grado se diagnostica por la presencia de un intervalo PR mayor que el rango normal para la edad; se asocia a uso de digital, que produce aumento del PR como una de las primeras manifestaciones y también se presenta en pacientes con miocarditis, fiebre reumática y portadores de comunicación interauricular, especialmente en aquellos operados de cardiopatía. Pueden ser bloqueos transitorios asociados a alguna patología subsecuente y muchas veces no progresan a bloqueos completos, por lo que es conveniente manejar los factores que puedan determinar su presencia (Fig. 18).
Figura 18. Bloqueo AV de primer grado.
El bloqueo AV de segundo grado se subdivide en tipo Mobitz I o Wenckebach y tipo Mobitz II. En el bloqueo Mobitz I el intervalo PR aumenta en forma progresiva hasta que un impulso no se conduce, es decir, una onda P no es seguida por un complejo QRS. Esta alteración se presenta tras cirugía cardiovascular, en pacientes con miocarditis, usuarios de digital y en niños mayores o adolescentes sanos durante el dormir profundo sin importancia patológica, ya que no suelen progresar a bloqueos completos (Fig. 19).
Figura 19. Bloqueo AV de segundo grado Mobitz I o Wenckebach.
El bloqueo AV de segundo grado Mobitz II presenta un patrón de bloqueo constante, en general se conducen dos impulsos y se bloquea uno, pero este tipo de arritmia, a diferencia del Mobitz I, puede progresar a bloqueo completo y en algunos casos tiene indicación de marcapaso definitivo (Fig. 20).
Figura 20. Bloqueo AV de segundo grado Mobitz II.
El bloqueo AV completo se caracteriza por ausencia de transmisión del impulso a nivel del nódulo auriculoventricular, lo que provoca disociación entre la frecuencia de impulsos que se origina en el nódulo sinusal a nivel de aurícula y la frecuencia que se origina en ventrículos, que es menor (Fig. 21).
Figura 21. Bloqueo AV completo.
El bloqueo AV completo se clasifica en congénito y adquirido. El congénito afecta a 1 en 27.000 recién nacidos vivos; puede pasar inadvertido si el niño tiene una frecuencia cardioventricular aceptable, pero puede motivar consulta o derivación de emergencia a cualquier edad, ya que es una causa importante de síncope en la infancia. Se puede presentar en forma aislada, no asociado a cardiopatía, en madres portadoras de mesenquimopatía como lupus eritematoso sistémico o asociado a alteraciones como ventrículo único, transposición de grandes vasos, comunicación aurículoventricular o tumores. Se diagnostica en etapa prenatal cuando se pesquisa una frecuencia cardíaca de 60 a 80 lpm en la ecografía. El bloqueo adquirido se asocia a cirugías o cateterismos cardíacos, enfermedades infecciosas como la endocarditis y fiebre reumática, miocardiopatías por depósito o fibrosis, trastornos hidroelectrolíticos como hiperpotasemia, intoxicación con algunas drogas, enfermedades del colágeno y enfermedad coronaria (Fig. 22).
Figura 22. Bloqueo AV completo congénito en hijo de madre con lupus eritematoso sistémico.
La manifestación clínica más grave de bloqueo AV es el síncope o muerte súbita recuperada. Según el tiempo de evolución y la frecuencia que maneje el paciente puede presentar sintomatología de insuficiencia cardíaca congestiva, en niños mayores; y con frecuencias más tolerables el paciente puede tener cierto grado de intolerancia al ejercicio como único síntoma. El diagnóstico se efectúa con ECG y, según lo que indique el examen general completo, se agrega ecocardiografía para determinar la existencia de patología de base o holter para determinar la indicación de marcapaso.
El manejo se realiza transitoriamente con atropina o Isuprel ® (isoproterenol) en una unidad de cuidados intensivos, mientras se espera por la instalación de un marcapaso transitorio o definitivo. El marcapaso definitivo se indica en pacientes con síncope o muerte súbita recuperada, portadores de insuficiencia cardíaca, recién nacidos o lactantes con frecuencias bajo 50 o 55 lpm, niños mayores con frecuencias menores de 45 lpm, adolescentes con frecuencias menores de 40 por minuto, presencia de bloqueo AV en pacientes sometidos a cirugía cardíaca de más de 15 días de evolución y en enfermedad del nódulo sinusal.
Doniger S. Pediatric Dysrhythmias. Pediatr Clin North Am 2006; 53(1):85-105.

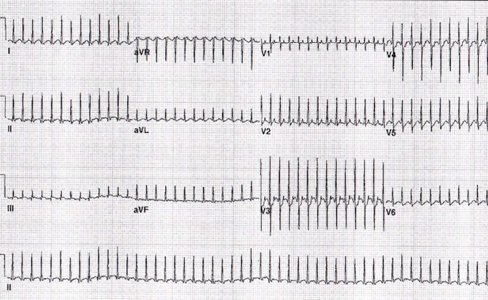 Figura 1. TSV paroxística reciprocante ortodrómica.
Figura 1. TSV paroxística reciprocante ortodrómica.

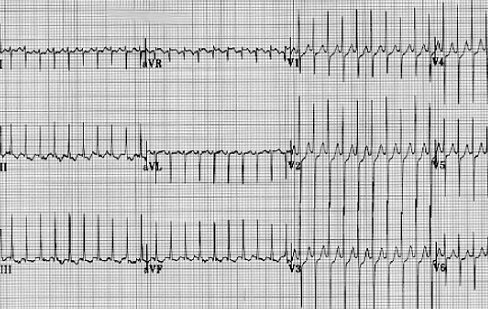 Figura 2. TSV paroxística sin ondas P ni T visibles.
Figura 2. TSV paroxística sin ondas P ni T visibles.

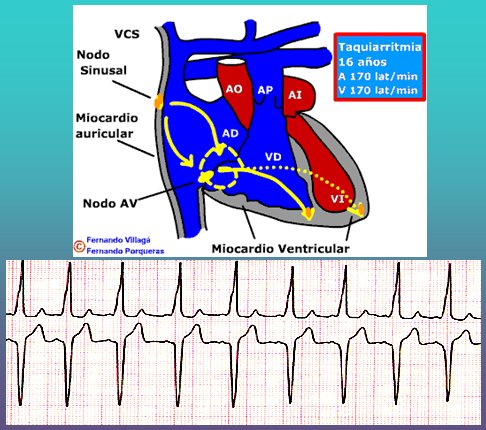 Figura 3. Esquema fisiopatológico del síndrome de Wolf Parkinson White.
Figura 3. Esquema fisiopatológico del síndrome de Wolf Parkinson White.

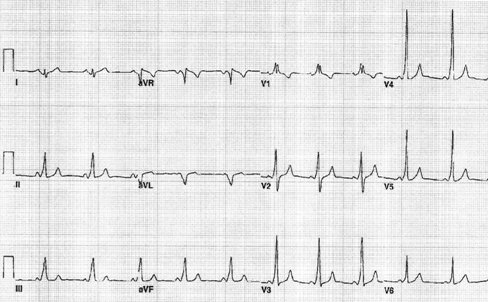 Figura 4. Diagnóstico de síndrome de WPW en ECG con ritmo sinusal.
Figura 4. Diagnóstico de síndrome de WPW en ECG con ritmo sinusal.

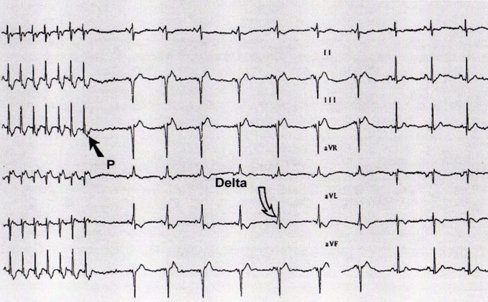 Figura 5. Conversión de síndrome de WPW tras administración de adenosina.
Figura 5. Conversión de síndrome de WPW tras administración de adenosina.

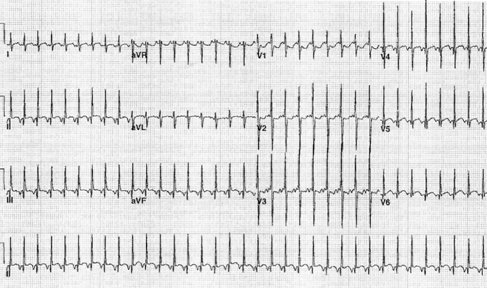 Figura 6. Taquicardia reciprocante de la unión o PJRT.
Figura 6. Taquicardia reciprocante de la unión o PJRT.

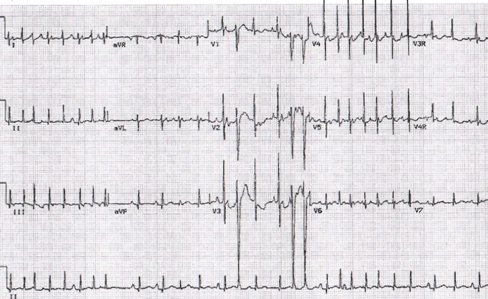 Figura 7. Taquicardia auricular multifocal.
Figura 7. Taquicardia auricular multifocal.

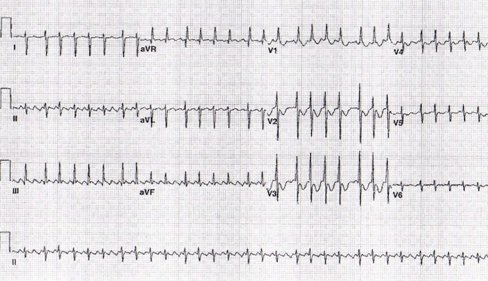 Figura 8. Flutter auricular con bloqueo 2:1. Frecuencia auricular 300 lpm y ventricular, 150.
Figura 8. Flutter auricular con bloqueo 2:1. Frecuencia auricular 300 lpm y ventricular, 150.

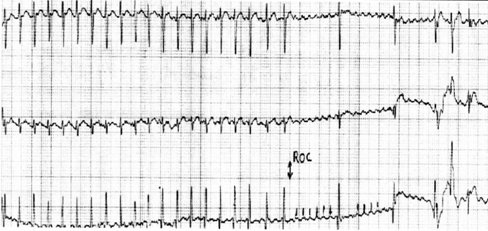 Figura 9. Flutter auricular tras la administración de adenosina. Onda auricular en serrucho seguida por complejo QRS.
Figura 9. Flutter auricular tras la administración de adenosina. Onda auricular en serrucho seguida por complejo QRS.

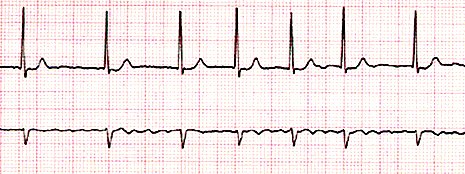 Figura 10. Fibrilación auricular.
Figura 10. Fibrilación auricular.

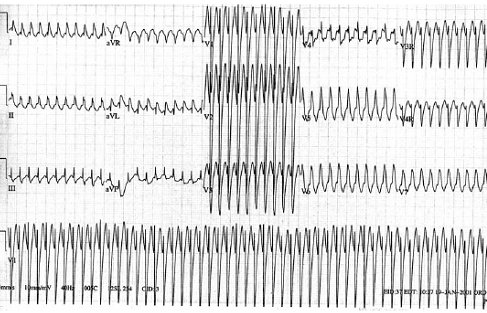 Figura 11. Taquicardia ventricular con QRS ancho y patológico.
Figura 11. Taquicardia ventricular con QRS ancho y patológico.

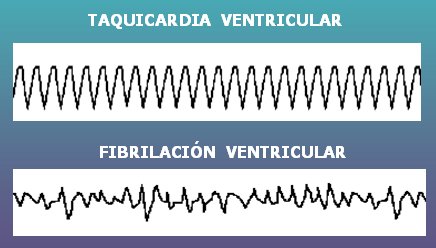 Figura 12. Taquicardia ventricular versus fibrilación ventricular.
Figura 12. Taquicardia ventricular versus fibrilación ventricular.

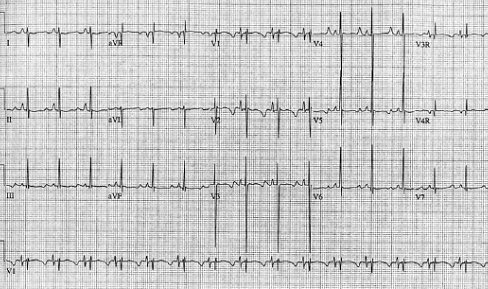 Figura 13. Síndrome QT prolongado. QTc 578 milisegundos ó 0,57 segundos.
Figura 13. Síndrome QT prolongado. QTc 578 milisegundos ó 0,57 segundos.

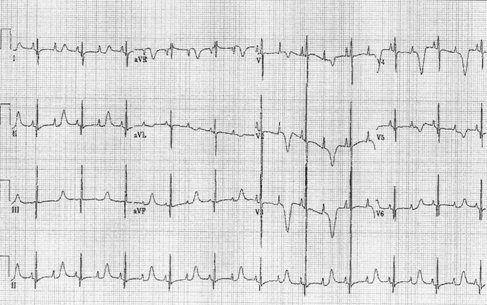 Figura 14. Síndrome QT prolongado con bloqueo 2 x 1.
Figura 14. Síndrome QT prolongado con bloqueo 2 x 1.

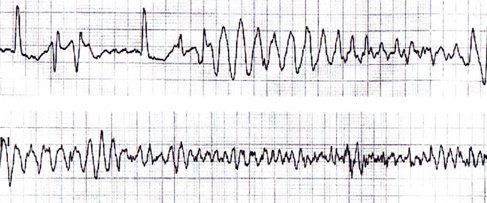 Figura 15. Torsión de puntas.
Figura 15. Torsión de puntas.

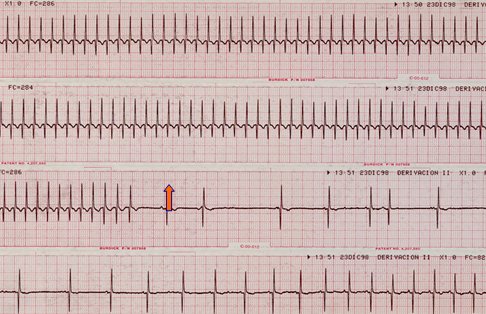 Figura 16. Conversión farmacológica de TPSV (300 lpm) con adenosina. Se aprecia conversión paulatina a ritmo sinusal.
Figura 16. Conversión farmacológica de TPSV (300 lpm) con adenosina. Se aprecia conversión paulatina a ritmo sinusal.

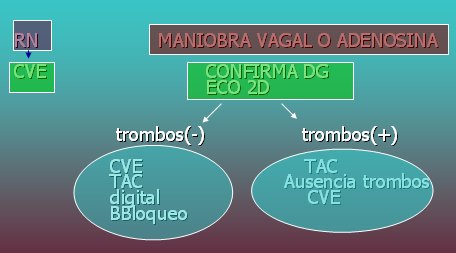 Figura 17. Manejo del flutter auricular.
Figura 17. Manejo del flutter auricular.

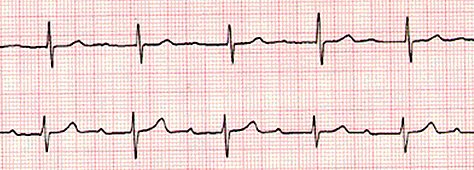 Figura 18. Bloqueo AV de primer grado.
Figura 18. Bloqueo AV de primer grado.

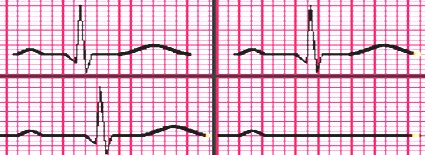 Figura 19. Bloqueo AV de segundo grado Mobitz I o Wenckebach.
Figura 19. Bloqueo AV de segundo grado Mobitz I o Wenckebach.

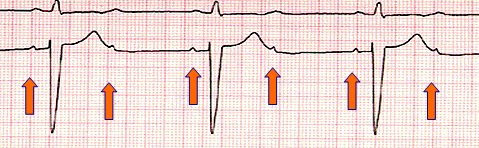 Figura 20. Bloqueo AV de segundo grado Mobitz II.
Figura 20. Bloqueo AV de segundo grado Mobitz II.

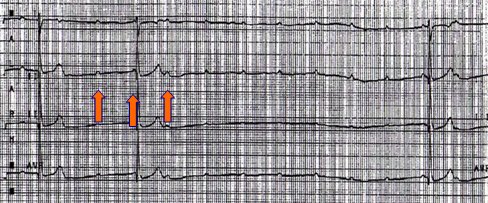 Figura 21. Bloqueo AV completo.
Figura 21. Bloqueo AV completo.

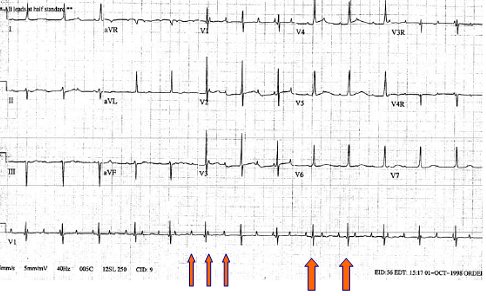 Figura 22. Bloqueo AV completo congénito en hijo de madre con lupus eritematoso sistémico.
Figura 22. Bloqueo AV completo congénito en hijo de madre con lupus eritematoso sistémico.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada de una conferencia dictada en el XVII Curso de Extensión de Pediatría, organizado por el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, el Departamento de Pediatría Centro de la Facultad de Medicina de la Universidad de Chile, el Servicio de Salud Metropolitano Central y la Dirección de Atención Primaria. Se realizó entre el 01 de abril y el 25 de noviembre de 2008 y sus directores fueron el Dr. Francisco Barrera y la Dra. Cristina Casado.
 Autora:
Claudia García[1]
Autora:
Claudia García[1]

Citación: García C. Cardiac arrhythmia. Medwave 2009 Sep;9(9):e4151 doi: 10.5867/medwave.2009.09.4151
Fecha de publicación: 1/9/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión