Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XV Curso de Extensión de Pediatría, organizado por el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, el Departamento de Pediatría Centro de la Facultad de Medicina de la Universidad de Chile, el Servicio de Salud Metropolitano Central y la Dirección de Atención Primaria. Se realizó entre abril y noviembre de 2006, y sus directores fueron el Dr. Francisco Barrera y la Dra. Cristina Casado.
La epistaxis recurrente es un motivo frecuente de consulta en pediatría. La mayoría de los casos son leves y autolimitados, pero hay un pequeño porcentaje de casos graves, que pueden producir anemia secundaria. En la anamnesis del paciente que consulta por epistaxis es muy importante preguntar por los antecedentes personales y familiares de sangrado e investigar en forma dirigida la historia de petequias, púrpura, equimosis de fácil aparición, hemorragias quirúrgicas o alveolorragias posteriores a extracciones dentarias, así como antecedentes de síndrome de mala absorción y de ingesta de medicamentos antiplaquetarios.
La irrigación de la nariz proviene de la arteria carótida interna y externa, y de sus ramas; por un lado está la carótida interna, con las arterias etmoidales anterior y posterior, que irrigan la parte posterior y superior de la nariz; de la carótida externa viene la arteria maxilar interna, cuya rama, la arteria esfenopalatina, irriga la parte posterior e inferior de la nariz, por medio de las arterias nasales. En la porción anterior del tabique nasal (Fig. 1), se originan anastomosis y se forma un verdadero plexo vascular que se conoce como plexo de Kiesselbach: 90% de las epistaxis se originan en esa zona.
Figura 1. Vascularización de la nariz.
En cuanto a la etiología de la epistaxis, las causas pueden ser locales o generales (sistémicas). Entre las causas locales está la ruptura de vasos de la zona de Little o de Kiesselbach, por sequedad de la mucosa; la desviación del tabique nasal; traumatismos nasales; la epistaxis digitorum, por grataje de la nariz con los dedos; la presencia de cuerpo extraño intranasal, que suele ocurrir en los niños más pequeños; y rinitis virales o bacterianas. Dentro de las causas sistémicas o generales están las discrasias sanguíneas; la ingesta de Aspirina o antiinflamatorios no esteroidales (AINES); la mielosupresión secundaria a quimioterapia; la hipertensión arterial, más bien en personas mayores; y la telangectasia hemorrágica familiar, que es un cuadro grave. El diagnóstico de la epistaxis es muy fácil, porque consiste en una hemorragia externa evidente. La rinoscopía anterior, en las epistaxis anteriores, que son mucho más frecuentes, es suficiente para hacer el diagnóstico. Las epistaxis posteriores sangran hacia la rinofaringe, por lo que pueden causar una pseudohematemesis, debido a la sangre deglutida.
El tratamiento local es fundamental, cualquiera sea la causa de la epistaxis. La primera medida es el taponamiento nasal anterior, que se puede hacer con algodón a presión, al que se puede agregar un vasoconstrictor, como adrenalina, o un antifibrinolítico local, como el ácido tranexámico; este tapón se debe mantener durante 3 a 7 días, según la cuantía de la hemorragia. Si no es suficiente el taponamiento nasal, se puede cauterizar el sitio sangrante con nitrato de plata. En las epistaxis posteriores se hace un taponamiento nasal posterior, que consiste en introducir una sonda Foley por la fosa nasal que sangra hasta llegar a la rinofaringe, donde se infla el balón y se tracciona para que quede enclavado en la coana, lo que determina vasoconstricción de la mucosa. En caso de epistaxis masiva, incluso se puede hacer una ligadura de la arteria maxilar interna y sus ramas.
La epistaxis se debe estudiar cuando es recurrente o masiva, al punto de causar anemia o necesitar transfusión; cuando forma parte de una enfermedad hemorragípara general; cuando hay antecedente de trastorno de coagulación en un miembro de la familia; cuando hay pruebas de coagulación alteradas en exámenes preoperatorios; y cuando hay sangrado difuso, sin explicación, durante una operación o una extracción dentaria, o después de ella. La etiología de la epistaxis, como todo sangrado mucocutáneo, puede deberse a una trombocitopenia, disfunción plaquetaria, enfermedad de Von Willebrand o telangectasia hemorrágica hereditaria, que son las causas más frecuentes.
La coagulación se compone de tres partes principales: la hemostasia primaria, la hemostasia secundaria o coagulación propiamente tal, y el sistema fibrinolitico. La hemostasia primaria (Fig. 2) se pone en marcha cuando se produce una lesión vascular, de modo que se expone el subendotelio; luego, la interacción entre el colágeno, la fibronectina y el factor de Von Willebrand provoca la adhesión plaquetaria, con lo que la plaqueta cambia de forma: se contrae, liberando serotonina y tromboxano-ADP. La consecuencia de este fenómeno es la agregación plaquetaria; posteriormente se forma el trombo plaquetario, que es muy frágil, y luego viene la segunda etapa, que es la hemostasia secundaria.
Figura 2. Hemostasia primaria.
La hemostasia secundaria tiene una vía intrínseca y una vía extrínseca, y ambas tienen una vía común. En la vía intrínseca siguen actuando los factores XII, XI y IX, que se activan y luego activan el factor X y lo transforman en X activado. La vía extrínseca, que puede activarse también debido a un trauma, también activa el factor X, por intermedio del factor VII, y ahí parte la vía común. En ésta, el factor X activa el factor V, el que actúa sobre la protrombina y la transforma en trombina, la que, a su vez, actúa sobre el fibrinógeno y forma la fibrina. El factor XIII interviene como factor estabilizador de la fibrina y origina una fibrina entrecruzada, mucho más firme y eficiente desde el punto de vista hemostático.
Figura 3. Hemostasia secundaria.
Por último, el sistema fibrinolítico permite que se recanalice el vaso sanguíneo que ha quedado obstruido por el coágulo. Esta etapa comienza con la activación del plasminógeno plasmático, el que así se convierte en plasmina; la acción de esta última sobre la fibrina causa la aparición de los productos de degradación de la fibrina (PDF). A su vez, la plasmina queda inactivada por un sistema de antiplasminas compuesto por la alfa 2 antiplasmina y la alfa 2 macroglobulina, lo que permite la recanalización del vaso (Fig. 4).
Figura 4. Sistema fibrinolítico.
La hemostasia primaria se evalúa mediante el tiempo de sangría, o método de Ivy, que es una prueba global para medir in vivo la pared vascular; el número de plaquetas, sobre todo cuando es menor de 50.000; la adherencia de las plaquetas al subendotelio; y la agregación plaquetaria. Consiste en hacer una incisión de 1 cm de largo y 1 mm de profundidad en la cara anterior del antebrazo y medir el tiempo que demora en coagular la sangre. El valor normal es de 3 a 8,5 minutos, pero puede variar de un laboratorio a otro. El tiempo de sangría se altera en presencia de alteración de la pared vascular; trombocitopenia, en especial menor de 50.000; defecto de adherencia de las plaquetas al subendotelio, como ocurre en la enfermedad de Von Willebrand, uno de los diagnósticos diferenciales de la epistaxis; defectos de la secreción plaquetaria; trombocitopatías adquiridas por enfermedad hepática o renal; fármacos, como Aspirina, ticlopidina y clopidogrel.
La función plaquetaria se estudia mediante agregometría, prueba que permite estudiar la función plaquetaria in vitro y cuyo resultado se expresa como porcentaje de agregación. También es posible, en algunos laboratorios, estudiar las glicoproteínas de membrana de las plaquetas, la cinética plaquetaria y la retracción del coágulo. La hemostasia secundaria, o coagulación propiamente tal, se puede evaluar mediante la tromboplastina parcial activada (TTPA o tiempo de cefalina), que es el tiempo de coagulación al añadir al plasma una sustancia con carga negativa; dicha sustancia es el Kaolín, que activa la vía intrínseca. El kaolín se altera en caso de déficit de los factores de la vía intrínseca VIII, IX, X, XI, XII, precalicreína y cininógeno de alto peso molecular; y en presencia de heparina y anticoagulante lúpico.
La vía extrínseca de la coagulación se evalúa con el tiempo de protrombina de Quick, que es el tiempo de coagulación al añadir al plasma tromboplastina (factor tisular, fosfolípido, calcio) y que mide la vía extrínseca, es decir, los factores II, V, VII, X y I. Se alarga en caso de hepatopatía y en presencia de anticoagulantes orales; por eso, los tratamientos con anticoagulantes orales se monitorizan con los valores del tiempo de protrombina. El tiempo de trombina es el tiempo de coagulación obtenido al añadir al plasma una concentración baja de trombina; mide la capacidad de polimerizar del fibrinógeno y es muy sensible a la heparina; se alarga en la hipofibrinogenemia y cuando están aumentados los PDF. También permite medir los factores, fibrinógeno, heparina I, II, V, VII y X y los factores VIII, IX, XI, XII.
Otra prueba de coagulación es la medición del factor Von Willebrand, mediante la actividad del cofactor ristocetina, que se mide con técnica de aglutinación. Para este efecto se utiliza un reactivo que contiene plaquetas humanas estabilizadas, ristocetina y EDTA, y que induce agregación plaquetaria, mediante unión del factor Von Willebrand a los receptores GPIb ubicados sobre la plaqueta. Otro posible examen es el análisis de la composición multimérica del factor Von Willebrand, que informa sobre la estructura y distribución de los distintos multímeros, pero es una prueba difícil, no está siempre disponible y está sujeta a diversos factores. También se puede hacer detección de inhibidores.
En la Tabla I se resumen las diferencias entre la epistaxis vascular, que es la causa más frecuente en pediatría y que explica 98% a 99% de los casos de epistaxis recurrente, y la enfermedad de Von Willebrand, de baja prevalencia, pero que es el principal diagnóstico diferencial. La epistaxis vascular es de alta prevalencia en los niños, a causa de una fragilidad capilar; da manifestaciones localizadas a nivel nasal; las pruebas de hemostasia son normales; da epistaxis en la edad preescolar y regresa en la pubertad; hay historia familiar de epistaxis recurrente, por lo general en el padre; y el tratamiento clásico es con vitamina C y citroflavonoides. En cambio, la enfermedad de Von Willebrand, que también causa epistaxis recurrente, tiene una prevalencia de 0,8 de la población en Chile; su causa es la falta de adherencia de la agregación plaquetaria y de la coagulación; da epistaxis recurrentes y hemorragias desproporcionadas durante una cirugía o después de ella; es muy frecuente que se manifieste como una hemorragia importante después de una tonsilectomía y adenoidectomía; el TTPA y el tiempo de sangría están prolongados; la epistaxis parte en la edad preescolar y por lo general es permanente, aunque a veces tiende a regresar en la pubertad, porque los estrógenos aumentan el factor Von Willebrand; y hay historia familiar positiva. El tratamiento dependerá del tipo de enfermedad de Von Willebrand.
Tabla I. Epistaxis vascular y enfermedad de Von Willebrand.
El factor Von Willebrand (FVW) es una plasmoproteína completa, grande, compuesta por 2.791 aminoácidos que forman monómeros, dímeros y multímeros. El gen del FVW se localiza en el cromosoma 12. Este factor tiene dos funciones en la hemostasia: por un lado es mediador de la adherencia plaquetaria al endotelio vascular dañado, en el cual el FVW se une a los receptores GPIb y GPIIb/GPIIIa de las plaquetas y favorece la formación del trombo plaquetario, que es la primera fase en la hemostasia primaria; por otro lado, actúa como proteína transportadora y estabilizadora del factor VIII, el que actúa en el proceso de la coagulación y formación de la fibrina. Gracias al FVW, el factor VIII tiene una sobrevida normal; en ausencia de aquél, se depura rápidamente de la sangre. El FVW se sintetiza en las células endoteliales y los megacariocitos; 85% de lo que se produce se almacena en los gránulos secretorios de Weibel-Palade, en las células endoteliales, y 15% se almacena en los gránulos alfa de las plaquetas.
La enfermedad de Von Willebrand es la más frecuente de las enfermedades hemorragíparas hereditarias; su prevalencia es de 0,8% a 2% de la población; afecta por igual a hombres y mujeres; es de herencia autosómica dominante y tiene alto poder de penetración y gran heterogeneidad dentro de la familia; se caracteriza por la disminución cuantitativa o cualitativa del FVW plasmático y alteración de la hemostasia primaria y de la coagulación. En 1926, Eric Von Willebrand describió un raro trastorno hemorragíparo en una familia que vivía en la costa de Finlandia, cuyo cuadro clínico constituye la enfermedad que lleva su nombre y que se caracteriza por hemorragia mucocutánea (80%) y con la epistaxis a repetición como uno de los signos más frecuentes; puede haber equimosis (76%), alveolorragia (50%), gingivorragia (47%), hemorragia intraoperatoria o post cirugía (60%), menorragia y metrorragia en la mujer.
Este cuadro clínico presenta gran variabilidad clínica dentro de la misma familia; los síntomas no son constantes y hay períodos asintomáticos. La mayoría de los portadores son sintomáticos leves y no requieren tratamiento especial; y sólo 65% de los heterocigotos tienen síntomas. El diagnóstico de la enfermedad de Von Willebrand es complejo y difícil; se requiere una buena historia clínica, la que no se puede reemplazar con los estudios de laboratorio, si bien ellos sirven como complemento. El tiempo de sangría está alargado; el estudio de la molécula del factor VIII demuestra que está disminuida en la misma proporción que el FVW y puede ser una macromolécula. En la determinación antigénica cuantitativa del FVW se encuentran disminuidas las formas 1 y 3 de este factor. La medición de la actividad del FVW mediante CoF Ristocetina determina la velocidad con que el FVW plasmático aglutina las plaquetas normales; su valor se encuentra disminuido en todas las formas de la enfermedad. Otra prueba es la aglutinación de plaquetas inducidas con ristocetina (APIR), la que se encuentra disminuida en esta enfermedad, pero es poco sensible en las formas leves; sirve en el tipo 2-B plaquetario.
El análisis multimérico del FVW antigénico no está disponible en todos los laboratorios, porque exige mucha experiencia, ya que se hace por electroforesis. Además, los valores se pueden alterar debido a una serie de factores, como la edad, el sexo, los ciclos hormonales, el hipo o hipertiroidismo y el embarazo. También está el problema del control genético del grupo sanguíneo: se sabe que el grupo ABO tiene una influencia importante en los niveles de antígeno FVW; el grupo O tiene los niveles más bajos, con 75 U/dL, seguido por el grupo A, con 106 U/dL; el B, con 117 U/dL; y, finalmente, el grupo AB, con 123 U/dL, lo que dificulta la determinación de un punto de corte exacto.
La clasificación de la enfermedad de Von Willebrand se basa en el fenotipo de la enfermedad en plasma y plaquetas. El tipo 1, que es la forma más frecuente, es una deficiencia cuantitativa parcial del FVW (80%); el FVW funcional corresponde a 20% a 50% de lo normal. El tipo 2 es una deficiencia cualitativa de la enfermedad de Von Willebrand y tiene 4 subtipos: A, B, M y N. El tipo 3 es la deficiencia completa de factor Von Willebrand; es la forma menos frecuente, pero la más grave. De los tipos 2, el 2A es una variante con disminución de la función del FVW asociada con ausencia de multímeros de alto peso molecular, lo que se asocia con sensibilidad aumentada a la proteolisis. La variante 2B es una variante cualitativa y se caracteriza por aumento de la afinidad del FVW por la GPIb plaquetaria; también es un Von Willebrand plaquetario. El 2M es una variante con disminución de la función del FVW, cuya estructura multimérica es normal, pero que cualitativamente es anormal. El cuarto subtipo, 2N, es una variante cualitativa con marcada disminución de la afinidad por el factor VIII C. Es similar a la hemofilia A, por lo que puede inducir a un diagnóstico erróneo. En este caso puede dar epistaxis, porque el factor VIII no se puede unir con el punto Von Willebrand y se depura rápidamente de la circulación hasta llegar a niveles de 3% a 5%.
El tratamiento de la enfermedad de Von Willebrand exige diagnóstico de certeza y clasificación del tipo de enfermedad, ya que a cada uno de los tipos corresponde un tratamiento de elección y uno de alternativa. El tipo 1, que es el más frecuente, se trata con DDAVP (desmopresina), que tendría utilidad; como alternativa se utiliza crioprecipitado o liofilizado. El tipo 2A se trata con crioprecipitado o liofilizado; el tipo 2B, también con crioprecipitado o liofilizado, pero a veces hay que transfundir plaquetas. El DDAVP puede causar trombopenia. El tipo 3 también necesita crioprecipitado o liofilizado. En la Tabla II se resume lo expuesto.
Tabla II: Tratamiento de la enfermedad de Von Willebrand, según tipo.
La DDAVP (1-deamino-8-D-arginina vasopresina) es un análogo sintético de la vasopresina, que aumenta el factor VIII y el FVW; hay un preparado parenteral endovenoso y un spray nasal. La dosis es de 0,3 a 0,4 ug/kg endovenoso en el Von Willebrand tipo 1; en la preparación nasal se administran 150 ug, lo que equivale a un puff nasal para pacientes de menos de 50 kg. El efecto máximo se obtiene en 30 a 60 minutos: acorta el tiempo de sangría y disminuye la hemorragia; puede tener efectos colaterales, por ejemplo cefaleas, taquicardia, aumento de la presión arterial, convulsiones, aunque son raras, y rubicundez facial.
El crioprecipitado contiene 100 U de factor VIII; 100 U de FVW; 250 mg de fibrinógeno; factor XIII y fibronectina. El FVW que contiene el crioprecipitado es de composición multimérica adecuada, por eso es de primera elección, en relación con el liofilizado. La dosis generalmente es una bolsa por cada 10 kg de peso o 25 U de factor VIII por kg de peso, pero depende de la hemostasia que se necesite: para una cirugía pequeña esto es suficiente, aunque se puede repetir cada 6 u 8 horas; pero si es una gran cirugía la dosis deberá ser mayor. Para calcularla, se multiplica el porcentaje de FVW que se desea obtener por el peso de paciente dividido por 2. Por ejemplo: si se desea obtener 40% del factor, se multiplica 40 por el peso y se divide por 2 y el resultado es la cantidad de FVW que se requiere para conseguir la hemostasia. El liofilizado contiene principalmente factor VIII, con poco FVW. Existe un preparado, que todavía no habría llegado a Chile, de nombre comercial Humate-P, que tiene FVW adecuado, con los multímeros conservados y se utiliza en dosis de 10 U/kg de peso endovenoso, según la hemostasia que se requiera.
El tratamiento de la enfermedad de Von Willebrand sigue siendo empírico y controvertido, ya que no hay correlación entre la clínica y el laboratorio que permita monitorizar la terapia de sustitución, especialmente en el Von Willebrand leve y moderado. En el Von Willebrand grave es más fácil hacer el diagnóstico, pero se necesita una buena historia, la que no se puede reemplazar con exámenes del laboratorio, porque, por un lado, se necesita un laboratorio muy experimentado que haga todas las pruebas y, por otro lado, hay que saber interpretarlas de acuerdo con una serie de factores que pueden modificarlas. Incluso una venopunción muy difícil puede desencadenar la cascada de la coagulación, de modo que es difícil saber interpretar estos valores. Por eso es que la historia tiene mucha importancia. La terapia antifibrinolítica es útil como coadyuvante, ya que previene la lisis del coágulo después de que se alcanzó hemostasia con DDAVP o crioprecipitado. Los preparados que se utilizan son el ácido aminocaproico (EACA o Amicar), en dosis inicial de 100 mg/kg, seguida de 50 mg/kg cada 6 horas por 4 a 5 días, hasta detener la hemorragia; y el ácido tranexámico (Espercil), en dosis de 50 mg/kg/día endovenoso, fraccionado cada 6 a 8 horas.
El Síndrome de Bernard-Soulier también puede dar epistaxis recurrente. Es una enfermedad hemorragípara congénita poco frecuente, de herencia autosómica recesiva, causada por la ausencia de GP1b en la membrana plaquetaria. Se manifiesta por trombocitopenia leve y plaquetas gigantes al frotis, con sobrevida disminuida, tiempo de sangría prolongado y aglutinación plaquetaria con ristocetina, defectuosa. El tratamiento consiste en transfusión de concentrado de plaquetas en casos especiales, pero con cuidado, porque, como estas plaquetas tienen GP1b, pueden desencadenar la producción de isoanticuerpos, lo que a la larga determina que el paciente se vuelva refractario a la transfusión plaquetaria.
La Tromboastenia de Glanzman es una enfermedad hemorragípara congénita, también rara, en la que hay disfunción plaquetaria, la que consiste en una falla de la agregación de las plaquetas con los agonistas normales: ADP, colágeno, ristocetina, etc. Además, hay ausencia de GPIIb/IIIa, que son receptores de fibrinógeno. El recuento de plaquetas y la morfología son normales y el diagnóstico se hace por ausencia de agregación plaquetaria, con todos los agonistas, y ausencia de retracción del coágulo. El tratamiento también consiste en transfusión de plaquetas en casos graves y también existe el riesgo de que se generen isoanticuerpos y refractariedad a la transfusión plaquetaria.

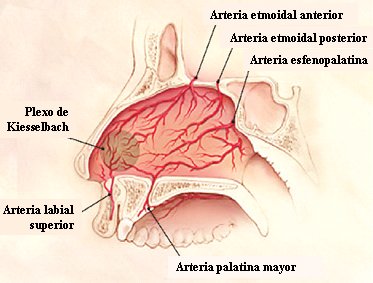 Figura 1. Vascularización de la nariz.
Figura 1. Vascularización de la nariz.

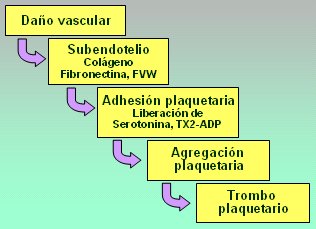 Figura 2. Hemostasia primaria.
Figura 2. Hemostasia primaria.

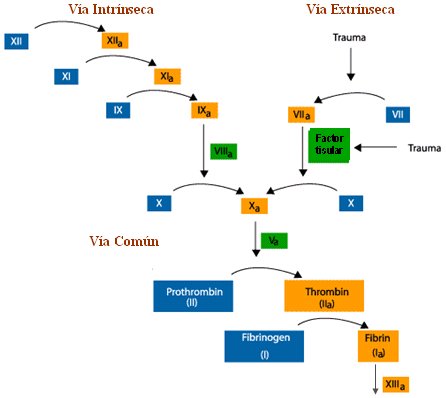 Figura 3. Hemostasia secundaria.
Figura 3. Hemostasia secundaria.

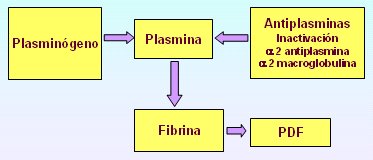 Figura 4. Sistema fibrinolítico.
Figura 4. Sistema fibrinolítico.

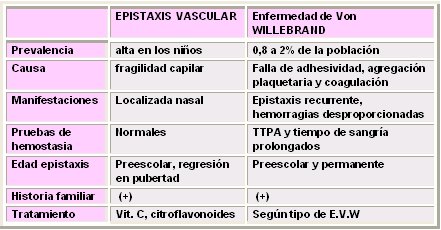 Tabla I. Epistaxis vascular y enfermedad de Von Willebrand.
Tabla I. Epistaxis vascular y enfermedad de Von Willebrand.

 Tabla II: Tratamiento de la enfermedad de Von Willebrand, según tipo.
Tabla II: Tratamiento de la enfermedad de Von Willebrand, según tipo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XV Curso de Extensión de Pediatría, organizado por el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, el Departamento de Pediatría Centro de la Facultad de Medicina de la Universidad de Chile, el Servicio de Salud Metropolitano Central y la Dirección de Atención Primaria. Se realizó entre abril y noviembre de 2006, y sus directores fueron el Dr. Francisco Barrera y la Dra. Cristina Casado.
 Expositora:
Irina Ocheretin P.[1]
Expositora:
Irina Ocheretin P.[1]

Citación: Ocheretin I. Epistaxis: when to consider further work-up?. Medwave 2007 Ene;7(1):e1981 doi: 10.5867/medwave.2007.01.1981
Fecha de publicación: 1/1/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión