El nombre del rotavirus se debe a su forma de rueda (rota, en latín, significa rueda), que se puede apreciar claramente en la microfotografía electrónica de la Figura 1. Este virus se aisló por primera vez en humanos en el año 1973, en biopsia duodenal de niños australianos que cursaban con cuadros de diarrea aguda; actualmente se sabe que el cuadro de gastroenteritis por rotavirus, o rotavirosis, puede ser leve, moderado o grave, debido a que este virus puede producir un daño importante y una destrucción masiva a nivel de las microvellosidades intestinales.
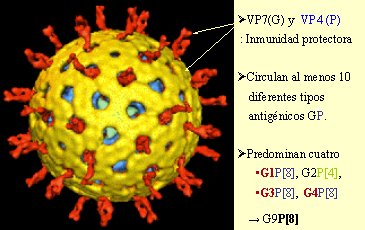
Rotavirus posee una triple capa proteica, es decir, tres cápsides que lo envuelven; en su interior contiene un ARN fragmentado, como el del virus influenza, con nueve segmentos; a la fecha se han descrito grupos de la A a la F, siendo el grupo A el que causa alrededor de 95% de las enfermedades en humanos. Este grupo A tiene a su vez distintos serotipos según la proteína de la cápside externa, que puede ser la proteína viral 4 y la proteína viral 7 (VP4 y VP7, respectivamente). VP4 es una proteasa (P) y corresponde a las puntas rojas que se ven en el esquema y VP7 es la glicoproteína (G), representada en amarillo.
Existen al menos diez combinaciones antigénicas VP4/VP7. En general, se habla de que la etiología es causada por P4G1 o P7G2, dependiendo de la característica proteica externa del rotavirus; pero en virología se clasifica de la siguiente manera: primero se escribe el serotipo VP4 (por ejemplo P1A, que es el más frecuente); luego, entre paréntesis cuadrados se anota el genotipo del VP4; y al final, el tipo de VP7 o G. Por ejemplo: P1A[8]G1. Esta es la forma en que se describen los distintos rotavirus que causan la enfermedad diarreica, desde el punto de vista virológico. En la Figura 1 se observa VP7G en amarillo y VP4, la proteasa, como una espícula roja. Existen diez diferentes tipos antigénicos de la unión GP, de los cuales predominan cuatro: G1P[8], G2P[4], G3P[8], G4P[8]; y en el último tiempo se agrega, en América Latina, el G9P[8], que está emergiendo.
Figura 1. Microfotografía electrónica de rotavirus
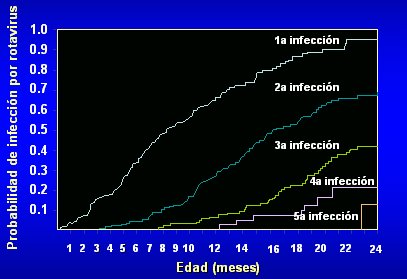
La probabilidad de infección por rotavirus afecta en forma especial a los menores de 36 meses. En la curva de la Figura 2 se observa que la posibilidad de un niño de infectarse va aumentando en los primeros 24 meses de vida, a medida que transcurre el tiempo, de modo que a los 20 meses de edad, cerca de 95% de los niños ha tenido una infección, lo que disminuye el riesgo de una segunda, tercera y cuarta infección; pero existe un riesgo cercano a 20% de tener una quinta infección en los primeros dos años de la vida.
Figura 2. Probabilidad de infección por rotavirus en los primeros 24 meses de vida (Reproducido de Velázquez et al. N Engl J Med. 1996;335:1022-1028)
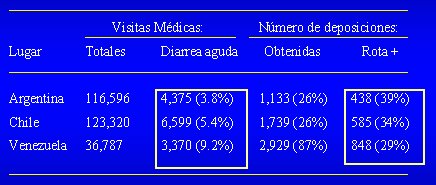
El impacto clínico de rotavirus quedó en evidencia en un trabajo del Dr. Miguel O´Ryan, pediatra investigador chileno que participó en un estudio multicéntrico efectuado en Argentina, Chile y Venezuela, en el que se hizo un seguimiento de 24 meses a niños menores de 36 meses de edad, con diarrea aguda. En Chile, de 123.320 consultas en este grupo etario, los episodios de diarrea correspondieron a 5,4%, es decir, 6.599 de las consultas médicas, de las cuales se tomaron 1.739 cultivos (en 26% de las diarreas). Como se puede ver, 34% de las diarreas fueron causadas por rotavirus (585 casos). En el mismo trabajo, de 4.773 niños que ingresaron a hospitales, en 5,9% la causa fue la diarrea aguda (283 casos) y la mitad de estos casos fue causada por rotavirus (130 pacientes, es decir, 47%). Por lo tanto, es un agente importante en América Latina, en el mundo y también en Chile (Tabla I).
Tabla I. Impacto de la diarrea aguda total y por rotavirus en consultas médicas. Niños menores de 36 meses de edad, período estudio 24 meses (O’Ryan M, Pérez-Schael et al. Ped Infect Dis J 2001; 20:685-93)
En el año en curso (2006) se publicó, en la Revista Chilena de Infectología, nuestra experiencia del Hospital San Borja-Arriarán en rotavirus intrahospitalario y de la comunidad, en 130 pacientes hospitalizados entre los años 2003-2004. De los que ingresaron al hospital con rotavirus de infección comunitaria, 80% eran mayores de seis meses de edad, a diferencia de lo que sucedió con la diarrea intrahospitalaria, que en la gran mayoría de los casos afectó a menores de seis meses, debido a que éstos requieren cambio de pañal en forma más frecuente, lo que facilita la transmisión entre pacientes. Se evaluó la gravedad de los lactantes con diarrea por rotavirus mediante la escala de Rennels, que tiene un máximo de 19 puntos y clasifica la diarrea en leve, con puntaje menor de 7; moderada, con 8 a 13 puntos; y grave, con más de 13.
En el grupo de la comunidad se clasificaron las diarreas de la misma forma y hubo un alto porcentaje de moderadas y leves intrahospitalarias, con una proporción significativamente mayor de diarreas graves en comparación con las del hospital, lo que se explica porque allí los niños están en observación y se instauran rápidamente las medidas de manejo, que es, precisamente, el objetivo de la hospitalización.
El aporte de este estudio al conocimiento del rotavirus en el medio nacional consistió en que se calculó el costo del manejo de una diarrea por rotavirus a nivel comunitario, en un total de 78 diarreas. Se estimó dicho costo en 143.805 pesos (es importante considerar que en el arancel FONASA hospitalario, un hemograma cuesta 800 pesos y la rotaforesis cuesta 1.200 pesos). Este valor es aproximadamente un 20% de lo que cuesta manejar a un paciente hospitalizado en una clínica privada, donde el gasto asciende a entre 400 y 800 mil pesos. En el caso del rotavirus nosocomial no se encontró diferencia, ya que el gasto fue de 139.423 pesos (Comportamiento clínico y costos de la gastroenteritis por rotavirus en lactantes: Adquisición comunitaria versus nosocomial, Luis Delpiano M., Joel Riquelme R., M. Cristina Casado F. y Ximena Álvarez H. Rev Chil Infect 2006; 23 (1):35-42).
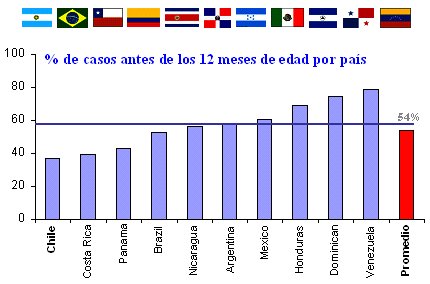
Un grupo latinoamericano compuesto por diez países, que estudió la epidemiología del rotavirus en América Latina entre los años 2000-2002, comprobó que a los seis meses de edad, 18% de los niños ya había presentado un episodio de rotavirosis; a los 12 meses, 54%; y a los 24 meses, 90% de la población infantil latinoamericana ya había tenido su primera rotavirosis. Si se analiza por país y se compara con un promedio de 54%, en Chile 38% los niños presentan su primera rotavirosis antes de los 12 meses de edad y la tasa va en aumento hasta llegar a Venezuela, donde 75% de los lactantes tienen un episodio de rotavirus en el primer año de vida. En este trabajo latinoamericano se observó que circularon diferentes serotipos entre los países durante el mismo período, predominando G1P8, con una baja circulación de G2P4. El serotipo G9P8 emergió en algunos países (Figura 3).
Figura 3. Porcentaje de casos de rotavirus antes de los doce meses de edad por país
Es importante, por lo tanto, que con la vacuna contra rotavirus no suceda lo mismo que con la vacuna conjugada antineumocóccica, que se diseñó para los países del hemisferio norte; la vacuna que se utilice en nuestro medio debería ser eficaz contra los serotipos más prevalentes en las comunidades latinoamericanas, como son G1P8, G2P4, G3P8, G4P8 y G9P8.
Se piensa que la infección por rotavirus puede ser enfrentada mediante una vacuna por las siguientes razones:
Por otra parte, en 1983 Bishop demostró que una infección precoz, en la edad neonatal o antes de los tres meses, protege a los niños contra la infección y la enfermedad en su vida posterior, que es lo mismo que ya se mencionó en cuanto a que después de la primera, segunda y tercera infección va disminuyendo el riesgo de infección, a medida que se desarrolla la respuesta inmune. Posteriormente se demostró una correlación entre la presencia de anticuerpos antirotavirus y protección contra la infección, lo que indica que existe una base inmunológica para plantear la utilidad de una vacuna.
Hoy, se sabe que la infección activa promueve la inmunidad humoral y celular, estimulando la producción de anticuerpos séricos medibles e IgA intestinal antirotavirus, que se han asociado con protección en modelos animales y humanos, aunque no existe un claro correlato entre el nivel de anticuerpos y el grado de protección. En animales, los anticuerpos anti VP4 y VP7 son protectores y en cultivo celular, son neutralizantes; y en humanos, la IgG sérica, que aparece después de una inmunización, la IgA sérica y la IgA fecal se han correlacionado con protección en algunos estudios, pero no en otros.
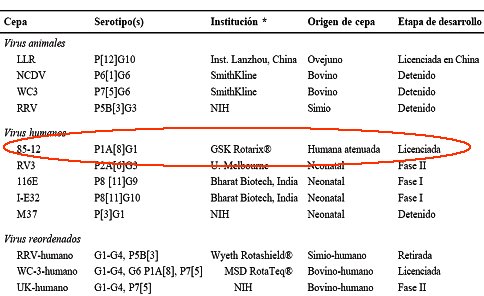
En 1998 se registró la vacuna Rotashield, de Wyeth, después de pasar las fases I, II y III de investigación, es decir, 25 años después de que se descubrió el virus. Después se licenciaron la vacuna china del laboratorio Lanzhou, la vacuna de la casa Merck Sharp & Dohme RotaTeq (en febrero de 2006) y la vacuna Rotarix, de la casa Glaxo-Smithkline, aprobada en septiembre del año 2004 por la FDA y en septiembre del año 2005, en Chile. Están en desarrollo las vacunas australiana, americana, inglesa y de la India. En resumen, a la fecha existen cuatro vacunas licenciadas para ser ocupadas en la especie humana, cuyas características se resumen en la Tabla II, donde se puede ver que se han elaborado a partir de cepas de procedencia humana, animal o mixta (humano-bovino). La vacuna Lanzhou tiene sólo un serotipo, sólo está licenciada en China y no se ha presentado para ser utilizada en países europeos o americanos; la Rotashield fue retirada del mercado; por lo tanto, la única disponible en Chile es la vacuna de Glaxo Smithkline, Rotarix. A continuación se analizarán las características de estas vacunas con detalle.
Tabla II. Características de las vacunas licenciadas anti rotavirus
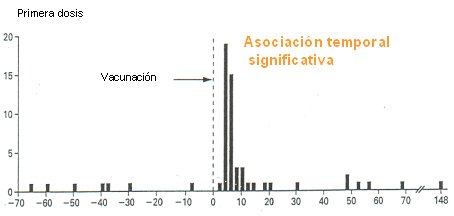
La primera vacuna disponible fue Rotashield. Entre los años 1980 y 1997 se realizaron los estudios de campo, que demostraron una eficacia de 50% contra la infección y de 80% contra la infección grave; y en los estudios de fase II y fase III se habló de una “posibilidad” de asociación de esta vacuna con invaginación intestinal. En 1998 fue aprobada por la Academia Americana de Pediatría para uso universal en Estados Unidos, indicando la necesidad de vigilar los casos de invaginación; así, la vacuna Rotashield, una vacuna recombinante (simio-humano) tetravalente, es decir, contra cuatro serotipos, fue licenciada en Estados Unidos en 1998. Sin embargo, tuvo que ser retirada del mercado en 1999, debido a que se encontró una relación de causalidad con intususcepción intestinal, con un odds ratio de 3-7:25, es decir, los niños vacunados tenían un riesgo 25 veces mayor de presentar este cuadro que los no vacunados. En la Figura 4 se observa el riesgo de intususcepción antes de introducir la vacuna y el aumento significativo del riesgo durante la primera semana después de la vacunación, en especial, después de la segunda dosis.
Figura 4. Rotashield e intususcepción (Murphy et al, N Engl J Med 2001 344 564–72. Copyright © 200x [2001] Massachusetts Medical Society. All rights reserved)
Los últimos trabajos, señalan que el riesgo de intususcepción atribuible a esta vacuna es de 1 por 10.000 vacunados, cifra bastante menor que las entregadas en las primeras informaciones, que hablaban de 1:600 lactantes vacunados; por lo tanto, esta vacuna se puede considerar, pero asumiendo el riesgo de 1:10.000 de intususcepción. Las posibles explicaciones de esta complicación podrían ser: la alta carga antigénica de la vacuna, por la mezcla con virus no humanos; que las proteínas de esta vacuna podrían producir una respuesta intestinal anómala; o que la vacuna desenmascaró, de alguna forma, a un grupo de pacientes que tenían una predisposición para tener intususcepción (“teoría del gatillo”), es decir, la vacuna sólo gatilla el cuadro. No existe una respuesta categórica con respecto a la causa, pero sí está claro que el riesgo no es de 1:600, sino 1:10.000, por lo que todavía se podría aplicar en los países que asumieran este riesgo.
Retirada del mercado, hoy en Chile está disponible Rotarix y pronto podría estarlo RotaTeq, que recién este año fue aprobada por la FDA. Rotarix es una vacuna monovalente que trae el serotipo P1A[P8]G1, mientras que RotaTeq es una vacuna pentavalente contra cinco serotipos; Rotarix es una monodosis liofilizada que se reconstituye y la otra es una monodosis líquida; Rotarix requiere dos dosis, que se administran a los dos y cuatro meses en promedio, sin sobrepasar los seis meses desde la segunda administración; el esquema de RotaTeq contempla tres dosis, que se administran a los dos, cuatro y seis meses, cuidando que la tercera administración no ocurra después de los ocho meses; o sea, son vacunas para el lactante menor. No existen trabajos que aseguren el comportamiento de esta vacuna en pacientes mayores de seis meses, en el caso de la primera, y de los ocho meses, en el caso de la segunda vacuna (Tabla III).
Tabla III. Comparación entre Rotarix y RotaTeq
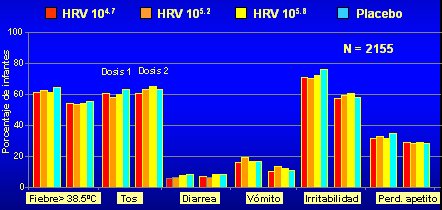
La vacuna Rotarix, presentada recientemente en Chile, es una vacuna virus vivo atenuado, basada en una cepa denominada 89-12, por el nombre del laboratorio de la cepa. Es una vacuna monovalente, P1A[P8]G1, que presenta protección cruzada con las cepas G3, G4 y G9. Se administra en dos dosis y el fabricante recomienda administrar la primera entre la sexta y decimocuarta semanas de edad y la segunda dosis entre la decimocuarta y vigésimocuarta semanas, con un intervalo de seguridad de cuatro semanas entre dosis. Se puede administrar junto a vacunas del PAI (Programa Ampliado de Inmunizaciones) y a vacunas “no PAI”, según estudios que lo avalan. Se presenta como un liofilizado en el que se coloca un dispositivo de transferencia y se carga la dosis para el paciente. Respecto a la reactogenicidad de esta vacuna, se puede presentar vómito o diarrea, de modo que cuando se prescribe la vacuna se debe alertar a la madre sobre la posibilidad de estos efectos, aunque son poco frecuentes (5%); más frecuentes son la tos, la irritabilidad y la pérdida del apetito, pero todos estos efectos adversos son comparables con el placebo, a distintas concentraciones del virus en la vacuna (4,7; 5,2; 5,8), o sea, las reacciones adversas no son mayores que lo que producen las vacuna que se indican clásicamente en la edad pediátrica (Figura5).
Figura 5. Reactogenicidad de Rotarix. Síntomas solicitados dentro de los 15 días postvacunación, DTPw-HBV/Hib co-administrado (OPV separado 15 días)
Respecto a seguridad, en 8 estudios americanos y europeos que agruparon 7.072 sujetos, de los cuales 5292 recibieron 9.670 dosis de vacuna RIX4414 y 1780 recibieron 3.600 dosis de placebo, hubo cuatro casos de invaginación, tres en pacientes vacunados (0,06%) y uno en placebo (0,06%); además, hubo quince fallecidos, nueve en vacunados (0,17%) y seis en placebo (0,34%), es decir, la mortalidad fue mayor con placebo, lo que permitió a este trabajo seguir avanzando hacia la fase III, que se implementó en América Latina (Human Rotavirus Vaccine Investigator Brochure - March 2004).
El primer trabajo que incluyó lactantes latinoamericanos fue publicado en el año 2005 por el grupo de la Dra. Belén Salinas; fue un estudio doble ciego, aleatorio y controlado, que se realizó entre los años 2001 a 2003 e incluyó lactantes de Brasil, Venezuela y México. Se aplicaron dos dosis, a los 2 y 4 meses de la vacuna monovalente G1P1A[8] en tres concentraciones distintas y en forma concomitante con las vacunas rutinarias, que son semejantes a las del PAI chileno, en un total de 2.155 lactantes, 1.618 con vacuna y 537 con placebo, o sea, en una proporción 1:3 y se realizó seguimiento hasta el año de edad. En este trabajo se midieron anticuerpos y se consideró como seguro y eficaz el obtener un 60% de seroconversión y un nivel de anticuerpos sobre 20 unidades/ml. La seroconversión observada fue de 61 a 65% para IgA antirotavirus, dependiendo de la concentración de cada vacuna; se midieron anticuerpos respecto a otras inmunizaciones y se encontró que había un nivel protector en todas las otras vacunas administradas; la reactogenicidad fue similar en los grupos, incluido el grupo placebo; y no se presentaron eventos adversos serios.
Se encontró eliminación del virus en deposiciones en 35 a 44% de los pacientes estudiados, al séptimo día de la primera dosis; lo mismo ocurre con la vacuna polio oral, porque teóricamente actúa como un inmunizador “de rebaño” del resto de la población. En cuanto a los ingresos hospitalarios, la eficacia fue de 79% en promedio para todos los grupos, o sea, produjo una disminución de 79 a 80% de los ingresos hospitalarios por rotavirus. Según la concentración administrada, la protección contra gastroenteritis fue de 70%; para diarrea o rotavirosis grave, fue de 86%; y se evitó la hospitalización, en promedio, en 79% de los pacientes que recibieron la vacuna.
En resumen, este trabajo, con buen diseño, ejecución y poder, demostró que la vacuna oral, administrada en dos dosis en niños latinoamericanos, o sea, en nuestra población, confiere una protección temprana, con baja reactogenicidad y sin interferir con la protección de las vacunas regulares del PAI. Los pacientes vacunados tuvieron significativamente menos gastroenteritis, de cualquier gravedad (p < 0,001); y hubo 86% de protección contra gastroenteritis grave y 79% de eficacia contra ingreso hospitalario, demostrando protección cruzada monovalente G1 con G9 en 77% (Evaluation of Safety Immunogenicity and Efficacy of an Attenuated Rotavirus Vaccine, RIX4414 A Randomized, Placebo- Controlled Trial in Latin American Infants. Pediatr Infect Dis J 2005; 24: 807- 816).
En enero de 2006 se publicó en New England Journal of Medicine los resultados del trabajo cooperativo americano europeo dirigido por el Dr. Miguel O´Ryan, investigador chileno que ha liderado grupos de trabajo respecto a vacunas rotavirus a nivel nacional y también mundial. Este fue un estudio aleatorio, doble ciego y controlado fase III, cuyas principales características y resultados se resumen a continuación:
En febrero de 2006 fue licenciada por la FDA la vacuna pentavalente RotaTeq, de la casa Merck Sharp & Dohme y se publicó en New England Journal of Medicine un trabajo que avala la seguridad y eficacia de esta vacuna, que en un futuro próximo podría estar disponible en nuestro país. El análisis del número de casos de gastroenteritis por rotavirus en el grupo vacunado (34.035 lactantes) y placebo (34.003 lactantes), según serotipo, demostró 95% de eficacia contra G1 y entre 87 y 100% para los otros serotipos que incluye la vacuna; y en cuanto a gravedad o consulta médica, se encontró una eficacia de 74% para G1 y algo menos para los otros serotipos, dando una eficacia global de 74% contra gastroenteritis grave (Safety and Efficacy of a Pentavalent Human-Bovine (WC3) Reassortant Rotavirus Vaccine. N Engl J Med 2006; 354: 23-33).
Rotavirus es muy frecuente en la práctica diaria; está presente durante todo el año; afecta a lactantes menores; tiene morbilidad importante; y costos de salud importantes. Se descubrió en 1973 y al menos se han conocido cuatro vacunas, de las cuales, la que está disponible en Chile tiene una seguridad y eficacia cercana a 85% para gastroenteritis grave y estadía hospitalaria. Está próxima a llegar a nuestro país una vacuna pentavalente que también dará seguridad a los niños que se desee inmunizar.
“La verdad absoluta no existe... y esto es absolutamente cierto”. Esta frase apunta a que las estadísticas y epidemiología de esta infección viral pueden cambiar, como sucedió con Rotashield e intususcepción, pero lo que se ha presentado aquí es lo que se sabe hasta el momento sobre la enfermedad y la vacuna contra este agente patógeno.









 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
Luis Delpiano Méndez[1]
Expositor:
Luis Delpiano Méndez[1]

Citación: Delpiano L. Rotavirus and vaccines. Medwave 2006 Sep;6(8):e1978 doi: 10.5867/medwave.2006.08.1978
Fecha de publicación: 1/9/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión