Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XI Curso Educación Continua Medicina Interna 2006, organizado por el Departamento de Medicina del Hospital Clínico U. de Chile, realizado desde el 26 de mayo al 30 de septiembre de 2006 y cuyos directores fueron la Dra. Leticia Elgueta y el Dr. Miguel Fodor.
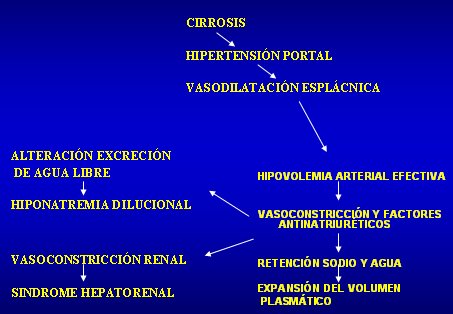
Es la acumulación anormal de líquido en la cavidad peritoneal; desde el punto de vista fisiopatológico, hay una resistencia aumentada al flujo portal y vasoconstricción sinusoidal hepática, con vasodilatación esplácnica secundaria, que se produce por producción de mediadores vasodilatadores como el óxido nítrico, tanto en la circulación sistémica como en el territorio vascular esplácnico. La vasodilatación esplácnica aumenta la presión del capilar esplácnico y la formación de linfa, lo que explica parte de la ascitis. La otra explicación es que la vasodilatación esplácnica provoca hipovolemia arterial efectiva, que es detectada a nivel de los sistemas barorreceptores carotídeos y de la mácula renal, lo que aumenta la secreción de renina-angiotensina-aldosterona, noradralina y de vasopresina; esto, a su vez, determina retención de sodio y agua, expansión del volumen plasmático y ascitis.
Figura 1. Ascitis: fisiopatología
En cuanto al manejo, cuando la ascitis es leve y se encuentra como hallazgo al realizar exámenes imagenológicos, como tomografía axial computarizada (TC) o ecografía, no tiene importancia desde el punto de vista clínico ni es necesario el tratamiento diurético. En cambio, esto es necesario cuando un paciente ya tiene manifestaciones clínicas de ascitis. La principal medida general es la restricción de sodio, que consiste en indicar al paciente que no use salero, cocine sin sal y coma pan sin sal, con lo que se logra un aporte de 2 a 3 gramos en la dieta. La restricción de volumen en general no se recomienda, ya que es excepcional que el paciente cirrótico ambulatorio tenga menos de 128 mEq/L de natremia; sólo se indica restricción de volumen con hiponatremia severa.
En ascitis moderada, que se manifieste en forma clínica en un paciente cirrótico con función renal normal, se recomienda dieta hiposódica y administración de diuréticos: espironolactona en dosis de 50 a 200 mg/día y furosemida, entre 20 y 40 mg/día. La dosis de diuréticos se regula por el peso: si el paciente tiene edema periférico, se considera aceptable que baje de peso, inicialmente, entre 0,8 y 1 kg al día; si el paciente no tiene edema periférico, lo aceptable es que baje hasta 0,5 kg al día. Al iniciar el tratamiento diurético, el paciente se debe controlar por lo menos una vez por semana el primer mes, para establecer la dosis final de diuréticos. Si el paciente funde los edemas con rapidez, como sucede en la mayoría de los pacientes que inician por primera vez un diurético, se debe controlar el nivel de electrolitos y la función renal hasta que el edema periférico y la ascitis hayan disminuido del todo desde el punto de vista clínico; desde ahí en adelante el médico se puede guiar por la dosis mínima de diurético necesaria para mantenerlo sin edema pretibial ni ascitis clínica importante.
En caso de ascitis grave, que interfiere con la actividad diaria en grado importante, con dificultad respiratoria y dificultad para levantarse, moverse o caminar, con función renal normal, pero retención de sodio (Na urinario menor de 10 mmol/L), el paciente va a requerir una dosis elevada de diuréticos; la dosis máxima de espironolactona es de 400 mg/día, pero en general se usa hasta 300 mg/día y, en el caso de furosemida, la dosis máxima es de 160 mg/día.
La ascitis refractaria, que se podría considerar como equivalente al síndrome hepatorrenal tipo 2, se observa en 5% a 10% de los pacientes con ascitis y es una pérdida de respuesta a la dosis máxima de diuréticos. En estos casos, el tratamiento es la paracentesis total: se hospitaliza al paciente para evacuar la ascitis con reposición de albúmina, con el fin de prevenir la insuficiencia renal. Otra alternativa es el TIPS (Transjugular Intrahepatic Portosystemic Shunt), que es la comunicación entre la circulación portal y la venosa sistémica para disminuir la hipertensión portal; da buenos resultados en los pacientes Child B, pero en los Child C es más difícil plantear su beneficio, por la evidencia de encefalopatía, que puede ser en extremo limitante.
Figura 2. Síndrome hepatorrenal: fisiopatología
El SHR puede ser de dos tipos: el tipo 1 se presenta con deterioro progresivo y rápido de la función renal, con creatinina que asciende sobre 2,5 mg/dl en menos de dos semanas; es una gran causa de mortalidad en los pacientes cirróticos. En el SHR tipo 2 se produce un deterioro lento y estable de la función renal y la creatinina se mantiene estable, entre 1,5 y 2 mg/dl, por semanas o meses. Chile cuenta, desde 2005, con el fármaco terlipresina, derivado de la vasopresina que actúa como vasoconstrictor esplácnico; si se administra asociado a albúmina puede revertir el síndrome hepatorrenal tipo 1, con un porcentaje de respuesta que oscila entre 60% y 80%. Los síndromes hepatorrenales puros que se tratan de esta manera se pueden recuperar, es decir, volver a su estado basal; la cirrosis es avanzada.
Es de suma importancia hacer el diagnóstico diferencial con encefalopatías metabólicas, como las causadas por hipoglicemia, alteraciones electrolíticas, hipoxia, uremia, cetoacidosis y narcosis por CO2; con encefalopatías tóxicas, por alcohol o drogas como los salicilatos; con lesiones intracraneales, como el hematoma subdural del cirrótico, que es frecuente u otras alteraciones como meningitis, abscesos, encefalitis o encefalopatía de Wernicke, en los alcohólicos, que siempre se deben considerar en el diagnóstico diferencial; y con alteraciones neurosiquiátricas.
Los factores desencadenantes de la encefalopatía son:
Entre todas las hipótesis que se han planteado sobre la patogenia de la encefalopatía hepática, la que se considera más exacta es la que postula la importancia del aumento de la producción y absorción de amonio, con alteración del metabolismo y aumento de este compuesto en la circulación, lo que explicaría los síntomas neurológicos. Por esta razón, toda la terapia apunta a disminuir la producción de amonio y su absorción en el tubo digestivo, mediante restricción de proteínas en la dieta, enemas con hidratos de carbono no absorbibles, aunque esto no está completamente validado en la literatura o con el uso de lactulosa oral. La lactulosa actúa por dos mecanismos: por ausencia de disacaridasa para desdoblarla llega intacta al colon, donde aumenta la producción de gas; 7 gr de lactulosa equivalen a la producción de 600 cc de gas hidrógeno en el tubo digestivo, los que estimulan la motilidad; junto con esto, la lactulosa se desdobla en el colon por acción de la flora sacarolítica, con lo que se produce ácido láctico, que acidifica la luz intestinal y disminuye el pH del lumen del colon, lo que hace que disminuya la absorción y aumente la excreción fecal de amoníaco.
Se pueden asociar antibióticos cuando el paciente no responde a lactulosa o si tiene intolerancia a ésta. Desde el punto de vista teórico, para evaluar el beneficio de la asociación de lactulosa y antibióticos, como neomicina o metronidazol, se debe medir el pH en la deposición: si la deposición es ácida, con pH menor de seis o siete, se asegura que la asociación es beneficiosa. Desde el punto de vista práctico, en el paciente que no responde a lactulosa se asocian antibióticos, neomicina o metronidazol, aunque la neomicina se debe administrar con cautela en pacientes con insuficiencia renal. También se pueden asociar probióticos como Lactobacillus acidophilus o Enterococcus faecium.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XI Curso Educación Continua Medicina Interna 2006, organizado por el Departamento de Medicina del Hospital Clínico U. de Chile, realizado desde el 26 de mayo al 30 de septiembre de 2006 y cuyos directores fueron la Dra. Leticia Elgueta y el Dr. Miguel Fodor.
 Expositor:
Jorge Contreras Basulto[1]
Expositor:
Jorge Contreras Basulto[1]

Citación: Contreras J. Outpatient management of liver cirrhosis (II): Complications. Medwave 2007 Ago;7(7):e1898 doi: 10.5867/medwave.2007.07.1898
Fecha de publicación: 1/8/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión