Resumen
Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XI Curso Educación Continua Medicina Interna 2006, organizado por el Departamento de Medicina del Hospital Clínico U. de Chile, realizado desde el 26 de mayo al 30 de septiembre de 2006 y cuyos directores fueron la Dra. Leticia Elgueta y el Dr. Miguel Fodor.
Introducción
La cirrosis hepática es un proceso de alteración final del hígado, que se caracteriza por el desarrollo progresivo de fibrosis difusa y alteración global de la arquitectura hepática, con formación de nódulos regenerativos y alteraciones hepatocelulares: pleomorfismo, displasia e hiperplasia regenerativa. Según la clasificación morfológica, existe la cirrosis micronodular (menor de 3 mm), que se observa principalmente por alcohol; la cirrosis macronodular (mayor de 3 mm) que puede ser postviral, por virus C o B y la cirrosis con morfología mixta. La clasificación más útil, indudablemente, es la etiológica.
La cirrosis trae aparejado un proceso de alteración morfológica global del hígado, de modo que éste pierde su característica superficie lisa, se vuelve irregular y disminuye de tamaño. Histológicamente se pueden ver nódulos de regeneración, compuestos por hepatocitos rodeados por trabéculas fibrosas; en la cirrosis macronodular los nódulos son más grandes y también se pueden ver en la tomografía axial computarizada (TC). En cortes de hígado cirrótico se puede ver la estructura irregular y heterogénea, con una hipertrofia característica del lóbulo caudado que probablemente se debe a que este lóbulo no sólo es irrigado por la arteria hepática y por la porta, sino que además tiene irrigación sistémica.
Etiología de la cirrosis hepática
La causa global más frecuente en Chile es el alcohol; en segundo lugar, el virus hepatitis C y en tercer lugar, criptogénica; en los Estados Unidos, la hepatitis C y el alcohol también representan las dos causas más importantes. El virus hepatitis B existe en Chile, pero su prevalencia es muy baja, por lo que, entre las causas de cirrosis, es la séptima u octava; el virus D no existe en Chile y cobraría importancia en casos de prevalencia pandémica de virus hepatitis B. La cuarta causa de cirrosis es el grupo de las enfermedades autoinmunes, que producen la hepatitis autoinmune y la cirrosis biliar primaria. En los diez últimos años se ha redescubierto la esteatohepatitis no alcohólica, que es la quinta causa de cirrosis; consiste en una alteración hepática causada por mediadores inflamatorios y se presenta en pacientes diabéticos, obesos y portadores de dislipidemias. Durante muchos años se habló de la cirrosis criptogénica, que constituía alrededor de 20% a 40% de los casos y designaba a aquellos casos en que no había una etiología clara; ahora se sabe que la mayor parte de estos casos cumplen los criterios de esteatohepatitis, lo que, desde el punto de vista epidemiológico, es de suma relevancia.
Otras causas son: la hemocromatosis, alteración genética por depósito de hierro; la enfermedad de Wilson, por depósito de cobre, con una base genética y la colangitis esclerosante primaria o primitiva, que es una enfermedad autoinmune, colestásica, que cursa con fibrosis de la vía biliar intra y extra hepática. Causas menos frecuentes son: el síndrome de Budd-Chiari, que es la trombosis u obstrucción de las venas suprahepáticas y provoca principalmente hipertensión portal, pudiendo llevar a cirrosis hepática; la enfermedad venooclusiva, que también es una obstrucción del flujo venoso hepático portal, pero a nivel sinusoidal y puede estar asociada con algunos fármacos; y el déficit de alfa-1 antitripsina. La cirrosis criptogénica ha disminuído como causa global, en la medida en que se diagnostican más esteatohepatitis no alcohólicas o hepatitis autoinmunes con serología negativa, que pueden quedar comprendidas en este grupo. Finalmente está la toxicidad por fármacos como metotrexato, que puede causar cirrosis, y la hipervitaminosis A, como causa anecdótica.
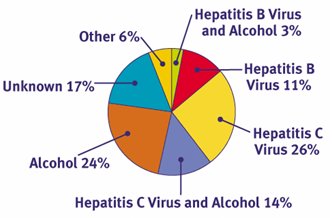
Según el CDC (
Centers for Disease Control) de los Estados Unidos, en 2004 la causa más importante de cirrosis fue el virus hepatitis C, seguida por el alcohol y en tercer lugar, el virus hepatitis C más alcohol. Luego está la cirrosis criptogénica, la causada por el virus hepatitis B, que en Chile no es tan importante. La cirrosis biliar primaria, la hepatitis autoinmune y la esteatohepatitis no alcohólica son destacables (Fig. 1).
Figura 1. Causas primarias de enfermedad crónica hepática (Fuente: Centers for Disease Control and Prevention)
Manifestaciones clínicas de cirrosis
Asintomático: no es raro que el diagnóstico de cirrosis hepática se haga en un paciente que está totalmente asintomático, en un chequeo médico o por hallazgos hematológicos más un examen de imagenología, por ejemplo, una ecografía abdominal.
Síntomas generales: cuando la cirrosis se manifiesta con claridad, el síntoma principal es la fatiga y el decaimiento; también están presentes anorexia y baja de peso.
Manifestaciones gastrointestinales: el paciente puede presentar parotidomegalia, diarrea intermitente, hemorragia digestiva secundaria a hipertensión portal por várices esofágicas, gástricas, duodenales o ano-rectales, o por gastropatía portal.
Manifestaciones hematológicas: hay anemia y los pacientes con cirrosis hepática avanzada presentan pancitopenia: anemia, leucopenia y trombocitopenia. La anemia siempre es multifactorial: por déficit vitamínico, en el caso de pacientes alcohólicos, en quienes el alcohol actúa como tóxico directo y causa anemia macrocítica; por hemólisis y secuestro esplénico de glóbulos rojos; por ferropenia secundaria a hemorragias, etc. Hay esplenomegalia (bazo de más de 12 cm en su diámetro mayor), por hiperesplenismo secundario a hipertensión portal y la trombocitopenia, que es una constante, se correlaciona con el grado de cirrosis; de hecho, en algunos
scores de gravedad de cirrosis, la trombocitopenia se considera como un factor pronóstico. La presencia de leucopenia también es importante; a veces el diagnóstico se realiza durante una evaluación hematológica, en la cual la punción medular demuestra una médula regenerativa. También hay alteraciones de la coagulación por déficit de producción de factores, en especial protrombina y factor V.
Manifestaciones renales: en la cadena de episodios fisiopatológicos que se suceden en la cirrosis hepática está el hiperaldosteronismo secundario: la presencia de hipovolemia activa el eje renina-angiotensina-aldosterona y, por lo tanto, al aumentar la aldosterona ocurre la consecuente retención de sodio y agua; hay glomerulopatías específicas asociadas, por ejemplo, con virus C, con crioglobulinas y con virus B; finalmente, la alteración más característica como complicación renal clásica de la cirrosis, es el síndrome hepatorrenal.
Manifestaciones endocrinas: se puede observar hipogonadismo, atrofia testicular y dismenorrea; o feminización, por aumento de estrógenos debido al metabolismo alterado a nivel hepático, con aparición de telangectasias, eritema palmar, ginecomastia y cambios en el vello pubiano.
Manifestaciones pulmonares: puede haber hipertensión pulmonar primaria; hidrotórax hepático, que es un equivalente ascítico en la cavidad pleural; síndrome hepatopulmonar, debido a mediadores vasodilatadores que se producen en la cirrosis y cuya consecuencia es la hipoxemia, que se manifiesta por platipnea y ortodeoxia. Es fundamental evaluar esto ante un daño hepático y la posibilidad de trasplante hepático.
Manifestaciones cardíacas: se sabe que los pacientes cirróticos tienen un estado hemodinámico muy particular, caracterizado por aumento del gasto cardíaco, como consecuencia de la vasodilatación esplácnica y sistémica causada por los mediadores vasodilatadores que se producen, el principal de los cuales es el óxido nítrico. También hay cardiopatía por cirrosis hepática: en décadas anteriores se describió una cardiopatía asociada con el alcoholismo, no sólo en pacientes cirróticos, sino también en alcohólicos sin cirrosis; se pensó que esta cardiopatía solamente estaba asociada con el alcoholismo crónico, pero en pacientes que tienen cirrosis de causa viral se puede encontrar una clara disfunción diastólica o sistólica; en consecuencia, hay una cardiopatía propia del cirrótico.
Manifestaciones neurológicas: puede haber neuropatía periférica y encefalopatía hepática. Hay también
manifestaciones músculoesqueleticas,
dermatológicas, etc.
Hipertensión portal: es uno de los aspectos más importantes de la cirrosis y un elemento cardinal en el diagnóstico. Su consecuencia directa son las várices, no sólo esofágicas sino también gástricas, duodenales y también rectales o hemorroidales. La gastropatía portal es una alteración por congestión venosa, habitualmente de la mitad superior del estómago, que aparece como consecuencia de la hipertensión portal y puede causar hemorragia digestiva. Manifestaciones adicionales son la ascitis, que es la acumulación anormal de líquido en el peritoneo; síntomas gástricos de cirrosis e hipertensión portal; esplenomegalia; encefalopatía hepática y circulación colateral, todas como consecuencia de hipertensión portal.
Estudio de laboratorio de la cirrosis hepática
Cuando se sospecha cirrosis hepática, se deben evaluar los siguientes aspectos:
Necrosis hepatocelular: la actividad citolítica se evalúa mediante las pruebas hepáticas (SGOT/SGPT). El perfil característico de la cirrosis consiste en transaminasas elevadas en forma discreta, no más de dos o tres veces lo normal, en un cirrótico compensado. Esto no se correlaciona con pronóstico ni con actividad, salvo que las transaminasas estén muy elevadas, en cuyo caso se debe pensar en la posibilidad de actividad hepatítica secundaria a un virus B o C o bien, que el paciente se haya descompensado por otro motivo, como una hepatitis isquémica. También es posible que un cirrótico alcohólico se enferme de hepatitis aguda por virus hepatitis A o que se ocluya la vena porta.
La colestasia: se evalúa mediante las fosfatasas alcalinas (FA) y la gamma glutamil transpeptidasa (GGT), que están ligeramente alteradas en la cirrosis y muy alteradas en las enfermedades colestásicas, como por ejemplo, la cirrosis biliar primaria y la colangitis esclerosante del hígado. De las pruebas hepáticas, el factor que se ha asociado con pronóstico es la bilirrubina, que está dentro de los
scores para el pronóstico de la cirrosis.
La función de síntesis: se evalúa mediante la albúmina, la protrombina, el factor V y el colesterol. En un paciente con cirrosis, disminución de la albúmina, disminución del colesterol y prolongación del tiempo de protrombina significan disminución de la síntesis hepática.
Dentro del estudio etiológico previo de la cirrosis se debe solicitar:
- Marcadores virales para virus hepatitis C y B: los marcadores de virus hepatitis C son los anticuerpos anti virus hepatitis C, específicamente anticuerpos de tipo IgG, por técnica de ELISA; en cuanto a hepatitis B, el screening se realiza con antígeno de superficie de virus B y con anticore total de virus B.
- Estudio de fierro: para descartar hemocromatosis genética o hemosiderosis asociada con hepatitis C o consumo de alcohol. Se debe solicitar ferritina plasmática y cinética de fierro, con informe de la saturación de transferrina (sobre 55% se debe plantear hemocromatosis). Con ferritina sobre 1000 ng/ml se plantea hemocromatosis genética.
- Ceruloplasmina: si está baja en el plasma se debe sospechar enfermedad de Wilson.
- Cuantificación de inmunoglobulinas: proporciona información y orienta hacia ciertas etiologías. La cirrosis autoinmune puede tener un peak gamma característico, habitualmente más prolongado. La IgA aumenta en la cirrosis alcohólica y la IgM, en la cirrosis biliar primaria.
- Los anticuerpos antinucleares y antimúsculo liso son característicos de la cirrosis autoinmune, mientras que los anticuerpos antimitocondriales son característicos de la cirrosis biliar primaria. Los anticuerpos anti LKM-1 (anticuerpos antiantígenos microsomales de hígado y riñón) son característicos de un subtipo de hepatitis autoinmune, que se ve en general en mujeres jóvenes, no muy frecuente.
El estudio de imágenes en cirrosis es absolutamente necesario; se debe solicitar ecografía abdominal, escáner (TC) abdominal y/o resonancia nuclear magnética (RNM) de abdomen o de hígado. La ecografía permite observar los nódulos de la cirrosis macronodular y la presencia de hepatocarcinoma, complicación temida en la cirrosis; también permite evaluar la dilatación de la vía biliar, la presencia de ascitis o visceromegalia y descartar la trombosis de las venas porta y suprahepáticas. Se puede obtener más información, sobre todo del árbol vascular hepático, agregando a la ecografía abdominal un doppler hepático y agregando a la TC o RNM una angio TC o angio RNM.
La biopsia hepática tiene poca utilidad en presencia de cirrosis avanzada, cuando están presentes las manifestaciones floridas de la enfermedad, ya que en ese caso no se necesita una biopsia para saber que el paciente está cirrótico. Si hay muchas dudas acerca de la etiología y el paciente está en etapa precoz, Child A, se podría utilizar la biopsia hepática como ayuda en el diagnóstico y pronóstico.
Diagnóstico de cirrosis
Se realiza con tres elementos:
alteración de la función de síntesis hepática, que se traduce en prolongación del tiempo de protrombina, disminución de colesterol, de factor V y de albúmina;
estigmas de daño hepático crónico, como arañas vasculares,
eritema palmar, ginecomastia, atrofia testicular y contractura de Dupuytren; y
signos de hipertensión portal. Este último aspecto es el más importante, ya que en 95% de los casos, la hipertensión portal tiene como causa la cirrosis. El diagnóstico de hipertensión portal se establece mediante imágenes: endoscopía, ecografía abdominal, TC, RNM y por signos de hipertensión portal: ascitis, visceromegalia, circulación colateral, várices esofágicas, encefalopatía o asterixis y disminución del vello torácico y axilar.
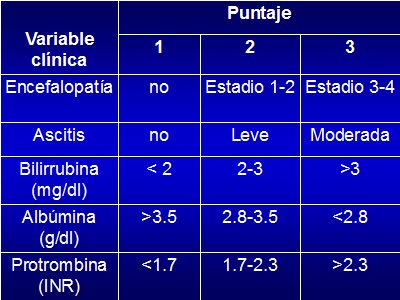
Existe un puntaje pronóstico con base en todos los elementos mencionados: el puntaje de Child-Pugh (Tabla I), que considera dos variables clínicas: encefalopatía hepática y presencia de ascitis, y tres variables de laboratorio: bilirrubina, albúmina y protrombina. El puntaje se asigna de acuerdo a la profundidad de cada alteración.
Tabla I: Score de Child-Turcotte-Pugh
Este puntaje se desarrolló para evaluar el pronóstico a largo plazo en cuanto a sobrevida, mortalidad y como indicador de riesgo quirúrgico; de hecho, se utilizó con este último objetivo en una época en que se realizaban muchos shunt espleno-renales, como medida de manejo de la hipertensión portal.
Actualmente se utiliza un nuevo puntaje, que se denomina MELD (Model for End stage Liver Disease), como criterio de asignación para trasplante hepático. Hasta 2006, la lista de trasplante hepático en Chile era una lista única nacional asignada por orden de llegada, con algunas excepciones, como la hepatitis aguda fulminante o las complicaciones post trasplante. En la actualidad, la mortalidad por trasplante hepático en Chile es de 25% y una forma de reducirla es reasignando a los pacientes por orden de gravedad, de modo que se trasplanten primero los más graves. El modelo matemático logarítmico MELD se diseñó a partir de los valores de bilirrubina, creatinina y protrombina, medida por INR y asigna entre 6 y 40 puntos, siendo 40 lo más grave. Hoy este score está ampliamente validado en cirrosis y está reemplazando progresivamente al score de Child. Por ejemplo, un paciente que tenga más de 15 puntos de MELD se va a beneficiar con un trasplante hepático y su sobrevida será mejor si se trasplanta; en cambio, si se somete a trasplante hepático a un paciente que tiene entre 10 y 15 puntos, es probable que su sobrevida sea parecida, por lo tanto no se debe realizar el trasplante; y en un paciente que tiene menos de 10 puntos la sobrevida es mejor sin trasplante.
Tratamiento
Las posibilidades de efectuar una terapia específica sobre la etiología de la cirrosis son limitadas, porque es habitual que en el momento del diagnóstico la enfermedad esté avanzada; cuando un alcohólico que ha desarrollado cirrosis deja de beber, no deja de ser cirrótico y los pacientes que tienen cirrosis por virus C o B no se mejoran; sólo en casos anecdóticos se ha descrito regresión de los nódulos de regeneración.
El efecto de las terapias específicas, como las sangrías, en la hemocromatosis; los antivirales para el virus hepatitis B y C en etapas precoces, antes de llegar a la cirrosis; la quelación del cobre en enfermedad de Wilson, con D-penicilamina; los inmunosupresores como corticoides o azatioprina, en el caso de la hepatitis autoinmune y el ácido ursodeoxicólico en la cirrosis biliar primaria, es limitado.
La terapia definitiva de la cirrosis hepática es el trasplante hepático. La sobrevida a diez años de un paciente con cirrosis compensada es de 50% y en caso de cirrosis descompensada es de 15%, aproximadamente, de modo que la decisión de tratamiento se debe basar en lo que es mejor para el paciente, considerando que actualmente la sobrevida a 5 años de un paciente con trasplante hepático es de alrededor de 80-85%.

Esta
obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.


 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
Jorge Contreras Basulto[1]
Expositor:
Jorge Contreras Basulto[1]

