El propósito de esta exposición es analizar la forma de combatir una de las patologías más importantes para los especialistas en nefrología, quienes se encuentran en la última parte de la cadena de atención de estos pacientes.
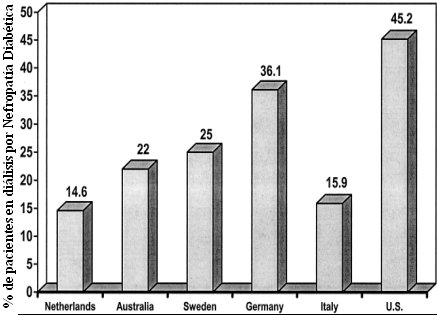
Se prevé que la prevalencia de diabetes mellitus continará aumentando en el mundo occidental, con un incremento estimado en 6% a 10% en la próxima década (Rosen et al Diabetes/Med Res Rev 2001). Por otra parte, la primera causa de insuficiencia renal crónica terminal, en el mundo occidental, es la nefropatía diabética: 90% de los pacientes con nefropatía crónica terminal son diabéticos tipo 2 y la mortalidad de este tipo de pacientes, en esta etapa de su evolución, es muy elevada. El porcentaje de pacientes en diálisis cuya nefropatía es de etiología diabética (Fig. 1) es elevado: por ejemplo, en los Estados Unidos casi la mitad de los pacientes que están en diálisis son portadores de nefropatía diabética; en Alemania, Australia, Suecia y Holanda también la proporción es importante y la excepción es Francia, con 12 a 13% de los pacientes.
Figura 1. Distribución porcentual de la nefropatía diabética en pacientes en diálisis.
Los datos de la encuesta anual de diálisis efectuada en Chile en 2004 señalan que 32% de la población total en hemodiálisis en Chile tiene como causa la nefropatía diabética (3.200 pacientes). El costo mensual de un programa de hemodiálisis es de 476.840 pesos, sin incluir las hospitalizaciones ni las consultas por comorbilidades, de modo que cada mes se gasta un alto porcentaje del presupuesto de salud en estos pacientes; se estima que 15% del presupuesto actual de FONASA está destinado a hemodiálisis. En Estados Unidos, la proyección de la curva de incidencia y prevalencia de nefropatíal terminal hacia el año 2030 indica aumento exponencial y es probable que Chile presente una curva similar.
La nefropatía comienza precozmente en el curso de la diabetes mellitus y su principal causa es la alteración hemodinámica, caracterizada por hipertensión intraglomerular e hiperfiltración. Se sabe que ésta aparece como un mecanismo compensador para mantener la función cuando hay daño renal previo, pero en la nefropatía diabética la hiperfiltración precede al daño estructural, o sea, es al revés. La hipertensión intraglomerular aumenta la filtración de proteínas y la reabsorción de proteínas tubulares, lo que provoca cambios inflamatorios importantes a nivel tubulointersticial.
El concepto de que la proteinuria es tóxica es uno de los más importantes adquiridos en los diez últimos años en el mundo de la nefrología. Por otro lado, la hiperglicemia puede activar directamente la angiotensina II intraglomerular y se sabe que ésta no sólo es mediador hemodinámico, en términos de provocar hiperfiltración, sino que también puede inducir cambios estructurales, activar la formación de TGF-beta y la síntesis de colágeno. Por lo tanto, actualmente la angiotensina II ya no se considera como un simple mediador hemodinámico, sino como una citoquina proinflamatoria. Todos estos cambios generan proliferación de fibroblastos, fibrosis intersticial y glomeruloesclerosis.
La hiperglicemia es otro mecanismo de daño. Por sí sola es capaz de provocar diversas alteraciones químicas y de activar directamente una serie de factores de crecimiento y citoquinas, lo que, en un terreno genético fértil, permite el desarrollo de la nefropatía diabética. En la hiperglicemia, los grupos carboxilos de la glucosa se unen a los receptores amino (NH2) de los aminoácidos y proteínas para formar una serie de productos que, inicialmente, son reversibles e inestables, pero que poco a poco van ocasionando cambios estructurales irreversibles hasta generar los productos de glicosilación no enzimática (AGE), perjudiciales para el endotelio, al que se fijan mediante receptores y causan cambios estructurales en el glomérulo renal. Hasta aquí, el proceso es reversible. En la actualidad, algunos grupos están investigando sustancias que eventualmente permitan detener la formación de estos productos de glicosilación avanzada, pero no se sabe si estarán disponibles en el curso de los próximos años. Por otro lado, además de los productos de glicosilación avanzada, la glucosa induce directamente, mediante su metabolismo intramitocondrial, la formación de radicales libres dañinos para las células y aumenta la producción de diacilglicerol (DAG) y de proteína kinasa C (PKC).
El TGF-beta (Factor de Crecimiento Transformante-Beta) tendría un papel importante en la patogenia de la nefropatía diabética, ya que puede causar aumento de la síntesis y disminución de la degradación de la matriz extracelular; lo anterior puede favorecer la aparición de expansión mesangial y fibrosis túbulointersticial. La investigación sobre la posibilidad de utilizar anticuerpos contra TGF-beta es amplia, pero todavía no hay resultados clínicos que demuestren su utilidad evidente.
Por último, en la patogenia de la nefropatía diabética participarían factores genéticos.
Las etapas del compromiso renal de la nefropatía diabética son conocidas:
Etapa 1: hiperfiltración glomerular y renomegalia, sin daño estructural.
Etapa 2: lesión glomerular precoz, con microalbuminuria intermitente o de ejercicio.
Etapa 3: nefropatía incipiente, caracterizada por cambios citológicos y presencia de microalbuminuria persistente.
Etapa 4: nefropatía clínica, macroalbuminuria y reducción marcada de la velocidad de filtración glomerular.
Etapa 5: insuficiencia renal crónica terminal.
Por desgracia, los enfermos son referidos al nefrólogo en la etapa 4. Las tres primeras etapas transcurren en forma silenciosa en el curso de 10, 12 ó 15 años, de tal manera que todo esfuerzo que se pueda desarrollar para capturar a los pacientes antes de esta fase es bienvenido y el mejor método disponible actualmente es la búsqueda de microalbuminuria persistente. La etapa 1 es, generalmente, una etapa de hiperfiltración. La velocidad de filtración glomerular se correlaciona con la glicemia; 25% a 40% de los pacientes cuyo control glicémico es adecuado presentan aumento de la velocidad de filtración glomerular; este subgrupo tiene mayor riesgo de nefropatía clínica. La etapa 2 es difícil de evaluar, por el hecho de ser intermitente; en ella ya existen cambios histológicos. En la etapa 3, la microalbuminuria persistente se puede determinar con cierta facilidad mediante los exámenes disponibles en la actualidad. En esta fase hay daño microvascular generalizado y aparece 5 a 15 años después del inicio de la diabetes en 25% a 40% de los pacientes. La etapa 4 es fácil de diagnosticar, pero es muy tardía. Se caracteriza por albuminuria mayor de 300 mg/día y síndrome nefrótico frecuente. Precede en 2 a 3 años a la etapa 5.
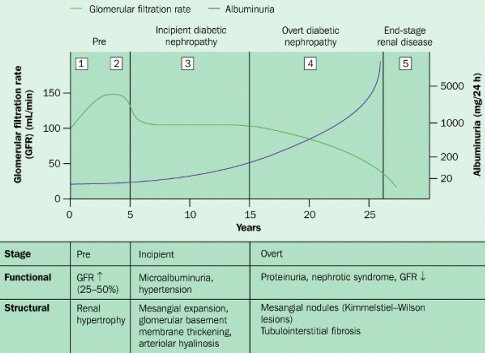
La historia natural de la diabetes tipo 1 (Fig. 2) y los estudios de diabéticos tipo 1 han proporcionado la mayoría de los conocimientos actuales en cuanto al desarrollo de la nefropatía diabética; sólo en los diez últimos años ha aparecido más información sobre lo que sucede en diabéticos tipo 2. Se puede ver que, pasado un período de algunos años de hiperfiltración, la filtración glomerular se estabiliza y, en la medida en que aparece proteinuria, empieza a disminuir. En los antiguos textos de la década de 1970 se decía que, después de que aparecía macroproteinuria, la caída de la filtración glomerular era inexorable, a razón de 1 ml/min por mes. En esa época no se sabía que la proteinuria era tóxica por sí misma y que probablemente explica los cambios que ocurren en los diabéticos tipo 1 después de 15 años de evolución. Es probable que en diabéticos tipo 2 ocurra algo parecido.
Figura 2. Historia natural de la nefropatía diabética.
A medida que transcurren los años, en el individuo portador de diabetes clínica se van produciendo cambios funcionales persistentes a nivel renal. Los cambios estructurales empiezan alrededor de los 3 a 5 años; la presión arterial va subiendo; aparece la microalbuminuria, que con los años se transforma en macroproteinuria; y al final se desarrolla la insuficiencia renal crónica, que progresa hasta la fase terminal.
Los principales factores de riesgo son microalbuminuria, hiperglicemia, hipertensión arterial crónica, tabaquismo e hiperfiltración, además de sexo masculino, predisposición familiar a hipertensión, aumento del cotransporte Na-Li, aumento de prorrenina, inicio precoz de la diabetes tipo 1 y factores étnicos y genéticos.
Con respecto la genética, se sabe que en el paciente diabético tipo 1 que tiene un progenitor portador de nefropatía diabética, el riesgo de desarrollar la misma nefropatía es de 70%; en cambio, si no tiene un progenitor portador, el riesgo de desarrollar esta enfermedad baja a 20%-25%. En el caso de los diabéticos tipo 2, en la población de indios Pima, que se caracteriza por alta incidencia de diabetes mellitus tipo 2, se ha visto que si ninguno de los padres del paciente diabético tiene proteinuria, el riesgo del paciente es comparativamente menor (14%), ya que si ambos padres presentan proteinuria, el riesgo de desarrollar nefropatía diabética puede subir hasta 46%. Si uno de los progenitores tiene proteinuria, el riesgo es de 23%.
Entre la multitud de genes que se supone están relacionados con la aparición y progresión de la nefropatía diabética, uno de los que recibe mayor atención actualmente es el gen que manda la aparición o fabricación de angiotensina 2 tisular, que también podría estar relacionado con el desarrollo de episodios cardiovasculares.
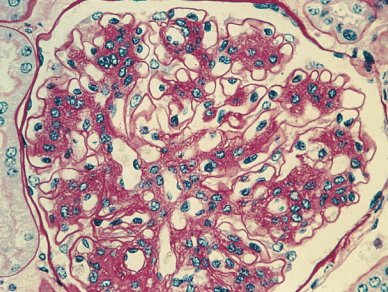
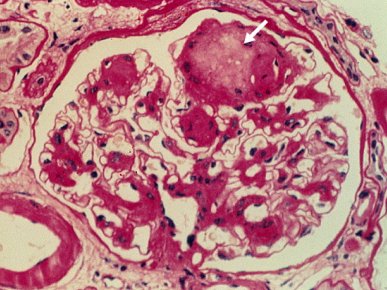
Las microfotografías de los cambios iniciales de la nefropatía diabética (Figs. 3 y 4) permiten apreciar la expansión mesangial característica de las etapas tempranas. Probablemente corresponden a una etapa 3, con microalbuminuria positiva. Las membranas basales de los capilares están algo engrosadas, en especial en algunos sectores, debido a glicosilación no enzimática de las proteínas de la membrana basal, que va a terminar con un glomérulo con presencia de depósitos PAS positivos y algún grado de fibrosis importante en las fases avanzadas de la nefropatía.
Figura 3. Cambios histológicos en nefropatía diabética: engrosamiento de membranas basales.
Figura 4. Cambios histológicos en nefropatía diabética: depósitos PAS (+) glomerulares.
El diagnóstico clínico se puede inferir por el antecedente de diabetes de larga data (más de 10 años de evolución) y la presencia de retinopatía, proteinuria, deterioro de la función renal, medida por la velocidad de filtración glomerular, e hipertensión arterial crónica, con riñones de tamaño normal. Se debe pensar en una nefropatía de otro origen en el paciente diabético y hacer el diagnóstico diferencial, en caso de proteinuria de rápida progresión, deterioro brusco de función renal, hematuria, ecotomografía renal no compatible (con riñones pequeños), presencia de enfermedad sistémica y ausencia de retinopatía, que es, probablemente, uno de los indicios más potentes para señalar que lo que sucede a nivel renal no es de causa diabética.
La detección de nefropatía diabética incipiente se hace por la presencia de microalbuminuria persistente en dos muestras, separadas por dos a tres semanas; su presencia indica una nefropatía diabética en etapa tres. Posteriormente, se debe hacer una evaluación clínica de la nefropatía diabética basada en la proteinuria. Se debe excluir la presencia de infección urinaria; determinar la presencia de glóbulos rojos y cilindros hemáticos; cuantificar la proteinuria; hacer ecografía renal y serología, si se sospecha glomerulonefritis (ANCA, anticuerpos anti DNA, C3, C4).
Con estos elementos se debe determinar si es un cuadro típico: cuando hay diabetes tipo 1 de más de 10 años de evolución, retinopatía, microalbuminuria previa, ausencia de hematuria macroscópica, ausencia de cilindros y ecografía renal normal. En este caso no se necesita biopsia renal. En caso de proteinuria atípica, que se da en un diabético de menos de 10 años, sin retinopatía, con proteinuria en rango nefrótico, hematuria macroscópica y cilindros hemáticos, se debe sospechar una patología asociada y está indicada la biopsia.
Las nefropatías no diabéticas (atípica) pueden corresponder a azotemia más proteinuria menor de 1 g/día, necrosis papilar (piuria, hematuria, cicatrices), tuberculosis (piuria, hematuria) u otras enfermedades renovasculares oclusivas. En este caso, tampoco se requiere biopsia renal.
Las recomendaciones internacionales plantean realizar examen de microalbuminuria en todo paciente diabético mayor de 12 años de edad. En los pacientes diabéticos tipo 1, la recomendación es hacerlo a partir del cuarto a quinto año del diagnóstico de diabetes, y en el diabético tipo 2 se debe realizar en el momento del diagnóstico, ya que no se puede saber con certeza la cantidad de años de evolución previa. La microalbuminuria es un predictor de nefropatía clínica, se asocia con mayor riesgo cardiovascular y presenta variación diaria hasta de 45%, por lo que se debe determinar en dos oportunidades a lo menos. Hay varios métodos de detección, entre ellos RIA, ELISA y Dipstick. En ciertas condiciones puede aparecer microalbuminuria como falso positivo; por ejemplo, en estados de hipervolemia, hipertensión arterial grave, infección urinaria, ejercicio. Por lo tanto, cuando se solicita microalbuminuria hay que cerciorarse de que no existe infección urinaria concomitante, porque se puede obtener un falso positivo.
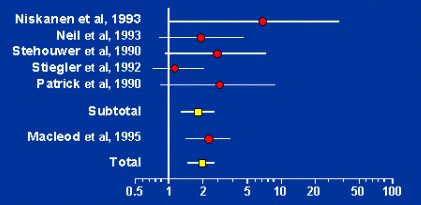
Hace 20 años que los nefrólogos conocen el hecho de que la microalbuminuria se asocia con mayor riesgo cardiovascular, pero los cardiólogos no estaban convencidos. Lentamente han ido cambiando de opinión y en el VII Informe de Hipertensión ya se considera la microalbuminuria como uno de los exámenes que se debe solicitar. En un metaanálisis realizado para analizar la asociación entre microalbuminuria y riesgo de morbilidad y mortalidad cardiovasculares en pacientes diabéticos tipo 2, se demostró claramente el mayor riesgo en pacientes con microalbuminuria positiva (Fig. 5).
Figura 5. Odds ratio de riesgo cardiovascular en pacientes con diabetes mellitus tipo 2, con microalbuminuria, versus normoalbuminuria (Arch Intern Med 1997;157: 1413-1418).
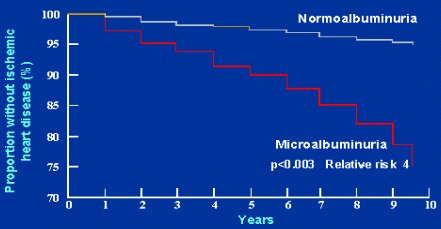
En los pacientes hipertensos no diabéticos, la microalbuminuria también se asocia con mayor riesgo. Los resultados de un estudio de Jensen sobre la sobrevida sin enfermedad cardíaca isquémica en pacientes hipertensos (Fig.6) permiten apreciar que los pacientes con normoalbuminuria tienen un riesgo estándar; en cambio, los pacientes no diabéticos con microalbuminuria positiva tienen mayor riesgo de presentar episodios cardiovasculares.
Figura 6. Sobrevida sin enfermedad cardíaca isquémica en pacientes hipertensos no diabéticos, según presencia de microalbuminuria (Hypertens 2000;35:898-903).
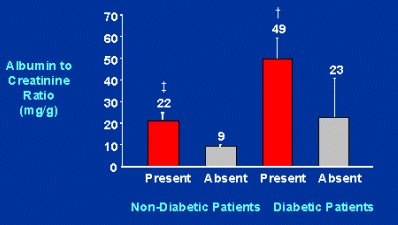
De la misma manera, la cardiopatía coronaria es más frecuente en pacientes no diabéticos con microalbuminuria que en pacientes no diabéticos sin microalbuminuria. Esta proporción también se observa en pacientes diabéticos, pero en ellos es mucho mayor (Fig. 7).
Figura 7. Albúmina urinaria y cardiopatía coronaria (Am J Kidney Dis 1999;34:918-925).
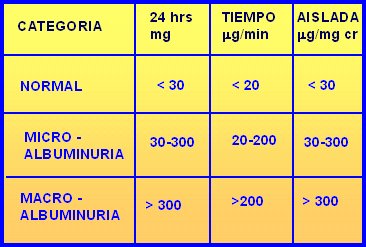
La microalbuminuria se puede determinar de tres modos: en 24 horas, por minuto o en muestra aislada. Lo que más se utiliza es la medición de microalbuminuria de 24 horas. Los valores normales y los rangos de micro y macro albuminuria se resumen a continuación (Tabla I). No se debe cometer el error de solicitar microalbuminuria en un paciente que presenta un examen de orina completa con proteinuria positiva en cantidades indetectables.
Tabla I. Valores de albuminuria según método de determinación.








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Expositor:
Antonio Saffie Ibáñez[1]
Expositor:
Antonio Saffie Ibáñez[1]

Citación: Saffie A. Prevention and progression of diabetic nephropathy I: epidemiology, pathogenesis, and diagnosis. Medwave 2006 Mar;6(2):e1885 doi: 10.5867/medwave.2006.02.1885
Fecha de publicación: 1/3/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión