 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: SARS-CoV-2, Vertical infection transmission, Infant, newborn, Pregnancy complication
Introducción
La enfermedad de COVID-19 puede afectar a gestantes en cualquier trimestre del embarazo. Por su parte, los neonatos podrían infectarse con SARS-CoV-2 por transmisión vertical u horizontal.
Objetivo
Determinar las características clínicas y epidemiológicas de madres con COVID-19, de sus neonatos y la transmisión vertical del SARS-CoV-2.
Métodos
Estudio observacional, descriptivo, transversal. Se incluyeron todas las madres con serología positiva para SARS-CoV-2 y sus neonatos nacidos en el Hospital Regional Docente de Trujillo desde el 18 de abril hasta el 30 de septiembre de 2020. La información para las variables se recogió de las historias clínicas. Para el análisis se usó estadística descriptiva.
Resultados
Participaron 647 madres y 656 neonatos. El 85,3% de los neonatos nació de término y el 14,7% fue prematuro. El 1,7% (11/656) tuvieron PCR-RT positivos para SARS-CoV-2, y de ellos el 27,3% (3/11) requirió hospitalizados. La mortalidad fue de 4/656 (0,6%), no atribuida a COVID-19. De las madres afectadas con COVID-19, 95,7% fue asintomática, el 4,3% presentó sintomatología clínica atribuida a COVID-19, siendo en su mayoría casos leves. Las complicaciones obstétricas más frecuentes fueron preeclampsia, eclampsia, rotura prematura de las membranas y sufrimiento fetal agudo. Todas las madres fueron dadas de alta.
Conclusión
De los neonatos estudiados, el 1,7% presentó prueba PCR-RT para SARS-CoV-2 positiva. El 20,1% fue hospitalizado. La morbilidad más frecuente fue sepsis neonatal y prematuridad. La mortalidad fue de 0,6%, ningún caso atribuido a COVID-19. El cuadro clínico de esta patología fue leve en los neonatos. El 95% de las madres con COVID-19 fueron asintomáticas. De las gestantes que presentaron cuadro clínico, tuvieron sintomatología leve a moderada. No se tuvo registro de mortalidad materna en el grupo de estudio. No se puede concluir si se trata de casos de transmisión vertical del SARS-CoV-2 o estamos frente a casos de posible infección neonatal adquirida intraparto.
Ideas clave
|
La enfermedad por coronavirus 19 (COVID-19) es producida por el coronavirus-2, síndrome respiratorio agudo severo (SARS-CoV-2). Fue reportada por primera vez a la Organización Mundial de la Salud (OMS) en Wuhan (China) el 31 de diciembre de 2019 como neumonía de causa desconocida. El coronavirus está formado por una sola cadena de ácido ribonucleico y una envoltura de glucoproteína. Tiene el 79% de nucleótidos idénticos al SARS-CoV y 50% al coronavirus causante del síndrome respiratorio del Medio Oriente (MERS-CoV) [1].
La Organización Panamericana de la Salud (OPS) y OMS reportan a casi un año de diagnosticado el primer caso en la Región de Las Américas, 41 141 507 casos confirmados y 947 455 muertes confirmadas. Al 21 de enero de 2021 en Perú se reportan 1 068 802 casos y 38 931 muertes. En la Región La Libertad hay 38 662 casos confirmados y 2540 muertes [2]. El 30 de enero de 2020 la OMS declara a COVID-19 como una emergencia de salud pública internacional y el 11 de marzo del mismo año fue declarada como pandemia. En Perú, el 15 de marzo de 2020 se declara el estado de emergencia nacional, después de haberse diagnosticado el primer caso en el territorio nacional el 6 de marzo.
De acuerdo a la evidencia actual COVID-19 se transmite de forma rápida por contacto cercano a través de las gotitas respiratorias, por fómites y por aerosoles. Por estas razones, puede afectar a gestantes en cualquier trimestre del embarazo en el que se encuentren. La gestación presenta una situación inmunológica especial, caracterizada por el aumento de la susceptibilidad a algunas infecciones, incluyendo patógenos respiratorios. Por lo tanto, las mujeres gestantes podrían estar en mayor riesgo de presentar COVID-19 grave en comparación con la población general. Sin embargo, la información disponible sobre COVID-19 actual es escasa, tanto en mujeres embarazadas como en neonatos. Se puede sugerir que las gestantes afectadas por SARS-CoV-2 tienen un curso clínico similar a las mujeres no embarazadas. Todavía la evidencia sobre la posibilidad de la transmisión vertical no es clara, especialmente cuando la gestante se infecta durante el tercer trimestre y el riesgo de transmisión horizontal en el neonato es el mismo que en la población general [3][4].
La posibilidad de la transmisión del SARS-CoV-2 de la madre a su niño es una preocupación, ya que existe un riesgo teórico de transmisión vertical del SARS-CoV-2 similar a la infección por SARS-CoV. Esto, porque los receptores de enzima convertidora de angiotensina II (ACE2) se encuentran ampliamente distribuidos en la placenta. No hay evidencia de neonatos infectados por transmisión vertical en 46 casos reportados, avalados por exámenes negativos en muestras tomadas de líquido amniótico, sangre de cordón e hisopado faríngeo de neonatos, ni tampoco en muestras de leche materna. Es importante mencionar que en todos los casos, las gestantes adquirieron COVID-19 en el tercer trimestre de gestación [5].
Sin embargo, debido a la escasez de reactivos para detectar al virus, en algunos lugares a la gran mayoría de las pacientes solo se les realiza un hisopado faríngeo para reacción en cadena de la polimerasa con transcriptasa inversa (PCR-RT), que no es suficiente para probar o descartar la presencia de transmisión vertical [6].
Ante la posibilidad de infección en neonatos por transmisión vertical es que nos planteamos como problema de investigación ¿Cuáles son las características clínicas y epidemiológicas de madres con COVID-19, de sus neonatos y el riesgo potencial de transmisión vertical del SARS-CoV-2?
El Hospital Regional Docente de Trujillo, localizado en la Región La Libertad, Perú, es de categoría III-1. Este establecimiento ha sido designado para la atención de la población afectada con COVID-19, entre ellos a las gestantes infectadas y sus recién nacidos. Siendo esta una enfermedad nueva, es muy poco lo que sabemos acerca de la infección en los neonatos. Es por ello que nos preocupa conocer las manifestaciones clínicas y evolución en esta etapa de la vida, al ser una población especialmente vulnerable por la inmadurez de su sistema inmunológico, principalmente en el caso de los nacidos prematuros.
Todavía hay muy poca información acerca si el SARS-CoV-2 tiene transmisión transplacentaria o vertical. Se han encontrado escasos reportes de casos aislados. Sin embargo, es razonable pensar que todo neonato nacido de madre SARS-CoV-2 positivo puede infectarse intraútero o perinatalmente, por lo que se deben tomar todas las medidas de protección necesarias [1]. Se debe considerar que los neonatos tienen muy alto riesgo de contagio del SARS-CoV-2, debido a su sistema inmune inmaduro y a que no se puede descartar la transmisión vertical [7]. Es por eso que se hace necesario estudiar el mayor número de casos. Esto se justifica en el hecho de que cada día la información disponible cambia y los riesgos en el recién nacidos podrían estar subestimados.
El presente estudio tiene como objetivo general: determinar las características clínicas y epidemiológicas de madres con COVID-19, de sus neonatos y la transmisión vertical del SARS-CoV-2. Los objetivos específicos son:
a) Identificar las características clínicas y epidemiológicas de los neonatos nacidos de madres con COVID-19.
b) Identificar las características clínicas y de laboratorio de las madres con COVID-19.
c) Determinar la transmisión vertical SARS- CoV-2.
Varios autores realizaron estudios en grupos pequeños de casos, entre 1 y 18, reportando neonatos nacidos de madres con COVID-19 positivas durante el tercer trimestre de gestación. En estos estudios tomaron muestras de líquido amniótico, placenta, sangre de cordón umbilical y de hisopado faríngeo, siendo todos los resultados negativos [6][8][9][10][11][12][13].
Cheruiyot y colaboradores [3] incluyeron en su análisis cinco estudios (16 gestantes con COVID-19) realizados en China. Todos los casos fueron mujeres gestantes que iniciaron los síntomas en el tercer trimestre. Ninguna de las nuestras tomadas a los neonatos fueron positivas para SARS-CoV-2. Asimismo, Di Mascio y colaboradores [14] realizaron una revisión sistemática en Italia, en la que incluyeron seis estudios de gestantes con COVID-19 (41 gestantes). Ninguno de los recién nacidos mostró signos de transmisión vertical durante el periodo de seguimiento. Del mismo modo Yan y colaboradores [15] en China, realizaron un estudio multicéntrico que incluyó 116 gestantes afectadas por COVID-19 confirmado. Al 86% de los neonatos se les tomó la muestra de hisopado faríngeo, muestra de líquido amniótico y de sangre de cordón para buscar la presencia de SARS-CoV-2. Todos los resultados fueron negativos.
Yu y colaboradores [16] en China, reportan el caso de un neonato con resultado positivo de PCR-RT para SARS-CoV-2 en la muestra tomada de hisopado faríngeo a las 36 horas de nacido. Quien presentó dificultad respiratoria leve y la radiografía de tórax mostró afectación pulmonar leve. El paciente tuvo PCR-RT positiva en muestra tomada de nasofaringe. Sin embargo, la prueba de placenta y sangre de cordón umbilical fueron negativas, por lo cual se pone en duda que haya sido una infección vertical.
Dong y colaboradores [17] en China, reportan el caso de un recién nacido con anticuerpos IgG e IgM elevados para SARS–CoV-2, producto de una madre positiva para COVID-19. De igual manera Zeng y colaboradores [18] reportan dos neonatos que tuvieron IgG e IgM elevados en muestras de sangre al nacer. Las pruebas de IgM e IgG en suero tienen una sensibilidad 88,2 y especificidad de 99% para IgM, y una sensibilidad 97,8 y especificidad de 97,9% para IgG. La IgM no se transfiere por vía placentaria y el hecho de encontrar IgM elevada en el neonato sugiere que se infectó en útero. La IgM se eleva después de tres a siete días de la infección y, dado que la muestra fue tomada al nacer, esto avala la infección en útero.
Estamos atravesando por una pandemia que está causando muchas muertes a nivel mundial, producida por un nuevo coronavirus. El SARS–CoV-2, que se ha asociado con infección severa del tracto respiratorio bajo, síndrome de dificultad respiratoria aguda y muerte [19].
Las manifestaciones clínicas de la infección por SARS–CoV-2 incluyen fiebre, tos seca, disnea, dolor de pecho, fatiga y mialgia. Son comunes las manifestaciones sensoriales como anosmia y disgeusia. Los síntomas menos comunes incluyen dolor de cabeza, mareos, dolor abdominal, diarrea, náuseas y vómitos. En piel se ha descrito erupción, urticaria generalizada y vesículas parecidas a la varicela. Se describe también alteraciones hematológicas, linfopenia y neutrofilia, trombocitopenia moderada, tiempo de protrombina alargado y coagulación intravascular diseminada en casos graves y eventos tromboembólicos.
Aproximadamente el 75% de los pacientes pueden cursar con neumonía bilateral. En la tomografía computarizada de tórax se puede observar opacidades en vidrio esmerilado, consolidación y anormalidades intersticiales que llevan a un síndrome respiratorio agudo severo con necesidad de ventilación mecánica que puede desembocar en la muerte. Se han informado complicaciones graves como hipoxemia, síndrome de dificultad respiratoria agudo, arritmia, shock, daño cardíaco agudo con falla cardiaca fulminante, accidente cerebrovascular agudo y daño renal agudo en pacientes con COVID-19. Los niños generalmente son asintomáticos y uno de los síntomas más frecuentes en ellos son los vómitos [19][20].
Los neonatos pueden ser asintomáticos o presentar síntomas como fiebre, rinorrea, tos, taquipnea, diarrea e intolerancia a la alimentación, con recuperación posterior sin secuelas. No obstante, la evolución de la enfermedad en algunos casos podría ser severa y requerir ventilación mecánica [21][22].
La evidencia actual muestra que COVID-19 durante el embarazo temprano no es más severo que entre las mujeres no embarazadas. Se presentan patrones similares de sintomatología, gravedad de la enfermedad y resultado. Sin embargo, algunas pacientes embarazadas infectadas podrían desarrollar una enfermedad muy grave, que requiere ventilación mecánica e incluso fallecer [19].
El Instituto Nacional de Salud de los Estados Unidos [23] refiere que la sintomatología clínica puede variar de acuerdo a la severidad de la enfermedad y la divide en las siguientes categorías:
a) COVID-19 leve: definida como la ausencia de neumonía viral e hipoxemia. Pueden tener síntomas como fiebre, tos, dolor de garganta, dolor de cabeza, malestar general, dolor muscular, náuseas, vómitos, diarrea, pérdida del gusto y el olfato
b) COVID-19 moderada: para aquellos con neumonía viral sin hipoxemia.
c) COVID-19 severa: cuando se presenta con disnea, hipoxemia o infiltrados pulmonares superior a 50%.
La detección rápida y precisa de COVID-19 es crucial para controlar los brotes en la comunidad y en los hospitales. Las pruebas de diagnóstico actuales para el coronavirus incluyen la PCR-RT, PCR-RT en tiempo real (PCR-rRT) y amplificación isotérmica mediada por bucle de transcripción inversa (RT-LAMP) [24].
La transmisión vertical se refiere al pasaje del patógeno de la madre al bebé durante el periodo antes y después al parto. Especialmente incluye la transmisión por células germinales o sangre a través de la placenta durante el embarazo y postparto mediante la lactancia materna [10].
Existe controversia acerca de si la infección por SARS-CoV-2 puede ser transmitida en útero de la madre a su feto, debido a que la mayoría de los trabajos reportados han sido en gestantes durante el tercer trimestre. Yu y colaboradores [25] reportan dos casos de SARS-CoV-2 negativo en líquido amniótico en mujeres infectadas durante el primer trimestre (ocho semanas). Al llegar al segundo trimestre se les realizó una amniocentesis. En la muestra se realizó PCR, IgM e IgG, siendo todas las pruebas negativas. Aunque el SARS-CoV-2 no fue detectado en el líquido amniótico de estas pacientes, la posibilidad de la transmisión vertical durante el primer y segundo trimestre de la gestación no se puede descartar por diversas razones:
A la fecha no hay evidencia de las consecuencias de la infección por SARS-CoV-2 en gestantes, pero los resultados podrían ser graves en la madre y el bebé. Algunos autores recomiendan que los recién nacidos, hijos de madres COVD-19 positivas, deben ser aislados por lo menos durante 14 días [26][27]. En contraste Elwood y colaboradores [28] a nombre del comité de enfermedades infecciosas de la Sociedad de Obstetras y Ginecólogos de Canadá, recomiendan que el manejo del neonato debe decidirse de acuerdo a la mejor evidencia y condiciones de la madre y su hijo. No se recomienda el aislamiento universal en el hijo de madre confirmada o sospechosa. Esto dependería de la disponibilidad de recursos y los valores de la familia, quienes pueden elegir separar al bebé de su madre hasta que ella termine su aislamiento. La madre puede usar mascarilla y realizar un correcto lavado de manos para cuidar a su bebé, y podría elegir dar lactancia directa. Es probable que la madre pueda transferir anticuerpos a su hijo a través de la lactancia materna. Sin embargo, no hay evidencia sobre eso y el beneficio potencial no es claro.
Los datos disponibles sobre COVID-19 en pacientes embarazadas no proporcionan una conclusión clara sobre las implicancias clínicas para la madre y su hijo. Los reportes presentados hasta ahora son favorables, pero los riesgos fetales y maternos podrían no estar considerándose en toda su magnitud. La experiencia, hasta ahora, se limita a las madres que desarrollaron la enfermedad en la gestación tardía y se desconocen las consecuencias fetales de las infecciones de larga data que ocurren en la gestación temprana [29].
El presente estudio es observacional, descriptivo, transversal, realizado en el Hospital Regional Docente de Trujillo, Perú. Este es un establecimiento categoría III-1, designado para atender a los pacientes con COVID-19 en la región.
La población estuvo conformada por todas las madres con serología positiva para SARS-CoV-2 y sus neonatos, nacidos en el establecimiento entre el 18 de abril y el 30 de septiembre de 2020.
Se identificaron retrospectivamente a todos los neonatos hijos de madres con COVID-19 que tuvieron su parto en el establecimiento de salud. Se incluyeron en el estudio todos los que contaron con los datos necesarios para la investigación registrados en las historias clínicas, así como el resultado de PCR-RT del neonato. Se excluyeron del estudio a los pacientes con historias clínicas neonatales o maternas incompletas.
El estudio fue de tipo censal, por lo que no se realizó el cálculo de tamaño de muestra. Se trabajó con todas las madres y sus neonatos que cumplieron con los criterios de inclusión.
La información de las variables del recién nacido se tomó de las historias clínicas: edad gestacional por examen físico, peso al nacer, Apgar al minuto y a los cinco minutos, si requirió hospitalización, morbilidad y mortalidad. Así también se registraron las variables maternas como la condición al egreso y las complicaciones obstétricas, los resultados de la prueba de anticuerpos anti SARS-CoV-2 y el cuadro clínico por COVID-19, considerando:
Los datos de las madres y sus neonatos se tomaron de las historias clínicas y fueron registrados en la ficha de investigación elaborada para ese fin, consignando la información con número de historia clínica para resguardar el anonimato del paciente. Para evitar los sesgos de medición, los datos fueron recogidos de manera simultánea por dos investigadores y posteriormente revisados por otros dos investigadores para asegurar la calidad de la información.
La evidencia de transmisión vertical se determinó realizando la prueba PCR-rRT en hisopado nasofaríngeo del recién nacido, tomado dentro de las dos horas de nacido. Las muestras fueron enviadas al laboratorio referencial de la Gerencia Regional de Salud La Libertad.
Se siguió la Directiva Sanitaria del Ministerio de Salud [30], que recomienda que a toda gestante que acuda a un establecimiento de salud se le debe realizar la prueba rápida, a fin de confirmar o descartar un caso de COVID-19. En cumplimiento de ello, si la gestante tenía anticuerpos anti SARS-CoV-2 positivo era ingresada al hospital del estudio y de ser negativa, era derivada a otros establecimientos de salud. Asimismo, eran admitidas todas las gestantes derivadas de otros centros que tenían prueba rápida serológica positiva. Para detectar los anticuerpos anti SARS-CoV-2 se utilizó la prueba rápida LUNGENE COVID-19 IgG/IgM rapid test cassette producido en China por la compañía Hangzhou Clongene Biotech. Esta es una prueba de inmunocromatografía de flujo lateral para la detección cualitativa de anticuerpos IgG e IgM para SARS-CoV-2 en sangre completa, suero o plasma.
Los resultados fueron presentados en tablas de contingencia. Para el análisis estadístico las variables continuas se expresaron en mediana y rango intercuartil y rangos simples. Las variables categóricas se presentaron en número y porcentaje mediante el programa estadístico SPSS para Windows versión 23.
En cuanto a los aspectos éticos, el presente estudio contó con la aprobación del Jefe de la Oficina de apoyo a la Docencia e Investigación del Hospital Regional Docente de Trujillo, quien considera que el proyecto presentado reúne los criterios técnicos y éticos necesarios, por lo que autorizó su ejecución. La información de los pacientes se tomó usando codificación para la identificación de los participantes y respetando la confidencialidad y veracidad de toda la información.
Se incluyeron 656 neonatos hijos de 647 madres con COVID-19, esto debido a que hubo nueve nacimientos gemelares.
En la Tabla1 se muestra las características de 656 neonatos. Se observa que la mediana (ME) y rango intercuartil (IQR) de la edad gestacional (por examen físico) en semanas fue de 39 (38 a 40). El 85,4% fueron neonatos a término y 14,6% fueron pretérmino. En relación al peso al nacer en gramos la mediana y rango intercuartil fue 3190 ± 780 (2770 a 3550), con el 10,6% de bajo peso al nacer (peso al nacer menor a 2500 gramos). El 3,1% tuvo puntaje de Apgar inferior a7 al primer minuto y el 0,5% a los 5 minutos. Se hospitalizó al 20,1% de neonatos y el 1,7% tuvo prueba PCR-RT de nasofaringe positiva.
Tabla 1. Características epidemiológicas de los neonatos, hijos de madre con COVID- 19 positivo.
La Tabla 2 muestra que de 132/656 casos que se hospitalizaron. Las morbilidades más frecuentes fueron la sepsis neonatal con 48,5%; enfermedad de la membrana hialina 9,1% e ictericia 9,1%, entre otras. El 99,4% de neonatos fueron dados de alta.
Tabla 2. Morbilidad neonatal, en hijos de madre con COVID- 19 positivo.
En la Tabla 3 se muestra la mortalidad neonatal, siendo de 4/656 (0,6%). De ellos el 75% fueron muerte neonatal precoz y el 25% muerte neonatal tardía. El peso al nacer promedio fue de 1105 gramos con rango entre 720 y 1600 gramos. Las causas de muerte neonatal temprana fueron inmaturidad extrema el 2/3 y enfermedad de la membrana hialina 1/3. La muerte neonatal tardía se produjo como consecuencia de enterocolitis necrotizante.
Tabla 3. Mortalidad neonatal, en hijos de madre con COVID- 19 positivo.
En la Tabla 4 se describen las características clínicas y de laboratorio de las 647 madres incluidas en el estudio. El 4,3% fue sintomática y de ellas el 71,4% tuvo sintomatología leve, el 17,9% moderada y el 10,7% severa. No hubo casos de muerte materna. En cuanto a las complicaciones obstétricas se presentaron en el 27,4% de las gestantes, siendo las más frecuentes la preeclampsia 76/177 (42,9%), la rotura prematura de las membranas 48/177 (27,1%) y la hipertensión inducida por la gestación 15/177 (8,5%), entre otras. A todas se les realizó prueba serológica de anticuerpos para SARS-CoV-2, observado IgM(+) IgG(-) en 7,4%, IgM(+) IgG(+) en 81,9% e IgM(-) IgG(+) en 10,7%.
Tabla 4. Características clínicas y de laboratorio de las madres con COVID-19.
La Tabla 5 muestra las características clínicas, epidemiológicas y de laboratorio de los 11 neonatos que tuvieron PCR-RT para SARS-CoV-2 positiva. De ellos 3 (27,3%) casos fueron hospitalizados 2 (18,2%) presentaron manifestaciones clínicas como dificultad respiratoria, taquipnea, vómitos y 1 (9,1%) por ictericia. Todos los casos fueron dados de alta en buenas condiciones y se les realizó seguimiento telefónico hasta los 28 días de nacidos, ninguno presentó complicaciones.
Las infecciones virales son complicaciones frecuentes en el embarazo; en gestantes, el COVID-19 puede causar desde infecciones asintomáticas hasta enfermedades muy graves que podría llevarlas a un estado crítico e incluso la muerte. Muchos microorganismos pueden transmitirse de forma vertical en el periodo prenatal (o infección congénita), en el momento o alrededor del momento del parto (transmisión perinatal), como así también de forma horizontal (transmisión posnatal), con una amplia gama de secuelas obstétricas y neonatales. Durante el periodo prenatal la infección puede darse en cualquier momento de la gestación. Las consecuencias en el feto pueden ir desde embriopatía (si la infección es en el primer trimestre de gestación) e infección fetal en el segundo trimestre, hasta síntomas provocados por la respuesta inmune en el segundo y tercer trimestre [31][32].
El riesgo de transmisión vertical durante el parto vaginal en pacientes embarazadas con COVID-19 es todavía un tema de debate. Mientras no tengamos claro el mecanismo de transmisión, se deben promover normas obstétricas para reducir el riesgo potencial de infección perinatal durante la asistencia del parto vaginal [33].
Dentro de las características epidemiológicas de los neonatos estudiados, predominaron los recién nacidos a término, peso al nacer igual o mayor a 2500 gramos y Apgar igual o mayor a 7 tanto al minuto como a los cinco minutos. Esto difiere de lo reportado por Bwire y colaboradores [34] quienes, en una revisión sistemática, encontraron que 62,5% tuvo parto prematuro, mientras que 37,5% fuer partos a término. En el grupo de nacidos a término 3,2% dio positivo para virus SARS-CoV-2, mientras que para los prematuros el 18,4% de los bebés fueron positivos. Por otro lado, Zeng y colaboradores [18] y Neef y colaboradores [35] reportan que el Apgar fue de 7 a 10 al minuto y de 8 a 10 a los cinco minutos.
De los neonatos atendidos, el 20,1% fueron hospitalizados y 79,9% permanecieron en alojamiento conjunto con sus madres, manteniendo las medidas de bioseguridad, distanciamiento de dos metros entre la madre y su bebé, y uso de mascarilla permanente por la madre. Estos resultados concuerdan con lo publicado por Neef y colaboradores [35], quienes reportan que de 261 neonatos hijos de madre con COVID-19, el 80,4% no presentó manifestaciones clínicas y los que presentaron síntomas fueron leves. Los hallazgos del presente estudio se pueden explicar porque la población neonatal estuvo conformada en su mayoría por recién nacidos a término, quienes suelen tener menor número de complicaciones en el periodo neonatal.
A todos los neonatos se les realizó hisopado nasofaríngeo para examen de PCR-RT para SARS-CoV-2 dentro de las dos horas de nacidos, encontrando el 1,7% de casos positivos. Neef y colaboradores [35] realizaron un estudio de revisión en el que se incluyeron 261 recién nacidos hijos de madres con COVID-19 y el 10% fueron positivos para SARS-CoV-2. Bwire y colaboradores [34] en una revisión sistemática de 33 artículos, incluyeron 205 bebés nacidos de madres con COVID-19 positivas, reportando que el 6,3% de los bebés dio positivo para SARS-CoV- 2 al nacer. Barrero y colaboradores [36] en su artículo de revisión citan un estudio de cohorte poblacional realizado en el Reino Unido por Knight, el cual encontró una prevalencia de 5% de recién nacidos positivos nacidos de madres infectadas con SARS-CoV-2, una cohorte española reportada por Martínez-Pérez donde la adquisición perinatal ocurrió en 6,9% de los recién nacidos expuestos, y los datos del Registro Nacional de Vigilancia y Epidemiología de la Infección Perinatal por COVID-19 (NPC-19) en Estados Unidos reportan que el 1,9% de las pruebas virales fueron positivas en recién nacidos de madres con infección confirmada por SARS-CoV-2. Shalish y colaboradores [37] realizaron un estudio de revisión en el que incluyeron 137 recién nacidos hijos de madres con COVID-19 y el 3% tuvo pruebas de PCR-RT para SARS-CoV-2 positivas. El resultado obtenido en el presente estudio es menor de lo reportado en los trabajos mencionados, donde se observó que la incidencia de neonatos con prueba PCR-RT para SARS-CoV-2 positiva en hijos de madres con COVID-19 varía en un rango de 1,9 a 10%.
El 20,1% de los neonatos estudiados fueron hospitalizados. Los diagnósticos más frecuentes fueron sepsis, enfermedad de la membrana hialina, ictericia, pequeños para la edad gestacional severos y taquipnea transitoria del recién nacido, entre otras. Estos hallazgos concuerdan con Neef y colaboradores [35], quienes reportan que 82,5% de neonatos estudiados fueron dados de alta, lo que apoya el curso leve de la infección en neonatos. Dentro de los síntomas más frecuentes refieren disnea (42,3%), fiebre (19,1%), vómitos (16,1%) y pequeño para la edad gestacional (8,1%). Del mismo modo, Zeng y colaboradores [38] en un estudio de cohorte de 33 recién nacidos hijos de madres con COVID-19, 3 (9%) fueron SARS-CoV-2 positivos, los síntomas clínicos fueron leves y los resultados favorables. Sin embargo, los resultados difieren de lo reportado por Liguoro y colaboradores [39], quienes realizaron una revisión sistemática que incluyó un total de 25 recién nacidos con SARS-CoV-2. De ellos fueron asintomáticos el 20%, tuvieron signos leves de infección clínica el 48%, síntomas moderados el 20% y el 12% estaba gravemente enfermo. La disnea fue el signo más común en la edad neonatal (40%). También se describió fiebre (32%) e intolerancia alimentaria (24%).
En el presente estudio observamos que la mortalidad fue de 0,6% y ninguna de las muertes fue atribuida a COVID-19. De los 11 neonatos que tuvieron PCR-RT para SARS-CoV-2 positiva, el 27,3% fue hospitalizado por manifestaciones clínicas como dificultad respiratoria, taquipnea, vómitos e ictericia. Todos los casos fueron dados de alta en buenas condiciones y se les realizó seguimiento telefónico hasta los 28 días de nacidos. Ninguno presentó complicaciones. Dichos resultados concuerdan con Neef y colaboradores [35], quienes reportan que el 66,7% de neonatos que tuvieron prueba positiva para SARS-CoV-2 presentaron sintomatología clínica leve y que la aparición de los síntomas fue antes de los tres días de nacidos. Asimismo, reportaron el 1,7% de muertes perinatales. Se trató de un caso natimuerto de 38 semanas de edad gestacional en el que el estudio de placenta mostró villitis crónica grave, un neonato nacido prematuro de 35 semanas de edad gestacional con diagnóstico de asfixia severa y un neonato prematuro de 34 semanas de edad gestacional con muerte neonatal tardía con diagnóstico de falla multiorgánica, coagulación intravascular diseminada y choque refractario. En todos los casos no se pudo demostrar infección por SARS-CoV-2. La información disponible muestra que los neonatos suelen tener síntomas clínicos leves, pero en algunos casos podría haber sintomatología severa. No se reporta COVID-19 como causa de muerte neonatal.
En nuestro trabajo las madres presentaron COVID-19 en el tercer trimestre de gestación y el 95,7% fue asintomática. No hubo fallecidas. Barrero y colaboradores [36] refieren que las tasas de infección en mujeres gestantes fluctúan de acuerdo a las regiones. Un establecimiento de salud en la ciudad de Nueva York reporta que 20% de gestantes presentó prueba positiva para SARS-CoV-2 y 13% de ellas fue asintomática, a diferencia de un estudio en Connecticut que reportó que 3,9% de gestantes tuvo prueba positiva para SARS-CoV-2 y de ellas 2,9% fue asintomática. Asimismo Yang y colaboradores [12] reportan el cuadro clínico de COVID-19 en mujeres embarazadas, siendo 86% leve, el 9,3% grave y el 4,7% crítica, lo que es similar a la de mujeres adultas no embarazadas. Del mismo modo, Blitz y colaboradores [40] refieren que de todas las mujeres hospitalizadas por COVID-19, las mujeres gestantes no presentaron mayor riesgo de admisión a unidad de cuidados intensivos, en comparación con las mujeres no gestantes. En contraste Hantoushzadeh y colaboradores [41] reportan nueve gestantes con el diagnóstico de infección por SARSCoV-2, todas presentaron un cuadro clínico severo y al momento del reporte 7/9 (77,8%) habían fallecido, 1/9 continuaba en estado crítico, dependiente de ventilador y 1/9 estaba en proceso de recuperación. Este estudio contrasta con dichos reportes, dado que no hay mortalidad en gestantes afectadas por COVID-19. Las diferencias encontradas podrían explicarse debido a que el grupo de madres incluidas en este estudio presentó COVID-19 en el tercer trimestre y la mayoría fue asintomática.
Las complicaciones obstétricas más frecuentes fueron preeclampsia, rotura prematura de las membranas e hipertensión inducida por la gestación. Yu y colaboradores [16] reportan los casos de siete gestantes con COVID-19 que terminaron en parto, ninguna de ellas presentó complicaciones obstétricas y todas ellas tuvieron sintomatología clínica leve. Por otro lado, Yan y colaboradores [15] en su estudio refieren que 6/99 (6,1%) pacientes presentaron rotura prematura de las membranas y 21/99 (21,2%) tuvieron parto pretérmino. Liu y colaboradores [13] incluyeron en su estudio 13 pacientes gestantes con COVID-19, de ellas cinco terminaron en parto por cesárea de urgencia y seis tuvieron labor de parto pretérmino. Las complicaciones obstétricas y perinatales podrían atribuirse a la infección por SARS-CoV-2, así como a que los cambios fisiológicos que ocurren durante la gestación, harían que la mujer sea menos tolerante a la hipoxia durante el tercer trimestre de embarazo.
A los 11 neonatos con PCR-RT para SARS-CoV-2 positiva, se les tomó las muestras en hisopado nasofaríngeo entre los cinco y 120 minutos de nacidos. Sus madres tuvieron pruebas de inmunoglobulinas específicas para SARS-CoV-2, IgM positiva y todas ellas fueron asintomáticas. Para diagnosticar la infección por SARS-CoV-2 en la gestante sintomática debe detectarse el virus por PCR-RT en muestra respiratoria y en mujeres asintomáticas debe haber la historia de contacto epidemiológico positivo y el detectar el virus por PCR-RT en muestra respiratoria. En neonatos sin signos clínicos de infección, nacidos de madres infectadas, debe diagnosticarse con PCR-RT nasofaríngeo positivo a SARS-CoV-2 tomado al nacer. Una segunda muestra negativa corresponde a un caso de posible infección neonatal adquirida intraparto [42].
Una de las limitaciones más importantes del estudio fue la escasez de pruebas moleculares en el hospital donde se realizó el estudio, debido a que los establecimientos de salud públicos en nuestro país tienen un presupuesto muy bajo. Por esta razón, no nos fue posible confirmar el diagnóstico de COVID-19 en las gestantes, al no poder realizarles PCR-RT en muestras de nasofaringe, ni tomar muestras en placenta, líquido amniótico, ni sangre de cordón umbilical. Por lo tanto, no se pudo demostrar la transmisión vertical. De acuerdo a la definición de casos en mujeres gestantes y neonatos publicados por Shah y colaboradores [42], podríamos decir que estamos frente a casos de posible infección neonatal adquirida intraparto. Sin embargo, por la limitante en realizar las pruebas diagnósticas, no podemos excluir la posibilidad de una transmisión vertical en los casos reportados.
La posibilidad de la transmisión del SARS-CoV-2 de la madre a su feto es una preocupación actual y existen diversos trabajos referentes al tema. Una madre podría infectarse en cualquier momento durante el embarazo. Además, los resultados en el feto cuando la infección materna ocurre en una etapa temprana del embarazo, puede ser diferente que cuando ocurre cerca al parto. La infección durante el primer o segundo trimestre podría causar aborto espontáneo, parto prematuro, defectos de nacimiento o posiblemente otras características de una infección congénita. Sin embargo, en la infección materna cercana al parto, debemos considerar la posibilidad de que el recién nacido pueda tener una infección activa [42].
Pulinx y colaboradores [32] y Penfield y colaboradores [43] reportan casos en el que realizaron pruebas para SARS-CoV-2 en tejido placentario, membranas y líquido amniótico, presentando resultados positivos. Algarroba y colaboradores [44] presentan el caso de una mujer de 28 semanas de gestación con COVID-19 grave. En ella se estudió la placenta usando microscopía electrónica para evaluar la posible transmisión vertical. En dichos estudios se visualizaron viriones de coronavirus que invadían los sincitiotrofoblastos en las vellosidades placentarias. Además, se identificaron viriones de SARS-CoV-2 en los procesos celulares de los fibroblastos de las vellosidades placentarias, y el bebé tuvo resultados negativos para la prueba de COVID-19 en los días dos y tres de vida. Estos hallazgos contribuyen con la evidencia de infección placentaria con SARS-CoV-2. Sin embargo, no hubo evidencia de infección fetal.
Vivanti y colaboradores [45] y Zamaniyan y colaboradores [46] reportan los casos de muestras de líquido amniótico tomadas antes de romper las membranas con resultados positivos para SARS-CoV-2. Los neonatos en ambos estudios tuvieron muestras de hisopado nasofaríngeo con resultados positivos para SARS-CoV-2. Lo que sugiere que los lactantes tendrían una probable infección intrauterina de transmisión transplacentaria de SARS-CoV-2.
La transmisión vertical del SARS-CoV-2 podría darse a través de la leche materna, lo cual todavía es muy discutido. Se han encontrado algunos estudios en los que reportan la presencia del virus en la leche materna. Sin embargo, no se ha podido confirmar que la infección en el neonato fue por esa vía. Grob y colaboradores [47] y Bastug y colaboradores [48] reportan casos de madres con COVID-19 que tuvieron muestras de leche materna positivas para SARS-CoV-2. Los hijos de ambas mujeres presentaron pruebas positivas para SARS-Cov-2, pero no fue posible confirmar si los neonatos se infectaron a través de la leche materna. Por otro lado, Buonsenso y colaboradores [49] reportan el caso de una madre con SARS-CoV-2 positivo, cuya leche materna fue recolectada para PCR-RT durante los primeros cinco días postparto que dio positivo en 3/5 muestras para SARS-CoV-2. En tanto, al neonato se le realizó PCR-RT para SARS-CoV-2 en hisopado nasofaríngeo y rectal, todos los resultados fueron negativos.
Los estudios previos no son concluyentes en cuanto a la transmisión vertical del SARS-CoV-2 por la leche materna, por lo cual debemos evaluar la importancia de la continuidad de la lactancia materna para el neonato en estos tiempos. Además de los beneficios ya bien conocidos y documentados de la lactancia materna, se han podido aislar anticuerpos IgG e IgA específicos contra el SARS-CoV-2 en la leche humana, y han mostrado una fuerte capacidad neutralizante del SARS-CoV-2. Si bien estos datos muestran una sólida respuesta inmunológica de la leche materna contra el virus, también sugieren que la leche materna proporciona una forma activa de protección contra el virus, lo que respalda la protección y promoción de la lactancia materna [50][51].
De acuerdo a los estudios reportados existe la posibilidad de transmisión vertical transplacentaria o por la leche materna. Sin embargo, todavía no se tiene una explicación del por qué algunos neonatos se ven afectados y otros no.
Al igual que con otras infecciones virales, las mujeres gestantes son vulnerables a la enfermedad por SARS-CoV-2, Si bien es cierto los reportes actuales muestran una baja incidencia de transmisión vertical, se deben continuar realizando estudios al respecto. Asimismo, cuando la infección materna se adquiere en las últimas semanas de la gestación, el cuadro clínico de la infección neonatal por lo general es leve a moderado. No obstante, aún falta mayor evidencia sobre los riesgos en el feto y neonato cuando las infecciones por COVID-19 se dan en gestantes durante el primer trimestre.
El 1,7% de los neonatos estudiados presentó prueba PCR-RT positiva para SARS-CoV-2, el 14,6% fueron recién nacidos pretérmino, el 20,1% fueron hospitalizados y la morbilidad más frecuente fue sepsis neonatal. Se presentó una mortalidad de 0,6%, ningún caso atribuido a COVID-19. Los neonatos con SARS-VoV-2 positivo que fueron hospitalizados, presentaron un cuadro clínico leve.
Las gestantes con COVID-19 fueron asintomáticas en más del 95%. De las que presentaron cuadro clínico, la mayoría tuvo sintomatología leve a moderada. No se tuvo registro de mortalidad materna en el grupo de estudio.
La limitante en la disponibilidad de pruebas diagnósticas, no nos permite concluir que se trata de casos de transmisión vertical del SARS-CoV-2, o si estamos frente a casos de posible infección neonatal adquirida intraparto.
Notas
Roles de contribución
AGVF, BMZV, FPFF: Conceptualización, Metodología, software, Validación, Análisis formal, Investigación, Recursos, Curación de datos, Redacción- Preparación del borrador original, Redacción- Revisión y edición, Visualización, Supervisión, Administración de proyectos. JCHP: Conceptualización, Metodología, Validación, Análisis formal, Investigación, Redacción- Preparación del borrador original. LMGCF, SAAG, RALA, KPAC, HAAH, WRZA, EJIC, CPRC, LKRG, JGPE, AMPC, SASR: Validación, Análisis formal, Investigación, Redacción- Preparación del borrador original.
Conflictos de intereses
Los autores declaran no tener conflicto de intereses con la publicación de este artículo y que no recibieron financiamiento de ninguna institución.
Financiamiento
El financiamiento se realizó con recursos propios de los autores, no se recibió financiamiento externo.
Aspectos éticos
Para el presente estudio se tomó en cuenta la Guía internacional de ética para estudios epidemiológicos, preparada por el Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS) en colaboración con la Organización Mundial de la Salud (OMS) en Ginebra, 2009. Respetando los principios éticos principales de los estudios epidemiológicos que involucran seres humanos, especialmente para salvaguardar la confidencialidad y la veracidad de los datos. Asimismo, el protocolo de investigación fue revisado y aprobado por el Jefe de la oficina de apoyo a la Docencia y la Investigación del Hospital Regional Docente de Trujillo.
Idioma del envío
Español.

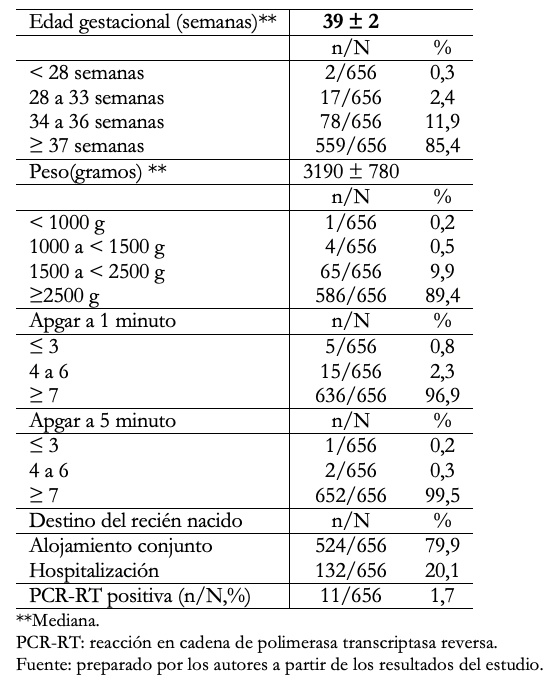 Tabla 1. Características epidemiológicas de los neonatos, hijos de madre con COVID- 19 positivo.
Tabla 1. Características epidemiológicas de los neonatos, hijos de madre con COVID- 19 positivo.

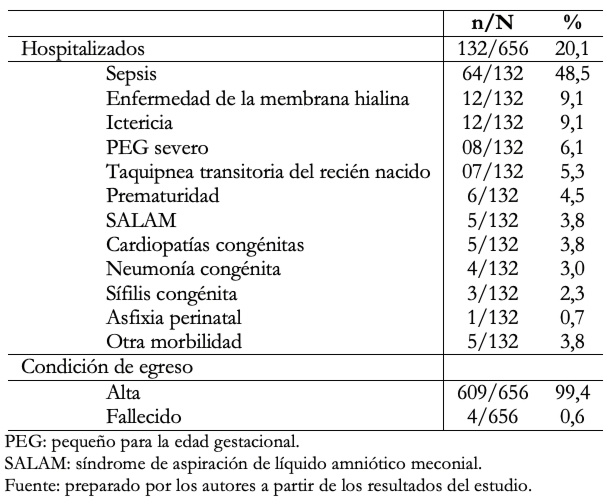 Tabla 2. Morbilidad neonatal, en hijos de madre con COVID- 19 positivo.
Tabla 2. Morbilidad neonatal, en hijos de madre con COVID- 19 positivo.

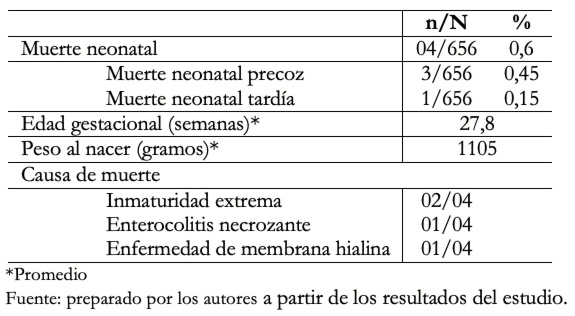 Tabla 3. Mortalidad neonatal, en hijos de madre con COVID- 19 positivo.
Tabla 3. Mortalidad neonatal, en hijos de madre con COVID- 19 positivo.

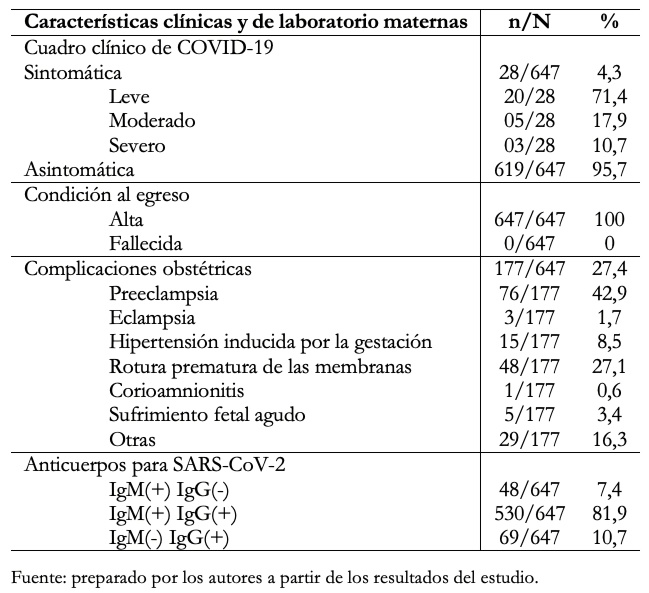 Tabla 4. Características clínicas y de laboratorio de las madres con COVID-19.
Tabla 4. Características clínicas y de laboratorio de las madres con COVID-19.

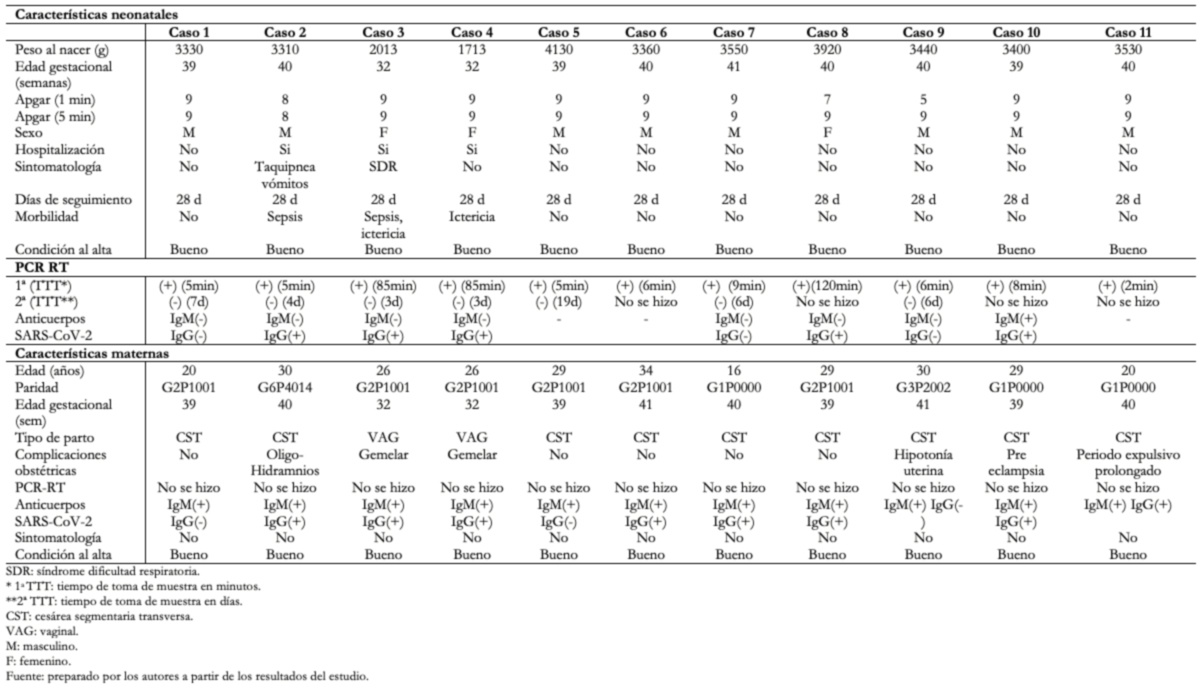 Tabla 5. Características clínicas, epidemiológicas y de laboratorio de neonatos con COVID-19 positivo.
Tabla 5. Características clínicas, epidemiológicas y de laboratorio de neonatos con COVID-19 positivo.

Introduction
COVID-19 disease can affect women at any stage of pregnancy, and newborns could become infected with SARS-CoV-2 through vertical or horizontal transmission.
Objective
To determine clinical and epidemiological characteristics of mothers with COVID-19, associated neonatal outcomes, and to evaluate SARS-CoV-2 vertical transmission.
Methods
We conducted an observational, descriptive, cross-sectional study. We included all mothers with positive serology for SARS-CoV-2 and their newborns at the Hospital Regional Docente de Trujillo from April 18 to September 30, 2020. Variables were collected from the medical records, and descriptive statistics were used for the analysis.
Results
A total of 647 mothers and 656 neonates were enrolled. Of all live births, 85.3% and 14.7% were term and preterm neonates, respectively. We found 1.7% (11/656) of newborns with positive RT-PCR for SARS-CoV-2; and that 27.3% (3/11) of these neonates required hospitalization. Neonatal mortality was 4/656 (0.6%), and no case was attributed to COVID-19. Of all mothers affected with COVID-19, 95.7% were asymptomatic, and 4.3% presented clinical symptoms attributed to COVID-19, most of which were mild. The most frequent obstetric complications were preeclampsia-eclampsia, prelabour rupture of membranes, and acute fetal distress. All the mothers were discharged.
Conclusion
We found 1.7% of newborns with positive RT-PCR test for SARS-CoV-2; and that 20.1% of these neonates were hospitalized. The most frequent morbidity was neonatal sepsis and prematurity. The infection was mild among newborns, showing a 0.6% overall mortality, with no cases attributed to COVID-19. We found that only 5% of mothers presented symptoms, most of which were mild to moderate symptoms. There was no record of maternal mortality in this study group. It is not possible to conclude whether vertical transmission or intrapartum-acquired infection is responsible for neonatal COVID-19 infections.
 Autores:
Amalia Guadalupe Vega-Fernández[1,2], Betty María Zevallos-Vargas[1,2], Fiorella del Pilar Flores-Figueroa[1], Juan Carlos Holguín-Plasencia[1], Luis Martín Galois Centeno-Fuentes[1], Silvia Antonia Ayquipa-Gil[1], Ramón Alberto Lescano-Alva[1], Karla Patricia Arrasco-Castro[1], Hubert Alberto Alvarado-Herrera[1], William Robert Zafra-Alegre[1], Edgar Jaime Idrogo-Cayotopa[1], Cristian Pierre Reyes-Carranza[1,2], Leyla Kathy Ramírez-Gamarra[1], Jakelina Glenda Peña-Estrella[1], Angelica María Pardo-Carrasco[1], Susana Andrea Suárez-Rebaza[1]
Autores:
Amalia Guadalupe Vega-Fernández[1,2], Betty María Zevallos-Vargas[1,2], Fiorella del Pilar Flores-Figueroa[1], Juan Carlos Holguín-Plasencia[1], Luis Martín Galois Centeno-Fuentes[1], Silvia Antonia Ayquipa-Gil[1], Ramón Alberto Lescano-Alva[1], Karla Patricia Arrasco-Castro[1], Hubert Alberto Alvarado-Herrera[1], William Robert Zafra-Alegre[1], Edgar Jaime Idrogo-Cayotopa[1], Cristian Pierre Reyes-Carranza[1,2], Leyla Kathy Ramírez-Gamarra[1], Jakelina Glenda Peña-Estrella[1], Angelica María Pardo-Carrasco[1], Susana Andrea Suárez-Rebaza[1]

Citación: Vega-Fernández AG, Zevallos-Vargas BM, Flores-Figueroa F del P, Holguín-Plasencia JC, Centeno-Fuentes LMG, Ayquipa-Gil SA, et al. Clinical and epidemiological characteristics of mothers with COVID-19 and their neonates: vertical transmission. Medwave 2021;21(07):e8454 doi: 10.5867/medwave.2021.07.8454
Fecha de envío: 23/2/2021
Fecha de aceptación: 5/7/2021
Fecha de publicación: 30/8/2021
Origen: No solicitado.
Tipo de revisión: Con revisión por pares externa, por cuatro árbitros a doble ciego.

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Rasmussen SA, Smulian JC, Lednicky JA, Wen TS, Jamieson DJ. Coronavirus Disease 2019 (COVID-19) and pregnancy: what obstetricians need to know. Am J Obstet Gynecol. 2020 May;222(5):415-426. | CrossRef | PubMed |
Rasmussen SA, Smulian JC, Lednicky JA, Wen TS, Jamieson DJ. Coronavirus Disease 2019 (COVID-19) and pregnancy: what obstetricians need to know. Am J Obstet Gynecol. 2020 May;222(5):415-426. | CrossRef | PubMed | Cheruiyot I, Henry BM, Lippi G. Is there evidence of intra-uterine vertical
transmission potential of COVID-19 infection in samples tested by quantitative
RT-PCR? Eur J Obstet Gynecol Reprod Biol. 2020 Jun;249:100-101. | CrossRef | PubMed |
Cheruiyot I, Henry BM, Lippi G. Is there evidence of intra-uterine vertical
transmission potential of COVID-19 infection in samples tested by quantitative
RT-PCR? Eur J Obstet Gynecol Reprod Biol. 2020 Jun;249:100-101. | CrossRef | PubMed | Alonso Díaz C, López Maestro M, Moral Pumarega MT, Flores Antón B, Pallás
Alonso CR. Primer caso de infección neonatal por SARS-CoV-2 en España [First
case of neonatal infection due to SARS-CoV-2 in Spain]. An Pediatr (Engl Ed).
2020 Apr;92(4):237-238. | CrossRef | PubMed |
Alonso Díaz C, López Maestro M, Moral Pumarega MT, Flores Antón B, Pallás
Alonso CR. Primer caso de infección neonatal por SARS-CoV-2 en España [First
case of neonatal infection due to SARS-CoV-2 in Spain]. An Pediatr (Engl Ed).
2020 Apr;92(4):237-238. | CrossRef | PubMed | Dashraath P, Wong JLJ, Lim MXK, Lim LM, Li S, Biswas A, et al. Coronavirus disease 2019 (COVID-19) pandemic and pregnancy. Am J Obstet
Gynecol. 2020 Jun;222(6):521-531. | CrossRef | PubMed |
Dashraath P, Wong JLJ, Lim MXK, Lim LM, Li S, Biswas A, et al. Coronavirus disease 2019 (COVID-19) pandemic and pregnancy. Am J Obstet
Gynecol. 2020 Jun;222(6):521-531. | CrossRef | PubMed | Peng Z, Wang J, Mo Y, Duan W, Xiang G, Yi M, et al. Unlikely SARS-
CoV-2 vertical transmission from mother to child: A case report. J Infect Public
Health. 2020 May;13(5):818-820. | CrossRef | PubMed |
Peng Z, Wang J, Mo Y, Duan W, Xiang G, Yi M, et al. Unlikely SARS-
CoV-2 vertical transmission from mother to child: A case report. J Infect Public
Health. 2020 May;13(5):818-820. | CrossRef | PubMed | Bellini C, Gente M. Neonatal Transport and COVID-19 outbreak. Air Med J. 2020
May-Jun;39(3):154-155. | CrossRef | PubMed |
Bellini C, Gente M. Neonatal Transport and COVID-19 outbreak. Air Med J. 2020
May-Jun;39(3):154-155. | CrossRef | PubMed | Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical
transmission potential of COVID-19 infection in nine pregnant women: a
retrospective review of medical records. Lancet. 2020 Mar 7;395(10226):809-815. | CrossRef | PubMed |
Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical
transmission potential of COVID-19 infection in nine pregnant women: a
retrospective review of medical records. Lancet. 2020 Mar 7;395(10226):809-815. | CrossRef | PubMed | Yang H, Sun G, Tang F, Peng M, Gao Y, Peng J, et al. Clinical
features and outcomes of pregnant women suspected of coronavirus disease 2019. J
Infect. 2020 Jul;81(1):e40-e44. | CrossRef | PubMed |
Yang H, Sun G, Tang F, Peng M, Gao Y, Peng J, et al. Clinical
features and outcomes of pregnant women suspected of coronavirus disease 2019. J
Infect. 2020 Jul;81(1):e40-e44. | CrossRef | PubMed | Zhu H, Wang L, Fang C, Peng S, Zhang L, Chang G, et al. Clinical
analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl
Pediatr. 2020 Feb;9(1):51-60. | CrossRef | PubMed |
Zhu H, Wang L, Fang C, Peng S, Zhang L, Chang G, et al. Clinical
analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl
Pediatr. 2020 Feb;9(1):51-60. | CrossRef | PubMed | Breslin N, Baptiste C, Gyamfi-Bannerman C, Miller R, Martinez R, Bernstein K, et al. Coronavirus disease 2019 infection among asymptomatic and
symptomatic pregnant women: two weeks of confirmed presentations to an
affiliated pair of New York City hospitals. Am J Obstet Gynecol MFM. 2020
May;2(2):100118. | CrossRef | PubMed |
Breslin N, Baptiste C, Gyamfi-Bannerman C, Miller R, Martinez R, Bernstein K, et al. Coronavirus disease 2019 infection among asymptomatic and
symptomatic pregnant women: two weeks of confirmed presentations to an
affiliated pair of New York City hospitals. Am J Obstet Gynecol MFM. 2020
May;2(2):100118. | CrossRef | PubMed | Yang P, Wang X, Liu P, Wei C, He B, Zheng J, et al. Clinical
characteristics and risk assessment of newborns born to mothers with COVID-19. J
Clin Virol. 2020 Jun;127:104356. | CrossRef | PubMed |
Yang P, Wang X, Liu P, Wei C, He B, Zheng J, et al. Clinical
characteristics and risk assessment of newborns born to mothers with COVID-19. J
Clin Virol. 2020 Jun;127:104356. | CrossRef | PubMed | Liu Y, Chen H, Tang K, Guo Y. Withdrawn: Clinical manifestations and outcome
of SARS-CoV-2 infection during pregnancy. J Infect. 2020 Mar
5:S0163-4453(20)30109-2. | CrossRef | PubMed |
Liu Y, Chen H, Tang K, Guo Y. Withdrawn: Clinical manifestations and outcome
of SARS-CoV-2 infection during pregnancy. J Infect. 2020 Mar
5:S0163-4453(20)30109-2. | CrossRef | PubMed | Di Mascio D, Khalil A, Saccone G, Rizzo G, Buca D, Liberati M, et al. Outcome of coronavirus spectrum
infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and
meta-analysis. Am J Obstet Gynecol MFM. 2020 May;2(2):100107. | CrossRef | PubMed |
Di Mascio D, Khalil A, Saccone G, Rizzo G, Buca D, Liberati M, et al. Outcome of coronavirus spectrum
infections (SARS, MERS, COVID-19) during pregnancy: a systematic review and
meta-analysis. Am J Obstet Gynecol MFM. 2020 May;2(2):100107. | CrossRef | PubMed | Yan J, Guo J, Fan C, Juan J, Yu X, Li J, et al. Coronavirus disease 2019 in pregnant women: a report based on 116
cases. Am J Obstet Gynecol. 2020 Jul;223(1):111.e1-111.e14. | CrossRef | PubMed |
Yan J, Guo J, Fan C, Juan J, Yu X, Li J, et al. Coronavirus disease 2019 in pregnant women: a report based on 116
cases. Am J Obstet Gynecol. 2020 Jul;223(1):111.e1-111.e14. | CrossRef | PubMed | Yu N, Li W, Kang Q, Xiong Z, Wang S, Lin X, et al. Clinical features and obstetric and neonatal
outcomes of pregnant patients with COVID-19 in Wuhan, China: a retrospective,
single-centre, descriptive study. Lancet Infect Dis. 2020 May;20(5):559-564. | CrossRef | PubMed |
Yu N, Li W, Kang Q, Xiong Z, Wang S, Lin X, et al. Clinical features and obstetric and neonatal
outcomes of pregnant patients with COVID-19 in Wuhan, China: a retrospective,
single-centre, descriptive study. Lancet Infect Dis. 2020 May;20(5):559-564. | CrossRef | PubMed | Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical
Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020
May 12;323(18):1846-1848. | CrossRef | PubMed |
Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical
Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020
May 12;323(18):1846-1848. | CrossRef | PubMed | Zeng H, Xu C, Fan J, Tang Y, Deng Q, Zhang W, et al. Antibodies in Infants
Born to Mothers With COVID-19 Pneumonia. JAMA. 2020 May 12;323(18):1848-1849. | CrossRef | PubMed |
Zeng H, Xu C, Fan J, Tang Y, Deng Q, Zhang W, et al. Antibodies in Infants
Born to Mothers With COVID-19 Pneumonia. JAMA. 2020 May 12;323(18):1848-1849. | CrossRef | PubMed | Segars J, Katler Q, McQueen DB, Kotlyar A, Glenn T, Knight Z, et al. Prior and novel coronaviruses, Coronavirus
Disease 2019 (COVID-19), and human reproduction: what is known? Fertil Steril.
2020 Jun;113(6):1140-1149. | CrossRef | PubMed |
Segars J, Katler Q, McQueen DB, Kotlyar A, Glenn T, Knight Z, et al. Prior and novel coronaviruses, Coronavirus
Disease 2019 (COVID-19), and human reproduction: what is known? Fertil Steril.
2020 Jun;113(6):1140-1149. | CrossRef | PubMed | Harapan H, Itoh N, Yufika A, Winardi W, Keam S, Te H, et al. Coronavirus disease 2019 (COVID-19): A literature review.
J Infect Public Health. 2020 May;13(5):667-673. | CrossRef | PubMed |
Harapan H, Itoh N, Yufika A, Winardi W, Keam S, Te H, et al. Coronavirus disease 2019 (COVID-19): A literature review.
J Infect Public Health. 2020 May;13(5):667-673. | CrossRef | PubMed | Gulati A, Pomeranz C, Qamar Z, Thomas S, Frisch D, George G, et al. A Comprehensive Review of Manifestations of Novel
Coronaviruses in the Context of Deadly COVID-19 Global Pandemic. Am J Med Sci.
2020 Jul;360(1):5-34. | CrossRef | PubMed |
Gulati A, Pomeranz C, Qamar Z, Thomas S, Frisch D, George G, et al. A Comprehensive Review of Manifestations of Novel
Coronaviruses in the Context of Deadly COVID-19 Global Pandemic. Am J Med Sci.
2020 Jul;360(1):5-34. | CrossRef | PubMed | Oliva JE, Pleitez JA. COVID-19: transmisión vertical, enfermedad y cuidados en recién nacidos. Alerta. 2021;4(1):19-30. | CrossRef |
Oliva JE, Pleitez JA. COVID-19: transmisión vertical, enfermedad y cuidados en recién nacidos. Alerta. 2021;4(1):19-30. | CrossRef | COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. [Accessed [5/6/2021]. [Internet] | Link |
COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. [Accessed [5/6/2021]. [Internet] | Link | Zhai P, Ding Y, Wu X, Long J, Zhong Y, Li Y. The epidemiology, diagnosis and
treatment of COVID-19. Int J Antimicrob Agents. 2020 May;55(5):105955. | CrossRef | PubMed |
Zhai P, Ding Y, Wu X, Long J, Zhong Y, Li Y. The epidemiology, diagnosis and
treatment of COVID-19. Int J Antimicrob Agents. 2020 May;55(5):105955. | CrossRef | PubMed | Yu N, Li W, Kang Q, Zeng W, Feng L, Wu J. No SARS-CoV-2 detected in amniotic
fluid in mid-pregnancy. Lancet Infect Dis. 2020 Dec;20(12):1364. | CrossRef | PubMed |
Yu N, Li W, Kang Q, Zeng W, Feng L, Wu J. No SARS-CoV-2 detected in amniotic
fluid in mid-pregnancy. Lancet Infect Dis. 2020 Dec;20(12):1364. | CrossRef | PubMed | González Romero D, Ocampo Pérez J, González Bautista L, Santana-Cabrera L.
Pronóstico perinatal y de la paciente embarazada con infección por COVID-19
[Pregnancy and perinatal outcome of a woman with COVID-19 infection]. Rev Clin
Esp (Barc). 2020 Nov;220(8):533-534. | CrossRef | PubMed |
González Romero D, Ocampo Pérez J, González Bautista L, Santana-Cabrera L.
Pronóstico perinatal y de la paciente embarazada con infección por COVID-19
[Pregnancy and perinatal outcome of a woman with COVID-19 infection]. Rev Clin
Esp (Barc). 2020 Nov;220(8):533-534. | CrossRef | PubMed | Favre G, Pomar L, Qi X, Nielsen-Saines K, Musso D, Baud D. Guidelines for
pregnant women with suspected SARS-CoV-2 infection. Lancet Infect Dis. 2020
Jun;20(6):652-653. | CrossRef | PubMed |
Favre G, Pomar L, Qi X, Nielsen-Saines K, Musso D, Baud D. Guidelines for
pregnant women with suspected SARS-CoV-2 infection. Lancet Infect Dis. 2020
Jun;20(6):652-653. | CrossRef | PubMed | Elwood C, Boucoiran I, VanSchalkwyk J, Money D, Yudin M, Poliquin V. SOGC Committee Opinion – COVID-19 in Pregnancy. JOGC. Forthcoming 2020. | CrossRef |
Elwood C, Boucoiran I, VanSchalkwyk J, Money D, Yudin M, Poliquin V. SOGC Committee Opinion – COVID-19 in Pregnancy. JOGC. Forthcoming 2020. | CrossRef | Della Gatta AN, Rizzo R, Pilu G, Simonazzi G. Coronavirus disease 2019 during pregnancy: a systematic review of reported cases.Am J Obstet Gynecol. 2020 Jul;223(1):36-41. | CrossRef | PubMed |
Della Gatta AN, Rizzo R, Pilu G, Simonazzi G. Coronavirus disease 2019 during pregnancy: a systematic review of reported cases.Am J Obstet Gynecol. 2020 Jul;223(1):36-41. | CrossRef | PubMed | Ministerio de Salud - Perú. Directiva Sanitaria N° 97-MINSA/2020/DGIESP. Directiva Sanitaria para la prevención y atención de la gestante y del recién nacido con riesgo o infección por COVID-19. Aprobada por Resolución Ministerial 245-2020-MINSA del 30 de abril 2020. [Internet] | Link |
Ministerio de Salud - Perú. Directiva Sanitaria N° 97-MINSA/2020/DGIESP. Directiva Sanitaria para la prevención y atención de la gestante y del recién nacido con riesgo o infección por COVID-19. Aprobada por Resolución Ministerial 245-2020-MINSA del 30 de abril 2020. [Internet] | Link | Lamouroux A, Attie-Bitach T, Martinovic J, Leruez-Ville M, Ville Y. Evidence
for and against vertical transmission for severe acute respiratory syndrome
coronavirus 2. Am J Obstet Gynecol. 2020 Jul;223(1):91.e1-91.e4. | CrossRef | PubMed |
Lamouroux A, Attie-Bitach T, Martinovic J, Leruez-Ville M, Ville Y. Evidence
for and against vertical transmission for severe acute respiratory syndrome
coronavirus 2. Am J Obstet Gynecol. 2020 Jul;223(1):91.e1-91.e4. | CrossRef | PubMed | Pulinx B, Kieffer D, Michiels I, Petermans S, Strybol D, Delvaux S, et al. Vertical transmission of
SARS-CoV-2 infection and preterm birth. Eur J Clin Microbiol Infect Dis. 2020
Dec;39(12):2441-2445. | CrossRef | PubMed |
Pulinx B, Kieffer D, Michiels I, Petermans S, Strybol D, Delvaux S, et al. Vertical transmission of
SARS-CoV-2 infection and preterm birth. Eur J Clin Microbiol Infect Dis. 2020
Dec;39(12):2441-2445. | CrossRef | PubMed | Carosso A, Cosma S, Serafini P, Benedetto C, Mahmood T. How to reduce the
potential risk of vertical transmission of SARS-CoV-2 during vaginal delivery?
Eur J Obstet Gynecol Reprod Biol. 2020 Jul;250:246-249. | CrossRef | PubMed |
Carosso A, Cosma S, Serafini P, Benedetto C, Mahmood T. How to reduce the
potential risk of vertical transmission of SARS-CoV-2 during vaginal delivery?
Eur J Obstet Gynecol Reprod Biol. 2020 Jul;250:246-249. | CrossRef | PubMed | Bwire GM, Njiro BJ, Mwakawanga DL, Sabas D, Sunguya BF. Possible vertical
transmission and antibodies against SARS-CoV-2 among infants born to mothers
with COVID-19: A living systematic review. J Med Virol. 2021
Mar;93(3):1361-1369. | CrossRef | PubMed |
Bwire GM, Njiro BJ, Mwakawanga DL, Sabas D, Sunguya BF. Possible vertical
transmission and antibodies against SARS-CoV-2 among infants born to mothers
with COVID-19: A living systematic review. J Med Virol. 2021
Mar;93(3):1361-1369. | CrossRef | PubMed | Neef V, Buxmann H, Rabenau HF, Zacharowski K, Raimann FJ. Characterization of
neonates born to mothers with SARS-CoV-2 infection: Review and meta-analysis.
Pediatr Neonatol. 2021 Jan;62(1):11-20. | CrossRef | PubMed |
Neef V, Buxmann H, Rabenau HF, Zacharowski K, Raimann FJ. Characterization of
neonates born to mothers with SARS-CoV-2 infection: Review and meta-analysis.
Pediatr Neonatol. 2021 Jan;62(1):11-20. | CrossRef | PubMed | Barrero-Castillero A, Beam KS, Bernardini LB, Ramos EGC, Davenport PE, Duncan
AR, et al. COVID-19: neonatal-perinatal perspectives. J Perinatol.
2021 May;41(5):940-951. | CrossRef | PubMed |
Barrero-Castillero A, Beam KS, Bernardini LB, Ramos EGC, Davenport PE, Duncan
AR, et al. COVID-19: neonatal-perinatal perspectives. J Perinatol.
2021 May;41(5):940-951. | CrossRef | PubMed | Shalish W, Lakshminrusimha S, Manzoni P, Keszler M, Sant'Anna GM. COVID-19
and Neonatal Respiratory Care: Current Evidence and Practical Approach. Am J
Perinatol. 2020 Jun;37(8):780-791. | CrossRef | PubMed |
Shalish W, Lakshminrusimha S, Manzoni P, Keszler M, Sant'Anna GM. COVID-19
and Neonatal Respiratory Care: Current Evidence and Practical Approach. Am J
Perinatol. 2020 Jun;37(8):780-791. | CrossRef | PubMed | Zeng L, Xia S, Yuan W, Yan K, Xiao F, Shao J, et al. Neonatal Early-Onset
Infection With SARS-CoV-2 in 33 Neonates Born to Mothers With COVID-19 in Wuhan,
China. JAMA Pediatr. 2020 Jul 1;174(7):722-725. | CrossRef | PubMed |
Zeng L, Xia S, Yuan W, Yan K, Xiao F, Shao J, et al. Neonatal Early-Onset
Infection With SARS-CoV-2 in 33 Neonates Born to Mothers With COVID-19 in Wuhan,
China. JAMA Pediatr. 2020 Jul 1;174(7):722-725. | CrossRef | PubMed | Liguoro I, Pilotto C, Bonanni M, Ferrari ME, Pusiol A, Nocerino A, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur
J Pediatr. 2020 Jul;179(7):1029-1046. | CrossRef | PubMed |
Liguoro I, Pilotto C, Bonanni M, Ferrari ME, Pusiol A, Nocerino A, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur
J Pediatr. 2020 Jul;179(7):1029-1046. | CrossRef | PubMed | Blitz MJ, Grünebaum A, Tekbali A, Bornstein E, Rochelson B, Nimaroff M, et al. Intensive care unit admissions for pregnant and nonpregnant women
with coronavirus disease 2019. Am J Obstet Gynecol. 2020 Aug;223(2):290-291. | CrossRef | PubMed |
Blitz MJ, Grünebaum A, Tekbali A, Bornstein E, Rochelson B, Nimaroff M, et al. Intensive care unit admissions for pregnant and nonpregnant women
with coronavirus disease 2019. Am J Obstet Gynecol. 2020 Aug;223(2):290-291. | CrossRef | PubMed | Hantoushzadeh S, Shamshirsaz AA, Aleyasin A, Seferovic MD, Aski SK, Arian
SE, et al. Maternal
death due to COVID-19. Am J Obstet Gynecol. 2020 Jul;223(1):109.e1-109.e16. | CrossRef | PubMed |
Hantoushzadeh S, Shamshirsaz AA, Aleyasin A, Seferovic MD, Aski SK, Arian
SE, et al. Maternal
death due to COVID-19. Am J Obstet Gynecol. 2020 Jul;223(1):109.e1-109.e16. | CrossRef | PubMed | Shah PS, Diambomba Y, Acharya G, Morris SK, Bitnun A. Classification system
and case definition for SARS-CoV-2 infection in pregnant women, fetuses, and
neonates. Acta Obstet Gynecol Scand. 2020 May;99(5):565-568. | CrossRef | PubMed |
Shah PS, Diambomba Y, Acharya G, Morris SK, Bitnun A. Classification system
and case definition for SARS-CoV-2 infection in pregnant women, fetuses, and
neonates. Acta Obstet Gynecol Scand. 2020 May;99(5):565-568. | CrossRef | PubMed | Penfield CA, Brubaker SG, Limaye MA, Lighter J, Ratner AJ, Thomas KM, et al. Detection of severe acute respiratory syndrome coronavirus 2 in
placental and fetal membrane samples. Am J Obstet Gynecol MFM. 2020
Aug;2(3):100133. | CrossRef | PubMed |
Penfield CA, Brubaker SG, Limaye MA, Lighter J, Ratner AJ, Thomas KM, et al. Detection of severe acute respiratory syndrome coronavirus 2 in
placental and fetal membrane samples. Am J Obstet Gynecol MFM. 2020
Aug;2(3):100133. | CrossRef | PubMed | Algarroba GN, Rekawek P, Vahanian SA, Khullar P, Palaia T, Peltier MR, et al. Visualization of severe acute respiratory syndrome
coronavirus 2 invading the human placenta using electron microscopy. Am J Obstet
Gynecol. 2020 Aug;223(2):275-278. | CrossRef | PubMed |
Algarroba GN, Rekawek P, Vahanian SA, Khullar P, Palaia T, Peltier MR, et al. Visualization of severe acute respiratory syndrome
coronavirus 2 invading the human placenta using electron microscopy. Am J Obstet
Gynecol. 2020 Aug;223(2):275-278. | CrossRef | PubMed | Vivanti AJ, Vauloup-Fellous C, Prevot S, Zupan V, Suffee C, Do Cao J, et al. Transplacental transmission of SARS-CoV-2 infection. Nat
Commun. 2020 Jul 14;11(1):3572. | CrossRef | PubMed |
Vivanti AJ, Vauloup-Fellous C, Prevot S, Zupan V, Suffee C, Do Cao J, et al. Transplacental transmission of SARS-CoV-2 infection. Nat
Commun. 2020 Jul 14;11(1):3572. | CrossRef | PubMed | Zamaniyan M, Ebadi A, Aghajanpoor S, Rahmani Z, Haghshenas M, Azizi S.
Preterm delivery, maternal death, and vertical transmission in a pregnant woman
with COVID-19 infection. Prenat Diagn. 2020 Dec;40(13):1759-1761. | CrossRef | PubMed |
Zamaniyan M, Ebadi A, Aghajanpoor S, Rahmani Z, Haghshenas M, Azizi S.
Preterm delivery, maternal death, and vertical transmission in a pregnant woman
with COVID-19 infection. Prenat Diagn. 2020 Dec;40(13):1759-1761. | CrossRef | PubMed | Groß R, Conzelmann C, Müller JA, Stenger S, Steinhart K, Kirchhoff F, et al. Detection of SARS-CoV-2 in human breastmilk. Lancet. 2020 Jun
6;395(10239):1757-1758. | CrossRef | PubMed |
Groß R, Conzelmann C, Müller JA, Stenger S, Steinhart K, Kirchhoff F, et al. Detection of SARS-CoV-2 in human breastmilk. Lancet. 2020 Jun
6;395(10239):1757-1758. | CrossRef | PubMed | Bastug A, Hanifehnezhad A, Tayman C, Ozkul A, Ozbay O, Kazancioglu S, et al. Virolactia in an Asymptomatic Mother with COVID-19. Breastfeed Med. 2020
Aug;15(8):488-491. | CrossRef | PubMed |
Bastug A, Hanifehnezhad A, Tayman C, Ozkul A, Ozbay O, Kazancioglu S, et al. Virolactia in an Asymptomatic Mother with COVID-19. Breastfeed Med. 2020
Aug;15(8):488-491. | CrossRef | PubMed | Buonsenso D, Costa S, Sanguinetti M, Cattani P, Posteraro B, Marchetti S, et al. Neonatal Late Onset
Infection with Severe Acute Respiratory Syndrome Coronavirus 2. Am J Perinatol.
2020 Jun;37(8):869-872. | CrossRef | PubMed |
Buonsenso D, Costa S, Sanguinetti M, Cattani P, Posteraro B, Marchetti S, et al. Neonatal Late Onset
Infection with Severe Acute Respiratory Syndrome Coronavirus 2. Am J Perinatol.
2020 Jun;37(8):869-872. | CrossRef | PubMed |