 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: retinopathy of prematurity, case-control studies, neonatal sepsis
Introducción
La retinopatía de la prematuridad es una causa importante de discapacidad visual. Existe poca información sobre la epidemiología, factores asociados con su desarrollo y consecuencias para países de medianos ingresos como Perú.
Objetivo
Evaluar factores asociados al desarrollo de retinopatía de la prematuridad en recién nacidos pretérmino con peso menor de 1500 gramos.
Métodos
Estudio de casos y controles (pareados 1:1) de pacientes admitidos en la unidad de cuidados intensivos neonatales del Hospital Cayetano Heredia durante el periodo de 2008 a 2018, con registro completo en la base de datos de la red Neocosur (N = 293). Caso: paciente recién nacido pretérmino con peso al nacer menor de 1500 gramos, que haya desarrollado cualquier tipo o grado de retinopatía; control: paciente con las mismas características, sin retinopatía. Se realizó análisis bivariado y multivariado (empleando modelo de regresión logística) para obtener Odds ratio, utilizando un intervalo de confianza del 95%.
Resultados
La información se obtuvo de 57 casos y 57 controles. El antecedente de sepsis tardía se asocia de manera significativa con el desarrollo de retinopatía de la prematuridad (Odds ratio 4,39; intervalo de confianza 95%; 1,23 a 15,76; p = 0,02). Al realizar el análisis bivariado y el análisis multivariado no se encontró asociación estadísticamente significativa entre la exposición a oxígeno a las 36 semanas de edad postmenstrual y el desarrollo de retinopatía de la prematuridad (Odds ratio 8,47; intervalo de confianza 95%; 0,51 a 141,17; p = 0,14).
Conclusiones
En pacientes con antecedente de sepsis tardía, la probabilidad de desarrollar retinopatía de la prematuridad fue 4,39 veces mayor. Se requieren estudios prospectivos que involucren un mayor tamaño muestral.
|
Ideas clave
|
La retinopatía de la prematuridad es un desorden neurovascular de los vasos sanguíneos de la retina de los recién nacidos pretérmino, principalmente aquellos con bajo peso al nacer, caracterizado por una proliferación fibrovascular anormal localizada en el límite entre la zona vascularizada y no vascularizada de la retina periférica[1],[2].
En el año 2010 se reportó una incidencia de 6 a 18% de casos de discapacidad visual atribuida a retinopatía de la prematuridad, de un total de aproximadamente 19 millones de pacientes pediátricos en el mundo[1]. En el año 2011 se reportó que en Latinoamérica la prevalencia de retinopatía de la prematuridad oscilaba entre 6,6 y 82%, incluyendo todos los estadios y la prevalencia de retinopatía severa variaba entre 1,2 y 25%[3]. En Perú, los estudios son variables en el tiempo y en criterios de inclusión. Así, un estudio realizado en el año 2007 en el Instituto Nacional Materno Perinatal, que incluyó recién nacidos con peso inferior a 1500 gramos, reportó 70,5% de incidencia[3]. En otro estudio que evaluó a todos los recién nacidos menores de 37 semanas entre enero de 2010 y diciembre de 2011 sin tomar en cuenta el peso, mostró una incidencia de 19,06%[4]. El estudio más reciente incluyó recién nacidos con peso menor de 2000 gramos, reportando una incidencia de 10,1% para el año 2016 y 7,5% para el año 2017[5].
Los principales factores asociados al desarrollo de retinopatía de la prematuridad son edad gestacional y peso al nacer[6]; así como el uso de oxígeno suplementario, su concentración y duración, además del uso de ventilación mecánica prolongada[7].
La corioamnionitis se ha reportado como factor asociado con todos los estadios de retinopatía de la prematuridad[8].
Otros factores descritos son el ductus arterioso persistente, que produce disminución del flujo sanguíneo sistémico que podría generar hipoxia de la retina[7]. La enterocolitis necrotizante involucra respuestas del sistema inmune ante microorganismos intestinales, generando una cascada inflamatoria que afectaría la angiogénesis de vasos sanguíneos de la retina, convirtiéndola también en un factor asociado a retinopatía de la prematuridad[7],[9]. Por el contrario, la alimentación con leche materna en recién nacidos con extremo bajo peso al nacer se asocia a 75% menor probabilidad de desarrollar retinopatía de la prematuridad[10],[11].
Algunos estudios han descrito a la sepsis tardía como un factor asociado. Sin embargo, específicamente en poblaciones de recién nacidos con peso menor de 1500 gramos, existe poca información y quedan dudas sobre el verdadero carácter del vínculo entre ambas variables[7]. Se decidió realizar el presente estudio para evaluar la asociación entre sepsis tardía y retinopatía de la prematuridad; y se realizó adicionalmente, una evaluación exploratoria de la asociación de otras condiciones clínicas.
Objetivo general
Evaluar la asociación entre sepsis tardía neonatal (sepsis posterior a las 72 horas de vida confirmada por cultivo) y retinopatía de la prematuridad.
Objetivo secundario
Evaluar factores asociados al desarrollo y prevención de retinopatía de la prematuridad entre los pacientes recién nacidos pretérmino con peso menor de 1500 gramos.
Contexto
El estudio se llevó a cabo en la unidad de cuidados intensivos neonatales del Hospital Cayetano Heredia (HCH) de Lima (Perú), entre los años 2008 y 2018.
Diseño del estudio
Estudio tipo casos y controles.
Definición de caso y control
El caso se definió como uno un paciente recién nacido, pretérmino, con peso al nacer menor de 1500 gramos, admitido en la unidad de cuidados intensivos neonatales, que hubiera desarrollado cualquier tipo o grado de retinopatía de la prematuridad (basado en la clasificación internacional de retinopatía de la prematuridad)[12]. El control se definió como un paciente recién nacido pretérmino con peso al nacer menor de 1500 gramos, admitido en la unidad de cuidados intensivos neonatales, que no presentara evidencia de retinopatía en evaluación oftalmológica.
Tamaño muestral
Para el cálculo del tamaño muestral se empleó el software para análisis epidemiológico EPIDAT versión 4.2, el cual contempló un estudio de casos y controles con exposición binaria. Dentro del software mencionado, se consideraron valores importantes: un Odds ratio esperado de 3,5 en relación con la variable principal del estudio: sepsis[13]. Se estimó que al menos el 50% de los controles de nuestro estudio estarían expuestos a la variable mencionada (sepsis). Otros valores importantes incorporados para el cálculo de la muestra fueron un intervalo de confianza al 95%, una potencia de 80% y una razón de controles por caso de 1 a 1; obteniéndose así un tamaño muestral calculado de 92 recién nacidos pretérmino (46 casos y 46 controles). Ante la posibilidad de datos incompletos y mejorar el poder del estudio, fueron incluidos todos los casos (n = 57) y controles comparables (n = 57). El pareo se hizo empleando las variables edad gestacional, peso al nacimiento y sexo.
Población de estudio
Pacientes recién nacidos pretérmino con peso al nacer menor de 1500 gramos admitidos en la unidad de cuidados intensivos neonatales del Hospital Cayetano Heredia en entre los años 2008 y 2018, incluidos dentro de la base de datos de la red Neocosur. El muestreo de los pacientes incluidos en el estudio no fue realizado de forma aleatoria, sino por conveniencia, con el fin de obtener casos y controles similares. Es decir, se incluyeron todos los pacientes que cumplieran con los criterios de inclusión y que fueron atendidos entre los años 2008 y 2018. Posteriormente se seleccionó un control para cada caso que cumpliera con presentar sexo, edad gestacional y peso al nacimiento similares.
La red Neocosur opera mediante el ingreso de datos en línea a través de una ficha virtual estandarizada para cada caso nuevo, los mismos que son actualizados en forma automática, permitiendo a cada centro incluido en la red neonatal poder contar con información estadística local y general. La información que se consigna dentro de la base de datos resulta ser confiable dado que es ingresada principalmente por neonatólogos. Además, los datos son revisados periódicamente para asegurar la consistencia de la información. El propósito de la base de datos de esta red no es el estudio de retinopatía de la prematuridad.
Criterios de inclusión
Criterios de exclusión
Procedimientos y técnicas
La extracción de información se realizó después de la autorización al acceso a la base de datos de la Red Neocosur, la cual registró a cada uno de los pacientes recién nacidos admitidos en la unidad de cuidados intensivos neonatales en el periodo comprendido entre los años 2008 y 2018. Se creó una base de datos en Microsoft Excel 2016 donde se colocó la información perteneciente a cada variable, luego dicha base se trasladó al programa STATA v. 15. Para realizar la limpieza de esta, primero se revisó que no hubiera códigos de identificación duplicados. Luego, se eliminaron los datos inconsistentes. Finalmente, para los datos desconocidos, principalmente para las variables de “severidad de displasia broncopulmonar” y “localización de la lesión (zona)”, se procedió a verificar que realmente faltara esa información. Asimismo, se realizó un pareo de casos y controles, asignando un control para cada caso según peso al nacer, edad gestacional y sexo del paciente, buscando que ambos grupos sean lo más similares y comparables posible, y cuya única diferencia fuera el desarrollo de retinopatía de la prematuridad.
Análisis estadístico
Se realizó un análisis secundario de la base de datos de la red Neocosur empleando el programa STATA v. 15. La estadística descriptiva incluyó valores de tendencia central y frecuencias para describir las variables independientes (clínicas).
La estadística analítica se inició con el análisis bivariado, para buscar asociación entre las variables independientes y la variable dependiente (retinopatía de la prematuridad). Para el análisis de las variables cualitativas, se utilizó la prueba no paramétrica de Chi-cuadrado. Sin embargo, para las variables que presentaron valores esperados menores a 5, se utilizó la prueba exacta de Fisher (únicamente “severidad de displasia broncopulmonar” y “sepsis temprana”).
Además, se empleó la prueba no paramétrica de U Mann Whitney para las variables cuantitativas, ya que tras ser evaluadas estas no presentaban una distribución normal. Se consideró un valor p < 0,05 como significativo. Posteriormente, se reportó el Odds ratio y el intervalo de confianza de 95% para las variables cuyo valor “p” fue estadísticamente significativo en el análisis inicial (p < 0,05). En el análisis multivariado se realizó una regresión logística, en la cual se incluyeron las variables independientes que, tras la segunda etapa del análisis bivariado (Odds ratio), obtuvieron un nuevo valor de “p” y un intervalo de confianza estadísticamente significativos.
Se realizó un grafo acíclico dirigido (Directed Acyclic Graph, DAG, por sus siglas en inglés) para identificar variables de confusión y colisionadoras. Sobre la base de esos resultados y la literatura, se incluyeron variables que podrían actuar como confusoras en el modelo de regresión logística. La multicolinealidad entre las variables incluidas fue evaluada mediante el cálculo del factor de inflación de varianza (Variance Inflation Factor, VIF, por sus siglas en inglés). Posteriormente, se realizaron pruebas de bondad de ajuste para evidenciar el valor de la regresión logística practicada. Por último, se realizó un análisis de subgrupo en el que también se emplearon medidas de tendencia central (mediana y rango intercuartílico) dada la distribución no normal de las variables y prueba de U Mann Whitney para el análisis de estas.
Aspectos éticos
El presente estudio fue revisado y aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia (Constancia 311-15-19) bajo la categoría de “exento”, exonerando el uso de consentimiento informado.
En el periodo comprendido entre 2008 y 2018, fueron admitidos 598 recién nacidos prematuros con peso al nacer menor de 1500 gramos. Se excluyeron a 305 que fallecieron antes de ser evaluados para descartar retinopatía de la prematuridad. Por lo tanto, fueron incorporados 293 recién nacidos pretérmino, de los cuales se eligió a todos los pacientes con retinopatía como casos (basado en la clasificación internacional de retinopatía de la prematuridad) (n = 57). Posteriormente, se realizó un pareo basado en edad gestacional, peso y sexo, tras lo que se obtuvo 57 pacientes como controles (Figura 1).
La distribución por género de los casos y controles fue similar, con un 58% de varones y 42% de mujeres. La media de edad gestacional de los casos fue 29,2 (desviación estándar igual a ± 2,7), mientras que para los controles fue de 29,3 (desviación estándar igual a ± 2,6) (p = 0,0861, determinado por prueba de T Student). La media de peso al nacimiento para los casos fue de 1035,9 gramos (desviación estándar igual a ± 227,6) y para los controles 1093,8 gramos (deviación estándar igual a ± 205,5) (p = 0,157, determinado por prueba de T Student). Según sus características, los grupos son similares y comparables entre sí.
El desarrollo de sepsis tardía demostró haber sido más prevalente en el grupo que desarrolló retinopatía de la prematuridad (casos) con un 38,6% (22/57) frente al 15,8% (9/57) de pacientes del grupo control. La exposición a oxígeno suplementario durante 28 días fue más frecuente en el grupo de casos con un 64,8% (35/54) frente al 42,1% (24/57) en los controles; y consecuentemente, la exposición a oxígeno suplementario a las 36 semanas de edad postmenstrual también con 50% (27/54) frente a 16,1% (9/56). El resto de las variables comparadas se muestran en la Tabla 1.
Tabla 1. Análisis bivariado de factores asociados al desarrollo de retinopatía de la prematuridad.
El análisis bivariado, mostró asociaciones estadísticamente significativas entre sepsis tardía y el desarrollo de retinopatía de la prematuridad (Odds ratio: 3,35; intervalo de confianza 95%: 1,38 a 8,16; p = 0,08); así como también entre esta última y la exposición a oxígeno suplementario a las 36 semanas de edad postmenstrual (Odds ratio: 5,22; intervalo de confianza 95%: 2,14 a 12,72; p < 0,001). También se encontró la displasia broncopulmonar moderada significativamente asociada a retinopatía en sus grados moderado (Odds ratio: 4,89; intervalo de confianza 95%: 1,15 a 20,76; p = 0,03) y severo (Odds ratio: 6,88; intervalo de confianza 95%: 1,98 a 23,84; p = 0,002). Otra asociación estadísticamente significativa, fue la reportada entre ductus arterioso persistente y el desarrollo de retinopatía (Odds ratio: 2,85; intervalo de confianza 95%: 1,31 a 6,19; p = 0,008). El antecedente de hipertensión gestacional estuvo asociado a retinopatía de la prematuridad como un factor protector para su desarrollo (Odds ratio: 0,29; intervalo de confianza 95%: 0,13 a 0,71; p = 0,006) (Tabla 2).
No se encontraron asociaciones estadísticamente significativas entre la ingesta de leche materna y el desarrollo de retinopatía de la prematuridad al realizar el análisis de subgrupo (47 pacientes) (Tabla 3).
Al realizar el análisis multivariado de regresión logística, casi todas las asociaciones previas dejaron de ser significativas, entre ellas: exposición a oxígeno suplementario a las 36 semanas de edad postmenstrual (Odds ratio: 8,47; intervalo de confianza 95%: 0,51 a 141,17; p = 0,14) (Tabla 2). Bajo esta operación, resultó únicamente significativa la variable sepsis tardía; observándose que la probabilidad de desarrollar retinopatía de la prematuridad fue 4,39 veces mayor en pacientes con antecedente de sepsis tardía con un intervalo de confianza al 95% de 1,23 a 15,76 y un valor p = 0,02.
Al analizar el tiempo y la frecuencia de casos de retinopatía de la prematuridad y sepsis tardía (entre todos los pacientes incluidos en el estudio), se observó que el número de casos de retinopatía de la prematuridad y sepsis tardía tuvieron casi siempre la misma tendencia (Gráfico 1), a excepción del año 2013 en que se puede apreciar que los casos de sepsis tardía superaron a los de retinopatía de la prematuridad. Otro dato importante obtenido es que los números más altos de pacientes con retinopatía de la prematuridad por año se ubicaron entre 2009 y 2012.
Con respecto a las características epidemiológicas y clínicas de los pacientes con retinopatía, resalta que la mayoría tuvo entre 28 y 30 semanas de edad gestacional, con 43,9% (25/57); así también, la mayoría pesó entre 750 y 999 gramos con el mismo porcentaje. La prevalencia de enfermedad plus fue de 22,8% (13/57). Por su parte, la zona reportada como más afectada en los exámenes de fondo de ojo fue la zona II, con un 68,8% (22/32) y el grado de retinopatía más reportado fue el grado I con 40,4% (23/57) (Tabla 4).
Tabla 4. Características epidemiológicas y clínicas.
En nuestro estudio, el diagnóstico de sepsis tardía mostró asociación estadísticamente significativa con retinopatía de la prematuridad. Estudios previos no habían sido concluyentes. Estudios realizados en latitudes diversas como Omán y Canadá, describieron asociación en el análisis multivariado al desarrollo de retinopatía de la prematuridad (Odds ratio: 7,42; intervalo de confianza 95%: 1,21 a 46,04; p = 0,03)[14] y (1,35; 1,16 a 1,67)[15], respectivamente. Sin embargo, esto no había sido corroborado en nuestro medio. Un estudio realizado en el Hospital de Cajamarca evidenció asociación no significativa entre sepsis y retinopatía de la prematuridad (9,8; 0,42 a 12,26; p = 0,97), así como una cohorte retrospectiva realizada en el Hospital Cayetano Heredia, entre los años 2005 y 2011, cuya principal diferencia con nuestro estudio radica en el manejo de los pacientes (que fue modificado a partir del año 2013 y puede influir en los resultados obtenidos)[16],[17].
No se encontró asociación significativa entre la exposición a oxígeno suplementario y retinopatía de la prematuridad. Sin embargo, el amplio intervalo de confianza obtenido para la variable “oxígeno a las 36 semanas de edad postmenstrual” sugiere que el resultado estadísticamente no significativo, pueda deberse a un tamaño de muestra muy pequeño. Además, todas las variables relacionadas con oxigenoterapia fueron evaluadas en forma dicotómica, lo que pudo haberles restado significancia, a diferencia del estudio realizado en Cajamarca, en el que la variable “días de duración de oxigenoterapia” fue estratificada y obtuvo una asociación estadísticamente significativa con el desarrollo de retinopatía de la prematuridad (6,3; 1,47 a 26,83; p = 0,013)[16]. Por este motivo, no se puede concluir que la exposición a oxígeno suplementario y retinopatía de la prematuridad no estén asociados. Otros factores que pudieron influenciar en este resultado son el diseño del estudio y el hecho de incluir únicamente una unidad neonatal, más aún si se tiene en cuenta toda la evidencia previa al respecto[18],[19].
La asociación entre lactancia materna y retinopatía de la prematuridad no resultó estadísticamente significativa en nuestro análisis. Esto podría estar explicado principalmente porque los pacientes incluidos en el presente estudio recibieron lactancia mixta. Ello reduciría las posibilidades de demostrar el efecto protector de la leche materna, tal como lo menciona el estudio realizado por Zhou y colaboradores quienes, a diferencia de los resultados obtenidos en nuestro estudio, concluyeron que la ingesta de leche materna despliega un rol protector frente al desarrollo de cualquier grado de retinopatía (0,29; 0,12 a 0,72)[20].
No se encontró una asociación estadísticamente significativa entre ductus arterioso persistente y retinopatía de la prematuridad, lo cual difiere con lo reportado en la literatura internacional[21],[22].
En nuestro estudio, el antecedente de hipertensión gestacional resultó un factor protector para el desarrollo de retinopatía de la prematuridad con un Odds ratio 0,34, lo cual coincide con reportes previos[23]. Sin embargo, la asociación no fue estadísticamente significativa (0,11 a 1,04; p = 0,06). Por otro lado, existen estudios con resultados opuestos al nuestro, como uno realizado en Turquía, en el que se asoció de forma significativa preeclamsia materna a retinopatía de la prematuridad como factor de riesgo (3,2; 1,002 a 11,535; p = 0,045)[22]. En un metanálisis realizado en China que incluyó 351 estudios (cohortes y caso-control), se evidenció que el Odds ratio para desarrollo de retinopatía de la prematuridad no fue diferente entre infantes expuestos a hipertensión gestacional y no expuestos[23]. Sin embargo, es claro que se necesitan estudios prospectivos más amplios para poder definir la relación entre la variable en cuestión y el desarrollo o prevención de retinopatía de la prematuridad.
En los resultados obtenidos al analizar el tiempo y el número de casos diagnosticados de retinopatía de la prematuridad, se pudo observar que la mayor cantidad de pacientes con retinopatía de la prematuridad figuran entre los años 2009 y 2012. Esto podría deberse a que, a partir del año 2013 y como consecuencia del crecimiento económico del país, se implementaron nuevas pautas e instrumentos (equipos y medicamentos) para el manejo del recién nacido en la unidad de cuidados intensivos del Hospital Cayetano Heredia. Principalmente, ello implicó cambios en el manejo ventilatorio con mayor uso de ventilación mecánica no invasiva, a diferencia del manejo previo con ventilación mecánica invasiva en los recién nacidos de muy bajo peso y sobre todo de extremo bajo peso, a partir de los estudios realizados por Morley y colaboradores[24], y Finer y colaboradores[25], que mostraron que estos pacientes se pueden manejar con ventilación mecánica no invasiva y con la técnica de INSURE (Intubation Surfactant Extubation, intubación, administración de surfactante y extubación en menos de 2 horas) sin incremento de mortalidad ni displasia broncopulmonar.
Con respecto a la severidad de la retinopatía de los pacientes con retinopatía de la prematuridad, se obtuvo que en 40,4% fue diagnosticado con estadio I, porcentaje menor al reportado en estudios previos en nuestro medio. Así, un estudio realizado el año 2014 en el Hospital Regional de Cajamarca, el estadio de retinopatía más reportado fue el Estadio I, con un 91,5%[16], al igual que en el realizado en el año 2012 en el Hospital Regional Docente Las Mercedes en Chiclayo, con un 51,3%[26]. En nuestra serie, 33,3% de los pacientes tuvo retinopatía severa (estadios III y IV) y 22,8% enfermedad plus; difiriendo del estudio realizado en Cajamarca, que solamente registró enfermedad plus en 4,2% los pacientes con retinopatía de la prematuridad[16].
Este estudio presentó varias limitaciones: la selección de los casos se realizó mediante un proceso no aleatorizado. Otra limitación estuvo representada por la temporalidad, pues al tomar 10 años, constantes cambios y renovaciones se realizaron en la base de datos y los usuarios fueron variando. De igual manera entendemos que, a pesar de los esfuerzos, existe la posibilidad de contar con un sesgo de información, ya que las historias clínicas, al igual que los diagnósticos fueron realizados por distintas personas y empleando distintos criterios.
Al realizarse un análisis secundario de la base de datos de la Red Neocosur, donde la información es consignada de forma estandarizada y cuyo fin no es el estudio de factores asociados al desarrollo o prevención de retinopatía de la prematuridad, no podemos concluir que las variables que, tras el análisis, no tuvieron una asociación significativamente estadística con la patología en estudio realmente no estén asociadas a ella. Finalmente, el tamaño de nuestra muestra no permitió hallar diferencias significativas en variables ampliamente reconocidas, por lo que estos resultados deben ser tomados con cautela.
Dentro de la población de recién nacidos pretérmino con peso al nacer menor de 1500 gramos admitidos en la unidad de cuidados intensivos neonatales del Hospital Cayetano Heredia entre los años 2008 y 2018, se halló asociación estadísticamente significativa entre sepsis tardía neonatal y retinopatía de la prematuridad, como un factor predisponente para el desarrollo de esta última.
Se eligió un modelo de estudios de casos y controles, en lugar de una cohorte retrospectiva, dado que los datos analizados fueron tomados en periodos distintos y no se contaba con información de seguimiento posterior al alta para todos los pacientes incluidos en el estudio. Además, puesto que se estudió una patología con baja prevalencia en nuestro medio, se vio por conveniente emplear un diseño tipo casos y controles como una primera aproximación para analizar la relación entre sepsis y retinopatía de la prematuridad; con un tamaño muestral adecuado para alcanzar una potencia adecuada.
Se requieren mayores estudios con un tamaño muestral más amplio y que incluyan a más unidades de cuidados intensivos neonatales de nuestro país, para poder tener resultados confiables y extrapolables a toda la población de recién nacidos pretérmino con peso al nacer menor de 1500 gramos. Sin embargo, resultaría importante publicarlo ante la evidencia de una importante incidencia de sepsis tardía y su relación con el desarrollo de retinopatía de la prematuridad, orientando así a los profesionales de la salud a tomar medidas específicas orientadas a prevenir el desarrollo de ambas.
Anexo: Anexo 1. Definición de variables
Roles de autoría
AGVT: conceptualización, metodología, software, validación, análisis formal, investigación, recursos, procesamiento de datos, redacción, visualización y adquisición de fondos.
DBE: conceptualización, metodología, software, validación, análisis formal, investigación, recursos, procesamiento de datos. +CVHN: conceptualización, metodología, validación, investigación, recursos, redacción, visualización, supervisión, administración del proyecto y adquisición de fondos. GJMR: conceptualización, metodología, validación, análisis formal, investigación, recursos, procesamiento de datos, redacción, visualización, supervisión, administración del proyecto y adquisición de fondos.
Agradecimientos
Al Dr. Brian Valenzuela y a la Dra. Sandra Rado por su aporte para realizar el presente estudio.
Financiamiento
Los autores declaran que el presente proyecto de investigación fue autofinanciado.
Declaración de conflictos de intereses
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o al Comité Editorial de la Revista.
Consideraciones éticas
El presente estudio fue revisado y aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia (Constancia 311-15-19) bajo la categoría de “exento”, exonerando el uso de consentimiento informado dado que representa un análisis secundario de una base de datos. La identidad de cada participante fue codificada en números manteniendo el anonimato y respetando la confidencialidad de la información personal.
Citación a repositorio
El presente estudio de investigación se encuentra dentro de la base de datos del repositorio de la Universidad Peruana Cayetano Heredia (disponible en: http://repositorio.upch.edu.pe/handle/upch/7189).

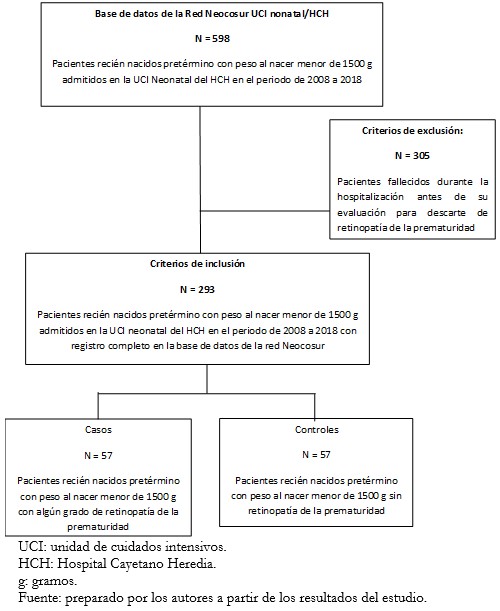 Figura 1. Recién nacidos pretérmino con peso al nacer menor de 1500 g incluidos en el estudio de casos y controles entre los años 2008 y 2018.
Figura 1. Recién nacidos pretérmino con peso al nacer menor de 1500 g incluidos en el estudio de casos y controles entre los años 2008 y 2018.

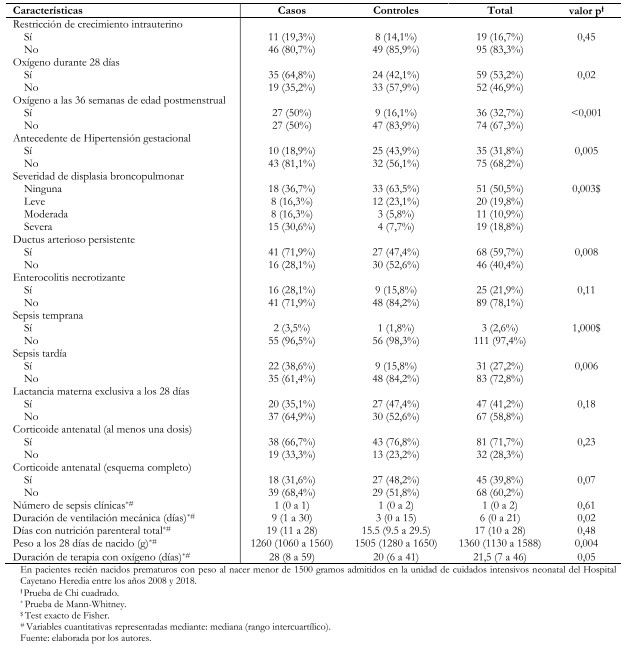 Tabla 1. Análisis bivariado de factores asociados al desarrollo de retinopatía de la prematuridad.
Tabla 1. Análisis bivariado de factores asociados al desarrollo de retinopatía de la prematuridad.

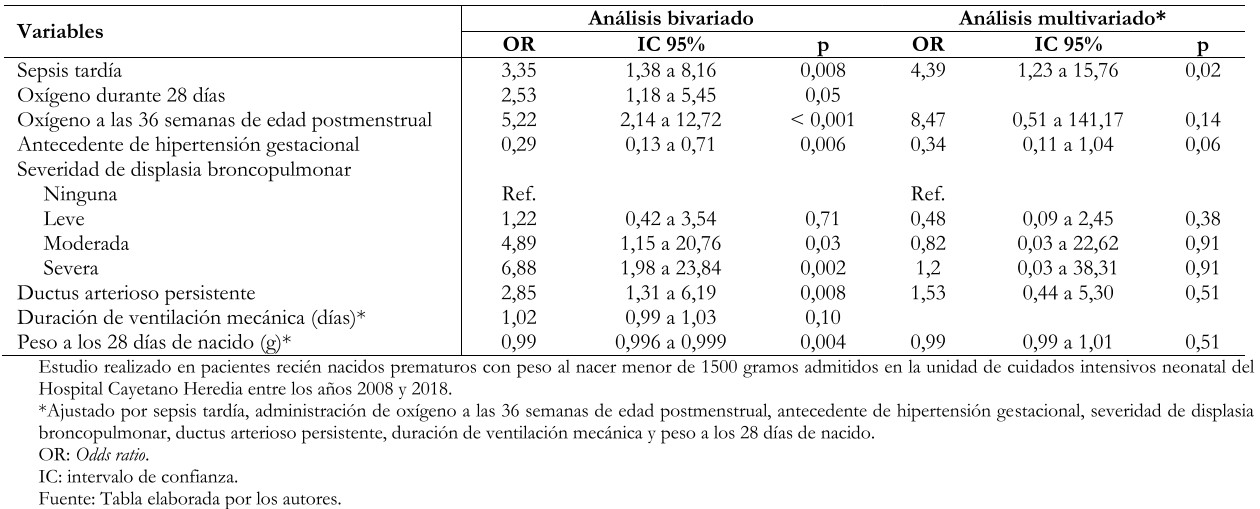 Tabla 2. Análisis bivariado y multivariado de regresión logística de factores asociados al desarrollo de retinopatía de la prematuridad.
Tabla 2. Análisis bivariado y multivariado de regresión logística de factores asociados al desarrollo de retinopatía de la prematuridad.

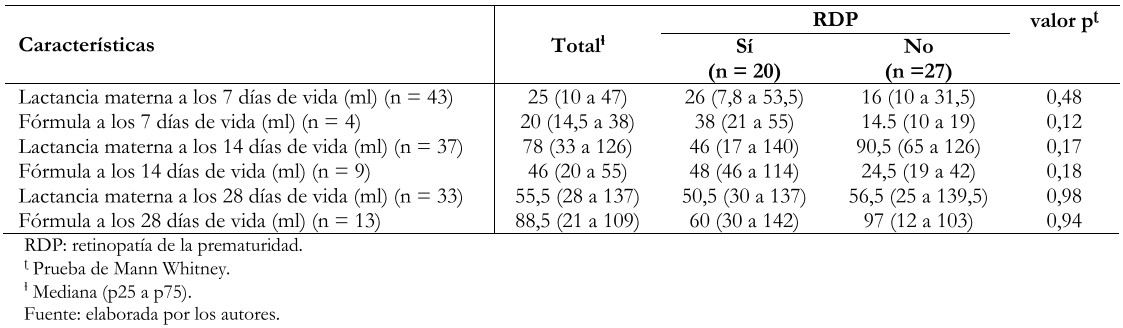 Tabla 3. Análisis bivariado de consumo de leche materna y fórmula a los 7, 14 y 28 días de vida y su asociación con desarrollo de retinopatía de prematuridad en subgrupo de 47 pacientes.
Tabla 3. Análisis bivariado de consumo de leche materna y fórmula a los 7, 14 y 28 días de vida y su asociación con desarrollo de retinopatía de prematuridad en subgrupo de 47 pacientes.

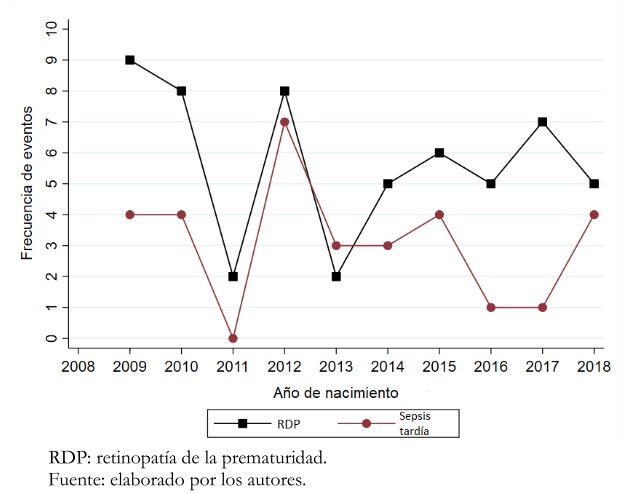 Figura 2. Número de casos diagnosticados de retinopatía de la prematuridad y sepsis tardía por año de estudio.
Figura 2. Número de casos diagnosticados de retinopatía de la prematuridad y sepsis tardía por año de estudio.

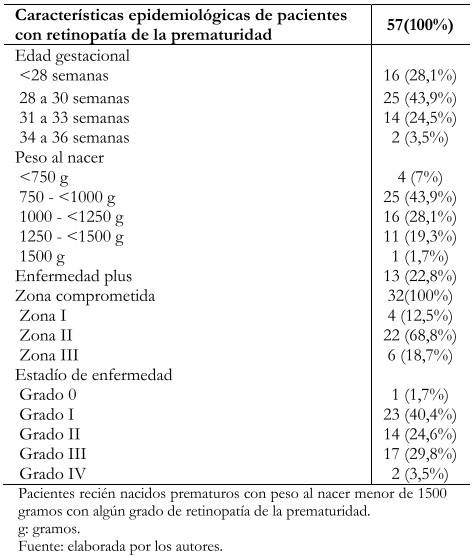 Tabla 4. Características epidemiológicas y clínicas.
Tabla 4. Características epidemiológicas y clínicas.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Background
Retinopathy of prematurity is the leading worldwide cause of visual impairment. There is little available data on its epidemiology and related factors and consequences in developing countries such as Peru. Due to this lack of information, we decided to do this study.
Objectives
To evaluate factors related to the development of retinopathy of prematurity in very low birth weight newborn patients.
Methods
We did a case-control (paired 1:1) study of patients admitted to the Neonatal Intensive Care Unit of the Hospital Cayetano Heredia between 2008 and 2018 who had a complete record in the Neocosur network database (N = 293). The case was defined as a preterm newborn patient with a birth weight lower than 1500 grams who developed any type or stage of retinopathy of prematurity; control was defined as a patient with similar characteristics without retinopathy. Univariate and bivariate analysis (using logistic regression model) was performed to obtain the odds ratio with a 95% confidence interval.
Results
Data were obtained from 57 cases and 57 controls admitted to the Neonatal Intensive Care Unit at Hospital Cayetano Heredia. Late-onset sepsis was the main factor associated with retinopathy of prematurity (odds ratio 4.39; 95% confidence interval 1.23 to 15.76, p = 0.02). Additionally, we performed a bivariate and multivariate analysis that showed that exposure to supplementary oxygen at 36 weeks of postmenstrual age and retinopathy of prematurity were not significantly associated (8.47; 0.51 to 141.17, p = 0.14).
Conclusions
Patients with late-onset sepsis have a 4.39 times higher odds of developing retinopathy of prematurity. Prospective studies are needed with larger sample sizes.
 Autores:
Alvaro Valdivia[1], Daniela Bullard Elias[1], Cecilia Herbozo[1], German Málaga[1]
Autores:
Alvaro Valdivia[1], Daniela Bullard Elias[1], Cecilia Herbozo[1], German Málaga[1]

Citación: Valdivia A, Bullard Elias D, Herbozo C, Málaga G. Severe sepsis and retinopathy of prematurity in very low birth weight preterm newborns in a third-level healthcare center in Lima, Peru between 2008 and 2018: A case-control study. Medwave 2021;21(3):e8157 doi: 10.5867/medwave.2021.03.8157
Fecha de envío: 30/5/2020
Fecha de aceptación: 24/2/2021
Fecha de publicación: 19/4/2021
Origen: No solicitado
Tipo de revisión: Revisión por pares externa, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kang HG, Choi EY, Byeon SH, Kim SS, Koh HJ, Lee SC, et al. Anti-vascular Endothelial Growth Factor Treatment of Retinopathy of Prematurity: Efficacy, Safety, and Anatomical Outcomes. Korean J Ophthalmol. 2018 Dec;32(6):451-458. | CrossRef | PubMed |
Kang HG, Choi EY, Byeon SH, Kim SS, Koh HJ, Lee SC, et al. Anti-vascular Endothelial Growth Factor Treatment of Retinopathy of Prematurity: Efficacy, Safety, and Anatomical Outcomes. Korean J Ophthalmol. 2018 Dec;32(6):451-458. | CrossRef | PubMed | Fierson WM; AMERICAN ACADEMY OF PEDIATRICS Section on Ophthalmology; AMERICAN ACADEMY OF OPHTHALMOLOGY; AMERICAN ASSOCIATION FOR PEDIATRIC OPHTHALMOLOGY AND STRABISMUS; AMERICAN ASSOCIATION OF CERTIFIED ORTHOPTISTS. Screening Examination of Premature Infants for Retinopathy of Prematurity. Pediatrics. 2018 Dec;142(6):e20183061. | CrossRef | PubMed |
Fierson WM; AMERICAN ACADEMY OF PEDIATRICS Section on Ophthalmology; AMERICAN ACADEMY OF OPHTHALMOLOGY; AMERICAN ASSOCIATION FOR PEDIATRIC OPHTHALMOLOGY AND STRABISMUS; AMERICAN ASSOCIATION OF CERTIFIED ORTHOPTISTS. Screening Examination of Premature Infants for Retinopathy of Prematurity. Pediatrics. 2018 Dec;142(6):e20183061. | CrossRef | PubMed | Carrion JZ, Fortes Filho JB, Tartarella MB, Zin A, Jornada ID Jr. Prevalence of retinopathy of prematurity in Latin America. Clin Ophthalmol. 2011;5:1687-95. | CrossRef | PubMed |
Carrion JZ, Fortes Filho JB, Tartarella MB, Zin A, Jornada ID Jr. Prevalence of retinopathy of prematurity in Latin America. Clin Ophthalmol. 2011;5:1687-95. | CrossRef | PubMed | Díaz M, Cruzado-Sánchez D. Factores de riesgo neonatales asociados a retinopatía de la prematuridad. Revista peruana de epidemiología. 2012;16(2):127-30. [On line]. | Link |
Díaz M, Cruzado-Sánchez D. Factores de riesgo neonatales asociados a retinopatía de la prematuridad. Revista peruana de epidemiología. 2012;16(2):127-30. [On line]. | Link | Mendoza Díaz KM. Incidencia y perfil epidemiológico de recién nacidos prematuros con retinopatía de la prematuridad en el Instituto Nacional Materno Perinatal. Lima - Perú. [Tesis de pregrado]. Perú: Universidad Nacional Federico Villarreal; 2018. [On line]. | Link |
Mendoza Díaz KM. Incidencia y perfil epidemiológico de recién nacidos prematuros con retinopatía de la prematuridad en el Instituto Nacional Materno Perinatal. Lima - Perú. [Tesis de pregrado]. Perú: Universidad Nacional Federico Villarreal; 2018. [On line]. | Link | Leng Y, Huang W, Ren G, Cai C, Tan Q, Liang Y, et al. The treatment and risk factors of retinopathy of prematurity in neonatal intensive care units. BMC Ophthalmol. 2018 Nov 20;18(1):301. | CrossRef | PubMed |
Leng Y, Huang W, Ren G, Cai C, Tan Q, Liang Y, et al. The treatment and risk factors of retinopathy of prematurity in neonatal intensive care units. BMC Ophthalmol. 2018 Nov 20;18(1):301. | CrossRef | PubMed | Kim SJ, Port AD, Swan R, Campbell JP, Chan RVP, Chiang MF. Retinopathy of prematurity: a review of risk factors and their clinical significance. Surv Ophthalmol. 2018 Sep-Oct;63(5):618-637. | CrossRef | PubMed |
Kim SJ, Port AD, Swan R, Campbell JP, Chan RVP, Chiang MF. Retinopathy of prematurity: a review of risk factors and their clinical significance. Surv Ophthalmol. 2018 Sep-Oct;63(5):618-637. | CrossRef | PubMed | Villamor-Martinez E, Cavallaro G, Raffaeli G, Mohammed Rahim OMM, Gulden S, Ghazi AMT, et al. Chorioamnionitis as a risk factor for retinopathy of prematurity: An updated systematic review and meta-analysis. PLoS One. 2018 Oct 17;13(10):e0205838. | CrossRef | PubMed |
Villamor-Martinez E, Cavallaro G, Raffaeli G, Mohammed Rahim OMM, Gulden S, Ghazi AMT, et al. Chorioamnionitis as a risk factor for retinopathy of prematurity: An updated systematic review and meta-analysis. PLoS One. 2018 Oct 17;13(10):e0205838. | CrossRef | PubMed | Tanner SM, Berryhill TF, Ellenburg JL, Jilling T, Cleveland DS, Lorenz RG, et al. Pathogenesis of necrotizing enterocolitis: modeling the innate immune response. Am J Pathol. 2015 Jan;185(1):4-16. | CrossRef | PubMed |
Tanner SM, Berryhill TF, Ellenburg JL, Jilling T, Cleveland DS, Lorenz RG, et al. Pathogenesis of necrotizing enterocolitis: modeling the innate immune response. Am J Pathol. 2015 Jan;185(1):4-16. | CrossRef | PubMed | Heller CD, O'Shea M, Yao Q, Langer J, Ehrenkranz RA, Phelps DL, et al. Human milk intake and retinopathy of prematurity in extremely low birth weight infants. Pediatrics. 2007 Jul;120(1):1-9. | CrossRef | PubMed |
Heller CD, O'Shea M, Yao Q, Langer J, Ehrenkranz RA, Phelps DL, et al. Human milk intake and retinopathy of prematurity in extremely low birth weight infants. Pediatrics. 2007 Jul;120(1):1-9. | CrossRef | PubMed | Ginovart G, Gich I, Verd S. Human milk feeding protects very low-birth-weight infants from retinopathy of prematurity: a pre-post cohort analysis. J Matern Fetal Neonatal Med. 2016 Dec;29(23):3790-5. | CrossRef | PubMed |
Ginovart G, Gich I, Verd S. Human milk feeding protects very low-birth-weight infants from retinopathy of prematurity: a pre-post cohort analysis. J Matern Fetal Neonatal Med. 2016 Dec;29(23):3790-5. | CrossRef | PubMed | International Committee for the Classification of Retinopathy of Prematurity. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol. 2005 Jul;123(7):991-9. | CrossRef | PubMed |
International Committee for the Classification of Retinopathy of Prematurity. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol. 2005 Jul;123(7):991-9. | CrossRef | PubMed | Al-Essa M, Azad RV, Rashwan N. Threshold stage of retinopathy of prematurity: maternal and neonatal risk factors. Ann Saudi Med. 2000 Mar;20(2):129-31. | CrossRef | PubMed |
Al-Essa M, Azad RV, Rashwan N. Threshold stage of retinopathy of prematurity: maternal and neonatal risk factors. Ann Saudi Med. 2000 Mar;20(2):129-31. | CrossRef | PubMed | Reyes ZS, Al-Mulaabed SW, Bataclan F, Montemayor C, Ganesh A, Al-Zuhaibi S, et al. Retinopathy of prematurity: Revisiting incidence and risk factors from Oman compared to other countries. Oman J Ophthalmol. 2017;10(1):26-32. | CrossRef |
Reyes ZS, Al-Mulaabed SW, Bataclan F, Montemayor C, Ganesh A, Al-Zuhaibi S, et al. Retinopathy of prematurity: Revisiting incidence and risk factors from Oman compared to other countries. Oman J Ophthalmol. 2017;10(1):26-32. | CrossRef | Thomas K, Shah PS, Canning R, Harrison A, Lee SK, Dow KE. Retinopathy of prematurity: Risk factors and variability in Canadian neonatal intensive care units. J Neonatal Perinatal Med. 2015;8(3):207-14. | CrossRef | PubMed |
Thomas K, Shah PS, Canning R, Harrison A, Lee SK, Dow KE. Retinopathy of prematurity: Risk factors and variability in Canadian neonatal intensive care units. J Neonatal Perinatal Med. 2015;8(3):207-14. | CrossRef | PubMed | Ventura Chilón JJ. Incidencia y factores de riesgo de retinopatía de la prematuridad en el servicio de Neonatología del Hospital Regional de Cajamarca en el periodo Enero 2012 - Diciembre 2013. [Tesis de pregrado]. Perú: Universidad Nacional de Cajamarca; 2014. [On line]. | Link |
Ventura Chilón JJ. Incidencia y factores de riesgo de retinopatía de la prematuridad en el servicio de Neonatología del Hospital Regional de Cajamarca en el periodo Enero 2012 - Diciembre 2013. [Tesis de pregrado]. Perú: Universidad Nacional de Cajamarca; 2014. [On line]. | Link | Gayoso M, Genaro S, Sáenz S, Webb D, Rospigliosi M, Rivera F. Preeclampsia como factor asociado al desarrollo de retinopatía en prematuros de muy bajo peso al nacer, nacidos en el Hospital Nacional Cayetano Heredia entre enero 2005 y diciembre 2011. Rev Peru Pediatr. 2013;66(2):73-83. [On line]. | Link |
Gayoso M, Genaro S, Sáenz S, Webb D, Rospigliosi M, Rivera F. Preeclampsia como factor asociado al desarrollo de retinopatía en prematuros de muy bajo peso al nacer, nacidos en el Hospital Nacional Cayetano Heredia entre enero 2005 y diciembre 2011. Rev Peru Pediatr. 2013;66(2):73-83. [On line]. | Link | Pastro J, Toso BRGO. Influence of oxygen in the development of retinopathy of prematurity. Rev Bras Enferm. 2019 Jun 27;72(3):592-599. | CrossRef | PubMed |
Pastro J, Toso BRGO. Influence of oxygen in the development of retinopathy of prematurity. Rev Bras Enferm. 2019 Jun 27;72(3):592-599. | CrossRef | PubMed | Chang JW. Risk factor analysis for the development and progression of retinopathy of prematurity. PLoS One. 2019 Jul 18;14(7):e0219934. | CrossRef | PubMed |
Chang JW. Risk factor analysis for the development and progression of retinopathy of prematurity. PLoS One. 2019 Jul 18;14(7):e0219934. | CrossRef | PubMed | Zhou J, Shukla VV, John D, Chen C. Human Milk Feeding as a Protective Factor for Retinopathy of Prematurity: A Meta-analysis. Pediatrics. 2015 Dec;136(6):e1576-86. | CrossRef | PubMed |
Zhou J, Shukla VV, John D, Chen C. Human Milk Feeding as a Protective Factor for Retinopathy of Prematurity: A Meta-analysis. Pediatrics. 2015 Dec;136(6):e1576-86. | CrossRef | PubMed | Bas AY, Demirel N, Koc E, Ulubas Isik D, Hirfanoglu İM, Tunc T, et al. Incidence, risk factors and severity of retinopathy of prematurity in Turkey (TR-ROP study): a prospective, multicentre study in 69 neonatal intensive care units. Br J Ophthalmol. 2018 Dec;102(12):1711-1716. | CrossRef | PubMed |
Bas AY, Demirel N, Koc E, Ulubas Isik D, Hirfanoglu İM, Tunc T, et al. Incidence, risk factors and severity of retinopathy of prematurity in Turkey (TR-ROP study): a prospective, multicentre study in 69 neonatal intensive care units. Br J Ophthalmol. 2018 Dec;102(12):1711-1716. | CrossRef | PubMed | Gebeşçe A, Uslu H, Keleş E, Yildirim A, Gürler B, Yazgan H, et al. Retinopathy of prematurity: incidence, risk factors, and evaluation of screening criteria. Turk J Med Sci. 2016 Feb 17;46(2):315-20. | CrossRef | PubMed |
Gebeşçe A, Uslu H, Keleş E, Yildirim A, Gürler B, Yazgan H, et al. Retinopathy of prematurity: incidence, risk factors, and evaluation of screening criteria. Turk J Med Sci. 2016 Feb 17;46(2):315-20. | CrossRef | PubMed | Zhu T, Zhang L, Zhao F, Qu Y, Mu D. Association of maternal hypertensive disorders with retinopathy of prematurity: A systematic review and meta-analysis. PLoS One. 2017 Apr 7;12(4):e0175374. | CrossRef | PubMed |
Zhu T, Zhang L, Zhao F, Qu Y, Mu D. Association of maternal hypertensive disorders with retinopathy of prematurity: A systematic review and meta-analysis. PLoS One. 2017 Apr 7;12(4):e0175374. | CrossRef | PubMed | Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB, et al. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med. 2008 Feb 14;358(7):700-8. | CrossRef | PubMed |
Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB, et al. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med. 2008 Feb 14;358(7):700-8. | CrossRef | PubMed | SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network, Finer NN, Carlo WA, Walsh MC, Rich W, Gantz MG, et al. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med. 2010 May 27;362(21):1970-9. | CrossRef | PubMed |
SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network, Finer NN, Carlo WA, Walsh MC, Rich W, Gantz MG, et al. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med. 2010 May 27;362(21):1970-9. | CrossRef | PubMed | Gutiérrez-Gutiérrez CI, Vergara-Wekselman EF, Rojas-Herrera P, Labrín-Palacios C. Retinopatía de la prematuridad en el hospital Regional Docente Las Mercedes. Chiclayo 2007-2009. Rev Cuerpo Méd. HNAAA. 2012;5(1):30-32. [On line]. | Link |
Gutiérrez-Gutiérrez CI, Vergara-Wekselman EF, Rojas-Herrera P, Labrín-Palacios C. Retinopatía de la prematuridad en el hospital Regional Docente Las Mercedes. Chiclayo 2007-2009. Rev Cuerpo Méd. HNAAA. 2012;5(1):30-32. [On line]. | Link | Mintz-Hittner HA, Geloneck MM, Chuang AZ. Clinical Management of Recurrent Retinopathy of Prematurity after Intravitreal Bevacizumab Monotherapy. Ophthalmology. 2016 Sep;123(9):1845-55. | CrossRef | PubMed |
Mintz-Hittner HA, Geloneck MM, Chuang AZ. Clinical Management of Recurrent Retinopathy of Prematurity after Intravitreal Bevacizumab Monotherapy. Ophthalmology. 2016 Sep;123(9):1845-55. | CrossRef | PubMed | Roberts JM, August PA, Bakris G, Barton JR, Bernstein IM, Druzin M, et al. Hypertension in pregnancy. 1st ed. Washington DC: ACOG; 2013.
Roberts JM, August PA, Bakris G, Barton JR, Bernstein IM, Druzin M, et al. Hypertension in pregnancy. 1st ed. Washington DC: ACOG; 2013.  Kesavan K, Devaskar SU. Intrauterine Growth Restriction: Postnatal Monitoring and Outcomes. Pediatr Clin North Am. 2019 Apr;66(2):403-423. | CrossRef | PubMed |
Kesavan K, Devaskar SU. Intrauterine Growth Restriction: Postnatal Monitoring and Outcomes. Pediatr Clin North Am. 2019 Apr;66(2):403-423. | CrossRef | PubMed | Sánchez Luna M, Moreno Hernando J, Botet Mussons F, Fernández Lorenzo JR, Herranz Carrillo G, Rite Gracia S, et al. Displasia broncopulmonar: definiciones y clasificación [Bronchopulmonary dysplasia: definitions and classifications]. An Pediatr (Barc). 2013 Oct;79(4):262.e1-6. | CrossRef | PubMed |
Sánchez Luna M, Moreno Hernando J, Botet Mussons F, Fernández Lorenzo JR, Herranz Carrillo G, Rite Gracia S, et al. Displasia broncopulmonar: definiciones y clasificación [Bronchopulmonary dysplasia: definitions and classifications]. An Pediatr (Barc). 2013 Oct;79(4):262.e1-6. | CrossRef | PubMed |