 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: risk factors, vancomycin-resistant enterococcus, pediatric intensive care unit
Introducción
Las infecciones por Enterococcus sp resistente a la vancomicina se han diseminado y generan un desafío clínico-terapéutico en los pacientes hospitalizados. La amenaza de que la infección por enterococos intratables y la posibilidad que la resistencia a la vancomicina pueda propagarse a neumococos o estafilococos, abogan por la vigilancia atenta de las cepas resistentes.
Objetivo
Determinar los factores de riesgos asociados a la portación de Enterococcus sp resistente a la vancomicina en pacientes pediátricos ingresados en una unidad de cuidados intensivos pediátricos del Paraguay en el periodo entre enero de 2012 y junio de 2013.
Métodos
Estudio transversal. Se analizaron las historias clínicas previas de 140 pacientes ingresados a terapia intensiva (niños de un mes a 18 años), a quienes se realizaron cultivos de hisopado rectal dentro de las 48 horas del ingreso, para determinar los factores asociados a la portación de Enterococcus sp resistente a la vancomicina en unidad de cuidados intensivos pediátricos. Se calculó el Odd ratio con sus intervalos de confianza y p < 0,05 para las variables de estudio. Posteriormente, se realizó regresión logística múltiple para las variables estadísticamente significativas.
Resultados
La portación de Enterococcus sp resistente a la vancomicina se observó en 18,6% de los pacientes. Se identificaron como factores asociados: la hospitalización previa durante el último año (Odds ratio: 10,8; intervalo de confianza 95%: 2,43 a 47,8; p = 0,001), uso previo de antibióticos de amplio espectro (Odds ratio: 5,05; intervalo de confianza 95%: 2,04 a 12,5; p = 0,000), uso de dos o más antibióticos de amplio espectro en el último año (Odds ratio: 5,4; intervalo de confianza 95%: 1,5 a 18,4; p = 0,009), internación previa en área de alto riesgo (Odds ratio: 4,91; intervalo de confianza 95%: 1,83 a 13,2; p = 0,000), internación por igual o mayor a seis días en área de alto riesgo (Odds ratio: 5,64; intervalo de confianza 95%: 2,18 a 14,6; p = 0,000) y uso de inmunosupresores (Odds ratio: 4,84; intervalo de confianza 95%: 1,92 a 11,9; p = 0,001). La regresión múltiple señala a la utilización de dos o más antibióticos de amplio espectro (Odds ratio: 4,81; intervalo de confianza 95%: 1,01 a 22,8; p = 0,047) y a la historia de hospitalización previa dentro del año (Odds ratio: 7,84; intervalo de confianza 95%: 1,24 a 49,32; p = 0,028) como factores independientes asociados estadísticamente con la portación de Enterococcus sp resistente a la vancomicina.
Conclusión
Los pacientes pediátricos ingresados en la unidad de cuidados intensivos con historia de internación previa dentro del año y la exposición a dos o más antibióticos de amplio espectro, tienen mayor riesgo de colonización por el enterococo resistente a vancomicina.
|
Ideas clave
|
La evolución de la resistencia a los antibióticos se ha convertido en una situación problemática global[1]. Identificados por primera vez a mediados de la década de 1980, los enterococos resistentes a vancomicina tienen resistencia intrínseca a la mayor parte de los antibióticos de uso común y la capacidad de adquirirla para la mayoría de los antibióticos actuales, además de la posibilidad de transferencia de genes de resistencia a vancomicina a otros organismos grampositivos[2],[3],[4].
El mayor reservorio de los Enterococcus sp resistentes a la vancomicina es el tracto gastrointestinal, pudiendo el humano ser portador. Ello contribuye a su diseminación intrahospitalaria[5]. Varios estudios previos sobre factores de riesgo han encontrado que la exposición a antibióticos previos, hospitalizaciones anteriores y prolongadas, el uso de antibióticos dentro del año que precede al ingreso, afecciones quirúrgicas, proximidad de pacientes portadores y la exposición a equipos contaminados con Enterococcus sp resistente a la vancomicina se asocian a la colonización de los pacientes[6],[7],[8],[9],[10],[11],[12]. Los niños colonizados con Enterococcus sp resistente a la vancomicina en el aparato gastrointestinal pueden transmitirlo por la diseminación fecal-oral, así como por la contaminación de su medio ambiente[13].
La amenaza de la infección por enterococos intratables y la posibilidad de que la resistencia a la vancomicina pueda propagarse de los enterococos a neumococos o estafilococos, abogan por la importancia de mejorar las medidas de control y prevención de infecciones hospitalarias, analizar cuidadosamente los esquemas antimicrobianos empíricos, tratar de reducir la estancia hospitalaria y seguir la vigilancia para evaluar la eficacia de dichos procedimientos[14],[15],[16].
Actualmente no se disponen de datos sobre la prevalencia de infección por Enterococcus sp resistente a la vancomicina en unidades de terapia intensiva pediátrica en nuestro medio, ni de los factores asociados a portar Enterococcus sp resistente a la vancomicina. Por lo tanto, el objetivo del presente estudio es determinar los factores de riesgo asociados a la colonización de Enterococcus sp resistente a la vancomicina en los pacientes pediátricos ingresados en una unidad de cuidados intensivos.
Diseño y sitio del estudio
Estudio transversal del periodo comprendido entre enero de 2012 y junio de 2013 del Departamento de Terapia Intensiva Pediátrica del Hospital de Clínicas de la Facultad de Ciencias Médicas de la Universidad Nacional de Asunción. Es una unidad polivalente de ocho camas y sirve como referencia a hospitales del área del Gran Asunción, Paraguay (alrededor de 2 500 000 habitantes). El Comité de Ética institucional aprobó la realización del presente estudio según nota UNA_FCM_DIN 279/2018, con fecha 11 de diciembre de 2018. No se requirió del consentimiento informado por tratarse de una revisión de historias clínicas. Se garantizó la confidencialidad de los datos personales con archivos encriptados de manejo exclusivo de los investigadores.
Se realizó un muestreo por conveniencia tomado en forma consecutiva, que incluyó la revisión de todas las historias clínicas de los pacientes atendidos en el departamento durante el periodo comprendido entre enero de 2012 y junio de 2013. En el periodo estudiado ingresó un total de 173 pacientes, de los cuales fueron excluidos 33: 15 por datos clínicos incompletos, cinco reingresos y 13 por hisopados no realizados, quedando conformada la muestra con 140 pacientes (Figura 1).
Población
Fueron incluidos 140 pacientes pediátricos cuya edad comprendía entre un mes y 18 años, a quienes se les realizó hisopado rectal para detección de portación de Enterococcus sp, cuyos resultados estuvieron disponibles, con historias clínicas completas y cuyos ingresos ocurrieron en el periodo estudiado. Fueron excluidos pacientes con datos clínicos incompletos y aquellos a quienes no se le realizó el hisopado. En la mayoría de los casos esto se debió a falta de insumos de laboratorio. En el caso de pacientes que reingresaron al servicio, sólo fue considerada la primera admisión.
Al momento del presente estudio, por protocolo la toma de hisopado rectal se realizaba a todos los pacientes ingresados a la unidad al momento del ingreso y dentro de las 48 horas ocurrido el mismo. En el intertanto, el paciente era considerado positivo hasta el retorno del cultivo y sujeto a aislamiento. Los casos en los que no se realizó la toma de material tuvieron dos casusas principales: factores administrativos como la falta de insumos o fallecimiento de los pacientes dentro de las primeras horas del ingreso.
Figura 1. Elegibilidad de pacientes.
Estudios de laboratorio
Las muestras de hisopado rectal se recogieron con hisopo de madera al ingreso a la terapia o dentro de las primeras 48 hora. Luego, fueron transportados en medio Stuart y enviados al laboratorio de microbiología de nuestro centro para su cultivo en placa Agar Bilis-Esculina-Azida con suplemento de vancomicina de seis microgramos por mililitro.
Análisis de datos
Las variables demográficas y clínicas, incluyendo la edad, el sexo y diagnóstico de admisión o subyacente el día de la admisión, fueron recopiladas de la historia clínica de cada paciente. Para el análisis se conformaron dos grupos según el resultado del cultivo: positivos (EVR +) y negativos (EVR -).
Las variables estudiadas en los dos grupos incluyeron las características basales de los pacientes, la historia de hospitalizaciones previas dentro del año al día de ingreso a la unidad, el antecedente de internación previa en áreas de alto riesgo (hematooncología o terapia intensiva) o de bajo riesgo (otras áreas de internación pediátricas). Se consideró el tiempo de internación definido de la siguiente manera:
1) Para áreas de bajo riesgo se categorizó en dos grupos:
2) Para áreas de alto riesgo en:
También se contempló la utilización de antibióticos previos dentro del año del ingreso, la cualidad del espectro antimicrobiano (amplio espectro o no, considerándose como antibiótico de amplio espectro a los agentes antiinfecciosos con actividad frente a gérmenes grampositivos y gramnegativos). Para este estudio se tomó en cuenta los de utilización en el ámbito hospitalario como vancomicina, cefalosporinas de tercera generación como ceftriaxona o ceftazidima, así como clindamicina, imipenen o meropenem. El tiempo de utilización de antibióticos fue definido en:
Asimismo, se contempló la utilización de un solo antibiótico de amplio espectro, o de dos o más de ellos; el uso de dispositivos invasivos (colocación de vía venosa central, sonda vesical, catéteres de diálisis o ventilación mecánica), y uso de inmunosupresores (administración de terapia antineoplásica dentro de los seis meses previos a la toma de muestra, o trasplante de medula previa).
Análisis estadístico
Las variables continuas fueron expresadas en media ± desviación estándar, asumiéndose que las variables tenían distribución normal. Las variables categóricas fueron expresadas en número y porcentaje. Se utilizó la prueba de t test para el contraste de las variables continuas y Chi-cuadrado para variables categóricas, considerándose significativa p < 0,05. En el análisis de datos se determinaron la razón de momios (Odds-ratios) y los intervalos de confianza del 95% para cada una de las variables. Se realizó análisis de regresión logística múltiple en variables que fueron estadísticamente significativas durante el análisis bivariado de relación. Estos se realizaron utilizando el paquete estadístico EPIINFO 3.4.
Se incluyeron 140 pacientes de la unidad de cuidados intensivos pediátricos durante el periodo de enero de 2012 a junio de 2013. De estos, en 26 pacientes (18,6%) el hisopado rectal resultó positivo para Enterococcus sp resistente a la vancomicina y en 114 (81,4%) resultó negativo. Ningún paciente con Enterococcus sp resistente a la vancomicina positivo desarrolló alguna enfermedad asociada al germen.
El promedio de edad fue de 6 ± 5,7 años. La distribución por sexo fue 52,8% niños y 47,1% niñas (p = 0,75). Los pacientes con Enterococcus sp resistente a la vancomicina fueron significativamente mayores a los Enterococcus sp no resistente a la vancomicina: 8 ± 5,3 versus 5,5 ± 5,6 años, p = 0,03. La distribución de frecuencia por grupo de edad se presenta en la Tabla 1.
Con respecto a las comorbilidades observadas en los pacientes estudiados, 48 (34,3%) de ellos presentaban patologías hematológicas (leucemias o linfomas) y 21 (20%) algún tipo de proceso tumoral. Por otro lado, 36 (25,7%) no presentaban comorbilidades. La patología hematológica (Odds ratio: 5,4; intervalo de confianza 95%: 2,2 a 13; p = 0,00) y el lupus o inmunodeficiencias (Odds ratio: 18; intervalo de confianza 95%: 1,8 a 18,1; p = 0,01) representaban significativamente mayor riesgo para la portación (Tabla 2).
Los principales diagnósticos de ingreso del total de la muestra estudiada fue el choque en 44 (31,4%) pacientes, posoperatorios en 17 (12,1%), dengue en 16 (11%) y sepsis en 10 (7%) (Tabla 3). La frecuencia de diagnósticos se mantuvo similar entre los portadores y no portadores.
En el análisis bivariado se observó una diferencia estadísticamente significativa en las siguientes variables: historia de hospitalizaciones previas (Odds ratio: 10,8; intervalo de confianza 95%: 2,43 a 47,8; p = 0,001), exposición de ocho o más días a antibióticos (Odds ratio: 5,54; intervalo de confianza 95%: 2,18 a 14,8; p = 0,05), exposición a dos o más antibióticos de amplio espectro (Odds ratio: 5,4; intervalo de confianza 95%: 1,5 a 18,4; p = 0,009), internación previa en área de alto riesgo (Odds ratio: 4,9; intervalo de confianza 95%: 1,83 a 11,9; p = 0,00), uso inmunosupresores (Odds ratio: 4,84; intervalo de confianza 95%: 1,95 a 11,9; p = 0,000) e internación en área de alto riesgo de seis días o más(Odds ratio: 5,64; intervalo de confianza 95%: 2,18 a 14,6; p = 0,00). No se observaron diferencias significativas en la exposición a antibióticos menor de siete días, ninguna exposición a antibióticos de amplio espectro, internación previa en área de bajo riesgo, el antecedente de procedimiento invasivo e internación en áreas de bajo riesgo menos y más de 10 días (Tabla 4).
Tabla 2. Comorbilidades previas al ingreso.
Tabla 3. Causas de ingreso a terapia intensiva.
Tabla 4. Factores relacionados a la portación de Enterococcus sp resistente a la vancomicina.
El análisis de regresión logística múltiple para las variables que presentaron significación estadística se muestra en la Tabla 5. El mismo mostró que entre los factores encontrados como asociados a la portación de Enterococcus sp resistente a la vancomicina fueron la utilización de dos o más antibióticos de amplio espectro con un Odds ratio: 4,8; intervalo de confianza 95%: 1,016 a 22,83; p = 0,04 y la historia de hospitalizaciones previas con un Odds ratio: 7,84; intervalo de confianza 95%: 1,24 a 49,32; p = 0,02.
Tabla 5. Resultado del análisis de regresión logística.
Los principales hallazgos del presente estudio fueron los siguientes:
1) La prevalencia de portación de Enterococcus sp resistente a la vancomicina en unidad de cuidados intensivos pediátricos fue de 18,6%.
2) Los factores significativamente asociados a colonización por Enterococcus sp resistente a la vancomicina en pacientes pediátricos ingresados en unidad de cuidados intensivos pediátricos fueron historia de internación previa dentro del año y la exposición a dos o más antibióticos de amplio espectro.
En el presente trabajo, 18,6% de los pacientes presentaban colonización con Enterococcus sp resistente a la vancomicina. Esta frecuencia de colonización es similar a otro estudio realizado en el país en un centro hospitalario de referencia, fuera del ámbito de la terapia intensiva, en el cual 13% de los pacientes estaba colonizado[17].
En países de la región como Brasil, donde también se ha evaluado esta colonización, Tresoldi y colaboradores[4] encontraron una tasa positiva de portación del 8,0%. Sin embrago, también en Brasil, Moemen y colaboradores reportaron una colonización del 23,1%[8]. En tanto que en reportes de Reale y colaboradores en Argentina, dan cuenta de una prevalencia de 17,9%[7].
Por otra parte, en Turquía, Sutcu M y colaboradores hallaron 9,5% de colonización con Enterococcus sp resistente a la vancomicina[18], mientras que Ulu-Kilic A y colaboradores[19] analizaron retrospectivamente los datos de vigilancia de Enterococcus sp resistente a la vancomicina de un hospital pediátrico entre 2010 y 2014 con un estudio de casos y controles, encontrando que la tasa de muestras de cultivos positivos entre todos los pacientes examinados fue de 3,75%.
En cambio en Pakistán, Yameen y colaboradores[15], encontraron 2,7% de portación de Enterococcus sp resistente a la vancomicina en un estudio realizado para evaluar la epidemiología local de colonización nasal y rectal en niños internados en unidad de cuidados intensivos pediátricos.
La portación en países del primer mundo ha sido altamente variable. Así, en Nueva Zelanda, Briggs S. y colaboradores[20] reportaron una tasa de colonización del 0,3%. Sin embargo, Gray y colaboradores[21] detectaron en Reino Unido que la colonización gastrointestinal con Enterococcus sp resistente a la vancomicina era del 38,3% en los pacientes de hematología/oncología, disminuyendo la frecuencia de colonización en pacientes internados en las salas de hepatología/gastroenterología a 11%, en tanto que solo el 2,3% de los niños en cuidados intensivos pediátricos estaban colonizados. Young y colaboradores en Corea, encontraron tasas de portación del 30,3%[5].
La frecuencia de colonización por Enterococcus sp resistente a la vancomicina encontrada puede considerarse alta si se tiene en cuenta las obtenidas en una revisión sistemática con metaanálisis realizada por Flokas ME y colaboradores[22], donde se incluyeron 19 estudios que incorporó a 20 234 niños hospitalizados en unidades generales y pediátricas de cuidados intensivos. Allí la colonización por Enterococcus sp resistente a la vancomicina era 5% (de tres a 8% en general y de dos a 9% en las unidades de cuidados intensivos pediátricos).
Las variaciones de las prevalencias podrían deberse a varios factores como el tipo de hospital, las características de los pacientes, las técnicas de recolección de las muestras, así como a la utilización efectiva de las medidas recomendadas para el control de la trasmisión del germen[12].
Dentro de los factores asociados encontrados en nuestro estudio, los pacientes con historia de hospitalización previa tienen mayor riesgo de colonización con Enterococcus sp resistente a la vancomicina. Según Reale y colaboradores en Argentina, uno de los factores es la hospitalización prolongada (p = 0,0001)[7].
Kim y colaboradores en Corea, encontraron que la hospitalización y la duración de esta (Odds ratio: 7,24; intervalo de confianza 95%: 3,22 a 16,26, p = < 0,001) representaban a factores de riesgo[16]. Asimismo, otros estudios coinciden con nuestro hallazgo. Por ejemplo, Elizaga y colaboradores en Perú reportaron que la hospitalización previa representaba un riesgo 3,6 mayor (Odds ratio: 3,6; intervalo de confianza 95%: 1,6 a 8,4, p = < 0,004)[10]. La historia de hospitalización previa tiene relación con la colonización con Enterococcus sp resistente a la vancomicina porque existe una mayor posibilidad de recibir antibióticos de amplio espectro durante las mismas, sobre todo si ello ocurre en un área de alto riesgo. Por otro lado, una estancia hospitalaria previa podría favorecer la exposición a microorganismos intrínsecamente resistentes a la vancomicina y, por tanto, la adquisición del enterococo por contacto con otro portador o a través de fómites contaminados[5],[6].
Los pacientes en los que se utilizaron dos o más antibióticos de amplio espectro, también presentaban mayor riesgo de colonización. Según Reale y colaboradores[7], en Argentina, encontraron que el uso de vancomicina (Odds ratio: 5,15; intervalo de confianza 95%: 1,22 a 21,76; p = 0,02) aumentaba el riesgo de portación. Igualmente, otros estudios coinciden con nuestros hallazgos. Tal es el caso de Singh y colaboradores[1], quienes encontraron que la terapia con ceftazidima combinada con vancomicina aumentaba el riesgo de colonización 1, 7 veces (p = 0,004) y el uso de vancomicina (Odds ratio: 50,39; intervalo de confianza 95%: 3,77 a 672; p = 0,003) o ceftazidima (Odds ratio: 95,62; intervalo de confianza 95%: 7,41 a 999; p = 0,001) representaban un riesgo aun mayor. De la misma manera, Henning y colaboradores observaron que la vancomicina (p = ,002) y la ceftazidima (p < 0,001) eran los antibióticos más relacionados a la colonización[13]. Elizaga y colaboradores, en Chicago, Estados Unidos, encontraron que el uso de cualquier antibiótico previo representaba un riesgo siete veces mayor (Odds ratio: 7 intervalo de confianza 95%: 2,7 a 18,4: p = < 0,001), y que aumentaba a 13,5 cuando se utilizó vancomicina (Odds ratio: 13,5 intervalo de confianza 95%: 1,6 a 111; p = 0,005)[10]. En Perú, Flores y colaboradores, dieron cuenta que la utilización de antibióticos representaba un riesgo seis veces mayor (Odds ratio: 6; intervalo de confianza 95%: 1,13 a 31,7; p = 0,03)[12].
Por un lado en Turquia, Sutcu M y colaboradores, encontraron asociación al uso previo de glucopeptidos (Odds ratio: 12,8; intervalo de confianza 95%: 1,9 a 26,6; p = 0,012)[18]: y por el otro, Ozkaya- Parlakay A. y colaboradores observaron que la exposición a antibióticos en los tres meses anteriores estuvo significativamente relacionada con el tiempo de colonización (p = 0,004)[23].
Finalmente, en una revisión sistemática con metaanálisis llevada a cabo por Flokas ME y colaboradores, reportaron que la exposición previa a la vancomicina y ceftazidima (Odds ratio: 4,34, intervalo de confianza 95%: 2,77 a 6,82) y (Odds ratio: 4,15, intervalo de confianza 95%: 2,69 a 6,40) respectivamente, fueron los factores de riesgo significativos encontrados en niños hospitalizados[22].
La utilización de dos o más antibióticos de amplio espectro tiene relación con la colonización, porque los mismos generan una alta presión antibiótica alterando la flora intestinal normal y conduciendo a un crecimiento selectivo del enterococo resistente a vancomicina. La colonización puede persistir desde semanas hasta incluso años[24].
El estudio tuvo varias limitaciones, entre las que se pueden señalar: el carácter retrospectivo basado en los registros de las historias clínicas, el tamaño pequeño de la muestra y la no determinación del antibiótico de amplio espectro con mayor asociación a la portación, ya que los antibióticos fueron agrupados según su espectro de acción.
Se requiere realizar estudios con diseños prospectivos y multicéntricos que puedan ayudar a validar los hallazgos.
Los pacientes pediátricos ingresados a la unidad de cuidados intensivos pediátricos con historia de internación previa dentro del año y la exposición a dos o más antibióticos de amplio espectro, tienen mayor de riesgo de colonización por el enterococo resistente a vancomicina.
El conocimiento del grado de colonización y de los factores de riesgos asociados pueden permitir el monitoreo de la utilización correcta y oportuna de medidas de prevención de infecciones como aislamiento de contactos, higiene de manos por parte del personal de salud y de la familia que ayuda al cuidado del niño; las cuales deben ser aplicadas en la atención de todos los pacientes. Del mismo modo, debe insistirse en la educación continua, la adopción de políticas adecuadas para la administración racional de antibióticos y la vigilancia adecuada de los casos que pudieran conducir a la disminución de las tasas de colonización de Enterococcus sp resistente a la vancomicina.
Roles y contribuciones de autoría
LD, AA: conceptualización, gestión de datos, análisis formal, investigación, metodología, administración del proyecto, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones).
MG: análisis formal, investigación, metodología, supervisión, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones).
IR, LD, HJJ: conceptualización, gestión de datos, análisis formal, investigación, metodología, administración del proyecto, supervisión, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones).
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del artículo; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Declaración de financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
Declaración de aspectos éticos
El estudio fue revisado y aprobado por el comité de ética de la Facultad de Ciencias Médicas de la Universidad Nacional de Asunción Paraguay, según nota UNA_FCM_DIN°279/2018, en fecha 11 de diciembre 2018

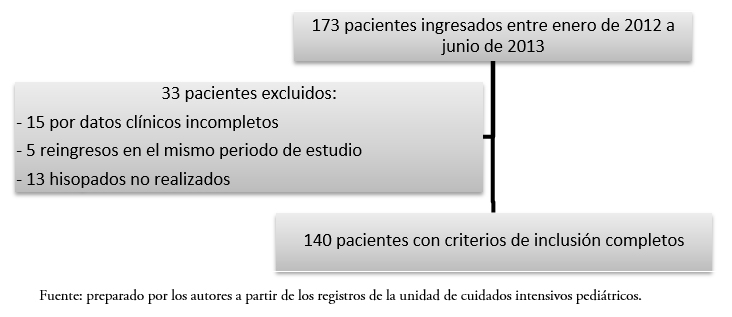 Figura 1. Elegibilidad de pacientes.
Figura 1. Elegibilidad de pacientes.

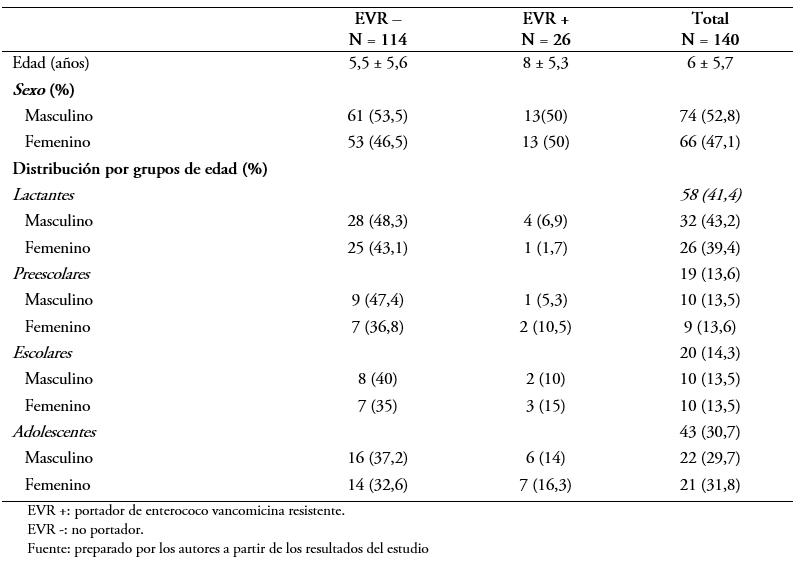 Tabla 1. Perfil de los pacientes estudiados con respecto a la portación de Enterococcus sp resistente a la vancomicina.
Tabla 1. Perfil de los pacientes estudiados con respecto a la portación de Enterococcus sp resistente a la vancomicina.

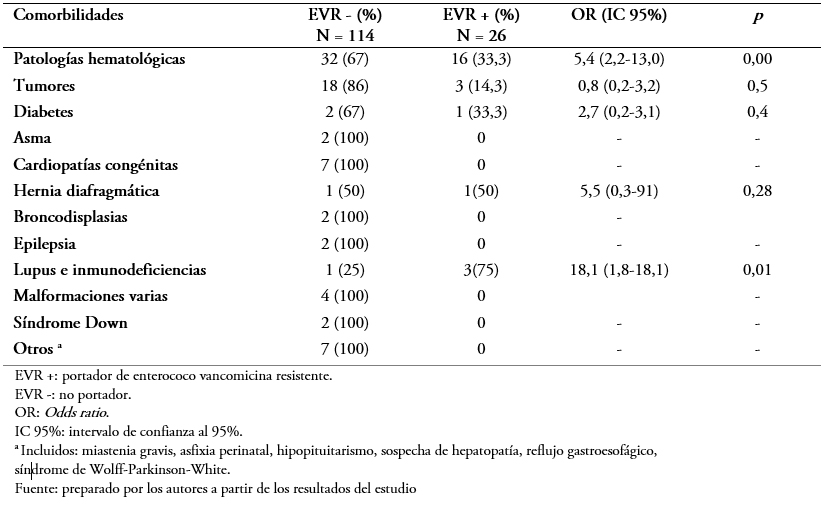 Tabla 2. Comorbilidades previas al ingreso.
Tabla 2. Comorbilidades previas al ingreso.

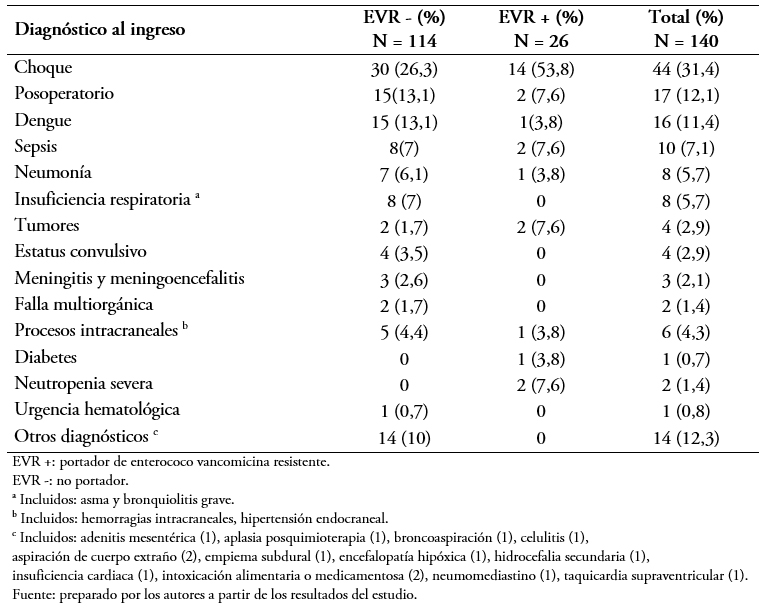 Tabla 3. Causas de ingreso a terapia intensiva.
Tabla 3. Causas de ingreso a terapia intensiva.

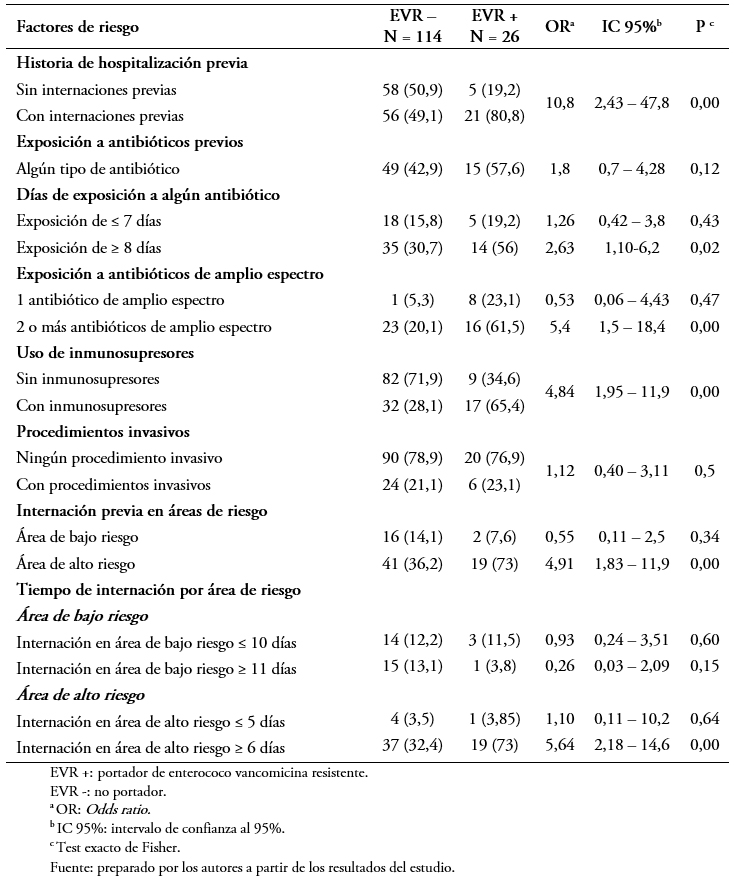 Tabla 4. Factores relacionados a la portación de Enterococcus sp resistente a la vancomicina.
Tabla 4. Factores relacionados a la portación de Enterococcus sp resistente a la vancomicina.

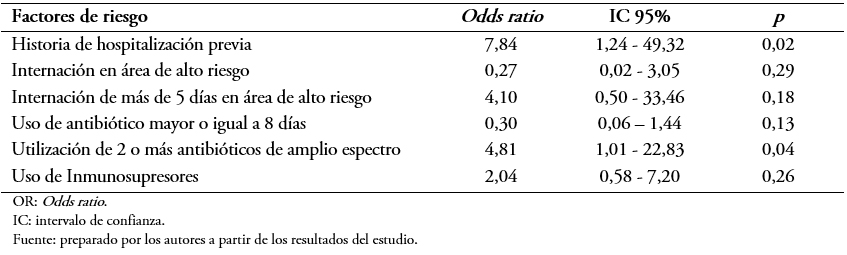 Tabla 5. Resultado del análisis de regresión logística.
Tabla 5. Resultado del análisis de regresión logística.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Introduction
Vancomycin-resistant enterococci (VRE) infections have become widespread and a challenge in hospitalized patients. The threat of infection by intractable enterococci and the possibility that vancomycin resistance could involve pneumococci or staphylococci advocate for careful surveillance of resistant strains.
Objective
To determine the risk factors associated with VRE colonization in pediatric patients admitted to the Pediatric Intensive Care Unit (PICU) in the period between January 2012 and June 2013.
Methods
We conducted a cross-sectional study analyzing the clinical histories of 140 patients admitted to the PICU (children from 1 month to 18 years) who underwent rectal swab cultures within 48 hours of admission. We calculated the odds ratios and confidence intervals of the risk factors for VRE colonization in the PICU, and then we used multiple logistic regression for the statistically significant variables.
Results
VRE colonization was present in 18.6% of patients. The following variables were identified as risk factors associated with VRE colonization: prior hospitalization in the past year (odds ratio: 10.8; 95% confidence interval: 2.43 to 47.8; p = 0.001); prior use of one broad-spectrum antibiotic (odds ratio: 5.05; 95% confidence interval: 2.04 to 12.5; p = 0.000); use of two or more broad-spectrum antibiotics in past year (odds ratio: 5.4; 95% confidence interval: 1.5 to 18.4; p = 0.009); prior hospitalization in a high-risk area (odds ratio: 4.91; 95% confidence interval: 1.83 to 13.2; p = 0.000); hospitalization for more than five days in a high-risk area (odds ratio: 5.64; 95% confidence interval: 2.18 to 14.6; p = 0.000); and use of immunosuppressant drugs (odds ratio: 4.84; 95% confidence interval: 1.92 to 11.9; p = 0.001). In a logistic multiple regression the use of two or more broad-spectrum antibiotics (odds ratio: 4.81; 95% confidence interval: 1.01 to 22.8; p = 0.047) and prior hospitalization in past year (odds ratio: 7.84; 95% confidence interval: 1.24 to 49.32; p = 0.028) were identified as independent factors statistically associated with VRE colonization.
Conclusion
Pediatric patients admitted for intensive care with a history of prior hospitalization in the past year and exposure to two or more broad-spectrum antibiotics have a greater risk of colonization by vancomycin-resistant enterococci.
 Autores:
Laura Duarte[1], Antonio Arbo[2], Mirna Gallardo[1], Irma Riquelme [1], Lorena Delgadillo[1], Hassel Jimmy Jiménez[1]
Autores:
Laura Duarte[1], Antonio Arbo[2], Mirna Gallardo[1], Irma Riquelme [1], Lorena Delgadillo[1], Hassel Jimmy Jiménez[1]

Citación: Duarte L, Arbo A, Gallardo M, Riquelme I, Delgadillo L, Jiménez HJ. Factors associated with vancomycin-resistant enterococci colonization in a pediatric intensive care unit of Paraguay: A cross-sectional study on hospital charts. Medwave 2019;19(8):e7694 doi: 10.5867/medwave.2019.08.7694
Fecha de envío: 22/4/2019
Fecha de aceptación: 2/9/2019
Fecha de publicación: 12/9/2019
Origen: no solicitado
Tipo de revisión: Con revisión externa por cuatro pares revisores, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Singh-Naz N, Sleemi A, Pikis A, Patel KM, Campos JM. Vancomycin-resistant Enterococcus faecium colonization in children. J Clin Microbiol. 1999 Feb;37(2):413-6. | PubMed |
Singh-Naz N, Sleemi A, Pikis A, Patel KM, Campos JM. Vancomycin-resistant Enterococcus faecium colonization in children. J Clin Microbiol. 1999 Feb;37(2):413-6. | PubMed | Amberpet R, Sistla S, Parija SC, Rameshkumar R. Risk factors for intestinal colonization with vancomycin resistant enterococci' A prospective study in a level III pediatric intensive care unit. J Lab Physicians. 2018 Jan-Mar;10(1):89-94. | CrossRef | PubMed |
Amberpet R, Sistla S, Parija SC, Rameshkumar R. Risk factors for intestinal colonization with vancomycin resistant enterococci' A prospective study in a level III pediatric intensive care unit. J Lab Physicians. 2018 Jan-Mar;10(1):89-94. | CrossRef | PubMed | Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-resistant enterococci. Clin Microbiol Rev. 2000 Oct;13(4):686-707. | PubMed |
Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-resistant enterococci. Clin Microbiol Rev. 2000 Oct;13(4):686-707. | PubMed | Tresoldi AT, Cardoso LGO, Castilho G V, Dantas SRPE, von Nowakonski A, Pereira RM, et al. Low prevalence of vancomycin resistant enterococci colonization in intensive care patients in a Brazilian teaching hospital. Braz J Infect Dis. 2006; 10(4):239-41. | CrossRef |
Tresoldi AT, Cardoso LGO, Castilho G V, Dantas SRPE, von Nowakonski A, Pereira RM, et al. Low prevalence of vancomycin resistant enterococci colonization in intensive care patients in a Brazilian teaching hospital. Braz J Infect Dis. 2006; 10(4):239-41. | CrossRef | Yoon YK, Lee SE, Lee J, Kim HJ, Kim JY, Park DW, et al. Risk factors for prolonged carriage of vancomycin-resistant Enterococcus faecium among patients in intensive care units: a case-control study. J Antimicrob Chemother. 2011 Aug;66(8):1831-8. | CrossRef | PubMed |
Yoon YK, Lee SE, Lee J, Kim HJ, Kim JY, Park DW, et al. Risk factors for prolonged carriage of vancomycin-resistant Enterococcus faecium among patients in intensive care units: a case-control study. J Antimicrob Chemother. 2011 Aug;66(8):1831-8. | CrossRef | PubMed | Moemen D, Tawfeek D, Badawy W. Healthcare-associated vancomycin resistant Enterococcus faecium infections in the Mansoura University Hospitals intensive care units, Egypt. Braz J Microbiol. 2015 Jul 1;46(3):777-83. | CrossRef | PubMed |
Moemen D, Tawfeek D, Badawy W. Healthcare-associated vancomycin resistant Enterococcus faecium infections in the Mansoura University Hospitals intensive care units, Egypt. Braz J Microbiol. 2015 Jul 1;46(3):777-83. | CrossRef | PubMed | Reale AL, Depetri ML, Culasso C, Paviolo M, Cheguirián ML, Enrico MC, et al. [Vancomycin-resistant enterococci: prevalence and factors associated with intestinal colonization in oncology patients from Hospital de Niños de Córdoba]. Rev Argent Microbiol. 2009 Apr-Jun;41(2):92-6. | PubMed | Link |
Reale AL, Depetri ML, Culasso C, Paviolo M, Cheguirián ML, Enrico MC, et al. [Vancomycin-resistant enterococci: prevalence and factors associated with intestinal colonization in oncology patients from Hospital de Niños de Córdoba]. Rev Argent Microbiol. 2009 Apr-Jun;41(2):92-6. | PubMed | Link | Loyola P, Tordecilla J, Benadof D, Yohannessen K, Acuña M. [Risk factor of intestinal colonization with vancomycin resistant Enterococcus spp in hospitalized pediatric patients with oncological disease]. Rev Chilena Infectol. 2015 Aug;32(4):393-8. | CrossRef | PubMed |
Loyola P, Tordecilla J, Benadof D, Yohannessen K, Acuña M. [Risk factor of intestinal colonization with vancomycin resistant Enterococcus spp in hospitalized pediatric patients with oncological disease]. Rev Chilena Infectol. 2015 Aug;32(4):393-8. | CrossRef | PubMed | Furuno JP, McGregor JC, Harris AD, Johnson JA, Johnson JK, Langenberg P, et al. Identifying groups at high risk for carriage of antibiotic-resistant bacteria. Arch Intern Med. 2006 Mar 13;166(5):580-5. | PubMed |
Furuno JP, McGregor JC, Harris AD, Johnson JA, Johnson JK, Langenberg P, et al. Identifying groups at high risk for carriage of antibiotic-resistant bacteria. Arch Intern Med. 2006 Mar 13;166(5):580-5. | PubMed | Elizaga ML, Weinstein RA, Hayden MK. Patients in long-term care facilities: a reservoir for vancomycin-resistant enterococci. Clin Infect Dis. 2002 Feb 15;34(4):441-6. | PubMed |
Elizaga ML, Weinstein RA, Hayden MK. Patients in long-term care facilities: a reservoir for vancomycin-resistant enterococci. Clin Infect Dis. 2002 Feb 15;34(4):441-6. | PubMed | Yiş R, Aslan S, Cıtak C, Değirmenci S. [Evaluation of vancomycin-resistant enterococcus colonization at Gaziantep Children's Hospital, Turkey]. Mikrobiyol Bul. 2011 Oct;45(4):646-54. Turkish. | PubMed |
Yiş R, Aslan S, Cıtak C, Değirmenci S. [Evaluation of vancomycin-resistant enterococcus colonization at Gaziantep Children's Hospital, Turkey]. Mikrobiyol Bul. 2011 Oct;45(4):646-54. Turkish. | PubMed | Flores-Paredes W. Epidemiología de la colonización intestinal con enterococo resistente a vancomicina en pacientes de alto riesgo del Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú. Rev Medica Hered. 2010; 21(3):128-39. | Link |
Flores-Paredes W. Epidemiología de la colonización intestinal con enterococo resistente a vancomicina en pacientes de alto riesgo del Hospital Nacional Edgardo Rebagliati Martins. Lima, Perú. Rev Medica Hered. 2010; 21(3):128-39. | Link | Henning KJ, Delencastre H, Eagan J, Boone N, Brown A, Chung M, et al. Vancomycin-resistant Enterococcus faecium on a pediatric oncology ward: duration of stool shedding and incidence of clinical infection. Pediatr Infect Dis J. 1996 Oct;15(10):848-54. | PubMed |
Henning KJ, Delencastre H, Eagan J, Boone N, Brown A, Chung M, et al. Vancomycin-resistant Enterococcus faecium on a pediatric oncology ward: duration of stool shedding and incidence of clinical infection. Pediatr Infect Dis J. 1996 Oct;15(10):848-54. | PubMed | Bonten MJ, Slaughter S, Ambergen AW, Hayden MK, van Voorhis J, Nathan C, et al. The role of "colonization pressure" in the spread of vancomycin-resistant enterococci: an important infection control variable. Arch Intern Med. 1998 May 25;158(10):1127-32. | PubMed |
Bonten MJ, Slaughter S, Ambergen AW, Hayden MK, van Voorhis J, Nathan C, et al. The role of "colonization pressure" in the spread of vancomycin-resistant enterococci: an important infection control variable. Arch Intern Med. 1998 May 25;158(10):1127-32. | PubMed | Yameen MA, Iram S, Mannan A, Khan SA, Akhtar N. Nasal and perirectal colonization of vancomycin sensitive and resistant enterococci in patients of paediatrics ICU (PICU) of tertiary health care facilities. BMC Infect Dis. 2013 Mar 27;13:156. | CrossRef | PubMed |
Yameen MA, Iram S, Mannan A, Khan SA, Akhtar N. Nasal and perirectal colonization of vancomycin sensitive and resistant enterococci in patients of paediatrics ICU (PICU) of tertiary health care facilities. BMC Infect Dis. 2013 Mar 27;13:156. | CrossRef | PubMed | Kim HS, Kim DH, Yoon HJ, Lee WJ, Woo SH, Choi SP. Factors Associated with Vancomycin-Resistant Enterococcus Colonization in Patients Transferred to Emergency Departments in Korea. J Korean Med Sci. 2018 Oct 25;33(48):e295. | CrossRef | PubMed |
Kim HS, Kim DH, Yoon HJ, Lee WJ, Woo SH, Choi SP. Factors Associated with Vancomycin-Resistant Enterococcus Colonization in Patients Transferred to Emergency Departments in Korea. J Korean Med Sci. 2018 Oct 25;33(48):e295. | CrossRef | PubMed | Talavera G, Rodriguez M, Castro H, Melgarejo N, Noguera J, Portillo S BW. Colonización intestinal por enterococo resistente a la vancomicina en pacientes oncológicos con factores de riesgo. Pediatr (Asunción). 2011;38(2):123-5.
| Link |
Talavera G, Rodriguez M, Castro H, Melgarejo N, Noguera J, Portillo S BW. Colonización intestinal por enterococo resistente a la vancomicina en pacientes oncológicos con factores de riesgo. Pediatr (Asunción). 2011;38(2):123-5.
| Link | Sutcu M, Akturk H, Acar M, Salman N, Aydın D, Akgun Karapınar B, et al. Impact of vancomycin-resistant enterococci colonization in critically ill pediatric patients. Am J Infect Control. 2016 May 1;44(5):515-9. | CrossRef | PubMed |
Sutcu M, Akturk H, Acar M, Salman N, Aydın D, Akgun Karapınar B, et al. Impact of vancomycin-resistant enterococci colonization in critically ill pediatric patients. Am J Infect Control. 2016 May 1;44(5):515-9. | CrossRef | PubMed | Ulu-Kilic A, Özhan E, Altun D, Perçin D, Güneş T, Alp E. Is it worth screening for vancomycin-resistant Enterococcus faecium colonization?: Financial burden of screening in a developing country. Am J Infect Control. 2016 Apr 1;44(4):e45-9. | CrossRef | PubMed |
Ulu-Kilic A, Özhan E, Altun D, Perçin D, Güneş T, Alp E. Is it worth screening for vancomycin-resistant Enterococcus faecium colonization?: Financial burden of screening in a developing country. Am J Infect Control. 2016 Apr 1;44(4):e45-9. | CrossRef | PubMed | Briggs S, Upton A, Bilkey M, Taylor S, Roberts S, Holland D. Vancomycin-resistant enterococcal colonisation of hospitalised patients in Auckland. N Z Med J. 2002 Aug 23;115(1160):U145. | PubMed |
Briggs S, Upton A, Bilkey M, Taylor S, Roberts S, Holland D. Vancomycin-resistant enterococcal colonisation of hospitalised patients in Auckland. N Z Med J. 2002 Aug 23;115(1160):U145. | PubMed | Gray JW, George RH. Experience of vancomycin-resistant enterococci in a children's hospital. J Hosp Infect. 2000 May;45(1):11-8. | CrossRef | PubMed |
Gray JW, George RH. Experience of vancomycin-resistant enterococci in a children's hospital. J Hosp Infect. 2000 May;45(1):11-8. | CrossRef | PubMed | Flokas ME, Karageorgos SA, Detsis M, Alevizakos M, Mylonakis E. Vancomycin-resistant enterococci colonisation, risk factors and risk for infection among hospitalised paediatric patients: a systematic review and meta-analysis. Int J Antimicrob Agents. 2017 May;49(5):565-572. | CrossRef | PubMed |
Flokas ME, Karageorgos SA, Detsis M, Alevizakos M, Mylonakis E. Vancomycin-resistant enterococci colonisation, risk factors and risk for infection among hospitalised paediatric patients: a systematic review and meta-analysis. Int J Antimicrob Agents. 2017 May;49(5):565-572. | CrossRef | PubMed | Özkaya-Parlakay A, Cengiz AB, Ceyhan M, Bağdat A, Barın-Kurtoğlu Ç, Gürbüz V, et al. Vancomycin-resistant enterococcus colonization and infection in children: six-year follow-up. Turk J Pediatr. 2014 Nov-Dec;56(6):618-25. | PubMed |
Özkaya-Parlakay A, Cengiz AB, Ceyhan M, Bağdat A, Barın-Kurtoğlu Ç, Gürbüz V, et al. Vancomycin-resistant enterococcus colonization and infection in children: six-year follow-up. Turk J Pediatr. 2014 Nov-Dec;56(6):618-25. | PubMed | Rice LB. Emergence of vancomycin-resistant enterococci. Emerg Infect Dis. 2001 Mar-Apr;7(2):183-7. | PubMed |
Rice LB. Emergence of vancomycin-resistant enterococci. Emerg Infect Dis. 2001 Mar-Apr;7(2):183-7. | PubMed |