 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: disnea irruptiva; disnea episódica; opioides; disnea refractaria
INTRODUCCIÓN
Siendo la disnea irruptiva un síntoma muy frecuente en los pacientes oncológicos, no existen recomendaciones precisas para su tratamiento. El objetivo principal del estudio fue analizar qué tratamientos se utilizan en la práctica clínica diaria para el manejo de la disnea irruptiva en pacientes con cáncer en España. Los objetivos secundarios fueron describir las características de los pacientes oncológicos con disnea irruptiva y los atributos de esta alteración.
MÉTODOS
Pacientes oncológicos mayores de 18 años, con disnea irruptiva y estado funcional Karnofsky mayor o igual a 30, atendidos en servicios de oncología. Se recogió el historial de tratamientos para la disnea irruptiva y las características de esta patología, variables antropométricas, índice de disnea de Mahler, escala de Borg, escala Edmonton Symptoms Assessment Scale, satisfacción del paciente con el tratamiento actual de la disnea irruptiva.
RESULTADOS
La edad media de los 149 pacientes incluidos fue de 66 años (intervalo de confianza 95%: 64,3 a 67,9), siendo mujeres el 35,6% (53). La intensidad media de la disnea irruptiva fue de 5,85 (intervalo de confianza 95%: 5,48 a 6,22 Borg). El 55,1% de los tratamientos de primera opción fueron los opioides, seguidos del oxígeno (17,3%). El 79,9% de los pacientes (119) fueron tratados en monoterapia. En los casos que presentaban disnea basal se administró oxígeno en mayor proporción 21,1% versus 7,4% (p = 0,07). Si la disnea era predecible se administró en mayor proporción opioides, 70,9% versus 44,4% (p = 0,01).
CONCLUSIONES
Los opioides constituyen el tratamiento de primera línea de la disnea irruptiva en la práctica clínica habitual; sin embargo, el grado de evidencia científica que justifique su uso es escasa. Se necesita más información procedente de ensayos clínicos controlados en los que se evalúe la eficacia comparativa de diferentes tratamientos.
La disnea es uno de los síntomas más comunes y que más afecta a los pacientes con enfermedades avanzadas. Es un síntoma desagradable, que genera alto impacto tanto en los pacientes como en sus familiares y en los propios equipos asistenciales. Está presente en la evolución de numerosas enfermedades, su prevalencia aumenta asociada a la progresión de las enfermedades y al deterioro físico de los pacientes que la sufren.
La disnea se puede presentar de manera continua y progresiva o en forma de crisis. No existe una definición consensuada de estas crisis, también llamadas disnea irruptiva, por su similitud con los episodios de dolor irruptivo. Por lo tanto, su prevalencia es difícil de establecer debido a esta falta de definición, aunque se estima que afecta entre 81 y 85% de pacientes con cáncer [1],[2].
Según los datos aportados por Simon y colaboradores en su revisión de 2013 [3], podemos definir la disnea irruptiva como un episodio de dificultad respiratoria aguda que aparece de forma brusca en un paciente con o sin dificultad respiratoria de base, auto-limitada en el tiempo y con una duración inferior a 10 minutos en la mayoría de los casos. Su intensidad es superior o igual a seis puntos en la escala de Borg (disnea muy severa). Suele presentarse diariamente (de uno a cinco episodios diarios). La disnea irruptiva puede asociase a sensaciones prodrómicas, físicas o emociones, que ponen en alerta al paciente; y se acompaña de otros síntomas como dolor, tos y fatiga. En algunos casos existen factores desencadenantes como el esfuerzo, pero en otros el paciente es incapaz de determinar ningún factor [3].
La disnea irruptiva tiene graves implicaciones en la vida del paciente tanto a nivel físico como psico-social, que condicionan de manera muy importante su calidad de vida [4],[5],[6],[7]. Además, afecta negativamente la calidad de vida de los cuidadores [1],[2],[3],[4],[8],[9],[10]. Habitualmente, el tratamiento de la disnea irruptiva está basado en la experiencia del equipo asistencial, la etiopatogenia del proceso subyacente, la enfermedad de base, las características del paciente, su ubicación, pronóstico y de los medios disponibles. Ninguna de las estrategias utilizadas, farmacológicas o no farmacológicas, han demostrado suficiente evidencia científica de calidad para ser incluidas como recomendaciones en las guías de práctica clínica [11].
Hasta la fecha, no se ha realizado ningún estudio que profundice en las características de la disnea irruptiva y de los tratamientos usados en nuestro medio. Por ello, el objetivo principal de este estudio fue analizar qué tratamientos se utilizan en la práctica clínica para el manejo de la disnea irruptiva en los pacientes con cáncer. Los objetivos secundarios fueron describir las características de los pacientes con cáncer con disnea irruptiva y las del síntoma.
Diseño del estudio y normas éticas
Se diseñó un estudio observacional transversal. Los pacientes se incluyeron entre los meses de mayo de 2015 y marzo de 2016. Todos los procedimientos siguieron los principios éticos del comité ético de referencia (de cada centro y nacional), la Declaración de Helsinki de 1964 y su revisión de 2013. Todos los pacientes recibieron información sobre el estudio y aceptaron participar mediante la firma del formulario de consentimiento.
Participaron especialistas de 23 servicios de oncología de 16 provincias españolas. Los investigadores completaron el cuaderno de recogida de datos diseñado específicamente para el estudio.
Criterios de selección
La selección de los pacientes se realizó de forma aleatoria consecutiva, seleccionando los 10 primeros casos ambulatorios que acudían a la consulta que cumplían los criterios de inclusión. La fuente de los datos fue la historia clínica y los datos recogidos en la visita de selección.
Se incluyeron pacientes de cualquier raza y género, mayores de 18 años, con diagnóstico de disnea irruptiva y patología basal oncológica. Se excluyó a aquellos pacientes con afectación cognitiva o gravemente afectados por su enfermedad de base, con índice funcional Karnofsky menor de 30 o no colaboradores.
Se definió la disnea irruptiva como episodios de dificultad respiratoria aguda, que aparecen de forma brusca en un paciente con o sin dificultad respiratoria como síntoma de base, autolimitada en el tiempo, con una duración inferior a 10 minutos, con intensidad superior o igual a seis puntos en la escala de Borg (disnea muy severa).
Variables sociodemográficas y clínicas
Se registró la fecha de nacimiento, género, peso, talla, grado de hidratación (mala, media, buena) en el momento de la consulta y nivel socioeconómico (bajo: ingresos inferiores a 15 000 euros al año; medio: entre 15 000 y 25 000 euros al año; alto: más de 25 000 euros al año). Se valoró el estado funcional del paciente mediante el índice Karnofsky graduado de cero a 100% [12]. Se recogió información sobre los antecedentes clínicos del paciente y sobre la intensidad de la disnea basal mediante el índice de disnea basal de Mahler. Este índice es una escala multidimensional indirecta, que contiene tres subescalas que miden tres componentes de la disnea: magnitud de la tarea, incapacidad funcional y magnitud del esfuerzo. Cada uno de los apartados se puntúa en cinco grados, del cero (intensa) al cuatro (nula) y la suma total obtiene una puntuación que oscila entre cero y 12. Cuanto más baja es la puntuación, mayor es la intensidad de la disnea [13]. Si el paciente presentaba disnea basal se registró la fecha de inicio de la disnea. Se registró la saturación de oxígeno en el momento de la consulta mediante pulsioximetría (porcentaje de saturación).
Se recogió información sobre las características principales de la disnea irruptiva: primer episodio o paciente en seguimiento; fecha del primer episodio de disnea irruptiva; número de episodios al día o a la semana; modo de comienzo (gradual o brusco); duración total del episodio; si algún evento aumentaba la disnea (movimiento, tos, ingestión, defecación, otro); si aparecía de noche, de día o sin relación; si era impredecible o predecible.
Valoración clínica
Se pidió a los pacientes que informaran sobre la intensidad media de la disnea irruptiva cuando ésta aparecía, puntuando la intensidad en la escala de Borg. Dicho instrumento es una escala analógica visual unidimensional, que se gradúa de cero a 10 puntos y presenta descriptores asociados a varias de las categorías [14]. Los pacientes anotaron también la intensidad de la disnea en el momento de la visita, mediante una escala visual analógica, de 10 centímetros, en la que el valor cero se correspondía con la ausencia de dificultad para respirar y el valor 10 con la máxima dificultad para respirar.
Se utilizó la escala ESAS (Edmonton Symptoms Assessment Scale) para evaluar otros síntomas asociados en la última semana: dolor, cansancio, náusea, depresión, ansiedad, somnolencia, anorexia, malestar, disnea en reposo e insomnio [15].
Tratamiento
Los pacientes seleccionados recibieron tratamiento y/o cuidado médico para su situación clínica, de acuerdo con el criterio clínico del especialista. Se recogió información sobre la historia de tratamientos consecutivos no farmacológicos y farmacológicos que hubieran sido administrados al paciente para la disnea irruptiva desde el momento en el que apareció por primera vez, y las medicaciones que recibía el paciente para otras indicaciones en el momento de la consulta. Los pacientes puntuaron su grado de satisfacción con el tratamiento que estaba recibiendo en ese momento para la disnea irruptiva, sobre una escala visual analógica de 10 puntos, donde el valor cero correspondía a “nada satisfecho”, y el valor 10 a “completamente satisfecho”. Se consideró que el paciente estaba satisfecho con el tratamiento si la puntuación era mayor o igual a cinco puntos.
Análisis estadístico
No se realizó un cálculo formal del tamaño de la muestra en este estudio.
Se completó un análisis descriptivo de las variables incluidas en el estudio mediante distribución de frecuencias para las variables cualitativas, cálculo de porcentajes para las variables cualitativas, y cálculo de media, desviación típica, mínimo y máximo, para las variables cuantitativas. Las comparaciones entre las variables cualitativas se realizaron mediante la prueba de Fisher o la de Chi-cuadrado (tratamiento con opioides en función de tratamiento previo con opioides o no, tratamiento con opioides en función de si la disnea fue o no predecible). Se aplicó la prueba de la t de Student para las comparaciones de grupos independientes en las variables cuantitativas (edad por sexo, índice de masa corporal por sexo, índice Mahler por sexo, escala Borg por sexo, intensidad de la disnea basal por sexo). Cuando se evaluaron las diferencias en variables cuantitativas entre grupos con más de dos categorías, se realizó el análisis de la varianza factorial aplicando las correcciones de Bonferroni o de Games Howell en función de la homogeneidad de las varianzas, para el control del error por comparaciones múltiples. Este análisis se aplicó en la comparación del número de episodios diarios de disnea irruptiva en relación con el tratamiento en monoterapia elegido como primera opción, y en la satisfacción del paciente con el tratamiento actual para esta enfermedad.
El nivel de significación se estableció en 0,05. Se utilizó para el análisis el programa estadístico SPSS 24.0.
Se incluyeron 154 pacientes en el estudio, siendo válidos para el análisis 149 pacientes. Todos los pacientes firmaron el consentimiento para participar en el estudio. Se excluyeron del análisis cinco pacientes que no cumplían el criterio de estado funcional Karnofsky. Cada centro incluyó una media de ocho pacientes (intervalo de confianza 95%: 5 a 11).
Datos demográficos y antecedentes médicos
El 64,4% eran hombres (96) y 35,6% mujeres (53) con una edad media de 66 años (intervalo de confianza 95%: 64,3 a 67,9), sin diferencias entre géneros (p = 0,356). En 71,8% (94) el nivel socioeconómico era medio, seguido de nivel bajo en 15,3% (20) y alto en 13% (17).
No se observaron diferencias en el índice de masa corporal entre hombres y mujeres, que fue de 25,5 kilógramos por metro cuadrado (intervalo de confianza 95%: 25 a 26,6) con mediana de 25,1 kilógramos por metro cuadrado. No se pudo determinar el índice de masa corporal en 13 pacientes (8,7%). El 10,5% (16 casos) presentaron caquexia [16] con índice de masa corporal menor de 20 kilógramos por metro cuadrado. El 44,1% (67) tenían índice de masa corporal menor de 25 y mayor o igual a 20 kilógramos por metro cuadrado, el 27% (41) evidenció sobrepeso con índice de masa corporal entre 25 y 30 kilógramos por metro cuadrado, y 18,4% (28) obesidad con índice de masa corporal mayor de 30 kilógramos por metro cuadrado.
En 64,3% de los pacientes (92), se observó una buena hidratación, en 35% la hidratación era media y en 0,7% (un caso) se observó una mala hidratación. La frecuencia de enfermedades concomitantes fue: respiratorias 76 pacientes (51%), cardiovascular 55 (36,9%), gastrointestinal 17 (11,4%), genitourinaria 16 (10,7%), musculoesquelética 22 (14,8%), neurológica ocho (5,4%), endocrina 30 (20,1%), hematológica siete (4,7%), dermatológica tres (2%), psiquiátrica 10 (6,7%), cirugía previa 52 (34,9%) y alergia 22 (14,8%).
El cáncer se localizaba en el pulmón en 71,6% de los pacientes (106), digestivo en 7,4% (11 casos), mama en 6,1% (9 casos) próstata en 2,7% (4 casos) y en otras localizaciones en 12,2% (18 casos). El 89,3% de los pacientes (133) presentó metástasis en el momento de la exploración.
La proporción de pacientes en cada índice Karnofsky fue de: 30, 2%; 40, 10,7%; 50, 15,4%; 60, 20,1%; 70, 27,5%; 80, 18,1%; 90, 5,4%; 100, 0,7%.
El 47,5% de los pacientes (67) experimentó dolor irruptivo asociado. El índice de disnea basal de Mahler medio de los pacientes incluidos en el estudio fue de 5,1 puntos (intervalo de confianza 95%: 4,6 a 5,5), con mediana de cinco puntos, mínimo de cero y máximo de 12. Resultó 1,03 puntos peor en las mujeres (intervalo de confianza 95%: 0,17 a 1,89), p = 0,019. El tiempo desde el diagnóstico de la disnea basal fue de 0,7 años (intervalo de confianza 95%: 0,4 a 0,9), con mediana de 0,2 años. El 75,2% (112) de los pacientes recibían tratamiento para la disnea basal. La saturación de oxígeno fue de 92,74% (intervalo de confianza 95%: 92,04 a 93,44), con mediana de 94%.
Características de la disnea irruptiva y otros síntomas
El 40,7% de los pacientes (57 casos), presentó su primer episodio de disnea irruptiva. En la Tabla 1 se resumen las características de la disnea irruptiva. No se observaron diferencias en la intensidad de la disnea entre hombres y mujeres (p = 0,594). Los eventos que provocaron la aparición de la disnea fueron el movimiento (113 casos) y la tos (57 casos), en 21 casos se manifestaron ambos eventos.
Tabla 1. Características de la disnea irruptiva
Evaluación de los síntomas
La intensidad de la disnea basal el día de la visita de inclusión fue de 3,46 puntos (intervalo de confianza 95%: 3,06 a 3,86), con mediana de tres puntos, sin diferencias entre géneros (p = 0,566). Se muestra en la Tabla 2 las puntuaciones medias de la escala Edmonton Symptoms Assessment Scale
Tratamientos para la disnea irruptiva
La proporción de cada tipo de tratamiento administrado para la disnea irruptiva en primera opción se muestran en la Figura 1. En la Tabla 3 se muestran los principios activos e intervenciones que se administraron en los pacientes en primera opción de tratamiento. Los tratamientos se administraron en monoterapia como primera opción en 79,9% de los pacientes (119), en 12,8% (19) se administraron dos fármacos o intervenciones, en 4% (seis pacientes) tres fármacos o intervenciones y en 3,4% (cinco pacientes) se administraron más de tres fármacos o intervenciones. El grupo de fármacos que se administró en primera opción en monoterapia con más frecuencia fueron los opioides (64,7%, 75 pacientes), seguido de oxígeno (19%, 22 pacientes), otro tipo de tratamientos o intervenciones (10,3%, 12 pacientes), corticosteroides en 3,4% (cuatro pacientes), benzodiacepina en el 1,7% (dos pacientes). El tratamiento de primera opción se modificó o se interrumpió por falta de eficacia en 26 pacientes (17,5%), y por toxicidad en cuatro pacientes (2,7%).
Los pacientes tratados fueron 72 (48,3%) con una primera opción de tratamiento, 77 pacientes (51,7%) necesitaron una segunda opción de tratamiento, una tercera opción de tratamiento 37 pacientes (24,8%), 14 una cuarta opción (9,4%), ocho en quinta opción (5,4%) y dos pacientes en sexta opción (1,3%).
Se analizaron los fármacos de segunda opción cuando los opioides fueron el primer tratamiento. En 64,9% de los casos la segunda opción de tratamiento fue incrementar la dosis del opioide utilizado; en 13,5% se usaron benzodiacepinas; en 8,1% corticosteroides, en 5,4% oxígeno, otros tratamientos en 5,4% e intervenciones no farmacológicas en 2,7%.
Se observó que la administración de oxígeno se asoció a la presencia de disnea basal (p = 0,007), 21,1% versus 7,4% en el caso de pacientes que no presentaban disnea basal. El uso de opioides para la disnea irruptiva se vinculó al tratamiento previo con opioides de la disnea basal (p = 0,044) 68,5% versus 50%. El uso de opioides también se vio asociado a los casos de disnea irruptiva predecible (p = 0,01) 70,9% versus 44,4%.
No se observaron diferencias estadísticamente significativas entre el número de episodios diarios de disnea irruptiva y el tipo de tratamiento administrado en primera opción en monoterapia (Figura 2).
Figura 2. Número medio de episodios de disnea irruptiva en pacientes tratados con monoterapia.
Satisfacción del paciente con el tratamiento
El 60,8% de los pacientes (87) estaba satisfecho con el tratamiento que estaba recibiendo en la actualidad para la disnea irruptiva. La puntuación media de la escala visual analógica de satisfacción fue de 6,02 puntos (intervalo de confianza 95%: 5,6 a 6,5), con mediana de seis puntos, sin diferencias entre géneros (p = 0,285), ni entre los tipos de tratamiento para la disnea irruptiva (Figura 3).
La American Thoracic Society define la disnea como “la experiencia subjetiva de malestar ocasionado por la respiración que engloba sensaciones cualitativas distintas que varían en intensidad. Esta experiencia se origina a partir de interacciones entre factores fisiológicos, psicológicos, sociales y ambientales múltiples, que pueden a su vez inducir respuestas fisiológicas y comportamientos secundarios” [17]. Aunque se trata de una definición globalmente aceptada, no distingue entre diferentes formas de disnea, como la disnea continua o la disnea episódica o irruptiva. Se han utilizado diferentes denominaciones para la disnea irruptiva: episódica, crisis o ataques, aguda, incidente e intermitente. En los pacientes con enfermedad pulmonar obstructiva crónica, se suele referir como exacerbación aguda de la enfermedad [1],[2],[4],[5],[6],[8],[9],[18],[19],[20].
A pesar los avances en el manejo de la disnea, ésta sigue siendo difícil de tratar con éxito [10],[21],[22]. La etiología de la disnea irruptiva puede estar relacionada con las causas de la disnea de base. Sin embargo, puede presentarse en los pacientes sin una disnea de base y sin unas causas etiológicas conocidas [3]. La disnea es un síntoma difícil de controlar independientemente de su etiología de base. El control de la disnea irruptiva es aún más complejo por las dificultades en su valoración y por su estrecha relación con factores emocionales y físicos que aumentan su impacto en el paciente [17]. La disnea irruptiva tiene unas características especiales que condicionan la elección del tratamiento, como son su rápida aparición, su corta duración y la repetición de los episodios en un mismo día.
Las evidencias científicas sobre la eficacia de los diferentes tratamientos no resultan concluyentes [11]. Los opioides se recomiendan como primera opción de tratamiento por estar respaldados por numerosos estudios y experiencia clínica. No obstante, solo hay evidencias suficientes con morfina, diamorfina y dihidrocodeína. No existen estudios comparativos entre ellos y la dosis de inicio para la titulación en la disnea irruptiva todavía no ha sido establecida. Fentanilo podría ser una opción interesante debido a su rápido inicio de acción también en el tratamiento de la disnea, que se adapta a la forma aguda en la que la disnea irruptiva aparece. Sin embargo, se precisan estudios comparativos frente a otros opioides, ya que los datos existentes hasta la fecha con fentanilo subcutáneo y fentanilo intranasal con base de pectina son positivos, aunque comparados con placebo [23],[24].
Las benzodiacepinas se recomiendan en segunda opción debido a que no son eficaces en la reducción de la gravedad de la disnea irruptiva, pero sí son importantes como medicaciones adyuvantes para aliviar la ansiedad o el pánico. Por este motivo se recomienda su asociación a los opioides, ya que es una opción eficaz demostrada en pacientes oncológicos con disnea [8]. Los corticosteroides solo se recomiendan cuando la causa de la disnea es una enfermedad respiratoria obstructiva o en la disnea producida por linfangitis carcinomatosa. No está demostrada la eficacia del oxígeno en pacientes no hipóxicos [11],[25].
En el estudio se observó que el tratamiento de primera opción fueron los opioides, seguidos del oxígeno (17,3%). La mayoría (79,9%) de los pacientes fue tratada con monoterapia. Si presentaban disnea basal se les administró oxígeno en mayor proporción que en aquellos sin disnea basal (21,1% versus 7,4%; p = 0,07). Si la disnea era predecible se administró opioides en mayor proporción a la indicada cuando la disnea no era predecible (70,9% versus 44,4%; p = 0,01). Algunos tratamientos para el tratamiento de la disnea irruptiva, como los inmunomoduladores y la toracocentesis, realmente fueron tratamientos de la disnea de base. Se observó que la primera opción de tratamiento para la disnea irruptiva más utilizada en la práctica clínica en España fue la monoterapia con opioides.
El hecho de que el tratamiento de elección fueron los opioides y a que la disnea irruptiva está muy acotada en el tiempo (normalmente dura menos de 10 minutos), sugiere que las vías de administración de opioides alternativas a la intravenosa y/o subcutánea y de rápido inicio de acción son considerados una opción muy atractiva para el manejo ambulatorio de la disnea irruptiva. El estudio que hemos realizado supone una aproximación global al manejo del paciente con disnea irruptiva en España. La muestra seleccionada fue muy heterogénea, ya que los pacientes estaban en diferentes estadios de la enfermedad oncológica y diferentes fases de tratamiento. No se recogió información sobre la etiología de la disnea basal o episódica. Por lo tanto, no se pudo valorar si la administración y la respuesta a los tratamientos podían también ser diferentes.
A pesar del extenso uso de los opioides en la práctica clínica, la evidencia científica que justifica su utilización en la disnea irruptiva es limitada. Se precisa más información procedente de ensayos clínicos controlados, en los que se compare la eficacia de diferentes opciones de tratamiento para justificar su uso en la práctica clínica.
Roles y contribuciones de autoría
LCG: conceptualización, metodología, análisis formal, investigación, gestión de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones), presentación de datos, supervisión, administración del proyecto. IDM: metodología, investigación, gestión de datos, presentación de datos. MNV: investigación, gestión de datos, presentación de datos. AJJ: conceptualización, validación, investigación, recursos, gestión de datos, presentación de datos, administración del proyecto, obtención del financiamiento. ACA: conceptualización, software, validación, recursos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones), presentación de datos, administración del proyecto, obtención del financiamiento. BSL: conceptualización, metodología, software, validación, recursos, preparación del manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones), presentación de datos, supervisión, administración del proyecto.
Declaración de financiamiento
El presente estudio fue patrocinado por Kyowa Kirin Farmacéutica S. L. U., Madrid, España. El patrocinador no participó en el diseño del estudio, ni en la recolección, ni en el análisis de los datos. La decisión de publicar este trabajo fue iniciativa exclusiva de los autores. Asimismo, no hubo influencia en la preparación, revisión o aprobación del manuscrito.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE. Antonio Jiménez y Ana Cabezón declaran pertenecer al Departamento Médico de Kyowa Kirin Farmacéutica S.L.U. El resto de los autores declaran no haber recibido financiamiento para la realización del artículo; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Declaración de aspectos éticos
El Comité Ético de Investigación Clínica del Hospital Universitario Puerta de Hierro Majadahonda ha aprobado el protocolo ARC-DIO-2015-01, en su versión 3.3 de febrero del 2015 en su reunión del 09/A3ll5 (Acta No. 308).

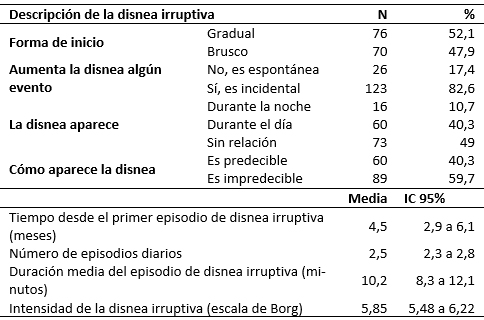 Tabla 1. Características de la disnea irruptiva
Tabla 1. Características de la disnea irruptiva

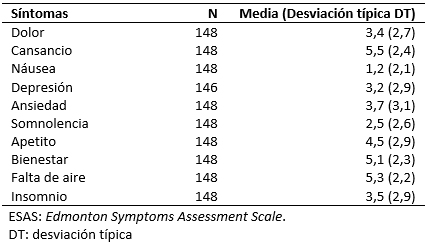 La intensidad de la disnea basal el día de la visita de inclusión fue de 3,46 puntos (intervalo de confianza 95%: 3,06 a 3,86), con mediana de tres puntos, sin diferencias entre géneros (p = 0,566). Se muestra en la Tabla 2 las puntuaciones medias de
La intensidad de la disnea basal el día de la visita de inclusión fue de 3,46 puntos (intervalo de confianza 95%: 3,06 a 3,86), con mediana de tres puntos, sin diferencias entre géneros (p = 0,566). Se muestra en la Tabla 2 las puntuaciones medias de

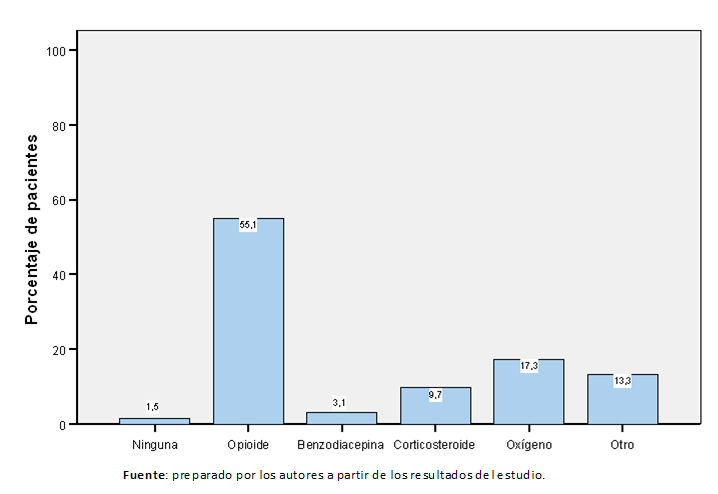

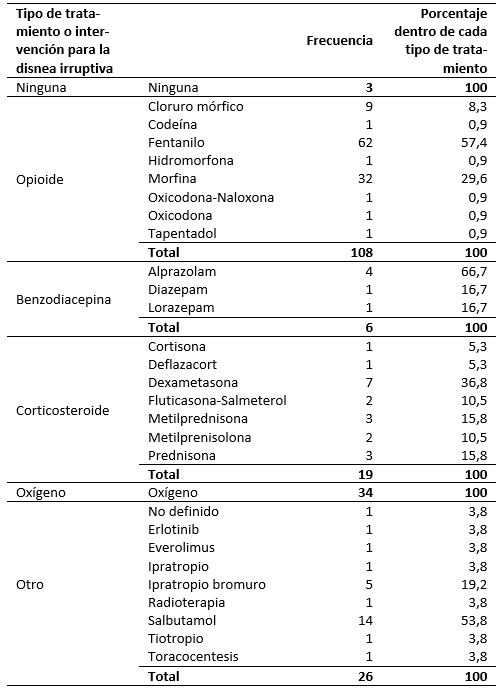 Tabla 3. Principios activos e intervenciones administrados en primera opción para el tratamiento de la disnea irruptiva.
Tabla 3. Principios activos e intervenciones administrados en primera opción para el tratamiento de la disnea irruptiva.

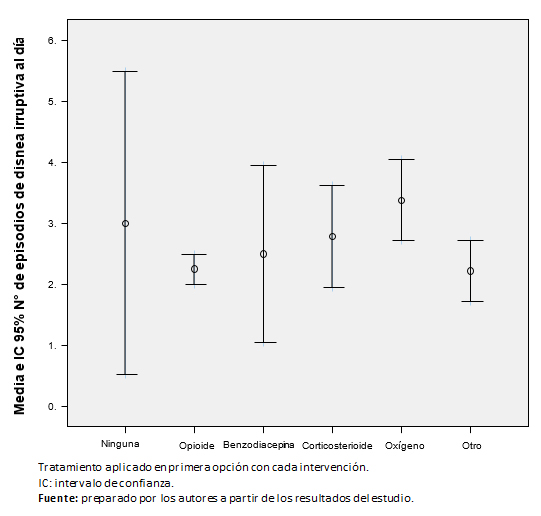 Figura 2. Número medio de episodios de disnea irruptiva en pacientes tratados con monoterapia.
Figura 2. Número medio de episodios de disnea irruptiva en pacientes tratados con monoterapia.

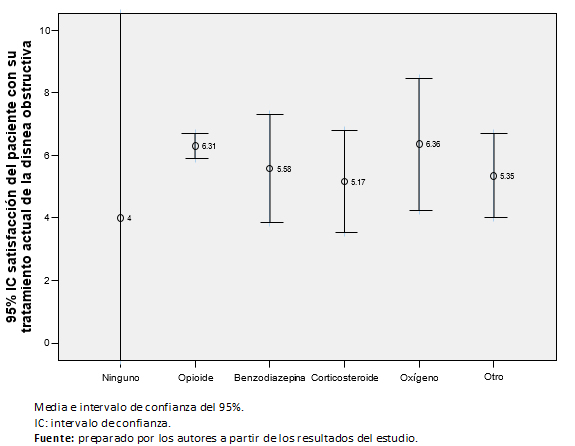 Figura 3. Satisfacción del paciente con tratamiento actual de disnea irrup-tiva, evaluado con escala visual analógica.
Figura 3. Satisfacción del paciente con tratamiento actual de disnea irrup-tiva, evaluado con escala visual analógica.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Although breakthrough dyspnea is very frequent in cancer patients, there are no precise recommendations for treating it. The main objective of this study was to analyze what treatments are used in clinical practice for the management of breakthrough dyspnea in cancer patients in Spain and the secondary objectives were to describe the characteristics of cancer patients with breakthrough dyspnea and the attributes of the disorder.
METHODS
Cancer patients over 18 years of age, with breakthrough dyspnea and a Karnofsky performance score of ≥30, who were treated at departments of oncology in institutes across Spain were included in this cross-sectional observational study. The characteristics of breakthrough dyspnea, history of treatment, anthropometric variables, Mahler dyspnea index, Borg scale, Edmonton Symptoms Assessment Scale, and patient satisfaction with current breakthrough dyspnea treatment were assessed.
RESULTS
The mean age of the 149 included patients was 66 years (95% confidence interval: 64.3 to 67.9), and 53 were females (35.6%). The mean breakthrough dyspnea intensity was 5.85 (95% confidence interval 5.48 to 6.22, Borg scale). A total of 55.1% of the first-choice treatments consisted of opioids, followed by oxygen (17.3%). A total of 119 patients (79.9%) received monotherapy for breakthrough dyspnea. Patients presenting with basal dyspnea received oxygen in a greater proportion of cases (21.1% vs 7.4%; p = 0.07). Patients with predictable dyspnea received a greater proportion of opioids (70.9% vs 44.4%; p = 0.01).
CONCLUSIONS
Opioids constitute first-line therapy for breakthrough dyspnea in routine clinical practice, though the scientific evidence supporting their use is scarce. Further information derived from controlled clinical trials is needed regarding the comparative efficacy of the different treatments in order to justify their use.
 Autores:
Luis Cabezón-Gutiérrez[1], Ignacio Delgado-Mingorance[2], María Nabal-Vicuña[3], Antonio Javier Jiménez-López[4], Ana Cabezón-Álvarez[4], Begoña Soler-López[5]
Autores:
Luis Cabezón-Gutiérrez[1], Ignacio Delgado-Mingorance[2], María Nabal-Vicuña[3], Antonio Javier Jiménez-López[4], Ana Cabezón-Álvarez[4], Begoña Soler-López[5]

Citación: Cabezón-Gutiérrez L, Delgado-Mingorance I, Nabal-Vicuña M, Jiménez-López AJ, Cabezón-Álvarez A, Soler-López B. Observational study to analyze patterns of treatment of breakthrough dyspnea in cancer patients in clinical practice. Medwave 2017 May-Jun;18(3):e7211 doi: 10.5867/medwave.2018.03.7211
Fecha de envío: 7/2/2018
Fecha de aceptación: 3/5/2018
Fecha de publicación: 12/6/2018
Origen: no solicitado
Tipo de revisión: con revisión por cuatro pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Reddy SK, Parsons HA, Elsayem A, Palmer JL, Bruera E. Characteristics and correlates of dyspnea in patients with advanced cancer. J Palliat Med. 2009 Jan;12(1):29-36. | CrossRef | PubMed |
Reddy SK, Parsons HA, Elsayem A, Palmer JL, Bruera E. Characteristics and correlates of dyspnea in patients with advanced cancer. J Palliat Med. 2009 Jan;12(1):29-36. | CrossRef | PubMed | O'Driscoll M, Corner J, Bailey C. The experience of breathlessness in lung cancer. Eur J Cancer Care (Engl). 1999 Mar;8(1):37-43. | PubMed |
O'Driscoll M, Corner J, Bailey C. The experience of breathlessness in lung cancer. Eur J Cancer Care (Engl). 1999 Mar;8(1):37-43. | PubMed | Simon ST, Bausewein C, Schildmann E, Higginson IJ, Magnussen H, Scheve C, et al. Episodic breathlessness in patients with advanced disease: a systematic review. J Pain Symptom Manage. 2013 Mar;45(3):561-78. | CrossRef | PubMed |
Simon ST, Bausewein C, Schildmann E, Higginson IJ, Magnussen H, Scheve C, et al. Episodic breathlessness in patients with advanced disease: a systematic review. J Pain Symptom Manage. 2013 Mar;45(3):561-78. | CrossRef | PubMed | Booth S, Silvester S, Todd C. Breathlessness in cancer and chronic obstructive pulmonary disease: using a qualitative approach to describe the experience of patients and carers. Palliat Support Care. 2003 Dec;1(4):337-44. | PubMed |
Booth S, Silvester S, Todd C. Breathlessness in cancer and chronic obstructive pulmonary disease: using a qualitative approach to describe the experience of patients and carers. Palliat Support Care. 2003 Dec;1(4):337-44. | PubMed | Lai YL, Chan CW, Lopez V. Perceptions of dyspnea and helpful interventions during the advanced stage of lung cancer: Chinese patients' perspectives. Cancer Nurs. 2007 Mar-Apr;30(2):E1-8. | PubMed |
Lai YL, Chan CW, Lopez V. Perceptions of dyspnea and helpful interventions during the advanced stage of lung cancer: Chinese patients' perspectives. Cancer Nurs. 2007 Mar-Apr;30(2):E1-8. | PubMed | Henoch I, Bergman B, Danielson E. Dyspnea experience and management strategies in patients with lung cancer. Psychooncology. 2008 Jul;17(7):709-15. | PubMed |
Henoch I, Bergman B, Danielson E. Dyspnea experience and management strategies in patients with lung cancer. Psychooncology. 2008 Jul;17(7):709-15. | PubMed | Ek K, Ternestedt BM. Living with chronic obstructive pulmonary disease at the end of life: a phenomenological study. J Adv Nurs. 2008 May;62(4):470-8. | CrossRef | PubMed |
Ek K, Ternestedt BM. Living with chronic obstructive pulmonary disease at the end of life: a phenomenological study. J Adv Nurs. 2008 May;62(4):470-8. | CrossRef | PubMed | Navigante AH, Cerchietti LC, Castro MA, Lutteral MA, Cabalar ME. Midazolam as adjunct therapy to morphine in the alleviation of severe dyspnea perception in patients with advanced cancer. J Pain Symptom Manage. 2006 Jan;31(1):38-47. | PubMed |
Navigante AH, Cerchietti LC, Castro MA, Lutteral MA, Cabalar ME. Midazolam as adjunct therapy to morphine in the alleviation of severe dyspnea perception in patients with advanced cancer. J Pain Symptom Manage. 2006 Jan;31(1):38-47. | PubMed | Bailey PH. The dyspnea-anxiety-dyspnea cycle--COPD patients' stories of breathlessness: "It's scary /when you can't breathe". Qual Health Res. 2004 Jul;14(6):760-78. | PubMed |
Bailey PH. The dyspnea-anxiety-dyspnea cycle--COPD patients' stories of breathlessness: "It's scary /when you can't breathe". Qual Health Res. 2004 Jul;14(6):760-78. | PubMed | Booth S, Moosavi SH, Higginson IJ. The etiology and management of intractable breathlessness in patients with advanced cancer: a systematic review of pharmacological therapy. Nat Clin Pract Oncol. 2008 Feb;5(2):90-100. | CrossRef | PubMed |
Booth S, Moosavi SH, Higginson IJ. The etiology and management of intractable breathlessness in patients with advanced cancer: a systematic review of pharmacological therapy. Nat Clin Pract Oncol. 2008 Feb;5(2):90-100. | CrossRef | PubMed | Simon ST, Köskeroglu P, Bausewein C. [Pharmacological therapy of refractory dyspnoea : a systematic literature review]. Schmerz. 2012 Sep;26(5):515-22. | CrossRef | PubMed |
Simon ST, Köskeroglu P, Bausewein C. [Pharmacological therapy of refractory dyspnoea : a systematic literature review]. Schmerz. 2012 Sep;26(5):515-22. | CrossRef | PubMed | Schag CC, Heinrich RL, Ganz PA. Karnofsky performance status revisited: reliability, validity, and guidelines. J Clin Oncol. 1984 Mar;2(3):187-93. | PubMed |
Schag CC, Heinrich RL, Ganz PA. Karnofsky performance status revisited: reliability, validity, and guidelines. J Clin Oncol. 1984 Mar;2(3):187-93. | PubMed | Mahler DA, Weinberg DH, Wells CK, Feinstein AR. The measurement of dyspnea. Contents, interobserver agreement, and physiologic correlates of two new clinical indexes. Chest. 1984 Jun;85(6):751-8. | PubMed |
Mahler DA, Weinberg DH, Wells CK, Feinstein AR. The measurement of dyspnea. Contents, interobserver agreement, and physiologic correlates of two new clinical indexes. Chest. 1984 Jun;85(6):751-8. | PubMed | Noble BJ, Borg GA, Jacobs I, Ceci R, Kaiser P. A category-ratio perceived exertion scale: relationship to blood and muscle lactates and heart rate. Med Sci Sports Exerc. 1983;15(6):523-8. | PubMed |
Noble BJ, Borg GA, Jacobs I, Ceci R, Kaiser P. A category-ratio perceived exertion scale: relationship to blood and muscle lactates and heart rate. Med Sci Sports Exerc. 1983;15(6):523-8. | PubMed | Bruera E, Kuehn N, Miller MJ, Selmser P, Macmillan K. The Edmonton Symptom Assessment System (ESAS): a simple method for the assessment of palliative care patients. J Palliat Care. 1991 Summer;7(2):6-9. | PubMed |
Bruera E, Kuehn N, Miller MJ, Selmser P, Macmillan K. The Edmonton Symptom Assessment System (ESAS): a simple method for the assessment of palliative care patients. J Palliat Care. 1991 Summer;7(2):6-9. | PubMed | Fearon K, Strasser F, Anker SD, Bosaeus I, Bruera E, Fainsinger RL, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011 May;12(5):489-95. | CrossRef | PubMed |
Fearon K, Strasser F, Anker SD, Bosaeus I, Bruera E, Fainsinger RL, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011 May;12(5):489-95. | CrossRef | PubMed | Dyspnea. Mechanisms, assessment, and management: a consensus statement. American Thoracic Society. Am J Respir Crit Care Med. 1999 Jan;159(1):321-40. | PubMed |
Dyspnea. Mechanisms, assessment, and management: a consensus statement. American Thoracic Society. Am J Respir Crit Care Med. 1999 Jan;159(1):321-40. | PubMed | Henoch I, Bergman B, Gustafsson M, Gaston-Johansson F, Danielson E. Dyspnea experience in patients with lung cancer in palliative care. Eur J Oncol Nurs. 2008 Apr;12(2):86-96. | PubMed |
Henoch I, Bergman B, Gustafsson M, Gaston-Johansson F, Danielson E. Dyspnea experience in patients with lung cancer in palliative care. Eur J Oncol Nurs. 2008 Apr;12(2):86-96. | PubMed | Heinzer MM, Bish C, Detwiler R. Acute dyspnea as perceived by patients with chronic obstructive pulmonary disease. Clin Nurs Res. 2003 Feb;12(1):85-101. | PubMed |
Heinzer MM, Bish C, Detwiler R. Acute dyspnea as perceived by patients with chronic obstructive pulmonary disease. Clin Nurs Res. 2003 Feb;12(1):85-101. | PubMed | Navigante AH, Castro MA, Cerchietti LC. Morphine versus midazolam as upfront therapy to control dyspnea perception in cancer patients while its underlying cause is sought or treated. J Pain Symptom Manage. 2010 May;39(5):820-30. | CrossRef | PubMed |
Navigante AH, Castro MA, Cerchietti LC. Morphine versus midazolam as upfront therapy to control dyspnea perception in cancer patients while its underlying cause is sought or treated. J Pain Symptom Manage. 2010 May;39(5):820-30. | CrossRef | PubMed | Abernethy AP, Currow DC, Frith P, Fazekas BS, McHugh A, Bui C. Randomised, double blind, placebo controlled crossover trial of sustained release morphine for the management of refractory dyspnoea. BMJ. 2003 Sep 6;327(7414):523-8. | PubMed |
Abernethy AP, Currow DC, Frith P, Fazekas BS, McHugh A, Bui C. Randomised, double blind, placebo controlled crossover trial of sustained release morphine for the management of refractory dyspnoea. BMJ. 2003 Sep 6;327(7414):523-8. | PubMed | Lacasse Y, Goldstein R, Lasserson TJ, Martin S. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD003793. | PubMed |
Lacasse Y, Goldstein R, Lasserson TJ, Martin S. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD003793. | PubMed | Hui D, Xu A, Frisbee-Hume S, Chisholm G, Morgado M, Reddy S, et al. Effects of prophylactic subcutaneous fentanyl on exercise-induced breakthrough dyspnea in cancer patients: a preliminary double-blind, randomized, controlled trial. J Pain Symptom Manage. 2014 Feb;47(2):209-17. | CrossRef | PubMed |
Hui D, Xu A, Frisbee-Hume S, Chisholm G, Morgado M, Reddy S, et al. Effects of prophylactic subcutaneous fentanyl on exercise-induced breakthrough dyspnea in cancer patients: a preliminary double-blind, randomized, controlled trial. J Pain Symptom Manage. 2014 Feb;47(2):209-17. | CrossRef | PubMed | Hui D, Kilgore K, Park M, Williams J, Liu D, Bruera E. Impact of Prophylactic Fentanyl Pectin Nasal Spray on Exercise-Induced Episodic Dyspnea in Cancer Patients: A Double-Blind, Randomized Controlled Trial. J Pain Symptom Manage. 2016 Oct;52(4):459-468.e1. | CrossRef | PubMed |
Hui D, Kilgore K, Park M, Williams J, Liu D, Bruera E. Impact of Prophylactic Fentanyl Pectin Nasal Spray on Exercise-Induced Episodic Dyspnea in Cancer Patients: A Double-Blind, Randomized Controlled Trial. J Pain Symptom Manage. 2016 Oct;52(4):459-468.e1. | CrossRef | PubMed | Davies AN, Dickman A, Reid C, Stevens AM, Zeppetella G; Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. Eur J Pain. 2009 Apr;13(4):331-8. | CrossRef | PubMed |
Davies AN, Dickman A, Reid C, Stevens AM, Zeppetella G; Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for Palliative Medicine of Great Britain and Ireland. Eur J Pain. 2009 Apr;13(4):331-8. | CrossRef | PubMed |