 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: risk factors, hepatitis C, blood transfusion
INTRODUCCIÓN
La mayor parte de las transfusiones se llevan a cabo en mujeres. La introducción en los bancos de sangre de las técnicas serológicas disminuyó la incidencia de infección por virus de hepatitis C después de una transfusión. En México, las pacientes que se transfundieron antes de 1994 están en riesgo de presentar una infección por virus de hepatitis C. El objetivo de este estudio fue medir la asociación entre el antecedente transfusional antes de 1994 e infección por virus de hepatitis C en mujeres atendidas en la zona metropolitana de Guadalajara, México.
MÉTODOS
Estudio observacional, analítico, de casos y controles, en el que se incluyeron mujeres sanas y mujeres con infección por hepatitis vírica tipo C, en las cuales se determinó el antecedente transfusional antes y después de 1994. El grupo de casos lo conforman 150 mujeres con diagnóstico serológico y confirmatorio de hepatitis C, en tanto el grupo control son 150 mujeres sanas con serología negativa.
RESULTADOS
Se encontró un odds ratio de 9,07 (intervalo de confianza 95% 5,37 – 15,3; p<0,001), una proporción de casos expuestos de 0,72, de controles expuestos de 0,22, una fracción atribuible poblacional de 0,64 (intervalo de confianza 0,53 – 0,73) y una fracción atribuible en expuestos de 0,88 (intervalo de confianza 0,81 – 0,93).
CONCLUSIONES
En las mujeres, el haber tenido una transfusión antes de 1994 en la zona metropolitana de Guadalajara, representa un riesgo 9,07 veces mayor de infección por virus de la hepatitis C que no tener antecedente transfusional en esa fecha.
Aunque la transfusión es un recurso terapéutico, para alivio o reanimación del paciente que la requiere por anemia o hemorragia, no puede efectuarse sin riesgo. En el caso de la hepatitis C, en México antes de 1994 se carecía de pruebas de escrutinio que garantizaran sangre segura. Hoy en día, se cuenta con la tecnología genómica de los ácidos nucleicos, la cual ha favorecido la detección más temprana de los virus. Esta detección temprana por dicha tecnología ha producido reducción del llamado periodo de ventana, durante el cual se genera la viremia que facilita la detección del virus de la hepatitis C [1].
Desde la década de 1970 comenzó a describirse un tipo de hepatitis, muy frecuente en receptores de transfusiones sanguíneas, que no estaba relacionado serológicamente con los virus de hepatitis A ni B, ni con ningún otro virus hepatotropo. Al virus causante de este tipo de hepatitis se le denominó virus de la hepatitis no A no B (HNANB). Este virus ya aparece descrito en trabajos publicados en 1975. Desde entonces se sabía que era el responsable de más del 90% de los casos de hepatitis postransfusional [2].
Se desconoce en la actualidad la incidencia real de hepatitis asociada a transfusión. Lo que se sabe es que es la forma más reconocida de hepatitis C y su frecuencia es de 7 a 10% en los pacientes multitransfundidos [3]. Hoy en día la sangre es extremadamente segura, pero no siempre ha sido así. Los avances en la medicina transfusional en la primera mitad del siglo veinte permitieron incrementar el uso de la sangre y sus derivados. De manera inherente se incrementó la hepatitis asociada a transfusión [4].
Considerando que el virus de la hepatitis C se descubrió en 1989, cuatro años más tarde en México se determinó que los bancos de sangre deben detectar los anticuerpos del virus de la hepatitis C a todos los donadores, a través de la Norma Oficial Mexicana para la disposición de sangre humana y sus componentes con fines terapéuticos (NOM-003-SSA2-1993). No obstante ello, la versión definitiva de la norma se dio a conocer hasta el 18 de julio de 1994 [5].
En un período de 10 años en que se compararon las diferentes técnicas del tamizaje para el virus de la hepatitis C, en el Banco de Sangre Central del Centro Médico de Occidente, perteneciente al Instituto Mexicano del Seguro Social, los hallazgos de seroprevalencia fueron: 1% por ensayo de inmunoadsorción ligado a las enzimas (ELISA), 0,96% por inmunoanálisis enzimático (EIA, micropartículas) y 0,91% por quimioluminiscencia [6].
En un reporte publicado en España [2], se hace una extensa mención del ámbito jurídico sobre la obligatoriedad de la prueba anti virus de la hepatitis C en todos los donadores en ese país. Se destaca que este proceso se inició en octubre de 1990, cuatro años antes que en México y dos años antes que en Hawái, Estados Unidos. En este último lugar el riesgo por transfusión se ubica en 1992, debido a que las pruebas de tamizaje a los donadores se iniciaron en ese año [7].
El riesgo potencial de transmisión de enfermedades por vía transfusional se puede estimar revisando las bases de datos de las donaciones de sangre, los procedimientos de tamizaje realizados y la prevalencia de los marcadores en las poblaciones estudiadas. Estimar estos riesgos es muy útil para monitorear la seguridad de las transfusiones sanguíneas, para proporcionar información que facilite las decisiones médicas para que un paciente reciba una transfusión alogénica o para utilizar otras medidas terapéuticas [8].
Para el virus de la hepatitis C el riesgo por unidad, es esencialmente el mismo para cada tipo de componente sanguíneo transfundido (glóbulos rojos, plaquetas, plasma o crioprecipitados). En América Latina el tamizaje de marcadores en donantes de sangre es fundamental, ya que las donaciones altruistas repetidas son la excepción y no la regla. Además, la mayoría son donantes de primera vez, en los cuales la prevalencia de enfermedades infecciosas es mayor que en los donantes de repetición, los que son estudiados periódicamente [8].
La infección por virus de la hepatitis C se diagnostica con mayor frecuencia entre adultos de 40 a 50 años, representando la causa más común de hepatitis y cirrosis hepática en el mundo [9]. En nuestros días no existe una vacuna que otorgue protección dirigida contra este virus. Por esta razón la comprensión integral, incluidos los factores de riesgo que la caracterizan, es invaluable para el diseño de estrategias de prevención y tratamiento.
Basados en este estudio, conocer el riesgo de transmisión del virus de la hepatitis C por transfusiones antes de 1994 es vital para implementar estrategias de tamizaje que puedan impactar en forma importante la detección de esta enfermedad. Nuestro punto es claro: siempre se debe solicitar una serología para virus de hepatitis C en mujeres que hayan recibido una transfusión antes de 1994, debido a que se detectó un alto riesgo de adquirir dicha infección mediante esas condiciones.
Estudio de tipo casos y controles, cuyo propósito fue medir la asociación entre el antecedente transfusional antes de 1994 y la infección por virus de la hepatitis C en mujeres. Se incluyeron mujeres derechohabientes del Instituto Mexicano del Seguro Social, atendidas en la zona metropolitana de Guadalajara, México.
Las pacientes controles fueron mujeres hospitalizadas en la Unidad Médica de Alta Especialidad, Ginecología y Obstetricia del Centro Médico Nacional de Occidente, con antecedente transfusional y diagnóstico negativo para infección vírica por hepatitis tipo C durante el periodo de enero de 2014 a diciembre de 2014. Se revisó su historial clínico. En caso de no contar con una serología que demostrase negatividad a la infección por virus de la hepatitis C, se solicitó el apoyo del Banco de Sangre Central del Centro Médico Nacional de Occidente para el procesamiento de la muestra sérica.
Los casos fueron mujeres notificadas como casos de infección por el virus de la hepatitis C, mediante el envío de sus estudios epidemiológicos a la Coordinación de Información y Análisis Estratégico del Centro Médico Nacional de Occidente desde el periodo de enero de 2007 hasta diciembre de 2014.
Tanto las mujeres casos como las mujeres controles corresponden a pacientes derechohabientes del Instituto Mexicano del Seguro Social. Las pacientes controles tienen las mismas características de las pacientes casos (mujeres transfundidas y atendidas en los hospitales de segundo nivel de la zona metropolitana de Guadalajara), sólo que no presentaron la infección por virus de la hepatitis C, lo que corresponde a nuestra variable independiente. Las pacientes casos también son mujeres transfundidas y atendidas en los hospitales de segundo nivel de la zona metropolitana de Guadalajara, pero presentaron el diagnóstico positivo para infección por el virus de la hepatitis C. En ambos grupos se buscó el antecedente transfusional anterior a 1994. Esta fue nuestra variable dependiente.
Tanto la confirmación de la infección por el virus de la hepatitis C en las pacientes casos como el descarte de la infección en las pacientes controles, se realizó mediante anticuerpos positivos y confirmación diagnóstica (o descarte en su caso) del Banco de Sangre del Centro Médico Nacional de Occidente. La confirmación diagnóstica se efectuó mediante el análisis de amplificación de ácidos nucleicos (tecnología genómica de los ácidos nucleicos de escrutinio y alternativo positivo –COBAS Amplicor HCV, Versión 2.0-, con límite inferior: ácido ribonucleico 50 unidades internacionales por mililitro en plasma y 60 unidades internacionales por mililitro en suero) con la positividad coordenada de dos celdas (“pools”).
Estamos conscientes de que los estudios de casos y controles tienen de forma inherente un riesgo alto de sesgos. Los que se tuvieron en cuenta fueron factores de riesgo asociados, como uso de drogas intravenosas, promiscuidad sexual, tatuajes o uso de hemodiálisis. Por este motivo, se intentó controlarlos no ingresando al estudio mujeres que presentaran estos riesgos.
Para el tamaño muestral se calcularon 150 casos y 150 controles, para determinar como significativa la asociación de hepatitis C en mujeres con antecedentes de transfusión (considerando un Odds ratio de 2 o más). Cuando la exposición (antecedente de transfusión antes de 1994) en las mujeres controles fuera del 50% o más (nivel de confianza del 95% y poder del 80%), se aplicó la metodología utilizada por Contreras y colaboradores en 2011 para asegurar un tamaño de muestra confiable en estudios donde los procedimientos quirúrgicos representen un factor de riesgo [10].El software utilizado en este trabajo fue EpiInfo 7.
Los resultados encontrados revelan que la media de edad en los controles fue de 45,6 años, con una desviación estándar de 16,1. La media de edad en los casos fue de 52,8 años, con una desviación estándar de 12,8. Ambos grupos no presentaron variables de confusión asociadas (Tabla 1). En cuanto al número de transfusiones que presentaron los casos, la moda fue una transfusión con 96 pacientes, representando el 64% de los casos (Tabla2). La frecuencia del factor de riesgo (transfusión antes de 1994) en estas pacientes fue elevada (109 sujetos) y representó el 72,7% de los casos.
En cuanto a los pacientes controles, en el número de transfusiones que presentaron la moda fue una transfusión con 119 pacientes, representando el 79,3% de los casos (Tabla 2). La frecuencia del factor de riesgo (transfusión antes de 1994) en los controles (34) fue baja comparada con los casos (109 mujeres) (Tabla 3).
Tabla 1. Descripción de variables sociodemográficas de ambos grupos.
Tabla 2. Número de transfusiones como antecedente en ambos grupos.
Asimismo, se agruparon los casos y controles dependiendo de si presentaron o no el factor de riesgo ya mencionado (Tabla 3). De esta manera, el odds ratio se ubicó en 9,07 (intervalo de confianza al 95%de 5,37 a 15,3), la significancia fue corroborada con la prueba Chi-cuadrado de asociación (73,12 p<0,001). Además, se determinaron las proporciones de exposición (Tabla 4) y se establecieron las fracciones atribuibles (Tabla 5).
Tabla 3. Tabla de contingencia para casos y controles.
Tabla 4. Proporciones de exposición en sujetos expuestos.
Tabla 5. Fracciones atribuibles.
Las medidas de asociación en casos y controles, basadas en la comparación entre las frecuencias del daño en diferentes grupos, pueden realizarse a través de razones (odds ratio) o de sus diferencias (riesgo atribuible y fracción atribuible). En este caso, la fracción atribuible o prevenible para la población es una medida de impacto. Esto, bajo el supuesto de que la exposición a un agente etiológico sea causal. Por haber obtenido una p menor a 0,05, se indica que se puede descartar el azar como explicación de la asociación observada con una reducida probabilidad de cometer el error de primer tipo (hacer un rechazo indebido) [11].
El principal hallazgo de este estudio es la cuantificación de la medida del efecto (odds ratio) del factor de riesgo “transfusión antes de 1994 en mujeres” para padecer una infección por virus de la hepatitis C en Guadalajara, México; dato no reportado en la literatura. Al comparar nuestra investigación con otros trabajos actuales, un reporte realizado en Hawái, Estados Unidos, revela que el grupo de edad entre 45 y 65 años es el que presenta la más alta prevalencia de anticuerpos para el virus de la hepatitis C (8,4%), comparados con otros grupos etarios [12]. Ello concuerda con el promedio de edad que tuvieron nuestros sujetos (media en años 52,6 ± 12,7).
En esta investigación se encontró que el odds ratio de presentar una transfusión antes de 1992 fue de 1,67 (intervalo de confianza al 95% 1,24 – 2,24, p<0,001). Cuando fue ajustado mediante un análisis multivariado (regresión logística) de acuerdo a otras cuatro variables intervinientes que sí presentaron (tatuajes o perforaciones de condiciones sanitarias dudosas, exposición a agujas contaminadas con sangre, compañero sexual infectado con el virus de la hepatitis C y finalmente uso de drogas intravenosas), el odds ratio se ubicó en 1,91 (intervalo de confianza al 95% 1,35 – 2,70, p<0,001).
Por otra parte, llama la atención que al estratificar por sexos, sólo el sexo masculino mantuvo la significancia estadística: 1,92 (intervalo de confianza al 95% 1,28 – 2,89, p=0,002), mientras que las mujeres tuvieron 1,85 (intervalo de confianza al 95% 0,94 – 3,65, p=0,074) [12]. La diferencia con nuestra investigación puede deberse a que en ese estado de Estados Unidos no se tiene el antecedente transfusional tan arraigado hacia las mujeres, como en los países en desarrollo donde la transfusión se utiliza en hemorragias del parto y que representan el 25% de todas las complicaciones [13].
En otro estudio reciente [14] realizado en la ciudad de Puebla, México, se cita que la prevalencia de infección por virus de la hepatitis C en este país es del 30 al 35% en pacientes con hepatitis activa [15], [16],[17]. El propósito del estudio fue determinar la prevalencia de infección por virus de la hepatitis C en dos clínicas del Instituto Mexicano del Seguro Social en Puebla, México, haciendo un análisis de los factores de riesgo ya mencionados que caracterizan a esta patología. Uno de ellos fue el antecedente transfusional antes de 1995 (decidieron hacerlo un año después respecto de este trabajo).
En la clínica 6, de un total de 6561 pacientes, 1608 presentaron este factor de riesgo (24,5%). En la clínica 55, de un total de 5954 pacientes, 2018 presentaron este factor de riesgo (33,9%). Después de realizar una regresión logística, solamente la transfusión antes de 1995 resultó significativa a la transmisión del virus (p=0,004) [14]. Además, se estratificaron los pacientes por grupos de edad: 362 (16,9%) eran menores de 30 años, 1758 (41,8%) eran del intervalo de edad de 31 a 50 años y, finalmente, 1491 (56,7%) eran mayores de 50 años. Esto concuerda con lo encontrado en publicaciones anteriores, donde se menciona que son los adultos y adultos en plenitud los más afectados por este virus [14]. Llama la atención que no se hizo el análisis por sexo, y como se ha mencionado, las mujeres tienen mayor frecuencia de transfusiones.
Por otra parte, en Brasil en la ciudad de Catanduva en la provincia de Sao Paulo, la transmisión del virus de la hepatitis C vía sanguínea ha sido bien caracterizada. En ese país la prevalencia de infección por este virus es similar a México, del 1 al 2% [18]. En un reporte reciente de casos y controles, se buscó cuantificar la medida del efecto de algunos factores de riesgo ya conocidos para esta enfermedad. Se consideraron uso de drogas intravenosas ilícitas, transfusiones de sangre previas, tatuajes, entre otros. El perfil demográfico de los grupos indicó una predominancia de hombres (68,9%) [19], difiriendo con nuestro trabajo ya que en el nuestro sólo se incluyeron mujeres y en este se incorporó a ambos sexos.
El factor de riesgo “historia previa de transfusión sanguínea” de ese estudio es clave para nuestra investigación, ya que encontraron 55 casos expuestos y 135 casos no expuestos; además de 20 controles expuestos y 170 controles no expuestos, como resultado un odds ratio crudo de 3,92 (intervalo de confianza al 95% 2,07 – 7,38). Cuando fue ajustado por regresión logística con las demás variables, se ubicó en 7,33 (intervalo de confianza al 95% 2,44 - 22,0) [19].
En este estudio se encontró que el 28,9% de los sujetos estudiados tuvieron un historial de transfusión de sangre y/o derivados, con 70,9% (39 de 55) que ocurrieron antes de 1993. No se observó discriminación con respecto del número de episodios de transfusión. El análisis multivariado indicó que la transfusión de sangre o derivados tuvo una fuerte asociación con la infección por virus de la hepatitis C [19]. Este trabajo es similar al nuestro, pero difiere en cuanto a que fue realizado en forma indistinta al sexo y no separó las transfusiones antes de 1993 (probablemente en ese año se implementó el tamizaje para virus de la hepatitis C en donadores). Únicamente se aclaró que 39 de los pacientes tuvieron este antecedente como factor de riesgo.
En conclusión, podemos establecer que ser una mujer y tener una transfusión antes de 1994 en la zona metropolitana de Guadalajara representó un riesgo 9,07 veces mayor de infección de virus de la hepatitis C, comparado con una mujer que no tuvo el antecedente transfusional en esa fecha (incluidas las transfusiones después de 1994).
En lo que respecta a las proporciones de exposición (Tabla 2), considerando que la proporción de casos expuestos fue de 72% y la de controles expuestos de 22%; podemos determinar que la proporción de expuestos mayor entre los casos indica un factor de riesgo atribuible a la transfusión, algo que se evidencia en el odds ratio encontrado.
En cuanto a las fracciones atribuibles (Tabla 3), la fracción atribuible poblacional es la proporción de todos los casos en la población que se pueden imputar a la transfusión antes de 1994. Es decir del total de la población, el 64% de los casos infectados por hepatitis C son potencialmente evitables si se pudiera suprimir la transfusión antes de 1994. Asimismo, la fracción atribuible en expuestos fue de 88%. Esta es la proporción de la infección por el virus de la hepatitis C que se debe al haberse expuesto al factor de riesgo, en este caso transfusión antes de 1994.
Ahora que tenemos la magnitud del riesgo, podemos implementar estrategias de tamizaje y vigilar a las pacientes, tanto asintomáticas como las que presentan síndromes ictéricos y que tienen una transfusión antes de 1994. Esto, con el fin de implementar eficazmente el diagnóstico precoz y tratamiento oportuno.
Aspectos éticos
La Revista tiene constancia de que el Comité Local de Investigación y Ética en Investigación del Hospital de Especialidades del Centro Médico Nacional de Occidente, Guadalajara, México; tuvo conocimiento sobre este estudio y su posible publicación en una revista de difusión biomédica.
Conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

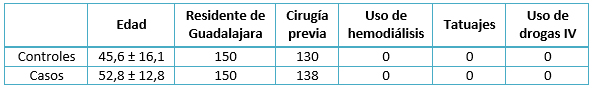 Tabla 1. Descripción de variables sociodemográficas de ambos grupos.
Tabla 1. Descripción de variables sociodemográficas de ambos grupos.

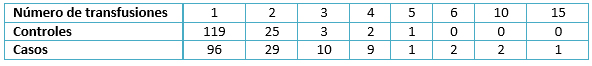 Tabla 2. Número de transfusiones como antecedente en ambos grupos.
Tabla 2. Número de transfusiones como antecedente en ambos grupos.

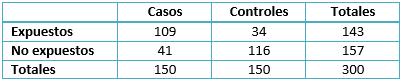 Tabla 3. Tabla de contingencia para casos y controles.
Tabla 3. Tabla de contingencia para casos y controles.

 Tabla 4. Proporciones de exposición en sujetos expuestos.
Tabla 4. Proporciones de exposición en sujetos expuestos.

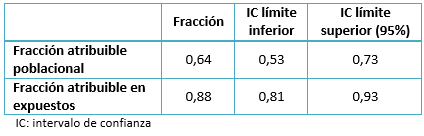 Tabla 5. Fracciones atribuibles.
Tabla 5. Fracciones atribuibles.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Most blood transfusions occur in female patients. The introduction of serologic screening practices by blood banks reduced the transfusion-related rate of infection with hepatitis C virus (HCV). In Mexico patients with pre-1994 transfusion history are at high risk of being detected with HCV infection. We aimed at establishing an interrelationship between two variables: pre-1994 transfusion history and rate of infection in women treated in the Guadalajara Metropolitan Area hospitals, in Mexico.
METHODS
Analytical observational case-control study which included both non-infected women and patients diagnosed with hepatitis C virus infection, in whom the pre-1994 transfusion history was determined. The cases were 150 women with confirmed hepatitis C virus serologic diagnosis. The controls were 150 women whose hepatitis C virus-detection serologic tests had yielded negative results.
RESULTS
An odds ratio of 9.07 (95% CI: 5.37 – 15.3; p< 0.001) was found where the rate of infection for the case group was 0.72 while the control group had a ratio of 0.22; population attributable risk (PAR) was 0.64 (95% CI: 0.53 – 0.73), while etiologic fraction was 0.88 (95% CI: 0.81 – 0.93).
CONCLUSIONS
Among women, having been exposed to pre-1994 blood transfusion means a risk 9.07 times higher than not being exposed to blood transfusion in the same time frame.
 Autores:
Christian Ramos Flores[1], Ernesto Echeagaray[2], Guadalupe Castañeda[3], Maria de Lourdes Vargas[4], Raúl Montes-González[5], Susana Luna[6], Laura Díaz[7], Oscar Torres[8]
Autores:
Christian Ramos Flores[1], Ernesto Echeagaray[2], Guadalupe Castañeda[3], Maria de Lourdes Vargas[4], Raúl Montes-González[5], Susana Luna[6], Laura Díaz[7], Oscar Torres[8]

Citación: Ramos Flores C, Echeagaray E, Castañeda G, Vargas ML, Montes-González R, Luna S, et al. Linking hepatitis C virus infection to pre-1994 blood transfusions in female patients. Medwave 2017 Mar;17(2):e6886 doi: 10.5867/medwave.2017.02.6886
Fecha de envío: 16/9/2016
Fecha de aceptación: 26/1/2017
Fecha de publicación: 15/3/2017
Origen: no solicitado
Tipo de revisión: con revisión por tres pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Rodríguez-Moyado H. Enfermedades infecciosas por transfusión en México. RevMexMedTran. 2011; 4 (2):78-90. | Link |
Rodríguez-Moyado H. Enfermedades infecciosas por transfusión en México. RevMexMedTran. 2011; 4 (2):78-90. | Link | Blas OC. Contagio transfusional de VHC. Reflexiones sobre la previsibilidad del daño. DS 2008; 16(2):179-216. | Link |
Blas OC. Contagio transfusional de VHC. Reflexiones sobre la previsibilidad del daño. DS 2008; 16(2):179-216. | Link | Manual de procedimientos estandarizados para la vigilancia epidemiológica de las hepatitis virales. SSA Mex. DGEPI. 2012.
Manual de procedimientos estandarizados para la vigilancia epidemiológica de las hepatitis virales. SSA Mex. DGEPI. 2012.  Engle RE, Bukh J, Alter HJ, Emerson SU, Trenbeath JL, Nguyen HT, Brockington A, Mitra T, Purcell RH. Transfusion-associated hepatitis before the screening of blood for hepatitis risk factors. Transfusion. 2014 Nov;54(11):2833-41. | CrossRef | PubMed |
Engle RE, Bukh J, Alter HJ, Emerson SU, Trenbeath JL, Nguyen HT, Brockington A, Mitra T, Purcell RH. Transfusion-associated hepatitis before the screening of blood for hepatitis risk factors. Transfusion. 2014 Nov;54(11):2833-41. | CrossRef | PubMed | Conde González C, Torres-Poveda K, Madrid-Marina V. [The viral hepatitides].Salud Publica Mex. 2011;53 Suppl 1:S4-6. | PubMed |
Conde González C, Torres-Poveda K, Madrid-Marina V. [The viral hepatitides].Salud Publica Mex. 2011;53 Suppl 1:S4-6. | PubMed | Hernández Lugo MI, Contreras NAM. Hepatitis C en el contexto de la donación sanguínea. Rev Med Inst Mex SeguroSoc 2006; 44 (2): 3-6. | Link |
Hernández Lugo MI, Contreras NAM. Hepatitis C en el contexto de la donación sanguínea. Rev Med Inst Mex SeguroSoc 2006; 44 (2): 3-6. | Link | Moyer VA; U.S. Preventive Services Task Force.. Screening for hepatitis C virus infection in adults: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2013 Sep 3;159(5):349-57. | CrossRef | PubMed |
Moyer VA; U.S. Preventive Services Task Force.. Screening for hepatitis C virus infection in adults: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2013 Sep 3;159(5):349-57. | CrossRef | PubMed | Blejer JL, Carreras Vescio LA, Salamone HJ. [Risk of transfusional-transmitted infections]. Medicina (B Aires). 2002;62(3):259-78. | PubMed |
Blejer JL, Carreras Vescio LA, Salamone HJ. [Risk of transfusional-transmitted infections]. Medicina (B Aires). 2002;62(3):259-78. | PubMed | Panduro A, Roman S, Khan A, Tanaka Y, Kurbanov F, Martinez-Lopez E,et al. Molecular epidemiology of hepatitis C virus genotypes in west Mexico. Virus Res. 2010 Jul;151(1):19-25. | CrossRef | PubMed |
Panduro A, Roman S, Khan A, Tanaka Y, Kurbanov F, Martinez-Lopez E,et al. Molecular epidemiology of hepatitis C virus genotypes in west Mexico. Virus Res. 2010 Jul;151(1):19-25. | CrossRef | PubMed | Contreras AM, Sotelo M, Celis A, Villalobos DB, Ancona-Piste O, Ochoa-Jiménez RJ, López-Ramírez K. [Nosocomial transmission of hepatitis C associated with anesthesia procedures: a case-control study]. Salud Publica Mex. 2011;53 Suppl1:S19-25. | PubMed |
Contreras AM, Sotelo M, Celis A, Villalobos DB, Ancona-Piste O, Ochoa-Jiménez RJ, López-Ramírez K. [Nosocomial transmission of hepatitis C associated with anesthesia procedures: a case-control study]. Salud Publica Mex. 2011;53 Suppl1:S19-25. | PubMed | Coughlin SS, Benichou J, Weed DL. Estimación del riesgo atribuible en los estudios de casos y controles. Bol Oficina Sanit Panam. 1996;121(2):143-58. | Link |
Coughlin SS, Benichou J, Weed DL. Estimación del riesgo atribuible en los estudios de casos y controles. Bol Oficina Sanit Panam. 1996;121(2):143-58. | Link | Takeuchi LC, Pham TK, Katz AR. Hepatitis C virus antibody prevalence, demographics and associated factors among persons screened at Hawai'i community-based health settings, 2010-2013. Hawaii J Med Public Health. 2015 Jan;74(1):9-15. | PubMed |
Takeuchi LC, Pham TK, Katz AR. Hepatitis C virus antibody prevalence, demographics and associated factors among persons screened at Hawai'i community-based health settings, 2010-2013. Hawaii J Med Public Health. 2015 Jan;74(1):9-15. | PubMed | Zamorano, F. Donación Voluntaria de Sangre: Análisis de Estrategias de Articulación entre los Servicios de Salud y la Sociedad. Documento Técnico Área Temática IV: Políticas de Salud Pública y Control de Riesgos. EUROPEAID 2007.
Zamorano, F. Donación Voluntaria de Sangre: Análisis de Estrategias de Articulación entre los Servicios de Salud y la Sociedad. Documento Técnico Área Temática IV: Políticas de Salud Pública y Control de Riesgos. EUROPEAID 2007.  Lopez-Colombo A, Melendez-Mena A, Sedeño-Monge V, Camacho-Hernandez JR, Vazquez-Cruz E, Morales-Hernandez ER, et al. Hepatitis C virus infection in patients and family members attending two primary care clinics in Puebla, Mexico. Annals of hepatology, 2014: 13(6): 746-752. | Link |
Lopez-Colombo A, Melendez-Mena A, Sedeño-Monge V, Camacho-Hernandez JR, Vazquez-Cruz E, Morales-Hernandez ER, et al. Hepatitis C virus infection in patients and family members attending two primary care clinics in Puebla, Mexico. Annals of hepatology, 2014: 13(6): 746-752. | Link | Santos-López G, Sosa-Jurado F, Vallejo-Ruiz V, Meléndez-Mena D, Reyes-Leyva J. Prevalence of hepatitis C virus in the Mexican population: a systematic review. J Infect. 2008 Apr;56(4):281-90. | CrossRef | PubMed |
Santos-López G, Sosa-Jurado F, Vallejo-Ruiz V, Meléndez-Mena D, Reyes-Leyva J. Prevalence of hepatitis C virus in the Mexican population: a systematic review. J Infect. 2008 Apr;56(4):281-90. | CrossRef | PubMed | Valdespino JL, Conde-González CJ, Olaiz-Fernández G, Oswaldo-Palma O, Kershenobich D, Sepúlveda J. Seroprevalencia de la hepatitis C en adultos de México: ¿un problema de salud pública emergente? Salud Publica Mex. 2007;49:(suppl 3):S395-S-403. | Link |
Valdespino JL, Conde-González CJ, Olaiz-Fernández G, Oswaldo-Palma O, Kershenobich D, Sepúlveda J. Seroprevalencia de la hepatitis C en adultos de México: ¿un problema de salud pública emergente? Salud Publica Mex. 2007;49:(suppl 3):S395-S-403. | Link | Chiquete E, Panduro A. Low prevalence of anti-hepatitis C virus antibodies in Mexico: A systematic review. Intervirology. 2007;50(1):1-8. Review. | PubMed |
Chiquete E, Panduro A. Low prevalence of anti-hepatitis C virus antibodies in Mexico: A systematic review. Intervirology. 2007;50(1):1-8. Review. | PubMed | Ministério da Saúde. Estudo de prevalência de base populacional das infecções pelos vírus das hepatites A, B e C nascapitais do Brasil.Boletim Epidemiológico HepatitesVirais. Brasília: Ministério da Saúde; 2010:11-15.
Ministério da Saúde. Estudo de prevalência de base populacional das infecções pelos vírus das hepatites A, B e C nascapitais do Brasil.Boletim Epidemiológico HepatitesVirais. Brasília: Ministério da Saúde; 2010:11-15.  Rosa RS, Martinelli Ade L, Passos AD. Risk factors for hepatitis C virus transmission in the municipality of Catanduva, State of São Paulo: a case-control study. Rev Soc Bras Med Trop. 2014 May-Jun;47(3):295-301. | PubMed |
Rosa RS, Martinelli Ade L, Passos AD. Risk factors for hepatitis C virus transmission in the municipality of Catanduva, State of São Paulo: a case-control study. Rev Soc Bras Med Trop. 2014 May-Jun;47(3):295-301. | PubMed |