 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: evoked potentials N200; event-related potentials, P300; paranoid schizophrenia, endophenotype
INTRODUCCIÓN
Los potenciales relacionados a eventos N200 y P300 son herramientas sensibles para evaluar el funcionamiento sensorial y cognitivo. Debido a que, frecuentemente se reporta una prolongación de la latencia y una disminución de la amplitud de los componentes N200 y P300 en pacientes con esquizofrenia, estos potenciales constituyen marcadores biológicos de vulnerabilidad genética para este trastorno mental.
OBJETIVO
Precisar la asociación de las alteraciones en la latencia, la amplitud y la distribución topográfica de los potenciales N200 y P300 de pacientes con esquizofrenia paranoide y sus familiares sanos de primer grado, pertenecientes a familias con esquizofrenia multiplex.
MÉTODOS
Se utilizó un paradigma “odd-ball” auditivo para evaluar la latencia, la amplitud y la distribución topográfica de los componentes N200 y P300 en 25 pacientes con esquizofrenia paranoide (probandos), 23 familiares sanos de primer grado y 25 sujetos controles, mediante un estudio de asociación familiar en 60 familias afectadas con esquizofrenia multiplex.
RESULTADOS
Los probandos y sus familiares mostraron una prolongación significativa de la latencia y una disminución de amplitud de las ondas N200 y P300 cuando se compararon con los sujetos sanos. De igual forma, la amplitud de los potenciales N200 y P300 resultó significativamente disminuida en regiones temporales del hemisferio izquierdo de los probandos y sus familiares con respecto al grupo control.
CONCLUSIONES
En concordancia con resultados de otros investigadores, este estudio sugiere que, la prolongación de latencia, la disminución de amplitud y las alteraciones en la distribución topográficas detectadas en regiones temporales de los potenciales N200 y P300, pueden constituir por su elevada asociación familiar, marcadores de rasgo para la esquizofrenia paranoide.
Los resultados de estudios de agregación familiar, de adopción y de gemelos, han demostrado la existencia de un componente heredable en la etiología de la esquizofrenia [1],[2],[3],[4]. Sin embargo, no existen evidencias de que sea una enfermedad monogénica o que sea exclusivamente de origen genético, probablemente, intervienen múltiples genes y factores ambientales en su etiología. Se ha planteado que se hereda una susceptibilidad al trastorno, pero no todos los individuos con genes de susceptibilidad desarrollan este trastorno, ya que se requieren desencadenantes ambientales [5],[6].
En la búsqueda de factores de riesgo subyacentes y de marcadores biológicos específicos para la esquizofrenia, varios estudios han mostrado un alto riesgo de morbilidad en sus familiares de primer grado al ser comparados con la población general, lo que sugiere una elevada asociación familiar [2],[3],[7],[8]. En este sentido, los endofenotipos han emergido con especial énfasis en los estudios familiares del trastorno [8],[9],[10]. Tradicionalmente, el elemento central en el diagnóstico de la esquizofrenia lo constituyen los elementos psicóticos. Sin embargo los estudios genéticos de la esquizofrenia basados en ellos, no han sido muy fructíferos. Por otro lado, los marcadores cognitivos se expresan antes de la aparición del primer episodio de psicosis, son estables en el tiempo y se presentan en los familiares de primer grado de los enfermos, por lo tanto pueden constituir indicadores de susceptibilidad genética [11],[12],[13].
Se considera que un endofenotipo es la expresión observable o medible de la vulnerabilidad para la enfermedad, que es transmitida de forma hereditaria y que es una condición necesaria, pero no suficiente, para que los fenotipos clínicos homogéneos se presenten [14],[15],[16],[17]. Gottesman (2003), definió los siguientes criterios para la evaluación de un endofenotipo:
Las técnicas más utilizadas para estudiar los marcadores cognitivos del trastorno son las escalas psicopatológicas dimensionales, las pruebas neuropsicológicas y los estudios psicofisiológicos, donde se destacan los potenciales evocados relacionados a eventos [9],[18]. Estos potenciales son cambios de voltaje que se registran sobre el cuero cabelludo en respuesta a un evento, que puede ser la presentación de un estímulo o la ejecución de una tarea mental [19].
El potencial evocado relacionado a evento más estudiado es la onda P300, que es provocada por un estímulo novedoso infrecuente (P3a) y por un estímulo diana target infrecuente (P3b). El clásico componente P300 es la mayor onda positiva que se produce en regiones parietales y línea media alrededor de los 300 ms después de aplicado un estímulo infrecuente. La P300 refleja el procesamiento de información a altos niveles, asociado con la evaluación contextual del estímulo atendido, orientación y control de la atención, con la memoria de trabajo y la resolución de las respuestas [16],[20]. En pacientes con esquizofrenia se ha reportado una reducción de la amplitud del componente P3b, altamente correlacionada con la presencia de síntomas negativos en los enfermos [21] y también con alto riesgo de psicosis [22]. En el análisis topográfico del componente P300 en los pacientes con esquizofrenia, se documenta una lateralización izquierda de la disminución de amplitud de P300 en regiones temporoparietales, que se ha relacionado a cambios estructurales del lóbulo temporal izquierdo [23]. En contraste, las alteraciones del componente P3a son poco reportadas e inconsistentes con la psicopatología del trastorno [21],[23].
El componente N200 refleja los controles en el proceso de toma de decisiones de respuestas conductuales, en tareas de discriminación sensorial. Este presenta dos negatividades, la primera (N2a) con una distribución topográfica frontal, refleja el registro o detección automático de los cambios del estímulo procesado. La segunda negatividad, denominada N2b, se produce en regiones frontales centrales y está asociada con una operación de emparejamiento o de disparidad [24],[25]. El potencial evocado relacionado a eventos N200, se ha estudiado especialmente en la esquizofrenia y en los trastornos de personalidad, y más recientemente en individuos con alto riesgo de psicosis [26],[27],[28],[29],[30].
En el presente estudio estimamos la asociación familiar de las alteraciones en los potenciales evocados relacionados a eventos auditivos N200 y P300, en familias con esquizofrenia múltiplex y mostramos la evaluación de estas respuestas como propuesta de endofenotipo en la esquizofrenia paranoide.
Tipo de estudio
Se realizó un estudio trasversal de asociación con base familiar, para evaluar la asociación de las alteraciones en la latencia, la amplitud y la distribución topográfica de los potenciales N200 y P300 con el fenotipo esquizofrénico, en pacientes y familiares sanos pertenecientes a familias con esquizofrenia paranoide.
Muestra
La muestra para la evaluación de los potenciales evocados relacionados a eventos procede de un estudio familiar compuesto por 60 familias habaneras con esquizofrenia. Quedó constituida por tres grupos de estudio: grupo de probandos (25 pacientes con esquizofrenia paranoide), grupo de familiares (23 familiares de primer grado discordantes para esquizofrenia, padres y hermanos) y el grupo de control (25 sujetos sanos procedentes del Centro de Neurociencias de Cuba y del Centro de Ingeniería Genética y Biotecnología de La Habana, que cumplían con los criterios de la escala de normalidad). Mediante el inventario de manualidad de Edimburgo (Edinburgh Handedness Inventory) se garantizó la manualidad derecha de todos los participantes, que además debían presentar audición y visión normal o corregida.
Diagnóstico
Para realizar el diagnóstico clínico de esquizofrenia se utilizó la versión en español del Cuestionario para la Evaluación Clínica en Neuropsiquiatría (Schedules for Clinical Assessment in Neuropsychiatry) [31], los criterios del Manual de Diagnóstico y Estadísticas para Enfermedades Psiquiátricas, IV edición y la Clasificación Internacional de Enfermedades, décima versión [2],. Los diagnósticos se generaron con la parte II del Present State Examination (PSE-10), destinada a evaluar síntomas psicóticos. Para el proceso de datos se empleó el programa informático Catego 5 [31]. Además, se aplicó una encuesta clínica global que recoge datos generales del paciente con interés para el estudio y escalas clínicas psicopatológicas específicas para la esquizofrenia: Escala de Síntomas Positivos y Negativos de la Esquizofrenia [32] y la Escala de Evaluación de Anomalías Perceptuales [33].
Cuatro expertos en psiquiatría aplicaron la entrevista: Family Interviews for Genetic Studies (1999), elaborada por el National Institute of Mental Health de Estados Unidos. Se revisaron los árboles genealógicos y sí además del probando se encontraron más casos de esquizofrenia en una familia, éstas fueron identificadas como una familia con esquizofrenia múltiplex aceptándose en el estudio familiar. Posteriormente se hicieron preguntas generales para tamizar a los familiares conocidos y se administraron las hojas de perfil y las listas de síntomas (depresión, manía, alcohol y abusos de drogas, psicosis, trastornos de personalidad esquizoide, paranoide y esquizotípico). Los familiares incluidos no fueron encontrados positivos en ninguna de las listas de síntomas del Family Interviews for Genetic Studies.
Criterios de inclusión y exclusión
Los probandos incluidos en el estudio son pacientes pertenecientes al estudio familiar, atendidos en los centros de salud mental de Ciudad de La Habana con diagnóstico de esquizofrenia paranoide. En los pacientes seleccionados fue posible obtener estudios de potenciales evocados relacionados a eventos con calidad electrofisiológica óptima, encontrándose al momento del estudio bajo monitoreo médico fuera del episodio activo de psicosis y libres de tratamiento con sustancias que interfieran con la atención. Todos recibían tratamiento farmacológico con neurolépticos típicos en dosis equivalentes a 100 mg de clorpromazina por vía oral (dosis medias: flufenazina 2 mg/día, trifluoperazina 5 mg/día, haloperidol 2 mg/día y tioridazina 100 mg/día).
Se excluyeron los pacientes con otros tipos clínicos de esquizofrenia o con esquizofrenia paranoide que sostenían tratamiento psicofarmacológico con neurolépticos atípicos o con ambos tipos de neurolépticos. Además, se excluyeron los familiares y controles que presentaban algún síntoma o enfermedad psiquiátrica, enfermedades neurológicas, historia de traumatismo o lesión cerebral de cualquier etiología, consumo de drogas o medicamentos que afectan las funciones cognitivas, historia de uso o adicciones a drogas, consumo de neurolépticos y defectos corporales motores.
Paradigma de estimulación utilizado
Se utilizó un paradigma odd-ball auditivo, constituido por un tono infrecuente o target (2000 Hz, probabilidad igual a 0,20), que era presentado entre tonos frecuentes o nontarget (1000 Hz, probabilidad igual a 0,80). La duración total del tono fue de 90 ms con un tiempo de subida y bajada de cinco milisegundos y un intervalo interestímulo de 1,7±0,1 segundos. Los tonos se administraron a los participantes en forma aleatoria a través del sistema de estimulación MindTracer 2.0 de Neuronic SA, en un local de registro en penumbras, con bajo nivel de ruido ambiental, previa calibración por expertos en fonoaudiología de todos los dispositivos utilizados al efecto. Los participantes fueron previamente entrenados para realizar un conteo en silencio de los tonos infrecuentes y reportar el número total de ellos al final de la tarea, así debían tener una exactitud mayor al 90% para que el estudio fuera aceptado. Los estudios se realizaron con el participante sentado confortablemente, con la cabeza apoyada y la vista fija en un punto situado en el centro de una pantalla a 65 cm del plano visual del sujeto, para disminuir los artefactos de parpadeo y evitar somnolencia. Los participantes debían acudir al estudio en horas de la mañana después de alimentarse, y eran instruidos para escuchar atentamente a los 100 tonos aplicados biauralmente mediante audífonos TDK.
Intensidad de estimulación
Se realizó una audiometría tonal convencional previa otoscopia del sujeto, mediante la técnica psicoacústica de límites ascendentes y descendentes, con pasos a 5 dB. Se determinó el umbral normal de audibilidad del sujeto y se fijó una intensidad de estimulación a 60 dB por encima de este, sin pasar de 85 dB como nivel de presión sonora.
Registro de los potenciales evocados relacionados a eventos
La actividad eléctrica cerebral se obtuvo con 19 electrodos de superficie colocados según el sistema internacional 10/20. Para eliminar del registro los componentes de frecuencia no deseados, se utilizó un filtro digital pasa-banda entre 0,5 y 30 Hz (-3 dB). Las señales se muestrearon a 200 Hz y los valores de impedancia se mantuvieron por debajo de 5 KΩ. Los segmentos de actividad eléctrica se obtuvieron 200 ms antes y 800 ms después de presentado el estímulo y las correcciones de la línea de base se refirieron a un intervalo entre -100 y 0 ms. Todos los segmentos de electroencefalograma fueron sujetos a un criterio de rechazo de artefactos de ±100 μV desde -100 hasta 800 ms. De esta forma se eliminaron los segmentos con exceso de actividad eléctrica muscular y otras actividades no estacionarias.
La rectificación de tendencias lineales permitió la corrección de cada segmento de electroencefalograma a partir del ajuste de los valores de voltaje por una regresión lineal. Mediante inspección visual del electroencefalograma se rechazaron los segmentos con artefactos de parpadeo y movimientos oculares. Por último se promediaron todos los segmentos electroencefalográficos libres de artefactos para la obtención de los potenciales evocados relacionados a eventos. Los potenciales se promediaron separadamente para cada condición experimental (frecuente e infrecuente).
Análisis de los potenciales evocados relacionados a eventos
Se midieron las latencias y amplitudes de los componentes de los potenciales evocados relacionados a eventos en las 19 derivaciones para las condiciones frecuente e infrecuente. A continuación se detallan cada una de las mediciones realizadas:
Análisis estadístico
Se realizó el análisis conductual de la tarea (medidas d', logaritmo de β y porcentaje de errores), sobre la base de la teoría de detección de señales, evaluando el desempeño de los participantes. Para explorar las diferencias de amplitud de los componentes (N100, P200, N200, P300, N2a y N2b) entre los tres grupos, se realizaron varios análisis de varianza de medidas repetidas sobre los valores de voltaje obtenidos, incluyendo un factor entre-sujetos: grupos (controles, familiares y probandos) y un factor intrasujetos: sitios de registros (19 derivaciones). Para mitigar violaciones en la esfericidad de los datos se aplicó la corrección de Greenhouse-Geisser. Para evaluar diferencias específicas se realizaron análisis de varianza adicionales y comparaciones planificadas entre grupos. Los valores de p se determinaron después de ajustar los grados de libertad. Siempre que existieron efectos de interacción entre el grupo y el electrodo (3 grupos Х 19 electrodos) en el análisis de los valores crudos de amplitud, se realizó un nuevo análisis de varianza con los valores del vector de normalización de los datos, evitando asumir resultados falsos positivos. Si se confirmaba el efecto de interacción, entonces los datos eran sometidos a un segundo análisis de varianza para especificar las diferencias topográficas, en el que se definieron regiones de interés como un nuevo factor intrasujetos. En el análisis de la latencia se realizaron análisis de varianza sobre los valores de latencia, obtenidos en todos los componentes estudiados para las 19 derivaciones entre los tres grupos de estudio.
No se encontraron diferencias significativas en la distribución del sexo [χ2 (2)=3,13, ns], la edad [H (2,11)=2,64 p=0,52], color de la piel [χ2 (3)=4,26, ns], y el nivel de escolaridad [H (2,60)=0,93, p=0,63] entre los tres grupos. Además, no se observaron diferencias significativas en el conteo del estímulo target realizado por los sujetos: grupo de control contra grupo de familiares [t (46)=0,031, p=0,99] y grupo de control contra grupo de probandos [t (49)=0,52, p=0,22]. Tampoco se encontraron diferencias significativas entre los tres grupos en la evaluación del número de ensayos libres de artefactos durante los estímulos infrecuentes: grupo de control contra grupo de probandos [t (67)= -1,84, p=0,10] y grupo de control contra grupo de familiares [t (85)= -1,59, p=0,14].
En la Figura 1 se muestra un gran promedio de los potenciales evocados relacionados a eventos obtenidos para ambas condiciones de estimulación en derivaciones de línea media (Fz, Cz, Pz) para los tres grupos.
Figura 1. Gran promedio de los potenciales relacionados a eventos.
Análisis global de la amplitud y la latencia de los componentes N100 y P200 para ambos estímulos en los tres grupos estudiados
En los análisis de varianza realizados sobre los valores de amplitud y latencia de los componentes N100 y P200, en ambas condiciones de estimulación, no se constataron diferencias significativas entre los tres grupos estudiados. Por ello, en adelante el análisis se centrará sólo en los componentes N200 y P300.
En la Figura 2 se muestran los promedios obtenidos de potencial diferencia para los tres grupos en posiciones F3, F4, C3, C4, Fz, Cz y Pz.
Figura 2. Promedios obtenidos en el potencial diferencia.
Análisis global de la amplitud de los componentes N200 y P300 en los tres grupos
En un análisis de varianza general que incluyeron las 19 derivaciones, se constataron diferencias significativas en la amplitud del componente P300 entre los tres grupos [F(2,70)= 2,93, p<0,05, ε=0,075, ajustado p=0,05]. Contrastes planificados demostraron diferencias significativas del grupo de probandos contra grupo de control [F(1,70)=4,86, p<0,03] y contra grupo de familiares [F(1,70)=3,16, p<0,05]. Sin embargo, no se detectaron diferencias significativas entre grupo de control y grupo de familiares [F(1,70)= 0,25, p=0,61]. Se evidenció una interacción entre el grupo y los sitios de registro [F(36,1260)=1,61, p<0,01], que al realizar correcciones de Greenhouse-Geisser no resultó significativa [ε=0,075, ajustado p=0,19].
Posteriormente se analizaron las diferencias de amplitud del componente P300 entre los tres grupos para los sitios donde se reportaron las mayores diferencias en el análisis de varianza general (P3, P4, T5, T6, Cz, Fz, Pz), constatándose diferencias significativas [F(2,70)=4,12, p=0,02, ε=0,30, ajustado p<0,0001]. Comparaciones planificadas entre los grupos revelaron que estas alteraciones obedecen a una disminución significativa de la amplitud de la onda P300 en el grupo de probandos con respecto al grupo de control [F(1,70)=7,10, p<0,0001]. No obstante, no se evidenciaron diferencias significativas entre grupo de familiares y grupo de control [F(1,70)=0,75, p=0,38], ni entre grupo de probandos y grupo de familiares [F(1,70)= 3,93, p=0,06].
En el análisis grupal con 19 derivaciones, los valores de amplitud del componente N200 no mostraron diferencias significativas entre grupos [F(2,69)=1,60, p=0,20]. Este análisis reveló una interacción del grupo X sitios de registro [F(30,720)=2,63, p=0,03]. Al restringir el análisis a los sitios de registro en línea media y derivaciones centro temporales (Cz, Fz, Pz, C3, C4, T3 y T4), se evidenciaron diferencias significativas entre los tres grupos [F(2,71)=4,79, p=0,01, ε=0,74, ajustado p=0,03], dadas por una disminución de amplitud de la onda N200 en grupo de probandos y grupo de familiares con respecto al grupo de control [F(1,71)=8,47, p<0,001 y F(1,71)=5,74, p=0,01 respectivamente]. Los familiares no presentaron diferencias con respecto a los probandos [F(1,71)=0,32, p=0,56].
Análisis de la distribución topográfica de los componentes N200 y P300
El análisis previo reveló una interacción del grupo X sitios de registro [F(30,720)=2,63, p=0,03]. Estos datos sometidos a un nuevo análisis de varianza con los datos normalizados, confirmaron el efecto de interacción [F(27,630)=3,43, p<0,0001] que sugiere diferencias topográficas en la distribución de la amplitud del componente N200 entre los tres grupos. Estas diferencias topográficas están asociadas con las regiones de interés hemisferio izquierdo: (F7, F3, C3, P3 y T5) contra hemisferio derecho: (F8, F4, C4, P4 y T6) [F(1,9)=10,23, p=0,01], pero no en las regiones de interés frontal: (F7, F3, Fz, F4 y F8) contra parietal: (T5, P3, Pz, P4 y T6) [F(1,9)=0,78, p=0,35].
Contrastes planificados entre los grupos mostraron similitud entre grupo de probandos y grupo de familiares (p=0,48), con respecto al grupo de control (p<0,0001 y p=0,04 respectivamente). Estas alteraciones consisten en una disminución de la negatividad N200 en regiones de interés centrales parietales izquierdas, fundamentalmente en posición C3 (ver Figura 2). El análisis detallado de los datos crudos reveló que N200 presenta una reducción de amplitud en el grupo de probandos y grupo de familiares al compararse con grupo de control en estas posiciones (gran estimado de la media para la regiones de interés parietal izquierda en los tres grupos): grupo de control: -3,16± 0,69 μV contra grupo de probandos: -0,91±0,86 μV [ts(32) =4,27, p<0,0001]; grupo de control: -3,16±0,69 μV contra grupo de familiares: -1,79 μV [ts(32) =3,48, p<0,0001] y grupo de probandos: -0,91±0,86 μV contra grupo de familiares: -1,79 μV [ts(33) = -0,26, p=0,79].
La inspección visual de los potenciales evocados relacionados a eventos, sugirió diferencias de los potenciales grupales en la lateralización del componente P300 para las regiones temporales en los pacientes con esquizofrenia y sus familiares. Posteriormente se realizó otro análisis de varianza de medidas repetidas que distinguió grupos (de probandos, de familiares y de control) hemisferios: izquierdo y derecho (T3, T5 vs, T4, T6), regiones: temporal (T3, T4) y temporoparietal (T5, T6). En ellos se revelaron diferencias significativas entre regiones temporales derechas e izquierdas, dadas por una disminución de amplitud en regiones temporales izquierdas con respecto a regiones homólogas del hemisferio derecho [F(4,92)=2,94, p=0,02, ε=0,41, ajustado p=0,01]. Contrastes planificados entre los tres grupos no demostraron diferencias significativas entre grupo de probandos y grupo de familiares (p=0,19) al compararse con el grupo de control (p=0,01 y p=0,04, respectivamente).
Análisis de la amplitud de los subcomponentes N2a y N2b de potenciales evocados relacionados a eventos N200
No existen diferencias entre los grupos estudiados con respecto a la amplitud media de la N2a y N2b [F(2,71)=1,63, p=0,20 y F(2,71)=0,19, p=0,82, respectivamente]. Evaluando los sitios Cz, Fz, Pz, F3, F4, C3 y C4, tampoco se evidenciaron diferencias de ambos componentes entre los tres grupos [F(2,71)=2,55, p=0,85 y F(2,71)=0,157, p=0,78 respectivamente] (ver Figura 2).
Análisis global de la latencia absoluta de los componentes N200 y P300 entre los tres grupos
Este análisis reveló diferencias significativas entre grupo de probandos, grupo de control y grupo de familiares [F(2,94)=3,65, p=0,02, ε=0,63, ajustada p=0,05]. Contrastes planificados evidenciaron que los probandos y sus familiares presentan enlentecimiento de sus latencias con respecto al grupo de control [F(1,47)=6,45, p=0,01 y F(1,47)=3,99, p=0,05 respectivamente]. Sin embargo, las comparaciones realizadas entre los pacientes y su familiares sanos no mostraron diferencias significativas entre ellos [F(1,47)= 0,48, p=0,49]. El análisis de la latencia media de los subcomponentes N2a [F(2,43)=2,44, p=0,09] y N2b [F(2,48)=1,36, p=0,26] no mostró diferencias significativas entre grupos.
El componente P300 mostró diferencias estadísticamente significativas en el análisis de varianza general realizado sobre sus valores de latencia entre los tres grupos [F(2,94)=4,75, p=0,01, ε=0,83, ajustada p=0,03]. Comparaciones planificadas entre grupos evidenciaron un enlentecimiento de la latencia del componente P300 en grupo de probandos [F(1,48)= 6,73l grupo de probandos, p=0,01] y grupo de familiares [F(1,48)= 3,35, p=0,04] al compararse con los sujetos sanos del grupo de control. Al mismo tiempo se evidenció similitud entre grupo de probandos y grupo de familiares [F(1,48)=0,48, p=0,49].
El objetivo principal de este estudio fue estimar la asociación familiar de las respuestas auditivas N200/P300 y la evaluación de estas respuestas como propuesta de endofenotipo en la esquizofrenia paranoide. Los componentes N100 y P200 reflejan etapas tempranas del procesamiento de información. Su reducción de amplitud sugiere un déficit en el procesamiento auditivo en la fase atentiva del proceso atencional en la esquizofrenia [24]. En este estudio no se constataron diferencias significativas en los valores de amplitud y latencia de las respuestas N100 y P200 entre los tres grupos estudiados, resultados coherentes con los trabajos de Frangou [34] y de Scheiber [35], que demostraron la ausencia de alteraciones de estos componentes en los familiares de pacientes con esquizofrenia.
Es oportuno destacar que a diferencia de otros potenciales evocados relacionados a eventos como P300, el grado de contribución genética de la N100 y la P200 es cuestionable, toda vez que el grado de similitud de su latencia en gemelos monocigóticos no resulta mayor que el encontrado en sujetos sin vínculo familiar [34]. No obstante, un estudio con familiares de primer grado no afectados de pacientes con esquizofrenia encontró una disminución de la amplitud de los componentes N100 y P200 en los familiares [36].
Los resultados encontrados en el presente estudio, confirman informes previos que refieren una disminución de amplitud de los componentes N200 y P300 en los pacientes con esquizofrenia con respecto a sus familiares y al grupo control [27],[29],[30]. Los hallazgos más prominentes de este estudio recaen en una prolongación de la latencia de los componentes N200 y P300 y una disminución de amplitud del potencial N200, compartida entre los pacientes con esquizofrenia y sus familiares no afectados al compararse con el grupo de control. Otro resultado interesante es la lateralización del componente P300 en regiones temporales, que resultó en una disminución de amplitud de P300 en regiones temporales izquierdas de grupo de probandos y grupo de familiares al compararse con el grupo de control. Igualmente, existe una diferencia en la distribución topográfica de la amplitud del componente N200 en regiones centrales parietales entre los tres grupos estudiados.
No existen estudios previos en familias con esquizofrenia donde se analicen por separado los subcomponentes N2a y N2b. No obstante, estos subcomponentes no presentaron diferencias significativas de amplitud y latencia entre los grupos estudiados. Esto evidenció que las alteraciones encontradas en el potencial N200 de los pacientes con esquizofrenia y sus familiares, reflejan alteraciones globales de los controles en el proceso de toma de decisiones de respuestas conductuales en tareas de discriminación sensorial, que involucran tanto la detección automática (N2a) como la detección controlada de los estímulos (N2b).
En el análisis de los valores de amplitud del componente N200 entre los tres grupos, se constató una disminución de amplitud del potencial restringida a la línea media y regiones centro temporales para el grupo de probandos y grupo de familiares, sin embargo no existieron diferencias entre ellos con respecto al grupo de control. Estos resultados son coherentes con otros reportes en la literatura y evidencian alteraciones en el procesamiento de estímulos auditivos en la esquizofrenia, que constituyen candidatos a endofenotipos para este trastorno [11],[12],[25]. La lateralización izquierda en la disminución de amplitud de N200, que comparten el grupo de probandos y el grupo de familiares, no se observó en el grupo de control. En la literatura revisada no se encuentran reportes similares. Estas alteraciones permiten inferir que los generadores neurales de N200 pueden estar afectados tanto en los pacientes como en sus familiares, dado que varias líneas de investigaciones localizan sus generadores neurales en regiones temporales, coincidiendo con los sitios de las alteraciones de los potenciales evocados relacionados a eventos, encontradas en este estudio. El grueso de los estudios con potenciales evocados relacionados a eventos y neuroimágenes, apuntan a favor de una disfunción hemisférica izquierda en la esquizofrenia. El resultado de este trabajo sugiere que también sus familiares presentan en menor cuantía un fenómeno de lateralización funcional anormal [14],[35],[37].
Este estudio reveló diferencias significativas en la amplitud del componente P300 auditivo entre los tres grupos, replicando parcialmente otros estudios que avalan la existencia de alteraciones en la amplitud de P300 de pacientes con esquizofrenia y sus familiares, proponiéndolas como posibles marcadores de vulnerabilidad en la esquizofrenia [23],[38],[39],[40]. Consideramos, al igual que otros autores, que la ausencia de alteraciones significativas en la amplitud del componte P300 en el grupo de familiares pudiera ser expresión de que sólo parte de la gran cantidad de dominios cognitivos explorados con este potencial evocado relacionado a eventos, se encuentren afectados en los familiares sanos [8],[20].
La disminución en la amplitud del componente P300 lateralizada al hemisferio izquierdo que presentan el grupo de probandos y el grupo de familiares, no se encontró en el grupo de control. Estos resultados son afines con la idea de un daño morfofuncional en las estructuras del lóbulo temporal de los pacientes con esquizofrenia, el que se ha reportado en estudios conjuntos de potenciales evocados relacionados a eventos y neuroimágenes funcionales y anatómicas, lo que sugiere una lesión histológica y metabólica predominantemente izquierda del cerebro de estos enfermos. Ello demuestra un fenómeno de lateralización hemisférica anormal en la esquizofrenia [11],[40],[41],[42]. El hallazgo de alteraciones equivalentes en sus familiares, permite inferir que esta disfunción en regiones temporales aparece incipientemente en sus familiares sanos y que pueden constituir un verdadero marcador biológico de vulnerabilidad para el trastorno [30],[41]. También se constató una prolongación significativa de latencia de ambos potenciales evocados relacionados a eventos al compararse con el grupo de control. Estos resultados coinciden con otros reportes que evalúan al componente P300 como un posible endofenotipo en la esquizofrenia [7],[40],[41].
Al analizar las alteraciones en la latencia, amplitud y topografía de los potenciales evocados relacionados a eventos N200 y P300, se puede inferir que los pacientes con esquizofrenia presentan una disfunción cognitiva global, que se extiende desde las fases preatentivas hasta las fases de procesamiento superior de la información. Los mecanismos que explican la asociación existente entre las alteraciones de los potenciales evocados relacionados a eventos y la esquizofrenia, no están esclarecidos [37],[40],[43]. Estos resultados aportan evidencias a favor de que las alteraciones encontradas en los potenciales evocados relacionados a eventos N200 y P300 obtenidos por estimulación auditiva, puedan constituir por su elevada asociación familiar posibles endofenotipos para la esquizofrenia paranoide.
Proyecciones futuras y limitaciones potenciales del estudio
Para que un marcador biológico cualquiera sea considerado un verdadero endofenotipo debe cumplir no sólo el criterio de asociación familiar, sino además debe cumplir con el resto de los criterios de Gottesman para endofenotipos expuestos en la introducción. Resulta importante también, poder disociar el efecto de la medicación y la cronicidad sobre las funciones cognitivas que se producen en los pacientes con esquizofrenia. Teniendo en cuenta estas limitaciones, proponemos dos recomendaciones futuras a trabajar:
Aspectos éticos
La Revista tiene constancia de que el estudio fue aprobado por el Comité de Ética de la Facultad de Ciencias de la Salud de la Universidad Nacional del Este de Minga-Guazú, Paraguay. En el dictamen emitido por este comité se declara que los participantes firmaron actas de consentimiento informado, que los instrumentos de medición aplicados sobre ellos no los colocaba en riesgo alguno para su salud y que se mantuvo la confidencialidad de toda la información obtenida.
Financiamiento
Los autores declaran que el estudio recibió financiamiento por parte del Centro de Neurociencias de Cuba.
Conflicto de intereses
Los autores han completado el formulario de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran no tener conflictos de intereses asociados a la materia del mismo. Los formularios pueden ser solicitados al autor responsable o a la dirección editorial de la Revista.

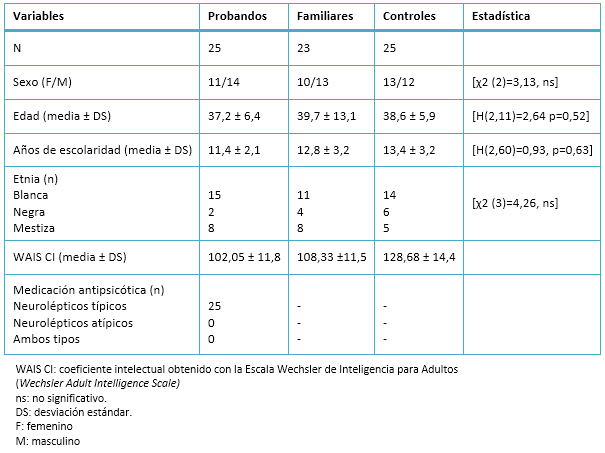 Tabla 1. Características clínicas y datos demográficos de los tres grupos estudiados (media ± desviación estándar).
Tabla 1. Características clínicas y datos demográficos de los tres grupos estudiados (media ± desviación estándar).

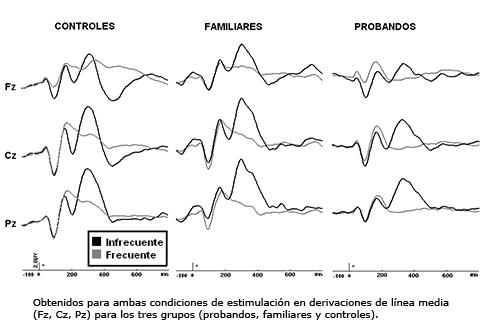 Figura 1. Gran promedio de los potenciales relacionados a eventos.
Figura 1. Gran promedio de los potenciales relacionados a eventos.

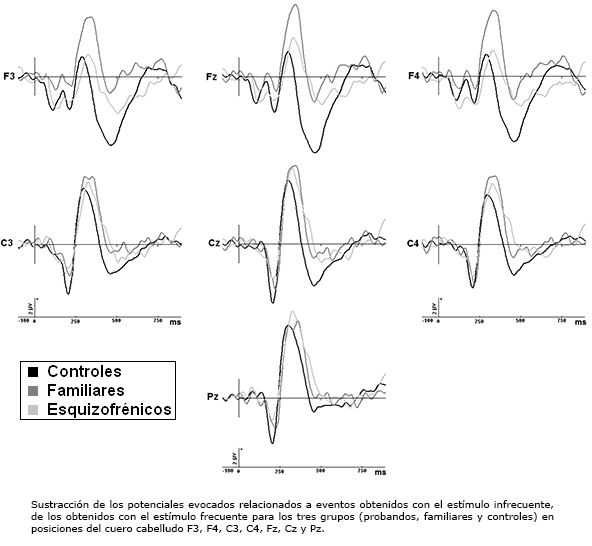 Figura 2. Promedios obtenidos en el potencial diferencia.
Figura 2. Promedios obtenidos en el potencial diferencia.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
N200 and P300 event-related evoked potentials provide sensitive measurements of sensory and cognitive function and have been used to study information processing in patients with schizophrenia and their unaffected first-degree relatives. Reduced amplitude and increased latency of N200 and P300 potentials have been consistently reported in schizophrenia. Thus, event-related evoked potentials abnormalities are promising possible biological markers for genetic vulnerability to schizophrenia.
OBJECTIVE
To assess the association of changes in latency, amplitude and topographic distribution of potentials N200 and P300 of patients with paranoid schizophrenia and their healthy first-degree relatives, in families with schizophrenia multiplex.
METHODOLOGY
We measured latency and amplitude of the N200 and P300 component of evoked potentials using an auditory odd-ball paradigm in 25 schizophrenic patients (probands) from 60 families multiply affected with paranoid schizophrenia, 23 of their non-schizophrenic first-degree relatives and 25 unrelated healthy controls, through a study of family association.
RESULTS
Schizophrenic patients and their relatives showed significant latency prolongation and amplitude reduction of the N200 and P300 waves compared to controls. Left-temporal as compared to right-temporal N200 and P300 were significantly smaller in schizophrenic patients and their non-schizophrenic first-degree relatives than in controls. Our results suggest that event-related evoked potentials abnormalities may serve as markers of genetic vulnerability in schizophrenia.
CONCLUSIONS
Confirming results of other researchers, this present study suggests that latency prolongation and amplitude reduction of the N200 and P300 waves and an altered topography at temporal sites may be a trait “marker” of paranoid schizophrenia.
 Autores:
Seidel Guerra López[1,2], Migdyrai Martín Reyes[3], María de los Ángeles Pedroso Rodríguez[4], Adnelys Reyes Berazain[5], Raúl Mendoza Quiñones[5], Tania Martha Bravo Collazo[6], Thais Días de Villarvilla[5], María Julia Machado Cano[7], María Antonieta Bobés León[5]
Autores:
Seidel Guerra López[1,2], Migdyrai Martín Reyes[3], María de los Ángeles Pedroso Rodríguez[4], Adnelys Reyes Berazain[5], Raúl Mendoza Quiñones[5], Tania Martha Bravo Collazo[6], Thais Días de Villarvilla[5], María Julia Machado Cano[7], María Antonieta Bobés León[5]

Citación: Guerra López S, Martín Reyes M, Pedroso Rodríguez MA, Reyes Berazain A, Mendoza Quiñones R, Bravo Collazo T, et al. Evoked potentials N200/P300 disorders and clinical phenotype in Cuban families with paranoid schizophrenia: a family-based association study. Medwave 2015 Abr;15(3):e6112 doi: 10.5867/medwave.2015.03.6112
Fecha de envío: 27/11/2014
Fecha de aceptación: 17/3/2015
Fecha de publicación: 1/4/2015
Origen: no solicitado
Tipo de revisión: con revisión por cinco pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Amenedo E, Díaz F. Aging-related changes in processing of non-target and target stimuli during an auditory oddball task. Biol Psychol. 1998 Aug;48(3):235-67. | PubMed |
Amenedo E, Díaz F. Aging-related changes in processing of non-target and target stimuli during an auditory oddball task. Biol Psychol. 1998 Aug;48(3):235-67. | PubMed | American Psychiatric Association. DSM-IV. Diagnostic and statistical manual of mental disorders, 4 ed, Washington, DC: American Psychiatric Association, 1994.
American Psychiatric Association. DSM-IV. Diagnostic and statistical manual of mental disorders, 4 ed, Washington, DC: American Psychiatric Association, 1994.  Braff DL. Psychophysiological and information processing approaches to schizophrenia. En: Neurobiological foundation of mental illness. New York: Oxford University Press, 1999:258-271.
Braff DL. Psychophysiological and information processing approaches to schizophrenia. En: Neurobiological foundation of mental illness. New York: Oxford University Press, 1999:258-271.  Blackwood DH, Young AH, McQueen JK, Martin MJ, Roxborough HM, Muir WJ, et al. Magnetic resonance imaging in schizophrenia: altered brain morphology associated with P300 abnormalities and eye tracking dysfunction. Biol Psychiatry. 1991 Oct;30(8):753-69. | PubMed |
Blackwood DH, Young AH, McQueen JK, Martin MJ, Roxborough HM, Muir WJ, et al. Magnetic resonance imaging in schizophrenia: altered brain morphology associated with P300 abnormalities and eye tracking dysfunction. Biol Psychiatry. 1991 Oct;30(8):753-69. | PubMed | Bharath S, Gangadhar BN, Janakiramaiah N. P300 in family studies of schizophrenia: review and critique. Int J Psychophysiol. 2000 Oct;38(1):43-54.
| PubMed |
Bharath S, Gangadhar BN, Janakiramaiah N. P300 in family studies of schizophrenia: review and critique. Int J Psychophysiol. 2000 Oct;38(1):43-54.
| PubMed | Boutros N, Nasrallah H, Leighty R, Torello M, Tueting P, Olson S. Auditory evoked potentials in schizophrenia. Biol Psychiatry. 1996;39(7):651. | CrossRef |
Boutros N, Nasrallah H, Leighty R, Torello M, Tueting P, Olson S. Auditory evoked potentials in schizophrenia. Biol Psychiatry. 1996;39(7):651. | CrossRef | Bramon E, McDonald C, Croft RJ, Landau S, Filbey F, Gruzelier JH, et al. Is the P300 wave an endophenotype for schizophrenia? A meta-analysis and a family study. Neuroimage. 2005 Oct 1;27(4):960-8. | PubMed |
Bramon E, McDonald C, Croft RJ, Landau S, Filbey F, Gruzelier JH, et al. Is the P300 wave an endophenotype for schizophrenia? A meta-analysis and a family study. Neuroimage. 2005 Oct 1;27(4):960-8. | PubMed | Brown KJ, Gonsalvez CJ, Harris AW, Williams LM, Gordon E. Target and non-target ERP disturbances in first episode vs. chronic schizophrenia. Clin Neurophysiol. 2002 Nov;113(11):1754-63. | CrossRef | PubMed |
Brown KJ, Gonsalvez CJ, Harris AW, Williams LM, Gordon E. Target and non-target ERP disturbances in first episode vs. chronic schizophrenia. Clin Neurophysiol. 2002 Nov;113(11):1754-63. | CrossRef | PubMed | Cohen RA, Sparling-Cohen YA, O’Donnell BF. The Neuropsychology of Attention. New York: Plenum Press, 1993.
Cohen RA, Sparling-Cohen YA, O’Donnell BF. The Neuropsychology of Attention. New York: Plenum Press, 1993.  Donchin E, Coles MGH. Is the P300 component a manifestation of context updating ? Behav Brain Sci. 1988;11(3):357-373. | CrossRef |
Donchin E, Coles MGH. Is the P300 component a manifestation of context updating ? Behav Brain Sci. 1988;11(3):357-373. | CrossRef | Debruille JB, Schneider-Schmid A, Dann P, King S, Laporta M, Bicu M. The correlation between positive symptoms and left temporal event-related potentials in the P300 time window is auditory specific and training sensitive. Schizophr Res. 2005 Oct 15;78(2-3):117-25. | CrossRef | PubMed |
Debruille JB, Schneider-Schmid A, Dann P, King S, Laporta M, Bicu M. The correlation between positive symptoms and left temporal event-related potentials in the P300 time window is auditory specific and training sensitive. Schizophr Res. 2005 Oct 15;78(2-3):117-25. | CrossRef | PubMed | Egan MF, Duncan CC, Suddath RL, Kirch DG, Mirsky AF, Wyatt RJ. Event-related potential abnormalities correlate with structural brain alterations and clinical features in patients with chronic schizophrenia. Schizophrenia Research. 1994;11(3):259-271. | CrossRef |
Egan MF, Duncan CC, Suddath RL, Kirch DG, Mirsky AF, Wyatt RJ. Event-related potential abnormalities correlate with structural brain alterations and clinical features in patients with chronic schizophrenia. Schizophrenia Research. 1994;11(3):259-271. | CrossRef | Fabiani M, Gratton G, Karis D, Donchin E: Definition, identification, and reliability of measurement of the P300 component of the event-related brain potential. En: Advances in Psychophysiology, vol 2. Greenwich, CT: JAI Press, 1987.
Fabiani M, Gratton G, Karis D, Donchin E: Definition, identification, and reliability of measurement of the P300 component of the event-related brain potential. En: Advances in Psychophysiology, vol 2. Greenwich, CT: JAI Press, 1987.  Ford JM, Mathalon DH, White PM, Pfefferbaum A. Left temporal deficit of P300 in patients with schizophrenia: effects of task. Int J Psychophysiol. 2000 Oct;38(1):71-9. | PubMed |
Ford JM, Mathalon DH, White PM, Pfefferbaum A. Left temporal deficit of P300 in patients with schizophrenia: effects of task. Int J Psychophysiol. 2000 Oct;38(1):71-9. | PubMed | Forte A, Bernardo A, Caputo F, Bucci P, Mucci A, Galderisi S, et al. P300 Brain Microstate in deficit and nondeficit schizophrenia. Eur Psychiatr. 2002;17(1):188. | PubMed |
Forte A, Bernardo A, Caputo F, Bucci P, Mucci A, Galderisi S, et al. P300 Brain Microstate in deficit and nondeficit schizophrenia. Eur Psychiatr. 2002;17(1):188. | PubMed | Frodl T, Meisenzahl EM, Müller D, Greiner J, Juckel G, Leinsinger G, et al. Corpus callosum and P300 in schizophrenia. Schizophr Res. 2001 Apr 15;49(1-2):107-19. | CrossRef | PubMed |
Frodl T, Meisenzahl EM, Müller D, Greiner J, Juckel G, Leinsinger G, et al. Corpus callosum and P300 in schizophrenia. Schizophr Res. 2001 Apr 15;49(1-2):107-19. | CrossRef | PubMed | Gottesman II, Gould TD. The endophenotype concept in psychiatry: etymology and strategic intentions. Am J Psychiatry. 2003 Apr;160(4):636-45. | CrossRef | PubMed |
Gottesman II, Gould TD. The endophenotype concept in psychiatry: etymology and strategic intentions. Am J Psychiatry. 2003 Apr;160(4):636-45. | CrossRef | PubMed | Gonul AS, Suer C, Coburn K, Ozesmi C, Oguz A, Yilmaz A. Effects of olanzapine on auditory P300 in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2003 Feb;27(1):173-7. | PubMed |
Gonul AS, Suer C, Coburn K, Ozesmi C, Oguz A, Yilmaz A. Effects of olanzapine on auditory P300 in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2003 Feb;27(1):173-7. | PubMed | Grillon C, Courchesne E, Ameli R, Geyer MA, Braff DL. Increased distractibility in schizophrenic patients. Electrophysiologic and behavioral evidence. Arch Gen Psychiatry. 1990 Feb;47(2):171-9. | CrossRef | PubMed |
Grillon C, Courchesne E, Ameli R, Geyer MA, Braff DL. Increased distractibility in schizophrenic patients. Electrophysiologic and behavioral evidence. Arch Gen Psychiatry. 1990 Feb;47(2):171-9. | CrossRef | PubMed | Guerra S, Ibáñez A, Martín M, Bobes MA, Reyes A, Mendoza R, et al. N400 deficits from semantic matching of pictures in probands and first-degree relatives from multiplex schizophrenia families. Brain Cogn. 2009 Jul;70(2):221-30. | CrossRef | PubMed |
Guerra S, Ibáñez A, Martín M, Bobes MA, Reyes A, Mendoza R, et al. N400 deficits from semantic matching of pictures in probands and first-degree relatives from multiplex schizophrenia families. Brain Cogn. 2009 Jul;70(2):221-30. | CrossRef | PubMed | Higashima M, Kawasaki Y, Urata K, Sakai N, Nagasawa T, Koshino Y, et al. Regional cerebral blood flow in male schizophrenic patients performing an auditory discrimination task. Schizophr Res. 2000 Mar 16;42(1):29-39. | CrossRef | PubMed |
Higashima M, Kawasaki Y, Urata K, Sakai N, Nagasawa T, Koshino Y, et al. Regional cerebral blood flow in male schizophrenic patients performing an auditory discrimination task. Schizophr Res. 2000 Mar 16;42(1):29-39. | CrossRef | PubMed | Shaikh M, Hall MH, Schulze K, Dutt A, Li K, Williams I, Walshe M, et al. Effect of DISC1 on the P300 waveform in psychosis. Schizophr Bull. 2013 Jan;39(1):161-7. | CrossRef | PubMed |
Shaikh M, Hall MH, Schulze K, Dutt A, Li K, Williams I, Walshe M, et al. Effect of DISC1 on the P300 waveform in psychosis. Schizophr Bull. 2013 Jan;39(1):161-7. | CrossRef | PubMed | Havermans R, Honig A, Vuurman EF, Krabbendam L, Wilmink J, Lamers T, et al. A controlled study of temporal lobe structure volumes and P300 responses in schizophrenic patients with persistent auditory hallucinations. Schizophr Res. 1999 Aug 17;38(2-3):151-8. | PubMed |
Havermans R, Honig A, Vuurman EF, Krabbendam L, Wilmink J, Lamers T, et al. A controlled study of temporal lobe structure volumes and P300 responses in schizophrenic patients with persistent auditory hallucinations. Schizophr Res. 1999 Aug 17;38(2-3):151-8. | PubMed | Hotchkiss AP, Harvey PD. Effect of concurrent distraction on thought disorder in schizophrenia. American Journal of Psychiatry. 1990;147(2):153-156.
Hotchkiss AP, Harvey PD. Effect of concurrent distraction on thought disorder in schizophrenia. American Journal of Psychiatry. 1990;147(2):153-156.  Díaz-Anzaldúa A, Velázquez-Pérez J, Berlanga C. Endophenotypes and biomarkers: an approach to molecular genetic studies of mental disorders. Salud Mental 2013;36(3):161-168. | Link |
Díaz-Anzaldúa A, Velázquez-Pérez J, Berlanga C. Endophenotypes and biomarkers: an approach to molecular genetic studies of mental disorders. Salud Mental 2013;36(3):161-168. | Link | Ogura C, Nageishi Y, Omura F, Fukao K, Ohta H, Kishimoto A, er al. N200 component of event-related potentials in depression. Biol Psychiatry. 1993 May 15;33(10):720-6.
| CrossRef | PubMed |
Ogura C, Nageishi Y, Omura F, Fukao K, Ohta H, Kishimoto A, er al. N200 component of event-related potentials in depression. Biol Psychiatry. 1993 May 15;33(10):720-6.
| CrossRef | PubMed | Meisenzahl EM, Frodl T, Müller D, Schmitt G, Gallinat J, Zetzsche T, et al. Superior temporal gyrus and P300 in schizophrenia: a combined ERP/structural magnetic resonance imaging investigation. J Psychiatr Res. 2004 Mar-Apr;38(2):153-62. | CrossRef | PubMed |
Meisenzahl EM, Frodl T, Müller D, Schmitt G, Gallinat J, Zetzsche T, et al. Superior temporal gyrus and P300 in schizophrenia: a combined ERP/structural magnetic resonance imaging investigation. J Psychiatr Res. 2004 Mar-Apr;38(2):153-62. | CrossRef | PubMed | McCarley RW, O’Donnell BF, Niznikiewicz MA, Salisbury DF, Potts GF, Hirayasu Y, et al. Update on electrophysiology in schizophrenia. Int Rev Psychiatry. 1997;9(4):373-386. | CrossRef |
McCarley RW, O’Donnell BF, Niznikiewicz MA, Salisbury DF, Potts GF, Hirayasu Y, et al. Update on electrophysiology in schizophrenia. Int Rev Psychiatry. 1997;9(4):373-386. | CrossRef | Matthysse S, Holzman PS, Lange K. The genetic transmission of schizophrenia: application of Mendelian latent structure analysis to eye tracking dysfunctions in schizophrenia and affective disorder. J Psychiatr Res. 1986;20(1):57-67. | PubMed |
Matthysse S, Holzman PS, Lange K. The genetic transmission of schizophrenia: application of Mendelian latent structure analysis to eye tracking dysfunctions in schizophrenia and affective disorder. J Psychiatr Res. 1986;20(1):57-67. | PubMed | Moser RK, Cienfuegos A, Barros J, Javitt D. Auditory distraction and thought disorder in chronic schizophrenic inpatients. Evidence for separate contributions by incapacity and poor allocation and a subsyndrome related to the allocation deficit. Schizophr Res. 2001 Sep 1;51(2-3):163-70. | CrossRef | PubMed |
Moser RK, Cienfuegos A, Barros J, Javitt D. Auditory distraction and thought disorder in chronic schizophrenic inpatients. Evidence for separate contributions by incapacity and poor allocation and a subsyndrome related to the allocation deficit. Schizophr Res. 2001 Sep 1;51(2-3):163-70. | CrossRef | PubMed | Vázquez- Barquero JL, et al. Report on the Spanish Translation of the SCAN, Schedules and Glossary. Informe a la Organización Mundial de la Salud. Santander, España: Unidad de Investigación en Psiquiatría Social de Cantabria, 1992.
Vázquez- Barquero JL, et al. Report on the Spanish Translation of the SCAN, Schedules and Glossary. Informe a la Organización Mundial de la Salud. Santander, España: Unidad de Investigación en Psiquiatría Social de Cantabria, 1992.  Kay SR, Fiszbein A, Vital-Herne M, Fuentes LS. The Positive and Negative Syndrome Scale--Spanish adaptation. J Nerv Ment Dis. 1990 Aug;178(8):510-7. | PubMed |
Kay SR, Fiszbein A, Vital-Herne M, Fuentes LS. The Positive and Negative Syndrome Scale--Spanish adaptation. J Nerv Ment Dis. 1990 Aug;178(8):510-7. | PubMed | Bunney WE Jr, Hetrick WP, Bunney BG, Patterson JV, Jin Y, Potkin SG, Sandman CA. Structured Interview for Assessing Perceptual Anomalies (SIAPA). Schizophr Bull. 1999;25(3):577-92. | CrossRef | PubMed |
Bunney WE Jr, Hetrick WP, Bunney BG, Patterson JV, Jin Y, Potkin SG, Sandman CA. Structured Interview for Assessing Perceptual Anomalies (SIAPA). Schizophr Bull. 1999;25(3):577-92. | CrossRef | PubMed | Frangou S, Sharma T, Alarcon G, Sigmudsson T, Takei N, Binnie C, Murray RM. The Maudsley Family Study, II: Endogenous event-related potentials in familial schizophrenia. Schizophr Res. 1997 Jan 17;23(1):45-53. | CrossRef | PubMed |
Frangou S, Sharma T, Alarcon G, Sigmudsson T, Takei N, Binnie C, Murray RM. The Maudsley Family Study, II: Endogenous event-related potentials in familial schizophrenia. Schizophr Res. 1997 Jan 17;23(1):45-53. | CrossRef | PubMed | Schreiber H, Stolz-Born G, Rothmeier J, Kornhuber A, Kornhuber HH, Born J. Endogenous event-related brain potentials and psychometric performance in children at risk for schizophrenia. Biol Psychiatry. 1991 Jul 15;30(2):177-89.
| CrossRef | PubMed |
Schreiber H, Stolz-Born G, Rothmeier J, Kornhuber A, Kornhuber HH, Born J. Endogenous event-related brain potentials and psychometric performance in children at risk for schizophrenia. Biol Psychiatry. 1991 Jul 15;30(2):177-89.
| CrossRef | PubMed | Surwillo WW. Cortical evoked potentials in monozygotic twins and unrelated subjects: comparisons of exogenous and endogenous components. Behav Genet. 1980 Mar;10(2):201-9. | PubMed |
Surwillo WW. Cortical evoked potentials in monozygotic twins and unrelated subjects: comparisons of exogenous and endogenous components. Behav Genet. 1980 Mar;10(2):201-9. | PubMed | Phillips NA, Chertkow H, Leblanc MM, Pim H, Murtha S. Functional and anatomical memory indices in patients with or at risk for Alzheimer's disease. J Int Neuropsychol Soc. 2004 Mar;10(2):200-10. | CrossRef | PubMed |
Phillips NA, Chertkow H, Leblanc MM, Pim H, Murtha S. Functional and anatomical memory indices in patients with or at risk for Alzheimer's disease. J Int Neuropsychol Soc. 2004 Mar;10(2):200-10. | CrossRef | PubMed | Polich J, Pollock VE, Bloom FE. Meta-analysis of P300 amplitude from males at risk for alcoholism. Psychol Bull. 1994 Jan;115(1):55-73. | CrossRef | Link |
Polich J, Pollock VE, Bloom FE. Meta-analysis of P300 amplitude from males at risk for alcoholism. Psychol Bull. 1994 Jan;115(1):55-73. | CrossRef | Link | Rao KM, Ananthnarayanan CV, Gangadhar BN, Janakiramaiah N. Smaller auditory P300 amplitude in schizophrenics in remission. Neuropsychobiology. 1995;32(3):171-4. | PubMed |
Rao KM, Ananthnarayanan CV, Gangadhar BN, Janakiramaiah N. Smaller auditory P300 amplitude in schizophrenics in remission. Neuropsychobiology. 1995;32(3):171-4. | PubMed | Guerra S, Iglesias J, Matín M, Bravo TM, Mendoza R, Reyes A, et al. Redes neurales de la atención en pacientes con esquizofrenia y sus familiares no afectados de primer grado: un endofenotipo potencial. Actas Esp. Psiquiatr. 2011;39(1):32-44. | Link |
Guerra S, Iglesias J, Matín M, Bravo TM, Mendoza R, Reyes A, et al. Redes neurales de la atención en pacientes con esquizofrenia y sus familiares no afectados de primer grado: un endofenotipo potencial. Actas Esp. Psiquiatr. 2011;39(1):32-44. | Link | Martín-Reyes M, Mendoza R, Domínguez M, Caballero A, Bravo TM, Díaz T, et al. Depressive symptoms evaluated by the Calgary Depression Scale for Schizophrenia (CDSS): genetic vulnerability and sex effects. Psychiatry Res. 2011 Aug 30;189(1):55-61. | CrossRef | PubMed |
Martín-Reyes M, Mendoza R, Domínguez M, Caballero A, Bravo TM, Díaz T, et al. Depressive symptoms evaluated by the Calgary Depression Scale for Schizophrenia (CDSS): genetic vulnerability and sex effects. Psychiatry Res. 2011 Aug 30;189(1):55-61. | CrossRef | PubMed |