 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
INTRODUCCIÓN
El bortezomib es un inhibidor selectivo del proteosoma usado en el tratamiento del mieloma múltiple. Los estudios clínicos han mostrado excelentes tasas de respuesta con dosis estándar (1,3 a 1,5 mg por metro cuadrado de superficie corporal), pero se ha documentado que hasta el 88% de los pacientes presentan efectos secundarios dados por episodios de neutropenia, neuropatía o anemia.
OBJETIVOS
Describir la respuesta clínica, citológica y citométrica así como la sobrevida libre de enfermedad y los posibles efectos adversos con dosis bajas y dosis estándar, en nuestra experiencia.
MÉTODOS
Estudio retrospectivo y descriptivo a partir de la información recogida en las historias clínicas de 48 pacientes con mieloma múltiple tratados en nuestro hospital en el período 2011 a 2013. Se incluyeron datos sobre: edad, género, tipo de mieloma múltiple, albúmina sérica, creatinina sérica, beta 2 microglobulina, calcemia, estudio radiológico con o sin resonancia magnética, estadio de la enfermedad, estudio medular pre y post tratamiento, eventos adversos y fecha de progresión, muerte o fecha de último seguimiento. Se identificaron pacientes en los que se empleó la dosis estándar de 1,3 mg por metro cuadrado y pacientes que recibieron una dosis más baja: 0,8 mg por metro cuadrado que definieron dos grupos de pacientes, los que recibieron dosis estándar y los recibieron dosis bajas.
RESULTADOS
Veintiún pacientes recibieron dosis bajas y 27 dosis estándar. Al inicio del tratamiento ambos grupos resultaron similares respecto a edad, creatinina sérica, presencia de falla renal, albumina sérica, distribución de los tipos de mieloma y estadio de la enfermedad. En el grupo de dosis bajas, 14 pacientes (66%) y en el grupo de dosis estándar 18 pacientes (67%) tuvieron respuesta clínica, citológica y citometrica al bortezomib (p =0,45). Al término de tratamiento el aclaramiento de plasmoblastos y de células plasmáticas en ambos grupos fue similar. En cuanto a efectos adversos, se observó una baja aparición de neuropatía en ambos grupos y la presencia de trombocitopenia, anemia, infecciones virales y neutropenia fue similar en los dos grupos (sin diferencias significativas). En el momento del análisis retrospectivo, veinte pacientes habían recaído y fallecido, nueve en el grupo de dosis bajas y once en el grupo de dosis estándar. El tiempo libre de enfermedad promedio fue de 30 meses en el grupo estándar y 29 meses en el grupo de dosis bajas.
CONCLUSIONES
Nuestros datos apoyan la hipótesis de que el tratamiento con dosis más bajas que lo habitual es capaz de lograr una respuesta medular y clínica similar al de la dosis considerada estándar. No se confirma que los efectos adversos puedan ser menores en los pacientes que reciben dosis más bajas.
El bortezomib (PS341) es un inhibidor selectivo del proteosoma usado en el tratamiento del mieloma múltiple. El proteosoma es un complejo sistema multi enzima que regula el ciclo celular, causando proteolisis del inhibidor kappa beta, incrementando la cantidad del factor nuclear kappa beta (Nfκβ) y regulando la transcripción proteica, promoviendo el crecimiento celular al reducir la apoptosis [1],[2]. Los estudios clínicos han mostrado excelentes tasas de respuesta con dosis estándar (1,3-1,5 mg/m2), aunque favorecen el que hasta 88% de los pacientes presenten episodios de neutropenia, neuropatía o anemia. Las dosis bajas (<1,0 mg/m2) se han usado exclusivamente en pacientes con neuropatía y falla renal. Sin embargo, los estudios fase 1 del medicamento mostraron igual efectividad a dosis bajas [3].
El presente estudio muestra nuestra experiencia en el tratamiento de pacientes con mieloma múltiple con dosis estándar y dosis bajas de bortezomib combinado con ciclofosfamida y dexametasona a dosis habituales. Nuestro objetivo primario fue determinar la respuesta clínica, medida por el control del componente monoclonal y la respuesta citológica y citométrica. Como objetivo secundario se pretendió precisar el efecto en la sobrevida libre de enfermedad y efectos adversos de las diferentes dosis.
Pacientes
Se realizó un análisis retrospectivo a 48 pacientes con mieloma múltiple, tratados en nuestro hospital (Hospital de la Pontificia Universidad Católica de Santiago) y se recolectaron datos de los últimos tres años, que abarcan desde 2011 hasta 2013. Los datos obtenidos fueron: edad, género, fecha de diagnóstico, tipo de mieloma múltiple, albumina sérica, creatinina sérica, beta 2 microglobulina, calcemia, estudio radiológico con o sin resonancia magnética, ISS score (International Staging System for Multiple Myeloma), Salmon Durie score, estudio medular pre y post tratamiento, eventos adversos de acuerdo a la terminología de NIH versión 3,0 y fecha de progresión, muerte o del último seguimiento.
En nuestro hospital se tratan pacientes con y sin cobertura previsional privada. Los viales comerciales de bortezomib traen 3,4 mg. El promedio de superficie corporal de nuestra población varía entre 1,8 y 2,0 m2, por lo que al usar la dosis estándar de 1,3 mg/m2, sólo 2,6 mg son potencialmente usados. Los restantes 0,8 mg (dosis bajas) fueron recolectados y donados a pacientes sin cobertura previsional con una distribución uno a uno. Todos los pacientes recibieron explicaciones detalladas del tratamiento y firmaron consentimiento informado de acuerdo a lo estipulado por el comité de ética de nuestro hospital.
Quimioterapia y tratamiento de soporte
El protocolo de quimioterapia usado en nuestro centro consiste en bortezomib (dosis estándar o baja) endovenoso o subcutáneo administrado los días 1, 8, 15 y 22; ciclofosfamida endovenosa (300 mg/m2) los días 1, 8 y 15 y dexametasona oral o endovenosa (40 mg) cada día de administración de bortezomib. Los ciclos se repitieron cada 28 días con un máximo de nueve ciclos. Todos los pacientes recibieron alopurinol, trimetroprim sulfametoxazol, omeprazol, antieméticos y bisfosfonato.
Análisis de las muestras de sangre y médula ósea
Se obtuvo información de los registros médicos de los pacientes con respecto a hemograma, electroforesis de proteínas, función renal, cuantificación de inmunoglobulinas y estudio de médula ósea para citología (mielograma) e inmunofenotipo por citometría de flujo. Se obtuvo información del estudio medular del diagnóstico y el realizado al finalizar el tratamiento, fuese por remisión de la enfermedad, por progresión o recaída.
Tipos de respuesta
Según los criterios del International Myeloma Working Group (citado en [4]) las respuestas se definieron así: a) remisión completa: respuesta medular completa e inmunofijación en sangre u orina negativa; b) muy buena respuesta parcial: respuesta medular completa con presencia residual de inmunofijación positiva; c) respuesta parcial: presencia de reducción de por lo menos el 50% del componente monoclonal afectado sin evidencia de remisión medular y d) ausencia de respuesta o enfermedad progresiva, cuando no se objetivó disminución alguna del componente monoclonal o de la plasmocitosis medular. La remisión completa medular se definió por el recuento de menos de 10% de células plasmáticas de aspecto normal en el mielograma y con el estudio citométrico por medio de clusters de diferenciación (CD) estableciendo la presencia de clones de mieloma múltiple [más de 95% de plasmoblastos con inmunofenotipo CD19 (-) CD56(+) CD45(-) CD38(+) y restricción de cadenas livianas kappa o lambda intracitoplasmática] y de células plasmáticas normales [CD19(+) CD56(-) CD45 (+) CD38 (++) con expresión policlonal de cadenas livianas kappa y lambda.
La remisión del componente monoclonal se definió por la disminución y negativización de la proteína monoclonal presente, en los casos del mieloma secretor. En aquellos pacientes con mieloma múltiple no secretor o de cadenas livianas, la respuesta se objetivó por el cambio o normalización en la función del órgano comprometido (renal o hematopoyético).
Análisis estadístico
La sobrevida libre de enfermedad se definió como el tiempo desde el diagnóstico hasta la fecha de progresión o muerte por cualquier causa. Los pacientes aún vivos fueron censurados en la última fecha de contacto. Se realizaron curvas de Kaplan-Meier para describir la sobrevida y el test de log rank para comparar las curvas. Las variables de los pacientes fueron comparadas usando test chi-cuadrado de Pearson para variables cualitativas y U de Mann Whitney para las variables cuantitativas o cualitativas ordinales. Todos los valores de p son de dos colas con la significancia estadística convencional de 5%. Se utilizó el programa SPSS versión 16.1 para la realización de los cálculos y el programa Graphpad versión 6 para la realización de los gráficos de las curvas de sobrevida y comparaciones entre los grupos.
Características de los pacientes
Durante el periodo analizado, en nuestro hospital 48 enfermos fueron tratados con bortezomib, 21 con dosis bajas y 27 con dosis estándar. Las características basales de los pacientes se describen en la Tabla 1. Los grupos de dosis estándar versus bajas, fueron similares en términos de edad, albúmina, creatinina y beta 2 microglobulina. La edad media fue de 58 años y 42% se encontraba en la categoría III del ISS score.
Tabla 1. Características basales de los pacientes.
Tipo de respuesta
En el grupo de dosis bajas la respuesta clínica, citológica y citométrica fue 66% (14/21 pacientes) y en el grupo dosis estándar fue 67% (p=0,45). Todos los pacientes que respondieron tuvieron reducción satisfactoria de la proteína monoclonal medida por inmunofijación o electroforesis de proteínas.
Dosis de bortezomib e ISS score
El grupo de dosis estándar recibió en promedio 2,6 mg de bortezomib por día de tratamiento, mientras que el grupo de dosis bajas recibió en promedio 1,8 mg lo cual resulta en dosis de 1,3 y 0,8 mg/m2 respectivamente (Figura 1). Los dos grupos tuvieron igual grado de compromiso medido con ISS score y no hubo elementos suficientes para considerarlos diferentes (p=0,28) (Figura 2).
Figura 1. Dosis medias de bortezomib en ambos grupos.
Figura 2. Comparación entre los dos grupos de tratamiento de acuerdo al ISS score.
Aclaramiento de plasmoblastos en médula ósea por citología (mielograma)
En los pacientes del grupo de dosis bajas se detectaron recuentos más altos de plasmoblastos al diagnóstico (p=0,002). Al término de tratamiento se encontró igual aclaramiento de plasmoblastos en ambos grupos, sin diferencias significativas (Figura 3).
Figura 3. Aclaramiento de plasmoblastos en médula ósea por mielograma/citología .
Los pacientes del grupo de dosis bajas tuvieron un valor medio más alto de plasmoblastos al momento del diagnóstico. Al término del tratamiento hubo un descenso y normalización de los recuentos y no hubo diferencias significativas entre los dos grupos.
Aclaramiento de células plasmáticas por citometría de flujo
No se detectaron diferencias significativas en los grupos. Se estableció que la respuesta fue igualmente satisfactoria independiente de la dosis usada. Tampoco hubo diferencias en la recuperación del inmunofenotipo normal (Figura 4).
El panel A muestra la reducción en el total de las células plasmáticas establecidas por citometría de flujo. El panel B muestra la citometría de flujo pre tratamiento y post tratamiento en cuanto a la presencia de poblaciones normales y patológicas. En el grupo de dosis bajas hubo una media de 17,5% células plasmáticas, de las cuales 95,5% fueron patológicas [CD 19(-), CD 56(+), CD45 (-), CD 38 (+) con restricción de cadenas livianas]; y 4,5% fueron normales [CD 19(+), CD 56(-), CD45 (+), CD 38 (++) con expresión policlonal de cadenas livianas]. En el grupo de dosis estándar hubo una media de 15,8% células plasmáticas, de las cuales 89% fueron patológicas [CD 19(-), CD 56(+), CD45 (-), CD 38 (+) con restricción de cadenas livianas] y 11% fueron células normales [CD 19(+), CD 56(-), CD45 (+), CD 38 (++) con expresión policlonal de cadenas livianas].Todo esto sin diferencias estadísticamente significativas. La citometría de flujo post tratamiento en el grupo de dosis bajas mostró una media de 0,5% de células plasmáticas, de las cuales 34,5% fueron patológicas y 65,5% normales. En el grupo de dosis estándar hubo una media de 1,5% células plasmáticas y de ellas 56% fueron patológicas.
Efectos adversos
Se observó una baja aparición de neuropatía grado 3 o 4 en los enfermos tratados con bortezomib a dosis bajas (18 vs 14%) pero la diferencia no fue significativa (p=0,38). La presencia de trombocitopenia y anemia grado 3 o 4, infecciones virales y neutropenia grado 3 o 4 fue similar en los dos grupos, sin diferencias significativas.
Sobrevida libre de enfermedad
Al tiempo del análisis retrospectivo, 20 pacientes habían recaído y fallecido, nueve en el grupo de dosis bajas y once en el grupo de dosis estándar. La sobrevida libre de enfermedad media fue de 30 meses en el grupo estándar y 29 meses en el grupo de dosis bajas (p=0,2) (Figura 5). Con un tiempo de seguimiento promedio de tres años.
Figura 5. Curvas de sobrevida libre de enfermedad.
La sobrevida media en el grupo de dosis estándar fue de 30 meses y en el grupo de dosis bajas fue de 29 meses (p=0,2). El test de log rank no mostró diferencias significativas entre ambas curvas de supervivencia.
El mieloma múltiple es una enfermedad frecuente y prevalente a nivel mundial. Si no es tratada de forma apropiada tiene una mortalidad de 100% durante el primer año desde el diagnóstico. Debido a ello se han realizado esfuerzos e históricos avances en el tratamiento de la enfermedad, tales como la incorporación de medicamentos altamente efectivos (talidomida, bortezomib, lenalidomida) y el trasplante de precursores hematopoyéticos [1],[4],[5],[6]. Estas estrategias han cambiado absolutamente el comportamiento de la enfermedad, logrando mejorar las tasas de respuesta y aumentando los tiempos de sobrevida libre de enfermedad y sobrevida global [3],[4].
Sin embargo los medicamentos, incluyendo los mencionados, tienen efectos indeseables que afectan la calidad de vida de los pacientes. Tratar de optimizar la terapia minimizando los efectos adversos es un ideal. Los esquemas de tratamiento iniciales de bortezomib usaron dosis de mayor densidad temporal cada cuatro días, induciendo neuropatía. Al modificar este esquema a dosis semanales o dosis subcutáneas se mejoró el perfil de toxicidad, siempre usando dosis de 1,3 mg/m2 y con tasas altas de efectos adversos. Orlowski en un estudio fase 1, encontró que las dosis de bortezomib de 0,40, 1,04, 1,38 y 1,40 mg/m2 fueron efectivas y bien toleradas [6]. Sin embargo, hay muy escasa información disponible sobre uso de dosis menores. Bao, et al. mostraron que 23 pacientes con mieloma múltiple refractario o recaído tuvieron igual respuesta a dosis menores de bortezomib [7].
Nuestro estudio es el primero en mostrar la efectividad de dosis bajas en cuanto a la respuesta citométrica y citológica de pacientes con mieloma múltiple no tratados previamente. Asimismo, esta respuesta es independiente de la función renal o del ISS score. Si bien el seguimiento de los pacientes fue breve, la sobrevida libre de enfermedad fue similar en los dos grupos. También encontramos una tendencia no significativa de una menor tasa de efectos adversos. Las limitaciones de nuestro reporte son dadas por la naturaleza retrospectiva de este y por la pequeña muestra. Sin embargo al no ser un estudio aleatorizado, con estrictos parámetros de selección, muestra el comportamiento de una población en escenario terapéutico de vida real.
Nuestros datos muestran que el tratamiento con dosis más bajas que lo habitual es posible, manteniendo la respuesta medular y clínica. Para confirmar nuestros hallazgos y evaluar la menor tasa de efectos adversos, se requiere mayor seguimiento y/o la realización de un estudio prospectivo.
Declaración de conflictos de intereses
Los autores han completado el formulario de conflictos de intereses del ICMJE y declaran no tener conflictos de intereses asociados a la materia del mismo. Los formularios pueden ser solicitados al autor responsable o a la dirección editorial de la Revista.
Aspectos éticos
Los autores declaran que los pacientes firmaron consentimiento informado para recibir el tratamiento, tal como estipula el comité de ética asistencial de la Pontificia Universidad Católica de Chile.

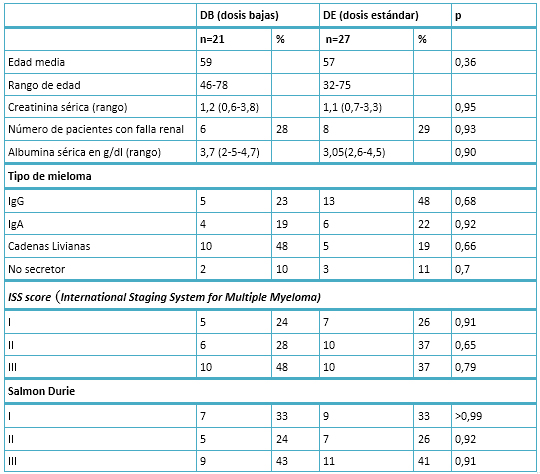 Tabla 1. Características basales de los pacientes.
Tabla 1. Características basales de los pacientes.

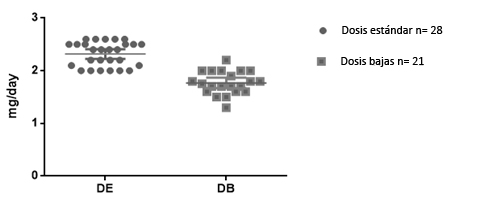 Figura 1. Dosis medias de bortezomib en ambos grupos.
Figura 1. Dosis medias de bortezomib en ambos grupos.

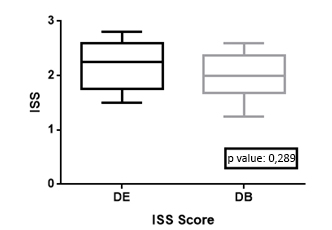 Figura 2. Comparación entre los dos grupos de tratamiento de acuerdo al ISS score.
Figura 2. Comparación entre los dos grupos de tratamiento de acuerdo al ISS score.

 Figura 3. Aclaramiento de plasmoblastos en médula ósea por mielograma/citología .
Figura 3. Aclaramiento de plasmoblastos en médula ósea por mielograma/citología .

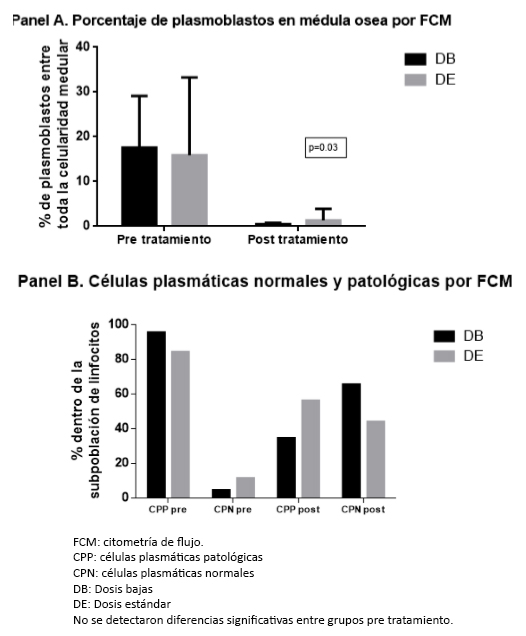 Figura 4. A y B aclaramiento de plasmocitos y plasmoblastos medidos por citometría de flujo en ambos grupos.
Figura 4. A y B aclaramiento de plasmocitos y plasmoblastos medidos por citometría de flujo en ambos grupos.

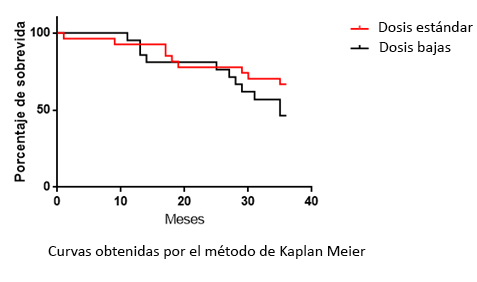 Figura 5. Curvas de sobrevida libre de enfermedad.
Figura 5. Curvas de sobrevida libre de enfermedad.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Bortezomib is a selective inhibitor of the proteosoma that is used in multiple myeloma. In combination with other antineoplastic drugs, it has a well-documented impact in progression-free survival rates and overall survival rates with standard doses (1.3-1.5 mg/m2). However, up to 88% of patients on standard doses have unwanted side effects (neutropenia, neuropathy or anemia. Standard dose (1.3 mg/m2) is used in almost all patients and low dose (0.7-0.8 mg/m2) is reserved for patients with kidney disease and neuropathy.
OBJECTIVE
We aim to describe clinical, cytological, and cytometric outcomes, as well as overall survival and side effects of low dose versus standard dose of bortezomib in our institution.
METHODS
Retrospective, descriptive study based on data recovered from clinical charts of 48 multiple myeloma patients treated in our hospital between 2011 and 2013. We included data on age, gender, type of multiple myeloma, serum albumin, serum creatinine, beta 2 microglobulin, calcemia, imaging studies, disease stage, pre-and post-therapy bone marrow studies, adverse events and rate of progression. We also recorded events like date of death or of the last medical appointment.
RESULTS
Forty-eight multiple myeloma patients were treated with bortezomib-cyclophosphamide-dexamethasone. Twenty-one patients received low dose and 27 patients were treated with the standard dose. No statistical differences between the two groups were found for clinical response (p=0.6), cytological response (p=0.28), flow cytometric response (p= 0.3), rate of adverse effects and overall survival rates.
CONCLUSION
This retrospective analysis suggests that lower doses of bortezomib have similar effects in disease control measured by flow cytometry and cytology compared to standard doses in multiple myeloma patients.
 Autores:
Marcela Espinoza Zelada[1], Nicole Befferman Cordova[1], Mauricio Ocqueteau Tachini[1], Pablo Ramírez Villanueva[1], Mauricio Galleguillos M.[1], Mauricio Sarmiento Maldonado[1]
Autores:
Marcela Espinoza Zelada[1], Nicole Befferman Cordova[1], Mauricio Ocqueteau Tachini[1], Pablo Ramírez Villanueva[1], Mauricio Galleguillos M.[1], Mauricio Sarmiento Maldonado[1]

Citación: Espinoza Zelada M, Befferman Cordova N, Ocqueteau Tachini M, Ramírez Villanueva P, Galleguillos M. M, Sarmiento Maldonado M. Retrospective study comparing low-dose versus standard dose of bortezomib in patients with multiple myeloma. Medwave 2015 Mar;15(2):e6098 doi: 10.5867/medwave.2015.02.6098
Fecha de envío: 23/11/2014
Fecha de aceptación: 22/1/2015
Fecha de publicación: 16/3/2015
Origen: no solicitado
Tipo de revisión: con revisión por cinco pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Attal M, Harousseau JL, Stoppa AM, Sotto JJ, Fuzibet JG, Rossi JF, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med. 1996 Jul 11;335(2):91-7. | CrossRef | PubMed |
Attal M, Harousseau JL, Stoppa AM, Sotto JJ, Fuzibet JG, Rossi JF, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med. 1996 Jul 11;335(2):91-7. | CrossRef | PubMed | Lü S, Wang J. The resistance mechanisms of proteasome inhibitor bortezomib. Biomark Res. 2013 Mar 1;1(1):13. | CrossRef | PubMed |
Lü S, Wang J. The resistance mechanisms of proteasome inhibitor bortezomib. Biomark Res. 2013 Mar 1;1(1):13. | CrossRef | PubMed | Orlowski RZ, Stinchcombe TE, Mitchell BS, Shea TC, Baldwin AS, Stahl S, et al. Phase I trial of the proteasome inhibitor PS-341 in patients with refractory hematologic malignancies. J Clin Oncol. 2002 Nov 15;20(22):4420-7. | CrossRef | PubMed |
Orlowski RZ, Stinchcombe TE, Mitchell BS, Shea TC, Baldwin AS, Stahl S, et al. Phase I trial of the proteasome inhibitor PS-341 in patients with refractory hematologic malignancies. J Clin Oncol. 2002 Nov 15;20(22):4420-7. | CrossRef | PubMed | Kumar S, Flinn I, Richardson PG, Hari P, Callander N, Noga SJ, et al. Randomized, multicenter, phase 2 study (EVOLUTION) of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma. Blood. 2012 May 10;119(19):4375-82. | CrossRef | PubMed |
Kumar S, Flinn I, Richardson PG, Hari P, Callander N, Noga SJ, et al. Randomized, multicenter, phase 2 study (EVOLUTION) of combinations of bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in previously untreated multiple myeloma. Blood. 2012 May 10;119(19):4375-82. | CrossRef | PubMed | Rosiñol L, Oriol A, Mateos MV, Sureda A, García-Sánchez P, Gutiérrez N, et al. Phase II PETHEMA trial of alternating bortezomib and dexamethasone as induction regimen before autologous stem-cell transplantation in younger patients with multiple myeloma: efficacy and clinical implications of tumor response kinetics. J Clin Oncol. 2007 Oct 1;25(28):4452-8.
| CrossRef | PubMed |
Rosiñol L, Oriol A, Mateos MV, Sureda A, García-Sánchez P, Gutiérrez N, et al. Phase II PETHEMA trial of alternating bortezomib and dexamethasone as induction regimen before autologous stem-cell transplantation in younger patients with multiple myeloma: efficacy and clinical implications of tumor response kinetics. J Clin Oncol. 2007 Oct 1;25(28):4452-8.
| CrossRef | PubMed | Neben K, Lokhorst HM, Jauch A, Bertsch U, Hielscher T, van der Holt B, et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. Blood. 2012 Jan 26;119(4):940-8. | CrossRef | PubMed |
Neben K, Lokhorst HM, Jauch A, Bertsch U, Hielscher T, van der Holt B, et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. Blood. 2012 Jan 26;119(4):940-8. | CrossRef | PubMed | Bao L, Lu XJ, Zhang XH, Huang XJ. [Effects of bortezomib at different doses in combination with dexamethasone in treatment of relapsed or refractory multiple myeloma: a comparative study]. Zhonghua Yi Xue Za Zhi. 2008 Jul 8;88(26):1829-31. | PubMed |
Bao L, Lu XJ, Zhang XH, Huang XJ. [Effects of bortezomib at different doses in combination with dexamethasone in treatment of relapsed or refractory multiple myeloma: a comparative study]. Zhonghua Yi Xue Za Zhi. 2008 Jul 8;88(26):1829-31. | PubMed |